水貂肺炎克雷伯菌感染的诊断与药敏试验
孙虎芝,庞天津,张 灿,邹 玲,刘文华,李文立,任慧英
(青岛农业大学动物科技学院,山东青岛266109)
随着水貂养殖业的蓬勃发展,水貂疾病也越来越复杂。山东省是水貂养殖大省,每年夏天水貂出血性肺炎的发生都很频繁,给养貂业造成一定的经济损失[1]。绿脓杆菌是水貂出血性肺炎的主要病原,临床较常见[2]。克雷伯菌属于革兰阴性杆菌,有大量黏性多糖形成的荚膜包覆,人医临床常见克雷伯菌引起感染的报道,水貂的则较少[3]。
山东省文登市某水貂养殖场2014年5月水貂发生出血性肺炎,发病水貂出现被毛逆乱,体温升高,结膜苍白,呼吸浅速,偶尔咳嗽,鼻腔有分泌物,站立不稳,病死率极高,死亡的水貂鼻腔流出血沫。剖检发现上呼吸道黏膜充血水肿,肺出血、充血,气肿。本文对病死水貂进行了一系列的微生物学诊断。
1 材料与方法
1.1 材料
病死水貂的肺脏、肝脏采自山东文登某水貂场;普通营养琼脂培养基,北京路桥技术有限公司产品;葡萄糖蛋白胨水、糖发酵管、药敏纸片,杭州天和微生物试剂有限公司产品;PCR试剂,TaKaRa公司产品。
1.2 方法
1.2.1 细菌的分离培养 对病死的水貂,在无菌条件下进行解剖,取肝脏、肺脏,用接种环划线接种于普通培养基、血清培养基及麦康凯培养基,37℃培养24h,观察结果。
1.2.2 生物学特性检查 挑取单个菌落进行革兰染色,镜检。挑取普通培养基上生长的单菌落分别接种于微量糖发酵管,同时按照常规方法[4]进行三糖铁试验与IMViC试验。
1.2.3 16SrRNA基因扩增与测序 挑取单个菌落接种于LB肉汤中,37℃,170r/min振摇培养12h,菌液作为16SrRNA的PCR扩增模板[5]。上游引物 5′-AGAGTTTGATCATGGCTCAG-3′,下游引物5′-GTGTGACGGGCGGTGTGTAC-3′。扩增目的片段为1 380bp。PCR反应体系为:模板2.0μL,上、下游引物各1.0μL,Premix 12.5μL,无菌水8.5μL。反应条件:94℃10min;94℃40s,55℃1min,72℃1min,30个循环;最后72℃10 min。10g/L琼脂糖凝胶电泳检查PCR产物,并将PCR产物送华大基因公司测序。
1.2.4 药敏试验 将浓度为108个/mL的新鲜菌液涂布普通板,放置5min后,将24种药敏纸片贴于平板表面,37℃培养18h后观察结果。按照CLSI标准进行药物敏感性评价[6]。
1.2.5 基因序列同源性比对以及进化树分析 将测序结果提交NCBI核酸数据库进行同源性分析,初步获得该细菌的基本信息。利用Blast进行比对,进一步分析同源性,同时构建系统进化树。
2 结果
2.1 细菌学检查结果
将肝脏及肺脏组织接种普通细菌培养基、血清培养基及麦康凯培养基,均出现密集生长菌落。普通细菌培养基及血清培养基上的菌落为灰白色、边缘整齐,生长速度快,挑取时出现明显的拉丝,且血清板上菌落较大,在麦康凯上呈红色菌落。细菌为革兰阴性杆菌,有明显的两极浓染特征,且两端不一样大,并有许多短杆状连接在一起。
该菌能够分解葡萄糖、麦芽糖、乳糖和甘露醇,产酸产气;不分解蔗糖;IMViC试验为“- + --”特征。
2.2 16SrRNA基因扩增与测序结果
对病原菌的16SrRNA基因片段进行了PCR扩增,电泳显示一条明亮条带,与预期的1 380bp相符(图1)。
将PCR产物进行测序,将测序结果提交NCBI进行Blast比对发现,结果与已知的克雷伯菌的核酸序列同源性高达98%。结合细菌学鉴定结果,确定该分离株为肺炎克雷伯菌。
通过对病原菌的16SrRNA测序结果进行Blast比对,发现与吉林大学分离的克雷伯菌菌株B-3属于同一分支,碱基序列的同源性高达98%,本研究分离的肺炎克雷伯菌与其他克雷伯菌的核苷酸序列构建系统进化树见图2。
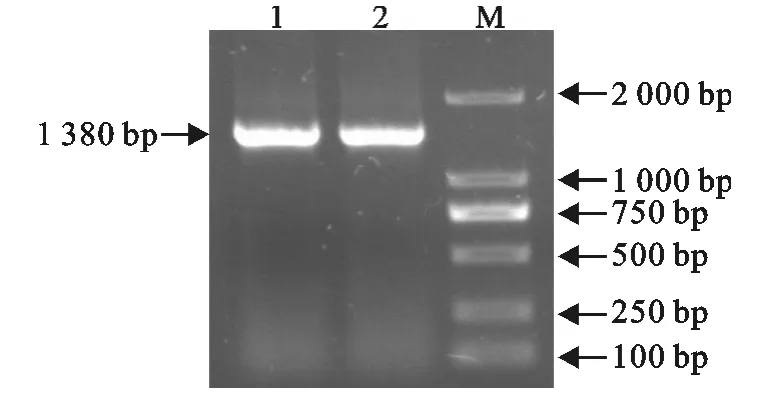
图1 16SrRNA基因PCR扩增结果Fig.1 PCR amplification result of 16SrRNA gene
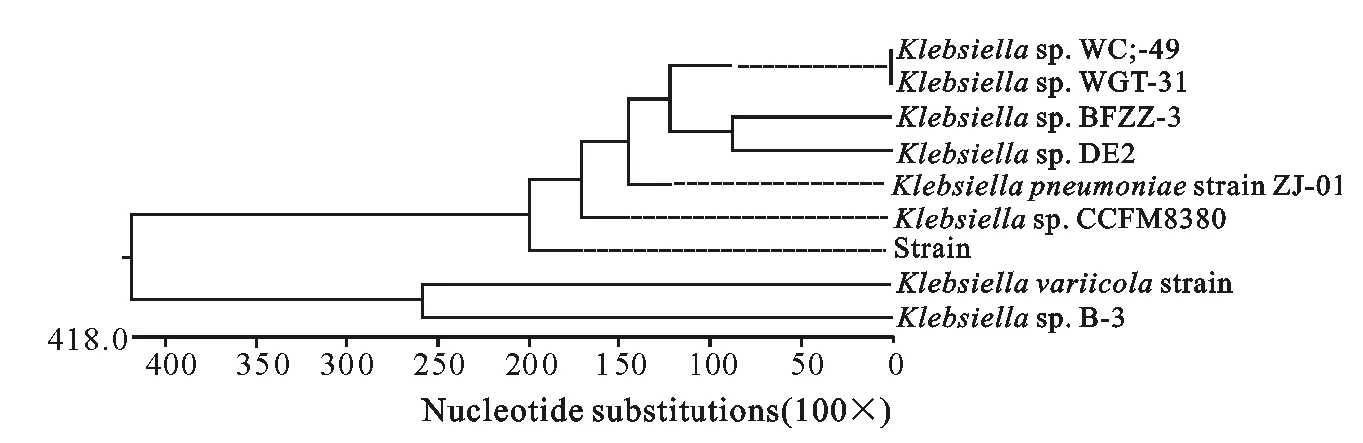
图2 核苷酸序列系统进化树Fig.2 The phylogenetic tree of nucleotide sequences
2.3 药敏试验结果
药敏试验结果显示,该肺炎克雷伯菌对诺氟沙星、头孢吡肟、阿米卡星、磷霉素、左氟沙星、头孢他啶、大观霉素、环丙沙星、氯霉素、多黏菌素B及头孢西叮敏感,对头孢曲松、头孢哌酮、链霉素及头孢噻肟中等敏感,对氨苄西林、卡那霉素、红霉素、林可霉素、四环素、头孢噻吩、头孢呋辛、头孢唑啉及青霉素G耐药。在24种药物中,62.5%的药物为敏感或中度敏感,37.5%的药物耐药。
3 讨论
肺炎克雷伯菌是临床常见的条件致病菌,也是呼吸道感染的重要病原菌之一,属于肠杆菌科细菌。肺炎克雷伯菌能够引发人的感染,临床报道的也比较多,主要导致呼吸机相关性肺炎、尿路、胆道、伤口、导管及血流等的感染,对于新生儿来说,该类病菌感染的比例较高[7]。然而,对于肺炎克雷伯菌感染动物的报道却很少。
肺炎克雷伯菌主要通过呼吸道感染,因此,高密度的水貂养殖使该类病原菌在暴发期更容易传播,导致机体的免疫力低下。通过病死的水貂,可以明显观察到上呼吸道黏膜充血水肿、肺脏以及肝脏出血。药敏试验显示该病原菌对青霉素以及常用的头孢菌素均不敏感,这一点与人源分离株一致[8]。该病原菌具有很高的耐药性,对于临床禁用的氯霉素则比较敏感,可能与氯霉素长期对动物禁用有关。从不同地区、不同发病群体分离的肺炎克雷伯菌对药物的敏感性有很大差异,因此,动物发生细菌病后,应及时通过药敏试验筛选敏感药物,指导生产用药,以减少水貂养殖业的经济损失。
[1]钟世勋,迟珊珊,王 振,等.山东规模化养殖场毛皮动物多重感染病原学分析[J].中国兽医学报,2014(11):1770-1777.
[2]杨海燕,王 颖,张传美,等.貂源绿脓杆菌分离株的鉴定、血清学分型及药敏试验[J].动物医学进展,2014,35(7):127-131.
[3]胡本钢,杜崇涛,雷连成,等.貂源肺炎克雷伯菌的分离与鉴定[J].中国预防兽医学报,2011,33(8):598-600.
[4]胡桂学.兽医微生物学实验教程[M].北京:中国农业大学出版社,2006:47-60.
[5]王秋实,曹 冶,谢 晶,等.一种适合检测养殖场环境中链球菌的PCR检测方法[J].广东畜牧兽医科技,2013(1):30-33.
[6]杨沙沙,王喜仁,韩 杰,等.美国CLSI抗菌药物敏感试验操作标准(2010年版)部分变更内容[J].中国感染控制杂志,2010,9(4):303-304.
[7]刘卫国.肺炎克雷伯菌临床分布及耐药性分析[J].实用中医药杂志,2011(3):192-193.
[8]胡志军,潘晓龙,周东升,等.肺炎克雷伯菌感染的临床分布及耐药性监测[J].中华医院感染学杂志,2014(12):2865-2867.

