胰腺浆液性囊腺瘤临床病理特点分析
刘 娟,唐白杰,徐 钢,王晓卿,李 科,刘 翔
(1.遵义医学院,贵州 遵义 563000;2.四川省医学科学院·四川省人民医院病理科,四川 成都 610072)
胰腺浆液性囊腺瘤临床病理特点分析
刘 娟1,2,唐白杰1,2,徐 钢2,王晓卿2,李 科2,刘 翔2
(1.遵义医学院,贵州 遵义 563000;2.四川省医学科学院·四川省人民医院病理科,四川 成都 610072)
目的 探讨胰腺浆液性囊腺瘤(serous cystadenoma of the pancreas,SCAP)的临床病理学特点。方法 收集四川省人民医院病理科2010年1月至2014年6月12例诊断为SCAP患者的病历资料,分析SCAP的临床特点及病理学特征。结果 本组12例中女性居多(83.3%),发病年龄36~73岁,平均年龄53岁。5例为体检时偶然发现,就诊时无明显临床症状。7例有不同程度的腹痛、腹胀。镜下见肿瘤由大小不等的囊腔组成,囊壁内衬扁平或富于糖原的立方上皮,细胞形态一致无异型性,胞质透明,核圆形或卵圆形,未见核分裂象,间质可见纤维组织分隔。免疫表型:12例肿瘤细胞CK7、CK19、EMA均阳性;10例不同程度地表达α-inhibin;Ki-67指数均为低表达,阳性率1%~2%。所有患者均采用手术切除治疗。随访3~55个月,12例患者均存活,无复发。结论 SCAP发病率低,影像学检查、免疫组化等辅助检查有助于诊断及鉴别诊断。患者手术切除肿瘤后预后好。
胰腺肿瘤;浆液性囊腺瘤;免疫组织化学;临床病理
胰腺浆液性囊腺瘤(serous cystadenoma of the pancreas,SCAP)是一种少见的胰腺外分泌腺肿瘤,发病率约占所有胰腺外分泌肿瘤的1%~2%[1],大多数病例为良性病变,有极罕见病例转化为胰腺浆液性囊腺癌[2,3],因此临床病理诊断和鉴别诊断对于治疗和预后有极其重要的作用。按照WHO组织学标准进行组织学分型,SCAP分为5型,包括浆液性微囊型囊腺瘤(serous microcystic adenoma,SMA)、浆液性寡囊型囊腺瘤(serous oligocystic adenoma,SOA)、实性浆液性腺瘤、混合型浆液性-神经内分泌肿瘤和VHL相关的浆液性囊性肿瘤[4]。本文收集四川省人民医院病理科12例诊断为SCAP病例进行回顾性分析,探讨其临床、病理形态学特征及免疫表型特点。
1 资料与方法
1.1 一般资料 四川省人民医院病理科2010年1月至2014年6月12例诊断为SCAP患者的病历,均有完整临床资料。
1.2 方法 收集四川省人民医院病理科2010年1月至2014年6月12例诊断为SCAP患者的病历资料,分析SCAP的临床特点及病理学特征。12例标本均经10%中性缓冲福尔马林固定,常规脱水,石蜡包埋,4 μm切片,HE染色,光镜观察。免疫组织化学采用En Vision二步法,第一抗体选用CK7、CK19、CK20、CEA、EMA、Villin、CgA、Syn、P53、α-inhibin、D2-40、CD31,Ki-67等;其中,CK7、CK19、Villin、Syn、D2-40购自北京中杉金桥生物技术有限公司;CK20、CEA、EMA、CgA、P53、α-inhibin、CD31,Ki-67购自福州迈新生物技术有限公司,En Vision试剂盒购自基因科技有限公司,按说明书进行IHC染色,常规设立阴性和阳性对照。并对12例标本进行 PAS及经淀粉酶消化后PAS(PAS-D)特殊染色。
2 结果
2.1 临床特征 12例SCAP患者以女性居多(83.3%),发病年龄36~73岁,平均年龄53岁,中位年龄44.5岁。7例有不同程度的腹痛、腹胀等临床表现,5例因体检行影像学检查发现胰腺占位病变,就诊时无明显临床症状。其中5例伴肾囊肿,1例伴肝囊肿。实验室检查:12例患者淀粉酶及脂肪酶正常,血清肿瘤学指标均阴性。术前临床诊断均为胰腺占位性病变。12例患者均经手术切除。随访3~55个月,中位随访时间 9.5个月,截至2014年8月,本组患者均存活,无复发、转移。
2.2 影像学特征 10 例患者术前行 CT 检查,主要表现为胰腺多房囊性或囊实性低密度影,边界多清楚,部分欠清(图1a)。4例患者术前行MRI检查,主要表现为分隔状囊性结节影,边界清楚,囊腔在T2WI上均表现为高信号,在T1WI上均可见低信号,增强扫描囊壁及分隔强化(图1b)。肿块最大径0.7~ 6.0 cm,平均3.4 cm。
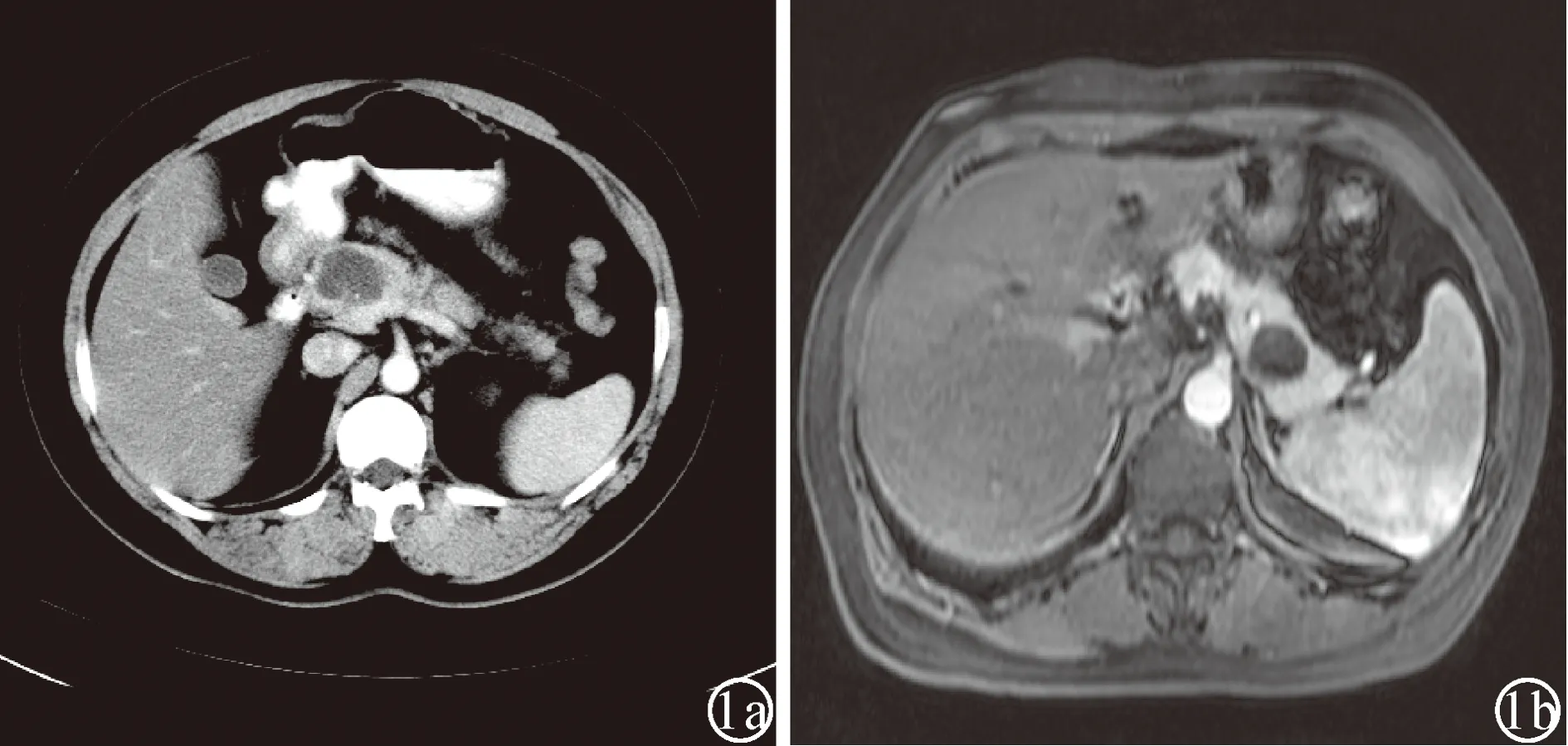
图1 SCAP影像学改变
2.3 病理形态学特征
2.3.1 巨检 肿块呈圆形或卵圆形,多数肿块界限清楚,有包膜,切面为多房囊性、蜂窝状或囊实性,囊内均为淡黄色清亮稀薄液体;可见星形纤维瘢痕灶;2例为单囊;少数边界欠清,与周围胰腺组织略有粘连。
2.3.2 镜下 本组病例中10例为SMA,2例为SOA。SMA肿瘤由众多小囊腔组成,部分囊腔内含囊液。部分病例小囊间可见星形纤维瘢痕灶和钙盐沉积。囊壁内衬立方、扁平上皮,细胞形态一致,胞质透明,核圆形或卵圆形,大小一致,位于中央,无明显异型性。囊内常见上皮细胞增生形成无纤维血管轴心的小乳头状突起,部分病例囊腔内乳头状凸起呈多级分支。间质血管较丰富,局部有出血及含铁血黄素沉积(图2)。2例为SOA,均由数个较大囊腔组成,囊内无分隔,内衬上皮与SMA 相似,其中1例囊壁纤维组织增生,另一例囊壁组织慢性炎症及周围组织纤维化(图3)。12例病例均未见神经、血管及周围胰腺组织的浸润。
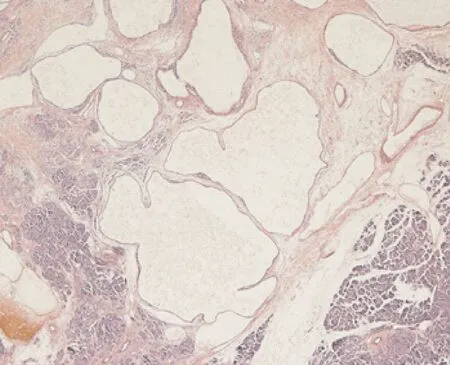
图2 SMA镜下表现(×20 倍)
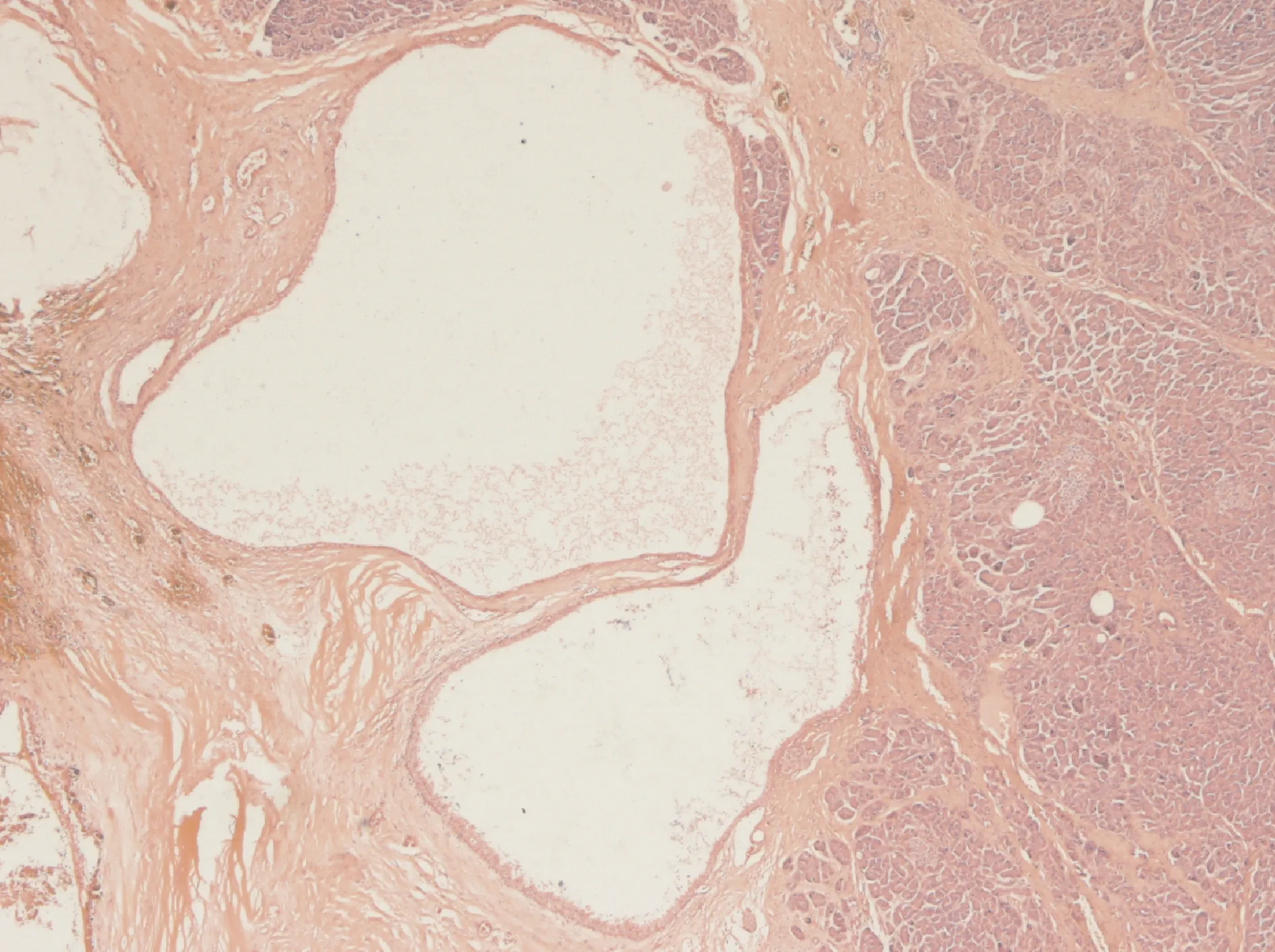
图3 SOA镜下表现(×10 倍)
2.3.3 免疫组化结果 12例患者肿瘤内衬上皮性细胞CK7、CK19、EMA均阳性;10例不同程度地表达α-inhibin,阳性表达分布呈灶性或节段性,阳性率20%~80%;2例阴性表达;Ki-67指数均为低表达,阳性率1%~2%;CK20、CEA、Villin、CgA、Syn、P53、D2-40、CD31均为阴性(图4)。
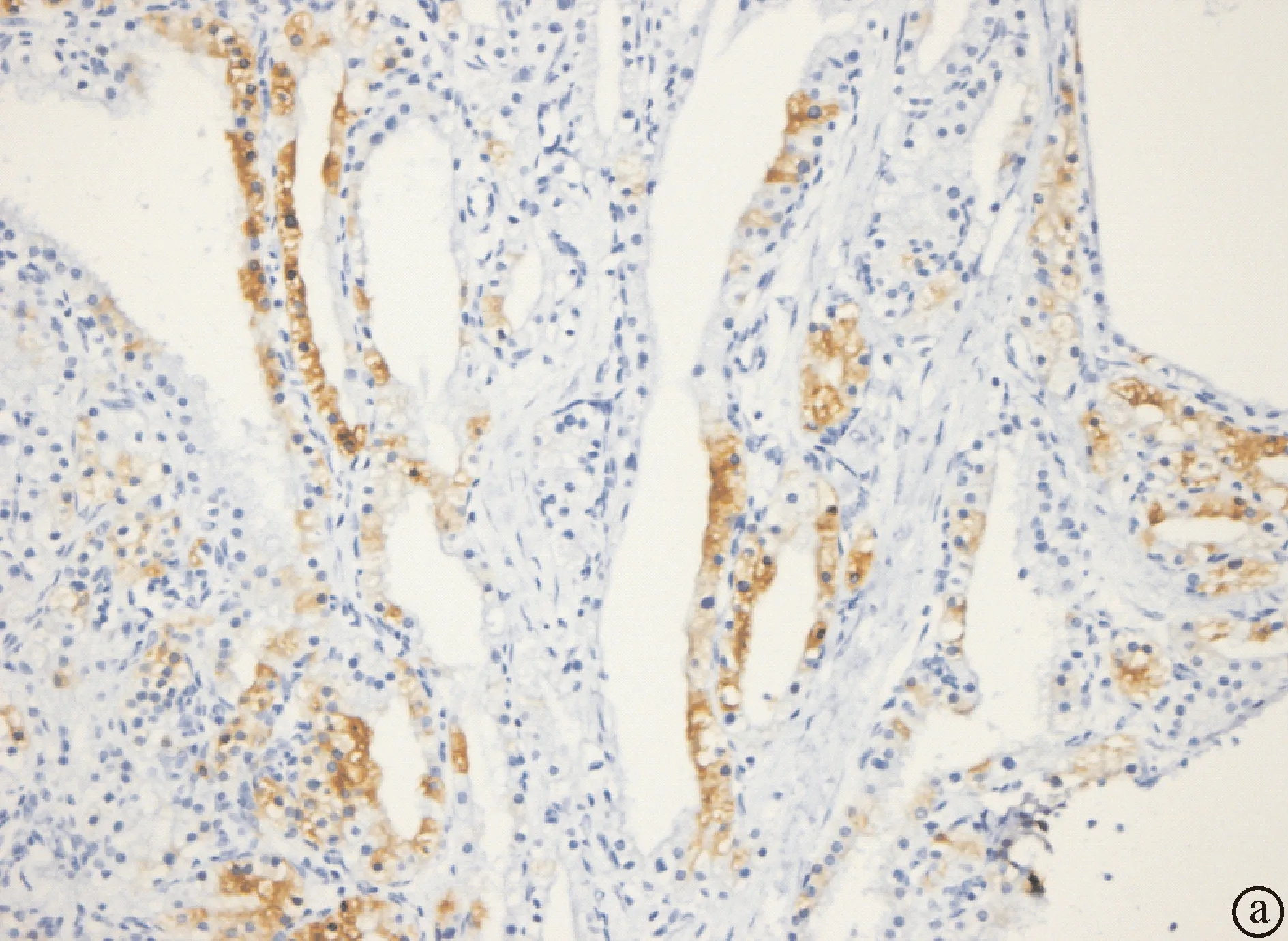
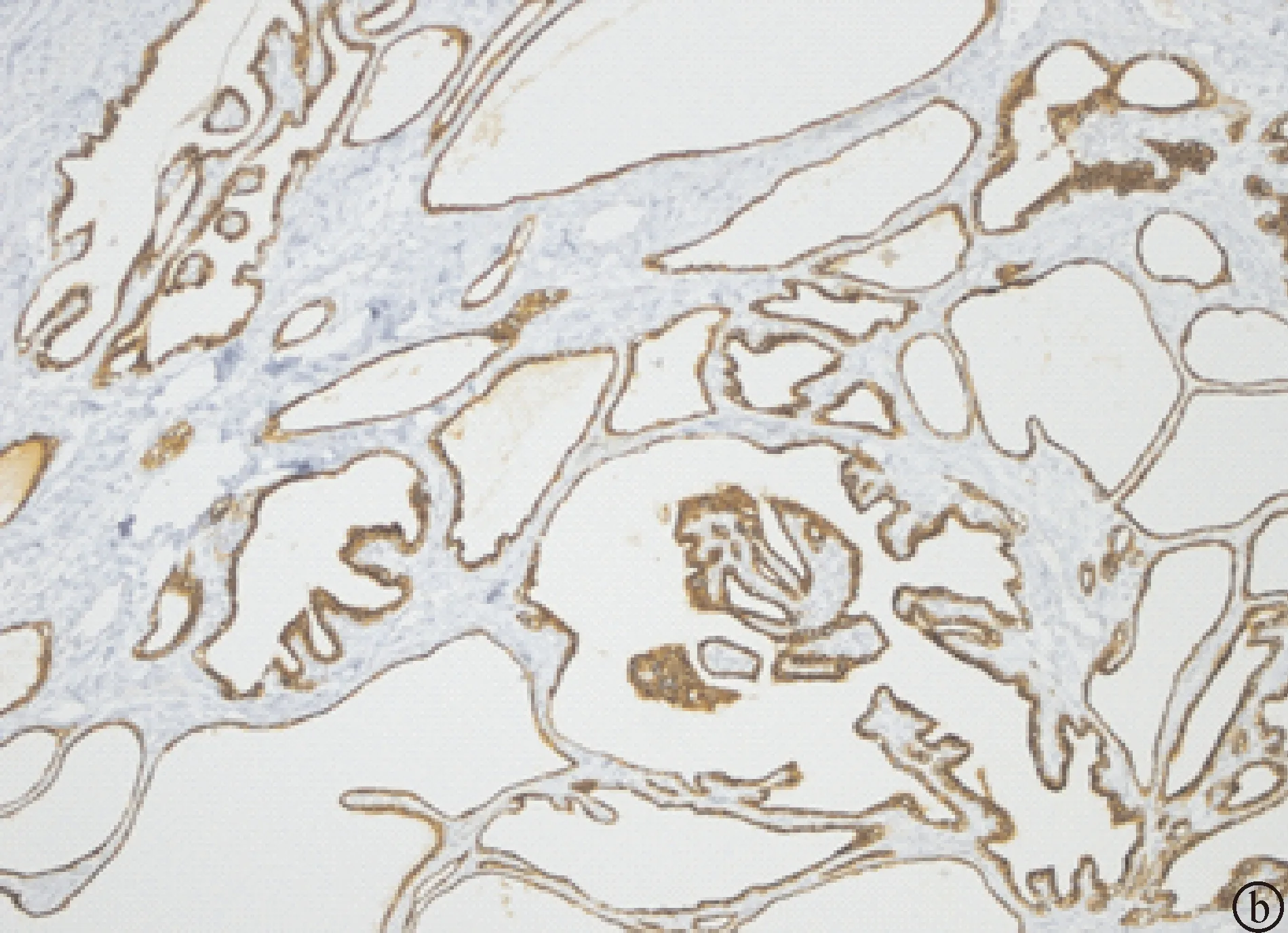
图4 SCAP免疫组化染色(En Vision法) a: 肿瘤上皮细胞胞浆α-inhibin阳性,阳性表达分布呈灶性或节段性(×40倍);b:肿瘤性上皮细胞CK7阳性(×20倍)
2.3.4 特殊染色结果 所有患者均为PAS阳性,PAS-D阴性。
3 讨论
SCAP是由Compagno 等[5]在1978 年根据病理学特征首次提出的概念,是一种少见的胰腺外分泌腺肿瘤,其发病率在所有胰腺外分泌肿瘤中占1%~2%,在所有胰腺囊性肿瘤中占32%~39%[1]。SCAP患者常为中老年女性,平均年龄60岁,胰体尾多见,其次为胰头[6]。本组也是女性居多,占83.3%,但平均发病年龄为53岁,略低于文献。临床上通常无明显症状,常常是在查体或体检时偶然发现。有症状或有体征的患者大部分表现为腹胀、腹痛或腹部触及包块,也可有恶心、呕吐和体重减轻,少数患者由于肿瘤位于胰头部,产生压迫,可以出现梗阻性黄疽[5,7]。本组病例临床多数表现为腹部不适、隐痛或胀痛,体检少数为偶然发现;4例胰头占位患者有1例有黄疸表现,和文献报道基本一致。本病发病隐匿,生长缓慢,影像学检查对诊断尤为重要。有研究认为CT和MRI 的表现有一定特征性[8],肿瘤境界清晰,呈多房囊性占位,伴中央星形瘢痕,偶见钙化;超声多显示胰腺囊性肿块,内可见分隔,边界尚清晰,血流信号不明显,主胰管不扩张。实验室检查目前没有特异性标记。
本组中4例肿物与周围胰腺组织有粘连,分界不清,占33.3%,与文献报道不一致[9]。本文1例诊断为SOA的病例较特殊,其为单囊,最大径5 cm,囊壁上有一直径0.8 cm的质硬结节,结节处镜下显示为纤维囊壁组织增生。免疫表型特点:上皮性标记CK7、CK19 和EMA 阳性,神经内分泌标记CgA、Syn 阴性,说明肿瘤源于导管上皮细胞和(或)泡心细胞而非腺泡细胞。Ki67 阳性率1%~2%,说明细胞增殖活性不高。特殊染色特点:上皮细胞胞质PAS 染色阳性,经淀粉酶消化后PAS 染色阴性,证实肿瘤细胞胞质内富含糖原颗粒。合并肝囊肿或肾囊肿的病例,在组织病理学及免疫表型上,与未合并其他病变特点一致。文献报道[10]SCAP各型免疫组化特征非常相似,尽管各型有生物学差异,但各种类型的SCAP都是由相同(或非常相似的)类型的细胞组成,因此可能向一个共同的方向分化。结合组织病理学及免疫组化分析是SCAP诊断与鉴别诊断的合适选择。
在病理组织学上,SCAP 需要和胰腺多种肿瘤进行鉴别。①胰腺淋巴管瘤和血管瘤: 多为囊性,影像学检查易与SMA混淆,需要与其鉴别。胰腺淋巴管瘤和血管瘤常见于年轻人,囊壁内衬为扁平内皮细胞及散在分布的平滑肌细胞和淋巴细胞的聚集,血管和淋巴管内内皮标志物如D2-40、CD31 阳性表达,而上皮性标记物阴性。②胰腺粘液性囊性肿瘤(MCN): MCN是胰腺最常见的囊性肿瘤,约占45%[11],并属于恶性或恶性潜能不明肿瘤,所以鉴别诊断尤为重要。MCN肿瘤亦常为多房囊性,但囊内被覆高柱状黏液上皮而非含糖原的立方上皮[12],上皮周围可见由梭形细胞紧密排列形成的卵巢样基质,此型间质常有抑制素的表达。③胰腺假性囊肿: 常为单个无分隔囊肿,易与SOA混淆。胰腺假性囊肿常有胰腺炎病史或外伤手术史,囊肿可位于胰腺表面或胰腺内,囊液淀粉酶升高,囊肿壁无上皮覆盖,囊壁为纤维或肉芽组织。④胰腺浆液性囊腺癌:组织学形态上胰腺浆液性囊腺癌与SCAP几乎完全相同,仅凭常规HE切片,镜下难以区分。浆液性囊腺癌实验室检查血清 CEA和CA199 常正常或轻度增高,镜下细胞增生活跃,呈乳头状长入腔内并可充满囊腔,可见血管和神经侵犯,并且必须有远处转移才能诊断。⑤ 转移性肾透明细胞癌:有时大体呈淡黄蜂窝样,镜下为明显、纤细的血管结构围绕腺泡状排列的透明细胞,部分区域瘤细胞可形成小管状或假乳头状结构,易误诊为SMA,根据病史及免疫组化CD10、Vimentin 阳性可鉴别。
SCAP病因尚不明确。有研究发现,部分SCAP有VHL 等位基因的缺失[6,13],虽然在VHL综合征患者中SCAP的发病率很高,但尚不清楚这些基因改变是否为导致肿瘤发生的原因。而据Moore 等[14]报道VHL基因缺失在SMA 的发生机制中并不十分重要,而10q 染色体上的基因出现杂合性缺失改变的意义更为明显并更有待于进一步研究证实。文献指出,约54.8%胰腺囊肿患者同时伴有其他内脏器官的囊肿,且SCAP很少伴发其他内脏囊肿[15],本组6 例(50%)伴有肝囊肿和(或)肾囊肿者,与文献报道的不一致。肝囊肿和肾囊肿多是先天遗传性疾病,并且高达90%Von-Hippel-Lindau(VHL)综合征患者并发浆液性囊性肿瘤[4],据此有文献[16]推测SCAP是伴有多个脏器的联合性疾病,以形成多发性肝囊肿和肾囊肿多见。该特征提示临床需重视对SCAP患者的其他器官检查。
手术切除为SCAP的主要治疗方式,术中积极防范手术后胰漏的发生。患者预后良好,手术切除后(即使切除不完整)一般不复发。恶性变的患者极少见。由于胰腺浆液性囊腺癌组织学形态与SCAP不易区别,胰腺浆液性囊腺癌与SCAP组织学形态几乎相同,并且个别SCAP会演变为浆液性囊腺癌而发生转移[9],因此,术后应注意对患者进行长期随访。本文12例经手术切除后,随访均预后良好,无1例复发及转移。
[1] Brugge WR,Lauwers GY,Sahani D,et al.Cystic neoplasms of the pancreas[J].N Engl J Med,2004,351(12):1218-1226.
[2] Pederzoli P,Bassi C.Uncommon Pancreatic Neoplasms[M].NewYork: Springer,2013:5-12.
[3] Tef E,El Nakeeb A,El Hanafy E,et al.Pancreatic cystic neoplasms: predictors of malignant behavior and management[J].Saudi J Gastroenterol,2013,19(1): 45-53.
[4] Bosman FT,Carneiro F,Hruban RH,et al.WHO classi-fication of tumours of the digestive system[M].4th ed.Lyon: IARC Press,2010: 296-299.
[5] Compagno J,Oertel JE.Microcystic adenomas of the pancreas(glycogen-rich cystadenomas): a clinicopathologic study of 34 cases[J].Am J Clin Pathol,1978,69(3):289-298.
[6] Vortmeyer AO,Lubensky IA,Fogt F,et al.1 Allelic delet ion andmutat ion of the von Hippe-l Lindau(VHL)tumor suppressor gene in pancreat ic m-icrocystic adenomas[J].Am J Pathol,1997,151(4): 951-956.
[7] Alpert LC,Truong LD,Bossart MI,et al.Microcystic adenoma(serous cystadenoma)of the pancreas1--A study of 14 cases with immunohistochemical and electron microscopic correlation[J].Am J Surg Pathol,1988,12(4): 251-263.
[8] 罗华,梁亮,曾蒙苏.胰腺巨囊型浆液性囊腺瘤的MSCT表现及其诊断[J].放射学实践,2011,26(7): 739-741.
[9] 詹鹤琴,张洪福.胰腺浆液性微囊型腺瘤 1 例[J].临床与实验病理学杂志,2005,21(4): 507-508.
[10] Kosmahl M,Wagner J,Peters K,et al.Serous cystic neoplasms of the pancreas: an immunohistochemical analysis revealing alpha-inhibin,neuron-specific enolase,and MUC6 as new markers[J].American Journal of Surgical Pathology,2004,28(3): 339-346.
[11]伍健,张晓莹,费绍华.胰腺浆液性微囊性囊腺瘤临床病理分析[J].肿瘤防治研究,2010,37(12): 1420-1422.
[12]张景丽,薛林.胰腺黏液性囊性肿瘤的临床病理观察[J].实用医院临床杂志,2010,7(4):68-70.
[13]Mohr VH,Vortmeyer AO,Zhuang Z,et al.Histopathology and molecular genetics of multiple cysts and microcystic(serous)adenomas of the pancreas in von Hippel-Lindau patients[J].Am J Pathol,2000,157(5): 1615-1621.
[14]Moore PS,Zamboni G,Brighenti A,et al.Molecular characterization of pancreatic serous microcystic adenomas: evidence for a tumor suppressor gene on chromosome 10q[J].Am J Pathol,2001,158(1): 317-21.
[15]Agrawal D,Maimone SS,Wong RC,et al.Prevalence and clinical significance of pancreatic cysts associated with cysts in other organs[J].Dig Liver Dis,2011,4 3(10): 797-801.
[16]林生明,张声,陈余朋,等.胰腺浆液性微囊性腺瘤13 例临床病理分析[J].临床与实验病理学杂志,2013,29(7): 721-725.
Clinico-pathological characteristics of serous cystadenoma of pancreas
LIU Juan1,2,TANG Bai-jie1,2,XU Gang2,WANG Xiao-qing2,LI Ke2,LIU Xiang2
(1.Zunyi Medical College,Zunyi 563000,China;2.Department of Pathology,Sichuan Academy of Medical Sciences & Sichuan Provincial People’s Hospital,Chengdu 610072,China)
XUGang
Objective To investigate the clinico-pathological features of serous cystadenoma of pancreas(SCAP).Methods Twelve cases of SCAP were collected from Jan.2010 to Jun.2014 at department of pathology of Sichuan Provincial People’s Hospital.The clinical characteristics and pathological features were retrospectively analyzed.Results Of the 12 cases,there were 2 males and 10 females.The age of patients ranged from 36 to 73 years old and with a mean age of 53 years old.Five cases were found on routine medical examinations without clinical symptoms.Seven cases had varying degrees of abdominal pain or abdominal distension.Four cases were in pancreatic head,1 in pancreatic body,3 in pancreatic tail,and 4 in pancreatic body and tail.Six patients were found to be accompanied with cystic diseases of liver and/or kidney.Under microscopic examination,the tumors were found to compose of multiple small cysts lined by flattened or cuboidal epithelial cells containing abundant glycogen.Tumor cells were consistent with clear cytoplasm and round or oval shaped nucleus,and without nuclear mitotic.The stroma of the tumors was found to contain fibrous tissue.By using immunohistochemical staining,the tumor cells were positive for CK7,CK19 and EMA in all cases while α-inhibin was positive in varying degrees in 10 cases.Ki-67 was weak expressed with positive rate from 1%to 2%.All patients were treated with mass resection,and lived without recurrence during the follow-up periods from 3 to 55 months.Conclusion Serous cystadenoma of pancreas is a rare tumor.The diagnosis and differential diagnosis mainly depends on histopathological and immunohistochemical examinations combined with radiological examinations.This tumor has a good prognosis after surgical removal.
Pancreatic neoplasm;Serous cystadenoma;Immunohistochemistry;Clinico-pathologic
徐 钢
R446.8;R576
A
1672-6170(2015)04-0066-04
2015-01-30;
2015-03-26)

