香菇多糖柱前衍生化高效液相色谱指纹图谱研究*
陈志辉,谭丽容,罗明,黄绮敏,张美玲,魏刚
[1.广州中医药大学,广州 510006; 2.无限极(中国)有限公司,江门 529156]
香菇多糖柱前衍生化高效液相色谱指纹图谱研究*
陈志辉1,谭丽容2,罗明1,黄绮敏2,张美玲2,魏刚1
[1.广州中医药大学,广州 510006; 2.无限极(中国)有限公司,江门 529156]
目的 建立香菇多糖1-苯基-3-甲基-5-吡唑啉酮(PMP)柱前衍生高效液相色谱(HPLC)指纹图谱。方法 采用水提醇沉法提取香菇多糖,经三氟乙酸(TFA)水解和PMP柱前衍生后,HPLC 法测定香菇多糖的单糖组成。结果 在所建立的指纹图谱中,共标示出13个特征共有峰,鉴别主要色谱峰6个,分别是甘露糖、D-葡萄糖醛酸、D-葡萄糖、半乳糖、木糖和L-岩藻糖,其中葡萄糖比例最高,其次是甘露糖、半乳糖及岩藻糖。结论 该方法稳定、简便、重复性好,可为香菇的质量控制提供参考。
香菇多糖;单糖;柱前衍生;色谱法,高效液相;指纹图谱
香菇为香菇科香菇属植物[Lentinusedodes(Berk.)sing.]的子实体,具有扶正补虚、健脾开胃、祛风透疹、化痰理气、解毒、抗癌的功效[1]。香菇的化学成分包括香菇多糖、香菇嘌呤、核苷酸、蛋白质、矿物质、微量元素、维生素、挥发性成分及一定量的萜类物质等[2]。其中香菇多糖是主要有效成分之一,也是研究得较早和较多的多糖之一。现代药理研究表明,香菇多糖具有抗肿瘤[3-4]、调节免疫[5-6]、抗氧化[7-8]、保肝[9-10]、降血糖[11]、降血脂[12]、抗病毒[13]等多种功效。多糖的单糖组成测定是控制多糖质量标准和提供基本信息的一项重要内容。柱前衍生化高效液相色谱(HPLC)法具有分离度高、操作快捷、重复性好等特点[14-15]。近年来,有关香菇多糖单糖组分的研究有少量报道[16-17],但笔者尚未见采用柱前衍生化HPLC法的报道,故采用此法对香菇多糖的单糖组成指纹图谱进行研究,旨在进一步为香菇化学成分和质量控制研究提供参考。
1 仪器与试药
1.1 仪器 岛津 LC-20AT(DAD)高效液相色谱仪;T1000型万分之一电子天平(常熟市双杰测试仪器厂);HWS24型电热恒温水浴锅(上海一恒科技有限公司);TYXH-1 漩涡混合器(上海乔跃电子有限公司);HC-3018 高效离心机(安徽中科中佳科学仪器有限公司);TC-15 套式恒温器(海宁市新华医疗器械厂);电热鼓风干燥箱(上海一恒科学仪器有限公司); ES1220-电炉(三角牌)。
1.2 试剂与材料 单糖对照品:D-葡萄糖(批号:110833-201205,含量≥99%),D-甘露糖(批号:140651-200602,含量≥99%),D-半乳糖(批号:100226-201105,含量≥99%),D-盐酸氨基葡萄糖(批号:140649-200702,含量:100%),均购自中国食品药品检定研究院。L-鼠李糖(批号:121029,含量≥98%),L-岩藻糖(批号:120927,含量≥98%),D-葡萄糖醛酸(批号:121009,≥含量98%),D-半乳糖醛酸(批号:121106,含量≥98%),D-木糖(批号:121026,含量≥98%),D-氨基半乳糖(批号:120927,含量≥99%),D-核糖(批号:121012,含量≥98%),D-阿拉伯糖(批号:121103,含量≥98%),均购自上海融禾医药科技有限公司。1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-5-pyrazalone,PMP,上海晶纯生化科技股份有限公司,批号:A1216009,含量≥99%),三氟乙酸(trifluoroacetic acid,TFA,国药集团化学试剂有限公司,批号:20120903,含量≥99%);乙腈(德国 Merk 公司,色谱纯);磷酸氢二钠(Na2HPO4)和磷酸二氢钠(NaH2PO4)均系广州化学试剂厂提供;水为纯化水;其他化学试剂除特殊标明外均为分析纯。香菇样品XGS1-XGS6购自长洲菜市场,香菇样品XGS7-XGS10由无限极(中国)有限公司提供,经广州中医药大学魏刚研究员鉴定为香菇科香菇属植物香菇的子实体。
2 方法与结果
2.1 色谱条件 参考文献[18]色谱条件,并经实验确定分离度相对较好的色谱条件。色谱柱:ZORBAX Eclipse XDB-C18(250 mm×4.6 mm,5 μm);流动相:乙腈-磷酸盐缓冲液(0.1 mol·L-1,pH 6.7,体积比15.5:84.5);柱温30 ℃,检测波长250 nm;流速0.8 mL·min-1;进样体积10 μL。
2.2 对照品溶液的制备 分别取D-核糖、D-阿拉伯糖、D-甘露糖、D-半乳糖、D-盐酸氨基葡萄糖、L-岩藻糖、D-葡萄糖、D-葡萄糖醛酸、D-半乳糖醛酸、L-鼠李糖、D-木糖对照品适量,精密称定,加纯化水制成单糖混合对照溶液(单糖浓度约0.45 g·mL-1)。精密吸取单糖混合对照品溶液100 μL置5 mL安瓿中,精密加入0.6 mol·L-1氢氧化钠溶液100 μL,混匀,精密加入0.5 mol·L-1PMP 100 μL,在70 ℃条件下反应60 min,取出,放冷,精密加入0.3 mol·L-1盐酸溶液200 μL,涡旋混匀,加水至1 mL,转移至5 mL离心管中,涡旋混匀。加入三氯甲烷1 mL,涡旋混匀,3 000 r ·min-1离心10 min,弃去三氯甲烷层,如此至少重复3次,至三氯甲烷层无颜色,水层即得对照品溶液。
2.3 供试品溶液的制备
2.3.1 香菇多糖溶液的制备 取本品粉末(50~60 ℃减压干燥,粉碎,过孔径0.425 mm 药筛)1 g,精密称定,加入80%乙醇100 mL,超声处理1 h,取出,滤过,滤渣重复超声处理1次。将滤渣连同滤纸置烧瓶中,加水100 mL,回流提取2 h,取出,趁热滤过,残渣加水100 mL,重新加热回流1 h,趁热滤过,用适量热水洗涤残渣和滤器,合并滤液与洗液,浓缩水提液至约10 mL,放冷,5 000 r ·min-1离心20 min,将上清液转移至10 mL量瓶中,加水至刻度,摇匀。转移至离心管中,精密加入无水乙醇40 mL(慢加快搅),置5~10 ℃冰箱中放置12 h,5 000 r ·min-1离心10 min,弃去上清液,沉淀加80%乙醇洗涤 2 次,每次10 mL,5 000 r ·min-1离心10 min,再加无水乙醇洗涤2次,每次10 mL,5 000 r ·min-1离心10 min,弃去上清液,沉淀加热水溶解,转移至5 mL量瓶中,放冷,加水至刻度,摇匀,即得粗多糖溶液。
2.3.2 香菇多糖的TFA部分酸水解 精密吸取“2.3.1”项下样品粗多糖溶液500 μL,置5 mL的安瓿中,精密加入0.4 mol·L-1TFA溶液500 μL,封口后置110 ℃条件下水解6 h,取出,放冷,水浴蒸干,加入甲醇1 mL搅拌,蒸干以去除TFA,如此重复至少3次,残渣加热水溶解,转移至2 mL量瓶中,放冷,加水至刻度,摇匀,即得香菇粗多糖水解溶液。
2.3.3 PMP衍生化 精密吸取“2.3.2”项下的粗多糖水解溶液 200 μL置5 mL安瓶中,精密加入0.6 mol·L-1氢氧化钠溶液200 μL,混匀,精密加入0.5 mol·L-1PMP溶液 200 μL,在70 ℃条件下反应60 min。取出,放冷,精密加入0.3 mol·L-1盐酸溶液 400 μL,涡旋混匀。移至5 mL离心管中,加入三氯甲烷1 mL,涡旋混匀,3 000 r ·min-1离心10 min,弃去三氯甲烷层,如此至少重复3次,至三氯甲烷层无颜色,水层即得供试品溶液,用孔径0.45 μm 微孔滤膜过滤,供HPLC进样分析。
2.3.4 TFA酸水解时间的筛选 按“2.3.2”项下方法实验,水解时间分别考察1,2,4,6,8 h,所得粗多糖水解溶液按“2.3.3”项下方法实验,衍生时间为60 min。精密吸取供试品溶液各20 μL,按“2.1”项下色谱条件进样分析。以供试品溶液所得 HPLC 图谱主要共有特征峰的峰面积之和作为衡量指标,反应6 h时共有峰面积和达到最大,进一步筛选水解时间4,5,6,7,8 h,结果见图1,可见随着水解时间的延长,主要共有特征峰的峰面积之和随之升高,当水解时间达6 h,水解完全,该点后峰面积和曲线开始下降,因此,确定水解时间为6 h。
2.3.5 PMP 衍生时间的筛选 按“2.3.2”项下方法实验,取水解时间为6 h所得的粗多糖水解溶液按“2.3.3”项下方法实验,衍生时间分别考察60,80,100,120及140 min,精密吸取所得供试品溶液各10 μL,按“2.1”项下色谱条件进样分析,以所得 HPLC 图谱主要共有特征峰的峰面积之和作为衡量指标,在所选时间范围内峰面积之和变化不明显,说明衍生反应60 min已基本完全。进一步筛选衍生反应时间20,40,60,80,100 min,结果见图2,可见随着衍生反应时间的延长,主要共有特征峰的峰面积之和随之升高,衍生反应时间为60 min,多糖趋于反应完全,峰面积达到最大,当衍生反应时间超过60 min,曲线下降,因此,确定衍生反应时间为60 min。
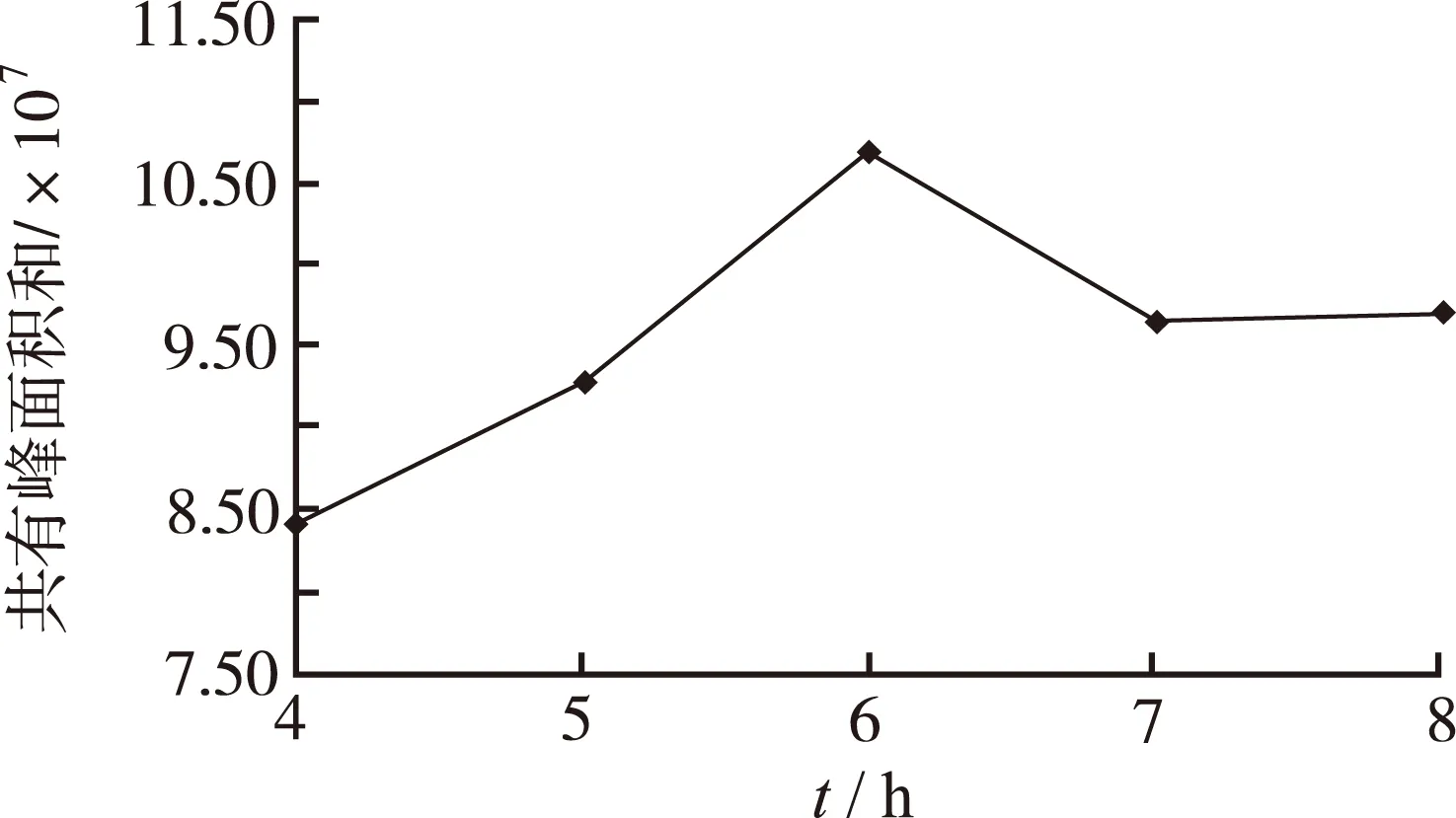
图1 不同水解时间对香菇多糖PMP-HPLC指纹图谱共有峰面积之和的影响
Fig.1 Effect of different hydrolysis time on the sum of common peak area PMP-HPLC fingerprint for mushroom polysaccharides
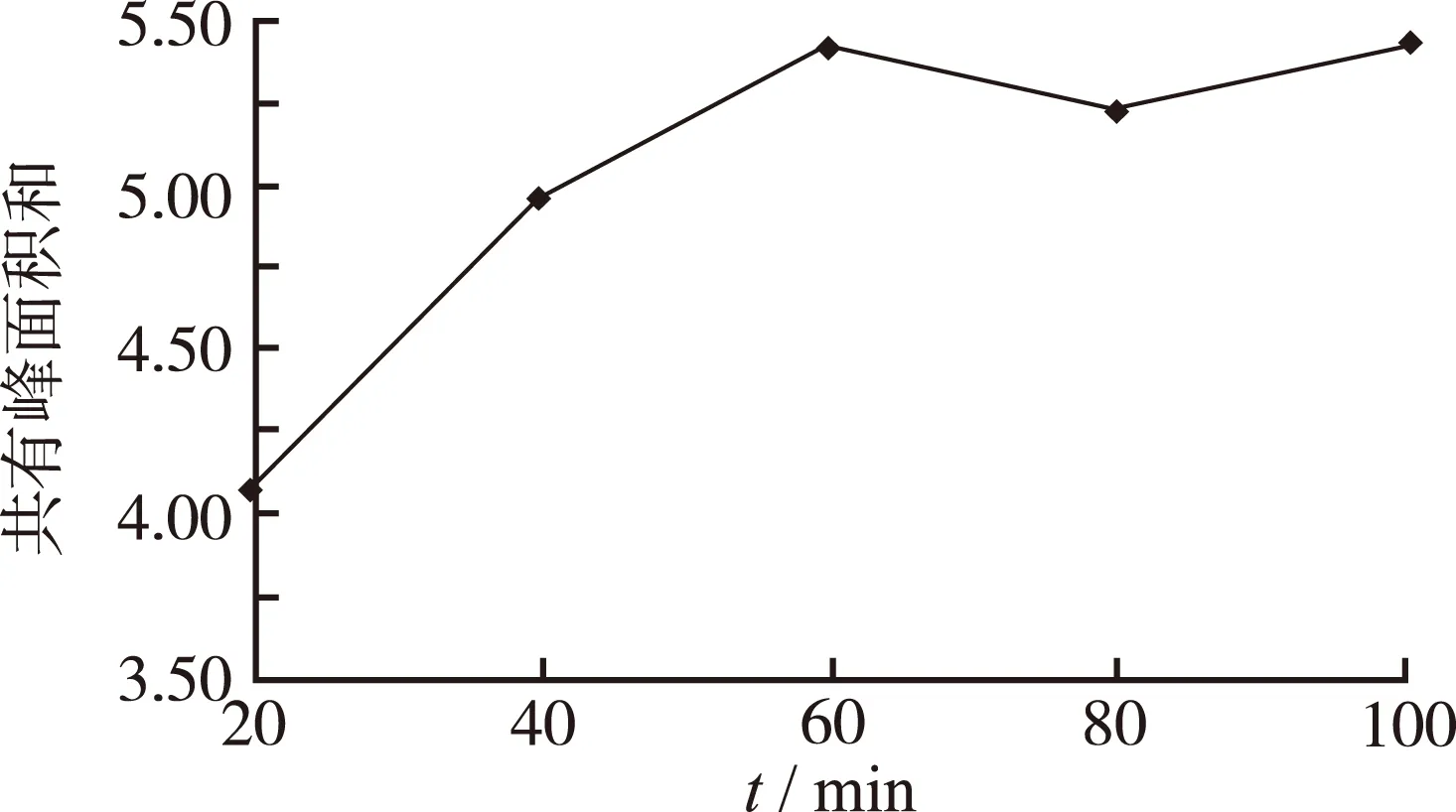
图2 不同衍生反应时间对香菇多糖PMP-HPLC指纹图谱共有峰面积和的影响
Fig.2 Effect of different derivative time on the sum of common peak area PMP-HPLC fingerprint for mushroom polysaccharides
2.3.6 供试品溶液制备方法的确定 精密吸收“2.3.1”项中样品粗多糖溶液500 μL,置5 mL安瓶中,精密加入0.4 mol·L-1TFA 溶液500 μL,封口后置110 ℃条件下水解6 h,取出,放冷,水浴蒸干,残渣加入甲醇1 mL搅拌,蒸干以去除 TFA,如此重复至少3次,残渣加热水溶解,转移至2 mL量瓶中,放冷,加水至刻度,摇匀,即得粗多糖水解溶液。精密吸取粗多糖水解溶液200 μL置5 mL安瓶中,精密加入0.6 mol·L-1氢氧化钠溶液200 μL,混匀,精密加入0.5 mol·L-1PMP 200 μL,在70 ℃条件下衍生反应60 min。取出,放冷,精密加入0.3 mol·L-1盐酸溶液400 μL,涡旋混匀。移至5 mL离心管中,涡旋混匀。加入三氯甲烷1 mL,涡旋混匀,3 000 r ·min-1离心10 min,弃去三氯甲烷层,如此至少重复3次,至三氯甲烷层无颜色,水层即得供试品溶液。
精密吸取与多糖水解溶液等量的水200 μL,按供试品溶液制备方法同法进行衍生处理,得溶剂空白对照。
2.4 方法学考察
2.4.1 精密度实验 取衍生化后的同一批供试品溶液,连续进样6次,考察各色谱峰相对保留时间和相对峰面积的一致性。结果,各主要色谱峰的相对保留时间RSD<3%,相对峰面积RSD<5%,表明仪器的精密度良好。
2.4.2 稳定性实验 取衍生化后的同一批供试品溶液,分别在0,2,4,6,10,24 h进样检测,考察各色谱峰相对保留时间和相对峰面积的一致性。结果,各主要色谱峰的相对保留时间RSD<3%,相对峰面积RSD<5%,表明供试品溶液在考察的时间范围24 h内具有较良好的稳定性。
2.4.3 重复性实验 取同一批样品6份,精密称定,按照“2.3”项下方法制备供试品溶液,分别进样检测,考察各色谱峰相对保留时间和相对峰面积的一致性。结果,各主要色谱峰的相对保留时间RSD<3%,相对峰面积RSD<5 %,表明重复性良好。
2.5 样品测定 按照“2.3”项方法制备10批样品的供试品溶液,按照“2.1”项色谱条件进行检测。
2.6 指纹图谱的建立与分析
2.6.1 混合单糖对照品分析 精密吸取“2.2”项中混合单糖对照品溶液20 μL,按“2.1”项色谱条件进样分析得到色谱图(图3),混合单糖对照品除氨基葡萄糖、核糖重叠外,其他9个成分能获得较好的分离效果。
2.6.2 共有峰的确定及参照峰的选择 按“2.3.6”项下制备10批样品的供试品溶液,按“2.1”项色谱条件各进样10 μL,按“2.1”项色谱条件进样分析,结果不同批次样品均具有基本一致的特征峰,共标示出13个共有峰。经对照品保留时间定位及色谱峰紫外光谱分析,鉴别6个色谱峰,即3号峰(甘露糖)、9号峰(葡萄糖醛酸)、10号峰(葡萄糖)、11号峰(半乳糖)、12号峰(木糖)、13号峰(岩藻糖)。以峰11(半乳糖)为参照峰(S)分别计算各特征共有峰的相对保留时间和相对峰面积,结果见表1,2。
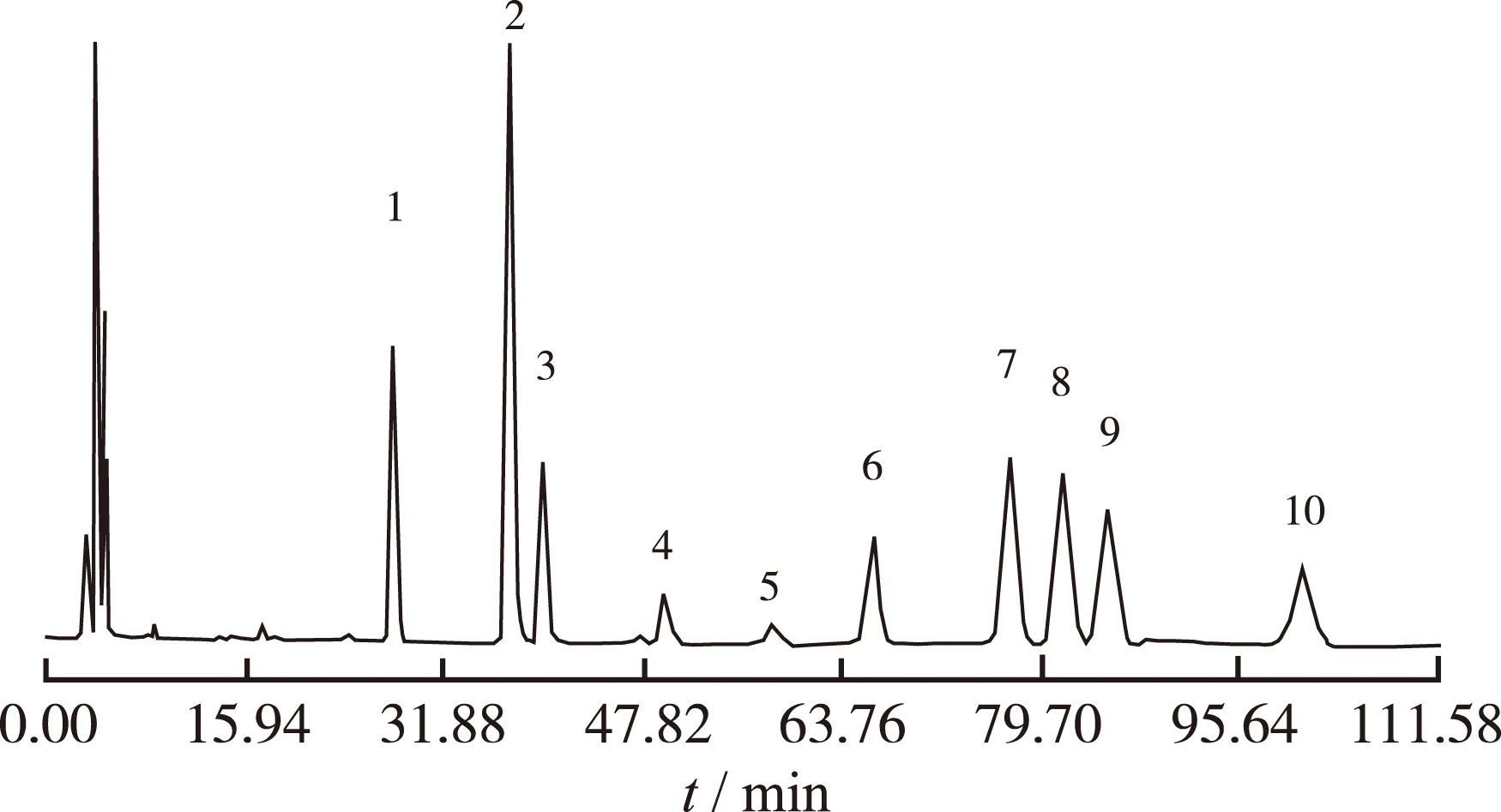
1.甘露糖;2.氨基葡萄糖、核糖(重叠);3.鼠李糖;4.葡萄糖醛酸;5.半乳糖醛酸;6.葡萄糖;7.半乳糖;8.木糖;9.阿拉伯糖;10.岩藻糖
图3 混合对照HPLC色谱图
1.mannose;2.amino glucose,ribose(overlapping);3.isodulcite;4.glucuronic acid; 5.galacturonic acid glucose galactose;6.glucose;7.galactose;8.xylose;9.Arabia sugar;10.fucose
Fig.3 HPLC chromatogram of mixed control
2.6.3 相似度分析 采用国家药典委员会中药色谱指纹图谱相似度评价系统软件(2004A版),以均值法生成指纹图谱共有模式,衍生试剂空白峰、10批样品重叠图及对照图谱见图4~6。以共有模式为对照分析样品相似度,结果见表3,提示样品多糖组成较稳定。
3 讨论
3.1 香菇多糖提取方法的考察 实验发现,香菇在水提过程中有较多泡沫,且易出现爆沸现象。采用80%乙醇超声处理2次除杂质,同时在水提过程中应注意加入沸石并用较大的圆底烧瓶进行提取,以利于提取的顺利进行。香菇中多糖含量较高,采用水提取2次,以提取完全,并经过筛选。
3.2 香菇多糖水解衍生条件的考察 本研究选择TFA和PMP浓度分别为0.4 和0.5 mol·L-1[18],并进行了不同水解时间和衍生时间的筛选。以共有峰面积和作为评价指标,得到最优的水解时间和衍生时间分别为6 h和60 min。
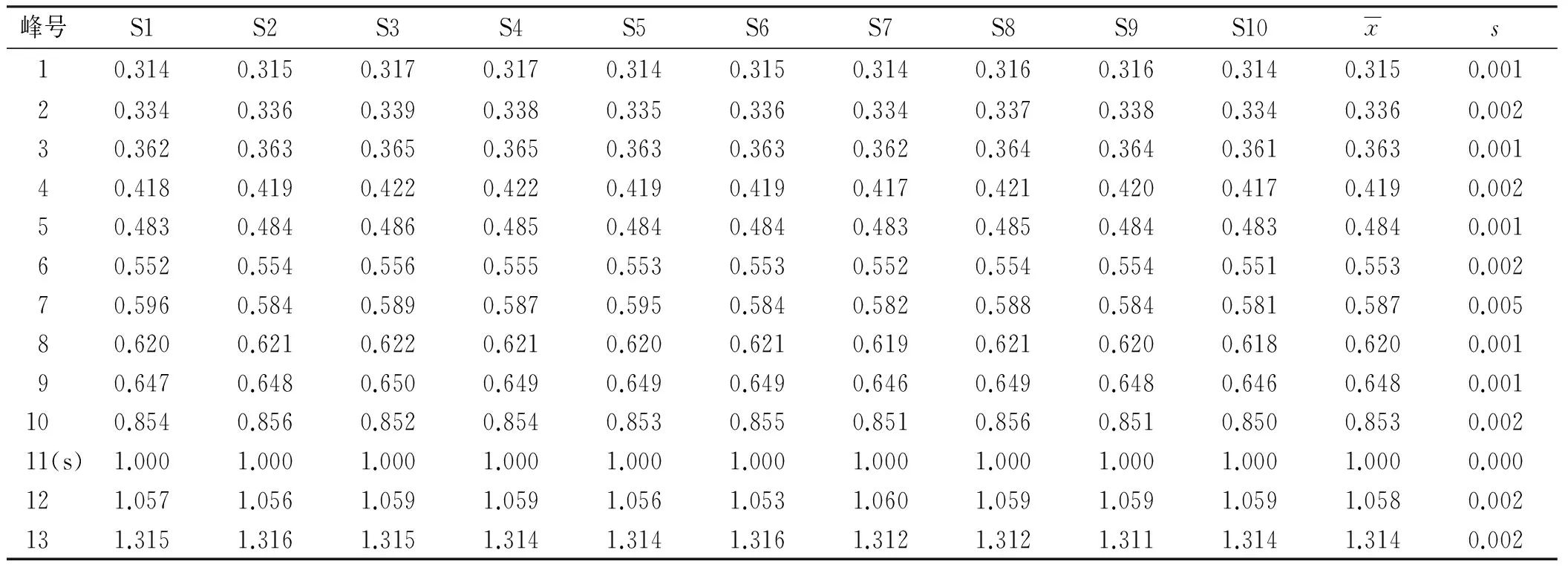
表1 10批香菇多糖共有峰相对保留时间
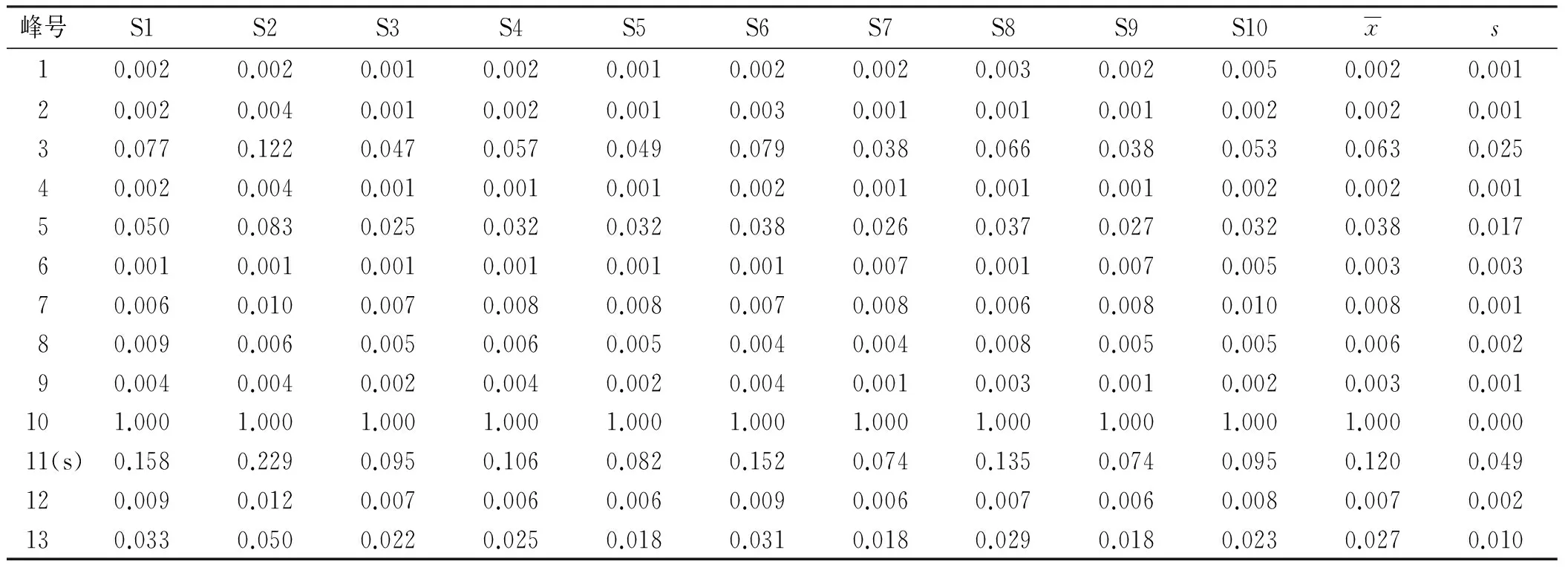
表2 10批香菇多糖共有峰相对峰面积

图4 衍生试剂HPLC图谱
图5 10批香菇多糖样品 HPLC 指纹图谱重叠图
Fig.5 HPLC overlapping fingerprint of ten batches of mushroom polysaccharides samples

1,2,4,5,6,7,8.待定;3.甘露糖;9.葡萄糖醛酸;10.葡萄糖;11.半乳糖;12.木糖;13.岩藻糖
图6 香菇多糖样品 HPLC 指纹图谱共有模式
1,2,4,5,6,7,8.undetermined;3.mannose;9.glucuronic acid;10.glucose;11.galactose;12.xylose;13.fucose
Fig.6 Common pattern of HPLC fingerprint of mushroom polysaccharides
3.3 样品指纹图谱分析 本研究采用酸水解柱前衍生HPLC法测定香菇多糖的单糖组成,共标示出13个特征峰,鉴别了6个色谱峰。从糖组成上可以看出,香菇多糖中葡萄糖的比例最大,与文献报道一致[16-17],其次是甘露糖、半乳糖及岩藻糖等,而其他色谱峰的峰面积相对较低。10批供试品相似度>0.99,表明香菇多糖PMP柱前衍生HPLC指纹图谱具有较好的稳定性和可控性,可作为香菇质量控制和评价指标的参考依据之一。
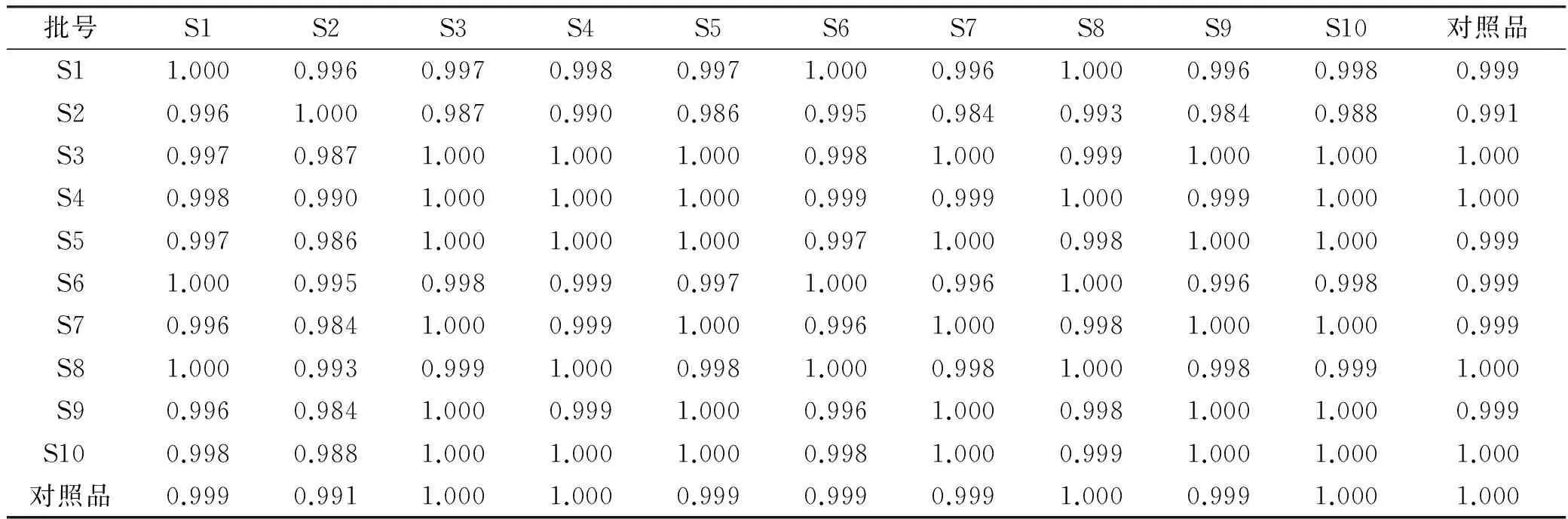
表3 香菇多糖HPLC指纹图谱相似度结果
[1] 国家中医药管理局《中华本草》编委会.中华本草(第3卷)[M].上海:上海科学技术出版社,1999:571-572.
[2] 何永,伍玉明,高红东,等.香菇营养成分研究进展[J].现代农业科技,2010,23(1):140-141.
[3] OOI V E C,LIU F.A review of pharmacological activities of mushroom polysaccharides [J].Int J Med Mushrooms,1999,1(1):195-206.
[4] 张鹏,苗玉荣,刘春英,等.香菇多糖对Lewis肺癌小鼠VEGF的表达及MVD的影响[J].宜春学院学报,2008,30(6):87-88.
[5] 芦殿荣,祝彼得,芦殿香,等.香菇多糖对正常小鼠以及免疫抑制小鼠免疫功能的影响[J].甘肃中医学院学报,2004,21(4):20-22.
[6] 罗若荣,林旭凯,蔡文德,等.香菇多糖对大鼠免疫调节作用的研究[J].现代预防医学,2007,34(21):4096-4097.
[7] 逯爱梅,于天贵.香菇多糖对谷氨酸损伤原代培养大鼠神经细胞保护作用的研究[J].中国老年学杂志,2008,28(4):337-339.
[8] 逯爱梅,于天贵,李文杰,等.香菇多糖改善衰老小鼠学习记忆能力的抗氧化机制[J].中国老年学杂志,2011,31(4):613-615.
[9] 孙设宗,孙欣,金波.香菇多糖对小鼠实验性肝损伤保护作用的研究[J].现代预防医学,2013,40(6):1035-1036,1039.
[10] 钟萍,孙延鹏,李萍,等.香菇多糖对酒精性肝损伤小鼠自由基及TNF-α含量的影响[J].山西医科大学学报,2012,43(6):401-404.
[11] 王慧铭,黄素霞,孙炜.香菇多糖对小鼠降血糖作用及其机制的研究[J].中国自然医学杂志,2005,7(3):181-183.
[12] 王慧铭,夏道宗,夏明,等.香菇多糖降血脂作用及其机制的研究[J].浙江中西医结合杂志,2005,15(10):599-602.
[13] 张福明,张淑芹,孙非,等.香菇多糖对流感病毒的抑制作用[J].长春中医药大学学报,2006,22(4):11-12.
[14] 马定远,陈君,李萍,等.柱前衍生化高效液相色谱法分析多糖中的单糖组成[J].分析化学研究简报,2002,30(6):702-705.
[15] 杨兴斌,赵燕,周四元,等.柱前衍生化高效液相色谱法分析当归多糖的单糖组成[J].分析化学研究简报,2005,33(9):1287-1290.
[16] 王金华,何霞辉.香菇多糖的提取纯化及成分分析[J].食用菌,1991,11(3):14.
[17] 李健,刘宁,阵平,等.香菇多糖单糖组成及含量的测定方法研究[J].化学与粘合,2005,27(2):71-74.
[18] 王浩豪.灵芝孢子粉多糖色谱指纹图谱及其免疫活性谱效关系的研究[D].无锡:江南大学,2012:2-8.
[19] 汲晨锋,季宇彬.高效毛细管电泳法测定香菇多糖中单糖的组成[J].化学与粘合,2006,28(4):276-278.
DOI 10.3870/yydb.2015.05.022
HPLC Fingerprint of Mushroom Polysaccharides by Pre-column Derivatization
CHEN Zhihui1,TAN Lirong2,LUO Ming1,HUANG Qimin2,ZHANG Meiling2,WEI Gang1
(1.GuangzhouUniversityofTCM,Guangzhou510006,China;2.Infinitus(China)CompanyLimited,Jiangmen529156,China)
Objective To establish the chromatographic fingerprint of mushroom polysaccharides by 1-phenyl-3-methyl-5-pyrazolone(PMP) pre-column derivatization. Methods The mushroom polysaccharides was extracted by hot distilled water, precipitated by alcohol, and hydrolyzed into monosaccharides by Trifluoroacetic Acid (TFA).The hydrolysate was derivatized with 1-phenyl-3-methyl-5-pyrazolone (PMP) and tested via HPLC to study the monosaccharide components in mushroom polysaccharides. Results Fingerprint was established with 13 common peaks, 6 peaks in which were identified as mannose,D-glucuronic acid,D-glucose, galactose, xylose andL-fucose.The glucose accounted for the most, followed by mannose, galactose and fucose. Conclusion Development of fingerprint chromatogram by HPLC is a stable, simple, and repeatable way, which can be applied to the quality control of mushroom polysaccharides.
Mushroom polysaccharides; Monosaccharide; Pre-column derivatization; Chromatography, high performance liquid; Fingerprint chromatogram
2014-07-08
2014-08-25
*广东省部产学研结合项目(2012B090600025)
陈志辉(1987-),女,湖南长沙人,硕士,从事创新中药研究与指纹图谱分析工作。电话:(0)13824448792,E-mail:czh198710@163.com。
魏刚(1969-),男,四川内江人,研究员,博士生导师,硕士,从事创新中药研究与指纹图谱分析工作。电话:020-39358519,E-mail:weigang021@163.com。
R282.71;R284
B
1004-0781(2015)05-0649-06

