白芍总苷对系统性红斑狼疮患者外周血B细胞内TLR9表达的影响*
王健,王信,陈琳洁,李志军
(安徽省蚌埠医学院第一附属医院风湿免疫科,蚌埠 233004)
白芍总苷对系统性红斑狼疮患者外周血B细胞内TLR9表达的影响*
王健,王信,陈琳洁,李志军
(安徽省蚌埠医学院第一附属医院风湿免疫科,蚌埠 233004)
目的 探讨白芍总苷(TGP)对系统性红斑狼疮(SLE)患者外周血B细胞内Toll样受体9(TLR9)表达的影响。方法 选取SLE患者60例和正常健康人30例,分离外周血单个核细胞(PBMC),每份标本均分为4组体外培养,即空白对照组、胞嘧啶-磷酸-鸟嘌呤-寡聚脱氧核苷酸(CpG-ODN)组、CpG-ODN+TGP组和TGP组。空白对照组仅加入RPMI-1640完全培养液,其他3组分别加入CpG-ODN(ODN终浓度1 μmol·L-1)、CpG-ODN+TPG(TPG最适终浓度为1×10-4mol·L-1)、TPG。各组均培养48 h后提取细胞,应用流式细胞仪检测各组B细胞内TLR9表达。结果 ①正常健康人:CpG-ODN组和空白对照组TLR9的表达率分别为(9.10±2.12)%,(4.96±2.11)%(P<0.01);②SLE患者:CpG-ODN组的TLR9表达率(14.86±3.42)%,显著高于空白对照组的(9.20±3.43)%(P<0.01),CpG-ODN+TGP组的TLR9表达率(11.95±3.63)%,低于CpG-ODN组(P<0.05);在SLE轻度活动患者中,CpG-ODN组和空白对照组TLR9的表达率分别为(10.74±3.17)%,(5.19±2.05)%(P<0.05);在SLE中重度活动患者中,CpG-ODN组和空白对照组TLR9的表达率分别为(16.51±1.72)%,(10.80±2.37)%(P<0.01),CpG-ODN+TGP组TLR9的表达率(13.59±2.58)%,低于CpG-ODN组(P<0.01)。结论 TGP可以拮抗CpG-ODN对B细胞内TLR9表达的上调作用。
白芍总苷;红斑狼疮,系统性;寡聚脱氧核苷酸;Toll样受体
系统性红斑狼疮(systemic lupus erythematosus,SLE)是典型的自身免疫性疾病,其特点为患者体内存在多种针对核抗原的自身抗体,抗原抗体形成免疫复合物并沉积于器官和组织,引起多系统受累。SLE的病理生理尚未完全了解,研究表明,Toll样受体(Toll-like receptors,TLRs)作为天然免疫中重要的模式识别受体,在先天性免疫和获得性免疫中发挥重要的作用,特别是TLR7和TLR9涉及免疫复合物识别,激活B细胞、树突状细胞,产生各种细胞因子,参与SLE的发病[1],并可减弱糖皮质激素对SLE的作用[2]。白芍总苷(total glucosides of paeony,TGP)是白芍的提取物,具有抗炎及免疫调节作用[3],对SLE亦有治疗作用,可以减少糖皮质激素和其他免疫抑制药的用量[4]。然而,TGP治疗SLE的作用机制目前尚不十分清楚。为深入了解TGP的药理学作用机制,为其治疗SLE提供科学依据,笔者应用TGP与外周血单个核细胞(peripheral blood mononuclear cells,PBMC)在体外共同孵育,探讨其对SLE患者外周血B淋巴细胞内TLR9表达的影响。
1 资料与方法
1.1 临床资料 收集蚌埠医学院第一附属医院风湿免疫科2011年6月—2012年1月门诊及住院患者,均符合美国风湿病协会(the American College of Rheumatology,ACR)1997年修订的SLE分类诊断标准[5]。共选择SLE患者60例,其中女59例,男1例,平均年龄(33.20±12.35)岁。均排除了病毒性肝炎、肿瘤和其他自身免疫疾病。所有患者6个月内未使用过抗疟疾类药物。SLE活动性指数(SLEDAI评分)的评分标准参见文献方法评分[6]。将SLE患者组按SLEDAI评分分为轻度活动(SLEDAI<10分)与中重度活动(SLEDAI≥10分),各30例。对照组30例为本院健康志愿者,平均年龄(28.37±11.30)岁。两组性别、年龄构成等均差异无统计学意义。本试验获得本单位伦理委员会批准,所有受试对象均知情同意。
1.2 试剂 胞嘧啶-磷酸-鸟嘌呤-寡聚脱氧核苷酸(cytosine phosphate guanine-oligodeoxynucleotides,CpG-ODN)的配制:CpG-ODN由生工生物工程(上海)股份有限公司合成,高效液相色谱纯化,序列如下:5′-TCGTCGAACGTTCGAGATGAT-3′;所有ODN的碱基全部经硫代修饰,紫外分光光度计定量,内毒素<0.25 EU·mg-1,无菌0.9%氯化钠溶液溶解,配成100 μmol·L-1储存液,分装后-20 ℃冻存。RPMI-1640配制:RPMI-1640干粉(GIBCO公司),用超纯水(Pall Pure Lab Plus UV/UF机制备)配制,补充L-谷氨酰胺2 mmol·L-1、二巯基乙醇 50 μmol·L-1、丙酮酸钠1 mmol·L-1、Hepes10 mmol·L-1、庆大霉素50 U·mL-1,调pH至7.2,经孔径0.22 μm滤膜滤过除菌后4 ℃备用。使用前加100 mL·L-1灭活新生小牛血清(new born bovine serum,NBS)。TGP溶液的配制:本试验所用的TGP为宁波朗生医药有限公司提供的TGP干粉,含量为90%,用配好的无菌RPMI-1640液配制,浓度为1×10-2mol·L-1,经孔径0.22 μm滤膜滤过除菌后4 ℃备用。使用前用无菌RPMI-1640液稀释10倍。
流式细胞仪所用检测抗体中PE-Cy5.5标记抗CD19单克隆抗体(小鼠抗人,批号:MHCD1918)和 PE-Cy5.5标记Mouse IgG1(批号:MG118,Isostype-Control)为美国Invitrogen公司产品;PE标记抗TLR9(CD289)单克隆抗体(大鼠抗人,批号:12-9099-82)和PE标记Rat IgG2a(批号:12-4321)均为美国eBioscience公司产品。
1.3 仪器 美国Becton Dickinson公司生产的FACSCalibur流式细胞仪,德国Eppendor公司生产的Eppendor 5810R低温离心机,蚌埠净化设备厂生产的CX-201型垂直层流工作台,美国Harris公司生产的Harris hw0301,T-VBA型二氧化碳(CO2)培养箱。
1.4 实验方法 无菌采集清晨空腹静脉血20 mL,分离PBMC,收集离心后的细胞,细胞计数,台盼蓝染色测定细胞活力,用RPMI-1640完全培养液调整细胞浓度至1×106个·mL-1,接种于24孔板中,每孔1 mL。置37 ℃、5% CO2恒温细胞培养箱中培养48 h。每份标本均分为4组体外培养,即空白对照组、CpG-ODN组、CpG-ODN+TGP组和TGP组,空白对照组仅加入RPMI-1640完全培养液,另3组组分别加入CpG-ODN(ODN终浓度1 μmol·L-1)、CpG-ODN+TPG(TPG最适终浓度为1×10-4mol·L-1)、TPG。各组均培养48 h后提取细胞及上清液,应用流式细胞仪检测培养后各组外周血CD19+B淋巴细胞内TLR9表达,比较各组之间TLR9的表达有无差异。
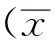
2 结果
2.1 正常健康人B淋巴细胞体外培养后TLR9的变化 CpG-ODN组TLR9的表达率显著高于空白对照组(P<0.01),平均荧光强度(mean flourscence indensity,MFI)显著高于空白对照组(P<0.05)。见表1。
2.2 SLE患者B淋巴细胞体外培养后TLR9表达的变化 CpG-ODN组TLR9的表达率显著高于空白对照组和CpG-ODN+TPG组(P<0.01或P<0.05)。 见表2。
2.3 不同活动度患者B淋巴细胞内TLR9的表达情况比较 在SLE轻度活动患者中,CpG-ODN组TLR9的表达率显著高于空白对照组(P<0.01)。见表3。
表1 正常健康人B淋巴细胞体外培养后TLR9的变化
Tab.1 Change of TLR9 expression in B lymphocytes from healthy people after cultureinvitro
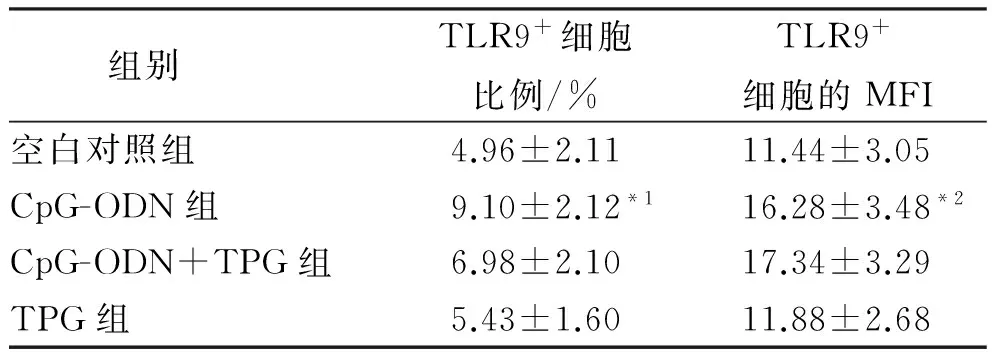
组别TLR9+细胞比例/%TLR9+细胞的MFI空白对照组4.96±2.1111.44±3.05CpG-ODN组9.10±2.12*116.28±3.48*2CpG-ODN+TPG组6.98±2.1017.34±3.29TPG组5.43±1.6011.88±2.68
与空白对照组比较,t=3.239,*1P<0.01;t=2.596,*2P<0.05
Compared with blank control group,t=3.239,*1P<0.01;t=2.596,*2P<0.05
表2 SLE患者B淋巴细胞体外培养后TLR9的变化
Tab.2 Change of TLR9 expression in B lymphocytes from SLE patients after cultureinvitro
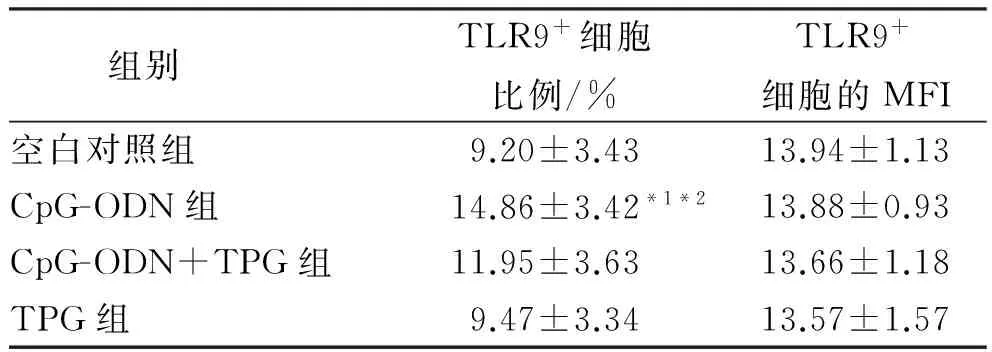
组别TLR9+细胞比例/%TLR9+细胞的MFI空白对照组9.20±3.4313.94±1.13CpG-ODN组14.86±3.42*1*213.88±0.93CpG-ODN+TPG组11.95±3.6313.66±1.18TPG组9.47±3.3413.57±1.57
与空白对照组比较,t=4.376,*1P<0.01;与CpG-ODN+TPG组比较,t=2.182,*2P<0.05
Compared with blank control group,t=4.376,*1P<0.01;compared with CpG-ODN plus TPG group,t=2.182,*2P<0.05
表3 SLE轻度活动组患者B淋巴细胞培养后TLR9的变化
Tab.3 Change of TLR9 expression in B lymphocytes from SLE patient at slightly active degree after cultureinvitro
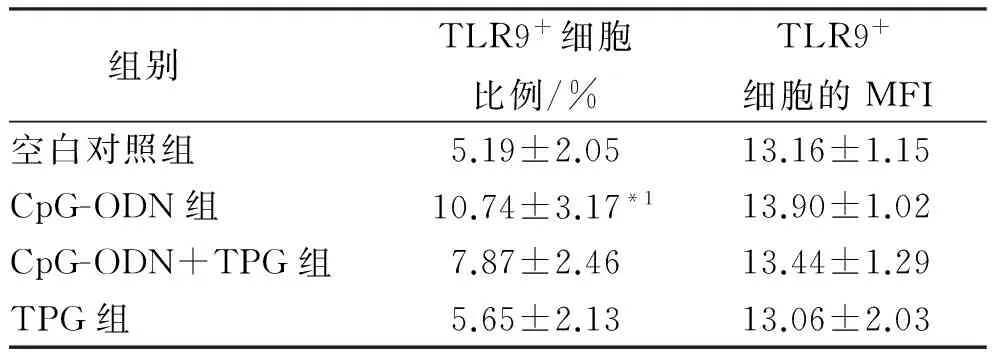
组别TLR9+细胞比例/%TLR9+细胞的MFI空白对照组5.19±2.0513.16±1.15CpG-ODN组10.74±3.17*113.90±1.02CpG-ODN+TPG组7.87±2.4613.44±1.29TPG组5.65±2.1313.06±2.03
与空白对照组比较,t=2.937,*1P<0.01
Compared with blank control group,t=2.937,*1P<0.01
在SLE中重度活动患者中,CpG-ODN组TLR9的表达率显著高于空白对照组和CpG-ODN+TPG组(均P<0.01)。见表4。
表4 SLE中重度活动患者B淋巴细胞培养后TLR9的变化
Tab.4 Change of TLR9 expression in B lymphocytes from SLE patients at moderately to vigorously active degree after cultureinvitro
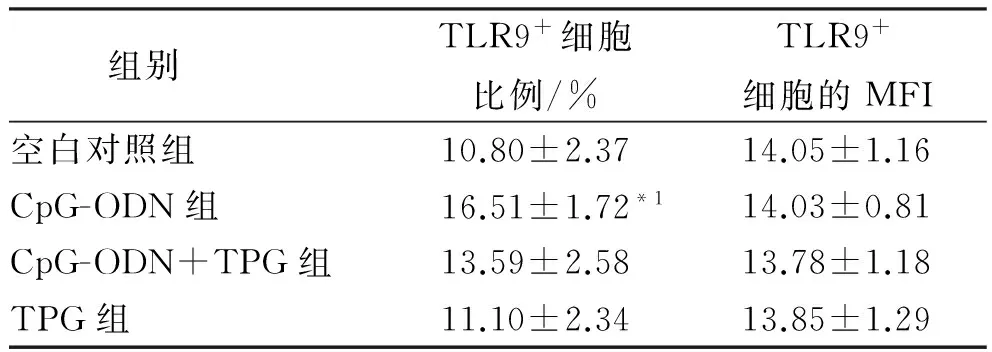
组别TLR9+细胞比例/%TLR9+细胞的MFI空白对照组10.80±2.3714.05±1.16CpG-ODN组16.51±1.72*114.03±0.81CpG-ODN+TPG组13.59±2.5813.78±1.18TPG组11.10±2.3413.85±1.29
与空白对照组和CpG-ODN+TPG组比较,t=6.170,2.986,*1P<0.01
Compared with normal control group and CpG-ODN plus TPG group,t=6.170,2.986,*1P<0.01
3 讨论
SLE是一种以自身反应性B细胞活化,多种自身抗体产生为特征的典型的自身免疫病,其发病机制尚未完全阐明。研究表明,TLRs对核酸成分的识别在SLE的自身反应性B细胞的活化和免疫复合物的沉积过程中发挥重要作用,特别是TLR7/9在SLE发病机制中有重要作用[7]。
人TLR9高表达于B细胞和浆细胞样树突状细胞,位于细胞内质网膜上,主要识别病毒和细菌中未甲基化的胞嘧啶-磷酸-鸟嘌呤序列(CpG-DNA),所以DNA病毒可引起TLR9介导的抗病毒反应,如鼠巨细胞病毒、单纯疱疹病毒1和2型及腺病毒均可以通过TLR9识别和激活浆细胞样树突状细胞从而产生干扰素-α(interferon-α,IFN-α)等细胞因子。TLR9也可以识别人工合成的CpG-ODN,可以模拟细菌或病毒DNA,具有相同的免疫刺激活性,CpG-ODN有B/K型、A/D型[8]及介于前两型之间的C型,后者拥有独特的5′端CpG修饰和3′端回文结构,既可以激活B细胞又可以引起IFN-α的分泌[9],而IFN-α为SLE患者血浆中高表达的细胞因子之一,可以诱导树突状细胞成熟、分化,并能增强其对自身抗原的捕获和呈递能力,从而打破耐受,诱导自身免疫应答,与SLE的发生、发展及转归相关[10]。王涛等[11]研究证实:SLE患者血浆IFN-α表达水平比健康人显著增高,与SLE患者疾病活动程度及部分临床指标有一定的相关性,IFN-α在SLE的发病中可能发挥着重要的作用。另一方面,应用IFN-α治疗不伴有自身免疫性疾病的患者会出现抗核抗体、抗ds-DNA抗体,甚至SLE综合征[12]。本试验中所用的CpG-ODN即为具有代表性的C型CpG-ODN。
本试验应用流式细胞仪检测培养48 h后PBMC中B淋巴细胞内TLR9的表达情况,结果显示在正常健康人和SLE患者中,加入CpG-ODN组的TLR9+细胞的比例显著高于空白对照组。同时,与空白对照组比较,CpG-ODN可以上调不同活动组患者PBMC中B淋巴细胞内TLR9的表达水平,且在中重度活动组中表现更为突出。ZORRO等[13]发现来源于SLE患者的B淋巴细胞对CpG-ODN的反应与SLE患者病情严重程度有关,本研究所得结果与此相同。推测CpG-ODN所引起的生物学效应可能是通过增加细胞内TLR9的表达来完成的。相关研究也证实CpG-ODN可以增加TLR9的表达,且这种增加可以被静脉注射用免疫球蛋白减弱[14]。但是,在SLE患者中,CpG-ODN组TLR9+细胞的MFI与空白对照组无明显差异,这跟正常健康人有所不同。可能因MFI主要是反映单个细胞上某种蛋白表达的强弱,SLE患者体内的免疫细胞功能有所缺陷,不同程度上影响了体内B细胞免疫反应,各组之间B淋巴细胞内TLR9表达的MFI水平有所不同,主要是表达TLR9蛋白的细胞数增多,而并非单个细胞上TLR9蛋白表达数量的增多,而在正常健康人中,由于其PBMC中B淋巴细胞功能完好,刺激后不仅表达TLR9蛋白的细胞数增多,而且在单个细胞上TLR9蛋白表达数量也有增加。
TGP加入含CpG-ODN的PBMC中共同培养48 h后,流式细胞仪分析结果显示,TLR9的表达量低于CpG-ODN组,提示TGP有拮抗CpG-ODN上调TLR9的作用,且和患者病情活动度相关。对TGP组结果分析显示,TLR9的表达量与空白对照组比较差异无统计学意义,提示TGP本身可能没有直接减弱TLR9表达的作用,而是在TLR9异常升高时通过某些物质对TLR9的上调作用来实现的。研究显示TGP可以抑制SLE患者和正常人PBMC分泌IFN-α[15],而SLE患者体内IFN-α含量应该是升高的,且与TLR9相关[16],间接提示TGP本身不能直接减弱TLR9的表达。张洪峰等[17]报道,SLE患者长期坚持应用TGP,可减少日平均泼尼松用量及环磷酰胺总量,减少复发例数及感染事件的发生,尤其是连续服用>5年者。研究发现,TGP可以通过调节转录因子Foxp3启动子甲基化的状态,激活IFN-γ和白细胞介素-2的信号传导,诱导调节性B细胞的分化,从而抑制SLE患者的自身免疫反应[18];可以通过选择性阻碍TLR4/5的信号传导,抑制树突状细胞的成熟与功能[19]。丁朝霞等[20]观察TGP对小鼠狼疮性肾炎的影响发现,TGP可以降低尿蛋白含量和血清抗dsDNA抗体、抗核抗体水平,明显改善肾组织病理损害,对小鼠狼疮性肾炎具有一定疗效。
总之,本研究结果表明,CpG-ODN可以促进外周血PBMC中B淋巴细胞内TLR9的表达,TGP可以减弱CpG-ODN对TLR9的表达上调作用,为深入研究TGP治疗SLE等自身免疫性疾病的机制提供线索。
[1] RICHEZ C,BLANCO,RIFRIN I,et al.Role for Toll-like receptors in autoimmune disease:the example of systemic lupus erythematosus[J].Joint Bone Spine,2011,78(2):124-130.
[2] GUIDUCCI C,GONG M,XU Z,et al.TLR recognition of self nucleic acids hampers glucocorticoid activity in lupus[J].Nature,2010,465(7300):937-941.
[3] 李传应,王春,魏伟.白芍总苷对小鼠慢性皮炎-湿疹的治疗作用及其部分机制[J].中国药理学通报,2008,24(10):1366-1369.
[4] 祝玉慧,魏春华.白芍总苷联合小剂量激素治疗系统性红斑狼疮35例临床观察[J].山东医药,2009,49(5):100-101.
[5] HOCHBERG M C.Updating the American college of rheu-matology revised criteria for the classification of systemic lupus erythematosus [J].Arthritis Rheum,1997,40(9):1725-1730.
[6] BOMBARDIER C,GLADMAN D D,UROWITZ M B,et al.Derivation of the SLEDAI,a disease activity index for lupus patients the committee on prognosis studies in SLE [J].Arthritis Rheum,1992,35(6):630-640.
[7]CELHAR T,MAGALHAES R,FAIRHURST A M.TLR7 and TLR9 in SLE:when sensing self goes wrong[J].Immunol Res,2012,53(1-3):58-77.
[8] KLINMAN D M.Immunotherapeutic uses of CpG oligodeo-xynucleotides [J].Nat Rev Immunol,2004,4(4) :249-258.
[9] HARTMANN G,BATTIANY J,POECK H,et al.Rational design of new CpG oligonucleotides that combine B cell activation with high IFN-alpha induction in plasmacytoid dendritic cells [J].Eur J Immunol,2003,33(6):1633-1641.
[10] NIEWORD T B.Interferon alpha as a primary pathogenic factor in human lupus[J].J Interferon Cytokine Res,2011,31(12):887-892.
[11] 王涛,江超,陈琳洁,等.系统性红斑狼疮患者血浆干扰素α的表达及临床意义[J].重庆医学,2012,41(17):1701-1703.
[12] RIZVI R,HOJJATI M.Interferon-α induced lupus in a pa-tient with chronic hepatitis C virus[J].J Clin Rheumatol,2011,17(3):152-153.
[13] ZORRO S,ARIAS M,PARIS S,et al.Response to CpG-ODN by B cells form patients with systemic lupus erythematosus correlates with disease activity[J].Lupus,2009,18(8):718-726.
[14] KESSEL A,PERI R,HAJ T,et al.IVIG attenuates TLR-9 activation in B cells from SLE patients[J].J Clin Immunol,2011,31(1):30-38.
[15] 刘雁,王健,刘国强,等.白芍总苷对正常人和SLE患者PBMC分泌IFN-α的影响[J].中华全科医学,2012,10(12):1843-1845.
[16] LASKA M J,TROLDBORG A,HANSEN B,et al.Polymor-phisms within Toll-like receptors are associated with systemic lupus erythematosus in a cohort of Danish females[J].Rheumatology(Oxford),2014,53(1):48-55.
[17] 张洪峰,肖卫国,侯平.白芍总苷治疗系统性红斑狼疮的临床研究[J].中国中西医结合杂志,2011,31(4):476-479.
[19] ZHOU Z,LIN J,HUO R,et al.Total glucosides of paeony attenuated functional maturation of dendritic cells via blocking TLR4/5 signalinginvivo[J].Int Immunopharmacol,2012,14(3):275-282.
[20] 丁朝霞,杨少锋,吴启富,等.白芍总苷对MRL/lpr小鼠狼疮性肾炎的影响[J].南方医科大学学报,2011,31(4):656-660.
DOI 10.3870/yydb.2015.05.006
Effect of Total Glucosides of Paeony on the Expression of Toll-like Receptor 9 in Peripheral Blood B Cells of Patients with Systemic Lupus Erythematosus
WANG Jian, WANG Xin, CHEN Linjie, LI Zhijun
(DepartmentofRheumatologyandImmunology,theFirstHospitalAffiliatedtoBengbuMedicalCollege,Bengbu233004,China)
Objective To investigate the effect of total glucosides of paeony (TGP) on the expression of Toll-like receptor 9 (TLR9) in peripheral blood B lymphocytes of the patients with systemic lupus erythematosus (SLE). Methods Sixty SLE patients and thirty healthy volunteers were enrolled, peripheral blood mononuclear cells (PBMC) were isolated from blood samples and divided into 4 groups, which were incubated with CpG-ODN(final concentration 1 μmol·L-1), CpG-ODN+TGP (TPG final concentration 1×10-4mol·L-1) ,TGP and RPMI medium (as the blank control group) for 48 hours, respectively.FLA (Flow cytometry analysis) was used to detect the expression of TLR9 on peripheral blood B lymphocytes after incubated. Results ①In the health people, TLR9 expression in the group of CpG-ODN was(9.10±2.12) %, which was higher than that in the blank control group(4.96±2.11) % (P<0.01).②In the SLE patients, the TLR9 expression in the group of CpG-ODN was(14.86±3.42)% , which was significantly higher than that in the blank control group(9.20±3.43) %(P<0.01).The TLR9 expression in the group of CpG-ODN+TGP was (11.95±3.63)%, which was lower than that in the group of CpG-ODN (P<0.05).The TLR9 expression in the group of CpG-ODN with lightly active SLE patients was (10.74±3.17)%, which was higher than that in the blank control group(5.19±2.05) % (P<0.01).For SLE from the moderately to vigorously active degree, the expression of TLR9 in the group of CpG-ODN(16.51±1.72) % was higher than the blank control group(10.80±2.37) %(P<0.01), but that in the group of CpG-ODN+TGP (13.59±2.58) % was lower than the group of CpG-ODN (P<0.01). Conclusion Our data indicate that TGP antagonize upregulation effect of CpG-ODN on the expression of TLR9 in peripheral blood B lymphocytes.
Total glucosides of paeony; Lupus erythematosus, systemic; Oligodeoxynucleotides; Toll-like receptor
2014-03-06
2014-10-01
*蚌埠医学院校自然科学项目(Byky1352)
王健(1985-),男,安徽芜湖人,住院医师,硕士,从事系统性自身免疫疾病的诊治工作。电话:0552-3086109,E-mail:wj606@live.com。
李志军(1962-),男,安徽合肥人,主任医师,教授,从事系统性自身免疫疾病的诊治。电话:0552-3086109,E-mail:lizhijun@medmail.com.cn。
R979.5;R593.24
A
1004-0781(2015)05-0589-05

