丹红注射液对低营养小鼠生理与生化指标的影响
谭浩,王浩,靳瑾,卞兰芳,沈秀,龙伟,樊赛军,周则卫
(1.天津市黄河医院药剂科,天津 300110;2.中国医学科学院北京协和医学院放射医学研究所,天津 300192)
丹红注射液对低营养小鼠生理与生化指标的影响
谭浩1,王浩2,靳瑾2,卞兰芳1,沈秀2,龙伟2,樊赛军2,周则卫2
(1.天津市黄河医院药剂科,天津 300110;2.中国医学科学院北京协和医学院放射医学研究所,天津 300192)
目的 观察小剂量丹红注射液对低营养模型小鼠生理及生化指标的影响,并评价其安全性。检验该体系在中药注射剂安全性再评价中的实用价值。方法 选取生长期ICR小鼠32只,制备玉米低营养小鼠模型,分为正常对照组(给予0.9%氯化钠溶液),以及丹红注射液小、中、大3个剂量(0.2,0.4及0.6 mL)组,每组8只;连续腹腔给药7 d,于第8天取血样后处死,完整剖取9种脏器组织,检测相关生理、生化指标。采用损益指数-总积分(BDI-GS)体系评价丹红注射液安全性。结果 丹红注射液对主要脏器或组织损伤较轻,BDI值均>0.85,GS值均>9.0;不同剂量丹红注射液对脾脏及胰腺的BDI值均>1.0,表现出良好的补益及健康效应,与正常对照组比较差异有统计学意义(P<0.05或P<0.01)。同时,表现出良好的降血糖效应。结论 丹红注射液在小剂量下用药风险低,安全性良好。同时,低营养模型结合BDI-GS体系可以作为临床中药注射剂安全性再评价的一种新方式。
丹红注射液;低营养模型;损益指数-总积分评价体系;安全性
中药注射剂是我国中医药发展的特色,是采用现代工艺方法,提取中药有效成分制成的可供注入人体的制剂[1]。由于多方面的影响因素,中药注射剂在临床用药安全方面存在一定的风险隐患,药品不良反应时有发生[2-3]。目前,国内对中药注射剂安全性均采用经典药物毒理学评价方法,是在数十倍甚至上百倍大剂量下评价其毒性反应,而且均使用普通标准鼠料进行评价。然而,其他领域的研究与实践表明[4-5],营养素及高营养具有一定的解毒作用,标准鼠料的高营养性有可能会影响受试中药的毒副作用表现,也难以揭示小剂量用药的毒副作用。目前尚缺乏在小剂量下药物毒副效应的安全性评价模型体系。因此,通过药理学技术方法开展中药注射剂安全性的再评价,对保证临床用药安全具有实际意义。笔者选取目前临床常用的中药注射剂——丹红注射液进行实验再评价,使用玉米低营养小鼠模型结合损益指数-总积分(Benefit Damage Index-General Score,BDI-GS)评价体系[6-7],通过小剂量下给药,观察其对动物生理及血液生化指标的影响。
1 材料与方法
1.1 动物 6~8周龄生长期雄性ICR小鼠32只,体质量18~21 g,由北京维通利华实验动物技术有限公司提供,饲养环境为无特定病原体(specific pathogen free,SPF)级实验动物房。实验动物使用许可证号:SYXK(津)2010-0004。动物合格证号:SCXK(京)2012-001。
1.2 饲料、试剂与仪器 饲料使用本地普通黄玉米粉(执行标准GB/T10463-89,天津市武清区华北玉米面加工厂生产)。所用药物:丹红注射液(国内某制药有限公司生产,批号:13042015),0.9%氯化钠注射液(山东齐都药业有限公司生产,批准文号:国药准字H37020766,批号:2013011702);主要仪器:HITACHI 7180型全自动生化分析仪(日本株式会社日立高新技术公司),Anke TGL-16G型台式离心机(上海安亭科学仪器厂),1/1 000 Mettler PL203型精密电子天平(梅特勒-托利多仪器上海有限公司),OLYMPUS SZX7-型体视生物显微镜(日本东京OLYMPUS公司)。
1.3 实验方法
1.3.1 饲料的选择与制备 玉米饲料以市售普通玉米细粉为原料,经过加水成型制成条柱状饲料,蒸制而成,制备4.0 kg,放冷后存入冰箱备用。
1.3.2 动物分组与处理 实验开始即换成玉米饲料。将小鼠随机分成4组,每组8只,即正常对照组给予0.9%氯化钠溶液0.4 mL;丹红注射液小、中、大3个剂量组,将丹红注射液以0.9%氯化钠溶液稀释10倍,分别腹腔注射0.2,0.4及0.6 mL,每天1次,共7 d。隔天称取体质量1次。于第8天称取体质量后,眼球取血,处死,解剖,检测指标参阅文献[6-7]的指标和方法。
1.4 BDI-GS评价方法 BDI=受试物实验指标统计均值结果/对照对应指标均值结果,可分为质量和系数BDI。以BDI值为依据,结合GS,作为整体综合补益健康效应及安全性价指标[6-7]。
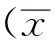
2 结果
2.1 小鼠体质量变化趋势 正常对照组小鼠体质量仅略有升高,表明玉米饲料的低营养性。丹红注射液0.2及0.4 mL组围绕初始体质量波动,基本恒定,而0.6 mL组小鼠终体质量明显下降,与正常对照组小鼠比较差异有统计学意义(P<0.01),表明丹红注射液在大剂量下对体质量指标影响较大。见图1。
2.2 脏器质量指标及其BDI-GS的评价结果 动物脏器质量指标及其BDI代表机体补益效应的高低。从表1可见,丹红注射液组小鼠脾脏及胰腺功能的补益效应良好,相应脏器指标均有提高,差异有统计学意义(P<0.05或P<0.01);而其他脏器多具有轻度或轻微损伤的负效应,个别脏器(0.6 mL丹红注射液对肾脏)差异有统计学意义(P<0.05)。从脏器质量及其BDI值分析,仅丹红注射液中剂量组2个脏器BDI<0.90,属轻度损伤;对肝肾及其他脏器组织的负面效应均属轻微影响。脏器局部的负面效应机体完全可以耐受,累计GSW值也均> 9.0(9项脏器质量累计总积分结果)。

图1 4组小鼠体质量变化趋势图
Fig.1 Curves of body mass changes in four groups of mice
2.3 脏器系数指标及其BDI-GS的评价结果 脏器系数指标及其BDI代表了受试物机体健康效应及安全性的高低。从表2可见,由于给予丹红注射液各组小鼠体质量均有所下降,相应的脏器系数及其BDI均有所升高。丹红注射液对脾脏及胰腺系数指标呈明显升高的有益效应,对肺脏及骨质系数呈轻微升高的有益效应(P<0.01),而对其他脏器系数随着剂量的改变也呈轻微有益或轻微负面的影响。从脏器组织系数BDI分析,丹红注射液对肝肾健康并没有造成明显的不良影响。累计GSI值均明显> 9.0分,表明丹红注射液对机体健康是有益的和安全的。
2.4 血清生化指标的评价结果 从表3可见,丹红注射液对丙氨酸氨基转移酶(alanine amino-transferase,ALT)、天冬氨酸氨基转移酶(aspartate amino-transferase,AST)等指标具有一定的降低作用,中、大剂量组ALT与正常对照组比较差异有统计学意义(P<0.05)。丹红注射液小、中、大剂量组对血清蛋白指标各有升降;对血清总蛋白影响不大,对清蛋白有明显降低作用;而对球蛋白具有剂量依赖性升高作用,与其具有的明显健脾功效相一致。丹红注射液小、中、大剂量组对血糖均有显著的降糖效应(P<0.01);对三酰甘油有明显的降低作用,且呈剂量依赖性,丹红注射液中、大剂量组与正常对照组差异有统计学意义(P<0.05
表1 4组小鼠脏器质量的评价结果
Tab.1 Evaluation on organ mass of four groups of mice


组别小鼠数体质量/g心脏质量/gBDI肺脏质量/gBDI胸腺质量/gBDI脾脏质量/gBDI正常对照组819.960±1.0100.113±0.020…0.140±0.020…0.040±0.010…0.080±0.020…丹红注射液 小剂量组819.160±0.8400.107±0.0100.950.134±0.0100.990.035±0.0200.900.100±0.020*11.33 中剂量组818.900±1.4100.098±0.0100.870.129±0.0100.960.038±0.0100.970.111±0.020*21.48 大剂量组818.310±1.050*30.104±0.0100.920.140±0.0201.040.038±0.0200.970.121±0.010*41.61组别胰腺质量/gBDI肝脏质量/gBDI肾脏质量/gBDI性腺质量/gBDI股骨质量/gBDIGSw/分正常对照组0.069±0.010…1.027±0.110…0.294±0.020…0.492±0.070…0.022±0.00……丹红注射液 小剂量组0.080±0.0201.161.001±0.1300.970.277±0.0200.940.480±0.0700.980.022±0.0001.009.22 中剂量组0.073±0.0101.060.934±0.0800.910.273±0.0200.930.440±0.0800.890.022±0.0001.009.07 大剂量组0.091±0.020*51.320.977±0.1300.950.264±0.030*60.900.453±0.1100.920.021±0.0000.959.58
与正常对照组比较,t=2.512,*1P<0.05,t=3.868,*2P<0.01,t=3.174,*3P<0.01,t=5.856,*4P<0.01,t=2.909,*5P<0.01,t=2.224,*6P<0.05
Compared with normal control group,t=2.512,*1P<0.05,t=3.868,*2P<0.01,t=3.174,*3P<0.01,t=5.856,*4P<0.01,t=2.909,*5P<0.01,t=2.224,*6P<0.05
表2 4组小鼠脏器系数的评价结果
Tab.2 Evaluation on organ indexes of four groups of mice

组别小鼠数心脏系数BDI肺脏系数BDI胸腺系数BDI脾脏系数BDI胰腺系数BDI正常对照组85.643±0.770…6.755±0.950…1.969±0.520…3.755±0.770…3.449±0.540…丹红注射液 小剂量组85.559±0.6200.996.965±0.4701.031.803±0.8300.925.183±0.980*11.384.149±1.0001.20 中剂量组85.190±0.4400.926.832±0.4301.012.028±0.5301.035.859±0.740*21.563.896±0.7501.13 大剂量组85.691±0.4801.017.701±1.2401.142.036±0.8601.036.649±0.860*31.774.926±0.780*41.43组别肝脏系数BDI肾脏系数BDI性腺系数BDI股骨系数BDIGSI9项指标累计/分正常对照组51.450±4.890…14.740±1.200…24.660±3.600…1.107±0.090……丹红注射液 小剂量组52.260±6.8801.0214.480±1.3900.9825.130±3.7501.021.135±0.1301.039.57 中剂量组49.410±2.0300.9614.470±1.1900.9823.170±2.8700.941.148±0.1001.049.57 大剂量组53.160±4.8101.0314.370±1.1500.9724.510±4.6400.991.149±0.1001.0410.41
与正常对照组比较,t=3.164,*1P<0.01,t=5.431,*2P<0.01,t=6.823,*3P<0.01,t=4.192,*4P<0.01
Compared with normal control group,t=3.164,*1P<0.01,t=5.431,*2P<0.01,t=6.823,*3P<0.01,t=4.192,*4P<0.01
或P<0.01);而对胆固醇影响不大。丹红注射液有一定的降低清蛋白及降糖、降脂功效与其降低小鼠体质量的宏观表现有一定的相关性。另外,丹红注射液对肾脏指标尿素氮亦有轻微降低作用;对血肌酐有明显的升高作用(P<0.05或P<0.01),原因不详。可能与其对肾脏的质量及系数的轻度负面影响相关,有待深入研究。
3 讨论
3.1 关于本体系剂量设计及安全性基本标准 经典毒理学方法在大剂量设计下评价并不能保证小剂量下没有任何不良反应,而且可能存在的不良反应信息也难以得到揭示,存在一定的不足之处。本研究小鼠按20 g体质量计算,通过人-鼠剂量生物等效折算系数12.33进行换算[8]。丹红注射液治疗用药剂量按稀释10倍折算成60 kg体质量成人的临床原药注射剂量,每只小鼠每次0.2 mL相当于人5 mL,依此类推0.4 mL相当于人10 mL,0.6 mL相当于人15 mL;基本符合或接近人体每次4 mL、每天2次的推荐剂量,也符合有时临床实际用药剂量偏大的实际情况。因此,本研究是在小剂量下进行的评价,其结果可以较好地拟合人体临床的实际治疗用药的效应。在小剂量下,如果药物在低营养饲料评价中仍然是安全的,表明药物的安全性更高,在临床应用中风险会更小。因此,本体系小剂量、低营养饲料的设计理念,特别适合于临床中药注射液安全性的再评价。
表3 4组小鼠血液生化指标评价结果
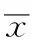
Tab.3 Evaluation on biochemical indexes of blood in four groups of mice±s
与正常对照组比较,t=2.765,*1P<0.01,t=2.579,*2P<0.01,t=2.827,*3P<0.01,t=7.647,*4P<0.01,t=3.837,*5P<0.01,t=3.312,*6P<0.01,t=3.312,*7P<0.01,t=2.338,*8P<0.05,t=3.060,*9P<0.01,t=2.566,*10P<0.01,t=4.377,*11P<0.01,t=3.500,*12P<0.01
Compared with normal control group,t=2.765,*1P<0.01,t=2.579,*2P<0.01,t=2.827,*3P<0.01,t=7.647,*4P<0.01,t=3.837,*5P<0.01,t=3.312,*6P<0.01,t=3.312,*7P<0.01,t=2.338,*8P<0.05,t=3.060,*9P<0.01,t=2.566,*10P<0.01,t=4.377,*11P<0.01,t=3.500,*12P<0.01
脏器系数指标是脏器质量对体质量的比值(单位mg·g-1),对处于正常生长期的实验动物而言,机体在健康生长状态下,各脏器组织发育得越好,质量生长越大其生理功能越强,同时占体质量份额越大承担机体的生理负荷相对越轻,该脏器就越不易生病、机体越健康;而脏腑虚损及机体肥胖的健康损害主要在于会增加机体脏器组织(功能单位)的生理负荷,而其不健康的风险特征均可以通过脏器系数及其BDI值的变小得以体现。因此,受试物对脏腑的补益、健康效应及风险均可以通过脏器质量和系数得到较好体现。通常受试物的风险更多通过脏器系数BDI和GSI来进行表征,更能反映其健康及安全性问题。如果受试中药存在明显的不良反应,系数BDI会明显<1.0(如<0.7)及GSI值会明显<9.0分(如<8.5分),短期连续用药就容易导致机体的健康损害,那么受试药物就会明确存在临床用药的安全问题,甚至会引起“药源性疾病”。本研究表明,低营养模型结合BDI-GS评价体系可以作为临床中药注射液安全性再评价的一种新方式,并可建立安全评价标准,以提高临床用药的安全性。
3.2 关于丹红注射液安全性及临床用药提示 传统中医认为脏器组织健康是机体健康的根本,结合本研究丹红注射液对机体重要脏器组织健康损伤程度的轻微性,均表明该药的组方配伍科学合理。本研究结果表明,在小剂量下使用丹红注射液安全性良好,与临床安全性再评价的结果相吻合[9-10]。相关报道也认为丹红注射液临床不良反应较少,偶见头晕、头痛、发热、皮疹,停药后均能恢复正常[11];罕见变态反应[12],表明其临床实际用药中安全性良好。同时,丹红注射液的健脾作用隶属于中医脾的功能范畴,根据传统中医“脾统血”脏腑功能的认识,患者在合理剂量下连续用药出血风险较低,蕴含着临床用药安全性方面会更具优势。
任何药物都具有一定的个体差异,即同一药物对于不同的人或动物个体在功效及安全性方面均存在差异,丹红注射液同样如此。虽然丹红注射液总体上安全性良好,但在临床中也要适当注意用药安全性的个体差异。本研究发现,随着给药剂量的增加在实验期间小鼠体质量变化差异加大,0.6 mL大剂量出现体质量明显下降;而个别小鼠体质量的明显下降可能是药物对个体特异性不良反应导致的一种结果。因此,提示临床不要随意加大治疗用药的剂量。而在小剂量下(如每次4 mL的推荐人体剂量)用药,个体危害性出现的概率很低,用药安全性良好。根据丹红注射液表现出明显的降血糖功效和一定降低血液清蛋白作用,提示在临床用药中应该对患者加强相关指标的监测;并在饮食上适当增加蛋白质类食物,使临床用药安全性更有保障。
3.3 关于丹红注射液主治功效及本研究发现 丹红注射液是采用现代工艺技术研制的新型中药制剂,主要含有从丹参、红花等提取的有效活性成分[13],具有明显的活血化瘀、通脉舒络的主治功效;可加快血液流通,改善血液循环,临床可用于冠心病心绞痛、心肌梗死、肺心病及缺血性脑病、脑血栓等血瘀诸症[14]。临床还拓展应用于多种病症的治疗,如降血脂、治疗肺纤维化、抗氧化,以及治疗骨折等[15-18]。本研究也表明其对三酰甘油有明显的降低作用,并发现其有明确而显著的降血糖效应。本研究还发现,该药同时还具有很好的健脾功效。而降糖功效与其健脾及活血化瘀增加胰岛素敏感性密切相关。
现代医学研究表明,心脑血管疾病与2型糖尿病之间有着互相促进的内在联系,均与血瘀、血液黏度高及动脉粥样硬化密切相关。2型糖尿病发病的一个重要原因是胰岛素抵抗,最终导致脾脏及胰腺的生理功能因过度分泌而劳伤受损。血瘀、高血脂及动脉硬化成为胰岛素抵抗的重要原因,因此活血化瘀和健脾兴胰均已成为中医治疗2型糖尿病的重要原则[19]。临床研究表明丹红注射液能改善糖尿病患者的血液流变学指标[20]。本研究表明,小剂量丹红注射液具有明显的健脾兴胰功效及降血糖、降血脂效应,结合其活血化瘀的主治功效,为其应用于糖尿病并发症的治疗[21-22]提供一定的实验支持,相关的治疗功效也值得特别重视。
[1] 于军,齐秋麟.丹红注射液上市后安全性再评价研究报告[J].天津药学,2012,24(5):15-17.
[2] 梁延燕,刘兰茹,朱虹,等.基于2010—2011年文献中的中药注射剂不良反应/事件分析[J].医药导报,2013,32(6):815-818.
[3] 于栋伟,顾琴华,卢恒清,等.中药注射剂临床安全使用的管理规范[J].医药导报,2012,31(7):962-965.
[4] HENNIG B,ETTINGER A S,JANDACEK R J,et al.Using nutrition for intervention and prevention against environmental chemical toxicity and associated diseases[J].Environ Health Perspect,2007,115(2):493-495.
[5] 王德明.胃肠高营养疗法在晚期卵巢癌治疗中的应用[J].川北医学院学报,2003,18(2):144-145.
[6] 靳瑾,龙伟,沈秀,等.补中益气丸对小鼠的补益功效的实验研究[J].中医杂志,2013,54(24):2135-2139.
[7] 李卫红,王浩,沈秀,等.用BDI-GS新体系评价传统中药六味地黄丸的功效[J].中华中医药学刊,2014,32(1):181-184.
[8] 黄继汉,黄晓晖,陈志扬,等.药理实验中动物间和动物与人体间的等效剂量换算[J].中国临床药理学与治疗学,2004,9(9):1069-1072.
[9] 张春喜,王春胜.丹红注射液上市后安全性再评价研究[J].天津药学,2012,24(6):14-15.
[10] 康阿龙,张娴,黄黎明,等.主动集中监测法评价700例丹红注射液临床应用的安全性[J].中国药物警戒,2012,9(6):360-362.
[11] 唐进法,李学林.丹红注射液不良反应的病历回顾研究[J].中药与临床,2011,2(5):48-50.
[12] 徐志宏,文君.丹红注射液致过敏反应1例[J].北方药学,2012,9(9):102.
[13] 张茹,宋巧凤,王希柱.丹红注射液对冠心病患者血管内皮功能影响的临床研究[J].中国药房,2008,19(2):1664-1665.
[14] 王桂英.丹红注射液临床应用研究现状[J].天津药学,2012,24(6):57-60.
[15] 贾秋颖.丹红注射液对老年患者血脂的调节作用[J].中国实用医药,2012,7(4):162-163.
[16] 任锋萍,王利民.丹红注射液治疗特发性肺纤维化的药理作用及安全性分析[J].中国现代医生,2012,50(1):140-141.
[17] 刘灵芝.丹红注射液对自然衰老大鼠心脏、大脑组织SOD、MDA 及GSH-Px的影响[J].中国实用神经疾病杂志,2012,15(17):73-74.
[18] 吕瑞岩.丹红注射液治疗骨折的临床研究进展[J].中国民康医学,2012,24(24):3065.
[19] 白卫莲,赵莉娟.糖尿病从血瘀论治思路探讨[J].世界中西医结合杂志,2010,5(10):900-902.
[20] 张志英,董利平,杨海燕.丹红注射液对糖尿病患者血液流变学的影响[J].时珍国医国药,2007,18(9):2272-2273.
[21] 杜书章.丹红注射液治疗糖尿病周围神经病变疗效的 Meta 分析[J].医药导报,2010,29(12):1651-1652.
[22] 何泽.辨证应用丹红注射液治疗糖尿病合并冠心病心绞痛40例临床疗效观察[J].中国实用医药,2012,7(2):151-152.
DOI 10.3870/yydb.2015.05.008
Impacts ofDanhongInjection on Physiological and Biochemical Indicators in Malnourished Mice
TAN Hao1, WANG Hao2, JIN Jin2, BIAN Lanfang1, SHEN Xiu2, LONG Wei2, FAN Saijun2,ZHOU Zewei2
(1.DepartmentofPharmacy,TianjinHuangheHospital,Tianjin300110,China;2.InstituteofRadiationMedicine,ChineseAcademyofMedicalSciences&PekingUnionMedicalCollege,Tianjin300192,China)
Objective To explore the impacts ofDanhonginjection on physiological and biochemical indicators in malnourished mice at low doses, evaluate its safety, and test the practical value of safety re-evaluation of Traditional Chinese Medicinal (TCM)injections. Methods A total of 32 ICR mice during growth period were selected to set up corn deficient nutrition model.Mice were assigned into the normal control group (given 0.9% saline),Danhonginjection at low, medium and high dosages (0.2, 0.4 and 0.6 mL) groups (n=8 in each group); Mice were administered with respective medications intraperitoneally for 7 consecutive days.Blood samples were taken and mice were executed on the 8th day.All 9 kinds of organ or tissue were obtained completely, to measure related physiological and serum biochemical parameters.The safety ofDanhonginjection was evaluated by using Benefit and Damage Index - General Score (BDI-GS) system. Results TheDanhonginjection showed only slight damages on major organs or tissues, the BDI values were all above 0.85, and the GS values were all above 9.0; BDI values forDanhonginjection at different dosages were all above 1.0 for spleen and pancreas, showing better replenishing and healthy effects, and the differences were of statistical significance compared with the normal control group (P<0.05 orP<0.01).Meanwhile, it exerted obviously hypoglycemic effect. ConclusionDanhonginjection is of rather low risk under low doses, and therefore is safe to use.The mal-nutrition model combined with the BDI-GS system may be developed as a novel approach for safety re-evaluation of TCM injection in clinic.
Danhonginjection;Low nutrition model; Benefit and Damage Index-General Score (BDI-GS) system; Safety
2013-12-25
2014-07-13
谭浩(1972-),女,天津人,主管药师,硕士,研究方向:医院药学。电话:022-27652250,E-mail:tanhao_tj@163.com。
周则卫(1966-),男,天津人,研究员,硕士生导师,硕士,研究方向:药物及功能食品。电话:022-85683018,E-mail:zhouzewei@irm-cams.ac.cn。
R286;R285.5
A
1004-0781(2015)05-0598-05

