金叶败毒颗粒防治妊娠中期巨细胞病毒宫内感染的实验研究*
李伟,熊锦文,陈娟娟,刘涛,肖娟,刘静,张艳丽,冯云,曾雪,陈素华
(1.华中科技大学同济医学院附属同济医院妇产科,武汉 430030;2.武警湖北总队医院妇科,武汉 430061;3.广州医科大学附属第三医院妇产科,广州 510150;4.山东省泰安市中心医院生殖遗传科,泰安 271000)
金叶败毒颗粒防治妊娠中期巨细胞病毒宫内感染的实验研究*
李伟1,熊锦文2,陈娟娟3,刘涛4,肖娟1,刘静1,张艳丽1,冯云1,曾雪1,陈素华1
(1.华中科技大学同济医学院附属同济医院妇产科,武汉 430030;2.武警湖北总队医院妇科,武汉 430061;3.广州医科大学附属第三医院妇产科,广州 510150;4.山东省泰安市中心医院生殖遗传科,泰安 271000)
目的 观察金叶败毒颗粒防治妊娠中期豚鼠巨细胞病毒宫内感染的效果。方法 选择无感染史、性成熟期雌雄豚鼠同笼受精,随机选择妊娠中期母豚鼠,分为3组,每组15只,正常对照组无特殊处理,模型对照组腹腔接种病毒,金叶败毒组接种病毒同时灌胃给予金叶败毒颗粒(3.09 mL· kg-1),7 d后观察各组母豚鼠病毒血症发生率,20 d后观察各组胎盘感染率、胎仔感染率及死胎率。结果 正常对照组和模型对照组死胎率分别为8.33%,34.55%(P<0.05)。模型对照组和金叶败毒组亲代感染率分别为86.67%,33.33%;胎盘感染率分别为91.67%,61.22%;胎仔感染率分别为90.91%,48.28%;死胎率分别为34.55%,15.52%(均P<0.05)。结论 金叶败毒颗粒可减少妊娠中期病毒接种引起的母胎感染及胎仔死亡,减少胎盘感染。
金叶败毒颗粒;巨细胞病毒;感染,宫内
人巨细胞病毒(human cytomegalovirus,HCMV)是人类最常见的宫内感染病原体,妊娠期感染可导致流产、死胎、小头畸形、出生后感音神经性耳聋、智力障碍、眼视网膜脉络膜炎、新生儿黄疸等不良后果[1-2]。HCMV宫内感染导致的长时程神经系统后遗症患儿数量已经超过了Down 综合征和胎儿酒精综合征[3]。目前,HCMV疫苗研制尚未成熟,更昔洛韦广泛应用于防治器官移植及人类免疫缺陷病毒感染并发HCMV感染患者,但其致畸毒性限制了在围产期的使用[4]。金叶败毒颗粒(曾用名:抗炎6号、热毒清)主要成分包括金银花(君药)、大青叶(臣药)、蒲公英、鱼腥草等,是华中科技大学同济医学院附属同济医院中西医结合研究所经过30余年的基础研究和临床研究制备而成的一种清热解毒中药,动物实验表明其无生殖毒性,不会致畸[5]。体外实验亦证实金叶败毒颗粒尤其是其主要成分金银花(主要有效成分为绿原酸)具有体外抗HCMV感染的作用[6-7]。笔者采用豚鼠巨细胞病毒(guinea pig cytomegalovirus,GPCMV)宫内感染实验动物模型,观察抗病毒药物金叶败毒颗粒防治妊娠中期CMV宫内感染的效果,报道如下。
1 材料与方法
1.1 细胞与病毒 豚鼠胚肺成纤维细胞株(guinea pig embryo lung fibroblast,GPEL) 和豚鼠巨细胞病毒标准株22122 均购于美国典藏物种保存中心(American Type Culture Collection,ATCC)。病毒采用上述细胞培养传代并进行病毒毒力检测。
1.2 试剂与仪器 树脂型基因组DNA提纯试剂盒(批号:G5907),2×Taq PCR Master Mix,琼脂糖,大鼠灌胃针(均购于武汉天根生化科技有限公司),PTC-150型PCR扩增仪(Biometra公司),DYCZ-22B型恒压恒流电泳仪(北京六一仪器厂)。
1.3 药物与给药方法 金叶败毒颗粒由华中科技大学同济医学院附属同济医院药学部制剂中心提供(批准文号:鄂药制字Z20111174,批号:20111128,20120620,20121211,20130122,20130416)。按人与豚鼠体质量剂量折算系数[5],换算每只豚鼠每日给药剂量(3.09 mL· kg-1)。将每日给药量均分为3份,每日分3次灌胃给药。用药期间,逐日测量豚鼠体质量,根据体质量变化情况逐日调整给药剂量。
1.4 动物模型建立及实验分组 清洁级Hartley豚鼠,大于6个月龄,雌性体质量(650±50) g,雄性体质量(700±50) g,购于湖北省医学实验动物中心,生产许可证号:SCXK(鄂)2008-0005,动物合格证号:4200600247。在华中科技大学实验动物中心[使用许可证:SCXK(鄂)2010-0057]半屏障环境适应性饲养1周后,应用巢式聚合酶链反应(nested-polymerase chain reaction,N-PCR) 筛查GPCMV-DNA 阴性的雌雄豚鼠,夜间按4:1比例合笼交配,次日清晨观察雌豚鼠阴道有无精栓,发现精栓时确认为受孕第0天,受孕第1~20天为早期妊娠,第21~40天为中期妊娠,第41天至分娩为晚期妊娠[8]。选择孕龄21 d雌豚鼠按随机数字表法随机分为3组,每组15只:正常对照组不予特殊处理,模型对照组每只腹腔注射GPCMV病毒悬液1 mL,金叶败毒组在接种病毒的同时灌胃给予金叶败毒颗粒,连续14 d。接种病毒7 d母豚鼠心脏采血检测GPCMV-DNA,接种病毒20 d乙醚麻醉处死母豚鼠,记录活胎及死胎数目,无菌收集亲代及子代血液、唾液腺、胸腺、脑、肝脏、肺脏、肾脏等脏器组织,检测各组织GPCMV-DNA。
1.5 检测方法及条件
1.5.1 N-PCR病原学检测 ①引物设计:两对引物序列见参考文献[9-10],第1对引物序列5′-AAGCTTGAGGGTTGTTATTC-3′和5′-GCCTCGCCTA-TGCCTTTACC-3′,基因位置分别为2 208~2 227和2 667~2 686,扩增片段长度为479 bp;第2对引物序列为5′-TGTTATTCTAGACCCG-3′和5′-AATATCTATT-TCGCTGA-3′,基因位置分别为2 220~2 235和2 416~2 432,位于第1次扩增片段内侧,扩增片段长度231 bp。②扩增体系:第1次扩增反应体系25 μL,包括上、下游引物各1.0 μL(10 μmol·L-1),2×Taq PCR Master Mix 12.5 μL,双蒸水8.5 μL、待检标本2.0 μL。第2次扩增反应体系24 μL,包含上、下游引物各1.0 μL(10 μmol·L-1)、2×Taq PCR Master Mix 12.0 μL,双蒸水10.0 μL及第1次扩增产物1.0 μL。③扩增条件:第1次扩增采用94 ℃预变性2 min,94 ℃变性25 s、55 ℃复性25 s、72 ℃延伸50 s共反应36个循环,72 ℃延伸10 min。第2次扩增采用94 ℃预变性2 min,再94 ℃变性35 s、42 ℃复性35 s、72 ℃延伸50 s共35个循环,72 ℃延伸10 min。④结果判定:取反应终产物5 μL,2%琼脂糖凝胶、90 V电泳30 min,在紫外灯下观察,摄相。每次均设置阴性对照(HSV-Ⅰ、HSV-Ⅱ毒株)、空白对照和阳性对照(GPCMV悬液)。
1.5.2 病理学检查 切取相同大小脏器组织块,磷酸盐缓冲液漂洗,10%甲醛缓冲液固定过夜,常规石蜡包埋、切片、苏木精-伊红(hematoxylin-eosinstaining,HE)染色、镜检,光镜下观察组织形态学特点。
1.6 诊断标准 母豚鼠感染:血液或任一脏器组织标本GPCMV-DNA阳性。胎盘感染:胎盘GPCMV-DNA阳性。宫内(胎仔)感染:脐带血或胎仔任一脏器组织标本GPCMV-DNA阳性。
1.7 统计学方法 应用Graphpad Prism 5.0版软件包进行卡方检验及双侧直接概率法检验。以P<0.05为差异有统计学意义。
2 结果
2.1 母豚鼠感染情况 各组母豚鼠感染情况见表1。其中,母豚鼠病毒血症征象包括被毛逆立、少食多睡、体质量下降等。统计学结果显示,金叶败毒颗粒能减少妊娠中期接种GPCMV导致的母豚鼠感染。
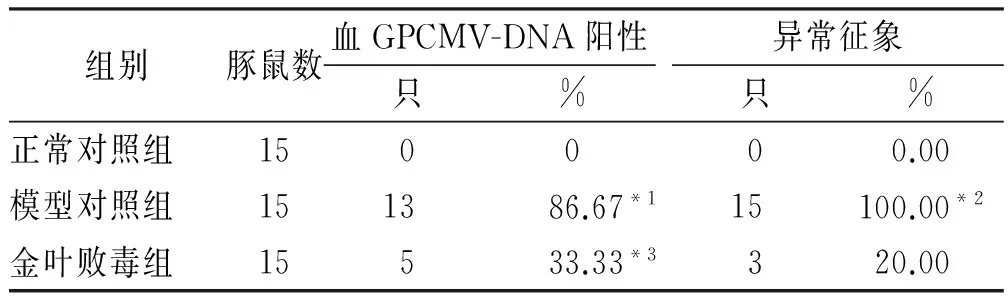
表1 3组母豚鼠感染情况
与正常对照组比较,χ2=22.94,*1P<0.01,χ2=30.00,*2P<0.01;与模型对照组比较,χ2=8.89,*3P<0.01
Compared with normol control group,χ2=22.94,*1P<0.01,χ2=30.00,*2P<0.01;Compared with model control group,χ2=8.89,*3P<0.01
2.2 胎盘感染情况 各组胎盘GPCMV-DNA检测结果见表2。感染胎盘光镜下可见单核细胞或浆细胞浸润,间质细胞增生,未见明显病毒包涵体。表明金叶败毒颗粒能有效降低孕中期病毒接种导致的胎盘感染。

表2 3组胎盘感染情况
与正常对照组比较,χ2=79.01,*1P<0.01,χ2=47.32,*2P<0.01;与模型对照组比较,χ2=10.03,*3P<0.01
Compared with normol control group,χ2=79.01,*1P<0.01,χ2=47.32,*2P<0.01;Compared with model control group,χ2=10.03,*3P<0.01
2.3 宫内感染情况 各组宫内感染情况见表3。结果表明,金叶败毒颗粒能够降低妊娠中期病毒接种引起的宫内传播。
2.4 死胎情况 各组死胎情况见表4。病理学检查发现,感染死亡胎仔存在肺间质炎性变、唾液腺导管细胞肿胀变性、脑细胞水肿、肾曲小管肿胀和间质水肿等病变。上述结果提示,孕中期母豚鼠接种病毒,可引起宫内传播及胎仔死亡,金叶败毒颗粒能减少妊娠中期病毒接种导致的宫内传播及胎仔死亡。
3 讨论
由于豚鼠具有与人类相似的妊娠特点(妊娠周期较长,可模拟3个妊娠阶段,胎盘结构相似,GPCMV可以通过胎盘发生宫内传播等),GPCMV宫内感染临床表现与HCMV 宫内感染相似[7],应用GPCMV宫内感染实验动物模型研究HCMV宫内感染发病机制、防治方案等,受到国际同行的广泛认可[11-12]。

表3 3组宫内(胎仔)感染情况
与正常对照组比较,χ2=96.50,*1P<0.01,χ2=37.98,*2P<0.01;与模型对照组比较,χ2=24.00,*3P<0.01
Compared with normol control group,χ2=96.50,*1P<0.01,χ2=37.98,*2P<0.01;Compared with model control group,χ2=24.00,*3P<0.01

表4 3组死胎情况
与正常对照组比较,χ2=11.94,*1P<0.01,χ2=48.81,*2P<0.01;与模型对照组比较,χ2=5.48,*3P<0.05
Compared with normol control group,χ2=11.94,*1P<0.01,χ2=48.81,*2P<0.01;Compared with model control group,χ2=5.48,*3P<0.05
中医理论认为,宫内感染乃是热邪之毒侵袭胞宫,辨证施治可采用清热解毒之法。金叶败毒颗粒主要有效成分为金银花、大青叶、蒲公英、鱼腥草,主要功效是清热解毒,急性毒性实验、长期毒性实验、生殖毒性实验结果均为阴性[5]。体外实验及整体动物实验模型证实,该药具有抗CMV作用[5],可减少孕早期病毒接种引起的母胎感染、胎盘感染及胎仔异常[13]。本研究证实,该药能降低妊娠中期病毒接种引起的母豚鼠感染率、胎盘感染率、胎仔感染率以及胎仔死亡率。减少亲代感染率及胎盘感染率,减轻胎盘感染引起的非特异性炎症反应以及相应的胎盘功能损伤,可能是该药阻断宫内传播、减少死胎的重要机制之一。笔者将进一步研究不同病毒接种剂量、不同给药剂量下,该药对GPCMV宫内传播及子代发育的影响。
[1] SCHLEISS M R.Cytomegalovirus in the neonate:immune correlates of infection and protection[EB/OL].[2013-03-07].http.www.hindawi.com/journals/jir/2013/501801.
[2] NYHOLM J L,SCHLEISS M R.Prevention of maternal cytomegalovirus infection:current status and future prospects [J].Int J Women’s Health,2010,2(1):23-35.
[3] CANNONANNON M J,FINN D K.Washing our hands of the congenital cytomegalovirus disease epidemic [J].BMC Public Health,2005,5(1):70-77.
[4] LACKNER A,ACHAM A,ALBORNO T,et al.Effect on hearing of ganciclovir therapy for asymptomatic congenital cytomegalovirus infection:four to 10 year follow up [J].J Laryngol Otol,2009,123(4):391-396.
[5] 陈素华,熊锦文,邢玮,等.中药金叶败毒防治巨细胞病毒宫内感染的动物实验初探 [J].中华检验医学杂志,2003,26(4):248.
[6] 姜宏,闻良珍,凌霞珍,等.中药热毒清对人巨细胞病毒抑制作用的实验与临床研究 [J].中华实验和临床病毒学杂志,1999,13(2):175-179.
[7] 陈娟娟,方建国,陈素华,等.绿原酸体外抗人巨细胞病毒的实验研究[J].医药导报,2009,28(9):1138-1141.
[8] 施新猷.现代医学实验动物学 [M].北京:人民军医出版社,2000:335.
[9] GRIFFITH B P,HSIUNG G D.Cytomegalovirus infection in the guinea pigs,maternal infection at different stages of gestation [J].J Infect Dis,1980,141(4):787-793.
[10] BIA F J,GRIFFITH B P,FONG C K Y,et al.Cytomega-lovirus infection in the guinea pig:experimental models for human disease [J].Rev Infect Dis,1983,5(1):177-195.
[11] HARRISM C J,BRITT W J,CHAPMAN N M,et al.Red-uced congenital cytomegalovirus infection after maternal iImmunization with a guinea pig CMV glycoprotein before gestational primary CMV infection in the guinea pig model [J].J Infect Dis,1995,172(5):1212-1220.
[12] OLEJNICZAK M J,CHOI K Y,MCVOY M A,et al.Intra-vaginal cytomegalovirus(CMV) challenge elicits maternal viremia and results in congenital transmission in a guinea pig model [J].Virol J,2011,8(1):89.
[13] 陈素华,熊锦文,邢玮,等.金叶败毒治疗孕早期豚鼠巨细胞病毒感染的研究 [J].医药导报,2004,23(1):1-3.
DOI 10.3870/yydb.2015.05.005
Experimental Study of Prevention and Therapeutic Effect ofJinyebaiduGranules on Cytomegalovirus Infection During Mid-pregnancy
LI Wei1, XIONG Jinwen2, CHEN Juanjuan3, LIU Tao4, XIAO Juan1, LIU Jing1, ZHANG Yanli1, FENG Yun1, ZENG Xue1, CHEN Suhua1
(1.DepartmentofObstericsandGynecology,TongjiHospital,TongjiMedicalCollege,HuazhongUniversityofScienceandTechnology,Wuhan430030,China; 2.DepartmentofGynecology,HubeiGeneralHospital,ChineseArmedPoliceForce,Wuhan430061,China; 3.DepartmentofObstericsandGynecology,theThirdHospitalAffiliatedtoGuangzhouMedicalUniversity,Guangzhou510150,China; 4.CenterforReproductiveGenetics,TaianCentralHospitalofShandongProvince,Taian271000,China)
Objective To study the effect ofJingyebaidugranules on treating cytomegalovirus (CMV) infection during mid-pregnancy. Methods The sexually mature guinea pigs with no CMV infection history served as the subjects.Put the male and female ones in the same cages.Then the female ones were randomly divided into three groups during mid-pregnancy.Model control group: 15 guinea pigs which were inoculated 1 mL suspension of GPCMV intraperitoneally.Jingyebaidugroup: 15 guinea pigs which were treated withJingyebaidu(3.09 mL·kg-1)through stomach perfusion after inoculation for 14 days.Normal control group: 15 normal mid-pregnant guinea pigs.Viremia rates were examined 7 days after infection.All animals were sacrificed 20 days after infection.The placenta infection rate, pup infection rate, still-born rate were examined. Results Compared with the normal controls, the still-born rate was increased in model control group(8.33%vs34.55%,P<0.05).In comparison to the model control group, the GPCMV maternal infection rate(86.67%vs33.33%), placenta infection rate(91.67%vs61.22%), pup infection rate(90.91%vs48.28%), still-born rate(34.55%vs15.52%) were significantly decreased in theJinyebaidugroup (allP<0.05). ConclusionJinyebaidugranules could reduce maternal infection,pup loss, and placenta infection caused by CMV inoculation during mid-pregnancy.
Jingyebaidugranules; Cytomegalovirus; Infection, intrauterine
2014-02-14
2014-07-13
*国家自然科学基金资助项目(81200354)
李伟(1984 -),男,河南信阳人,在读博士,主要从事围产医学研究。电话:027-83663857,E-mail:topliwei@hotmail.com。
陈素华(1961-),女,湖北武汉人,教授,主任医师,博士生导师,主要从事围产医学研究。电话:027-83663857,E-mail:chen_suhua@mail.hust.edu.cn。
R978.7;R286;R285.5
A
1004-0781(2015)05-0585-04

