法舒地尔对结肠炎模型大鼠的治疗作用*
望运玲,岳源,武双婵,丁虹
(1.湖北省宜昌市第二人民医院药剂科,宜昌 443000;2.武汉大学药学院教育部重点实验室,武汉 430071)
·药物研究·
法舒地尔对结肠炎模型大鼠的治疗作用*
望运玲1,岳源2,武双婵2,丁虹2
(1.湖北省宜昌市第二人民医院药剂科,宜昌 443000;2.武汉大学药学院教育部重点实验室,武汉 430071)
目的 探讨法舒地尔对三硝基苯磺酸(TNBS)诱导的结肠炎模型大鼠的治疗作用。方法 斯泼累格·多雷(SD)雌性大鼠30只,随机分为正常对照组(0.9%氯化钠溶液造模+腹腔注射0.9%氯化钠溶液)、模型对照组(TNBS造模+腹腔注射0.9%氯化钠溶液)和法舒地尔组(TNBS造模+腹腔注射法舒地尔4.5 mg·kg-1),每组10只,连续给药14 d。观察法舒地尔对大鼠疾病活动指数(DAI)、结肠髓过氧化物酶(MPO)、肿瘤坏死因子-α(TNF-α) 及白细胞介素1β(IL-1β)含量的影响;苏木精-伊红(HE)染色观察组织病理学变化;蛋白免疫印迹法观察结肠组织Rho激酶含量变化。结果 正常对照组、模型对照组、法舒地尔组DAI评分分别为(0.00±0.00),(7.76±1.32),(3.20±0.98)分; MPO含量分别为(59.32±9.08),(96.65±16.57),(69.58±11.40) U·g-1; TNF-α含量分别为(0.15±0.11),(0.28±0.22),(0.20±0.62) ng·mL-1;IL-1β含量分别为(0.04±0.01),(0.08±0.02),(0.06±0.02) ng·mL-1;Rho激酶相对表达量分别为0.713±0.170,1.083±0.210,0.907±0.260。结论 法舒地尔可能通过降低Rho激酶的表达及减少炎症因子的释放来保护结肠炎模型大鼠。Rho激酶可能是治疗炎症性肠病的新靶标。
法舒地尔;肠病,炎症性;大鼠
炎症性肠病(inflammatory bowel disease,IBD)包括溃疡性结肠炎(ulcerative colitis,UC)和克罗恩病(Crohn's disease,CD),是一种病因和发病机制尚不确定的慢性肠道非特异性炎症疾病,目前认为肠黏膜免疫功能紊乱、感染、遗传和环境等因素共同参与了IBD的发病过程[1]。目前治疗策略着眼于控制炎症和调节免疫,主要采用抗炎药及免疫抑制药治疗,但始终未摆脱有效率低的现状。研究表明,IBD中肠道血管的生理功能和血流状态有所改变,三硝基苯磺酸(trinitro-benzene-sulfonic acid,TNBS)诱导的急性反应中,肠微血管重构后血容量增加,但血流速度减慢,灌注减少,导致肠道缺血缺氧、组织坏死,因此,逆转血管功能不良可能有助于IBD的治疗[2-3]。研究发现,在IBD发生过程中,肠黏膜上皮细胞内Rho激酶活性增加[4]。在体内,抑制Rho激酶通路可减少中性白细胞及单核细胞的浸润,降低炎症反应[5],改善微血管功能不良[6-7]。提示,减少Rho激酶表达有可能成为治疗IBD的新靶标。法舒地尔是Rho激酶抑制药,可通过增加肌球蛋白轻链磷酸酶的活性,扩张血管,改善脑组织微循环。但是,法舒地尔是否具有治疗炎症性肠病作用,能否成为治疗IBD的新药物,目前尚不清楚。鉴于此,笔者建立TNBS诱导结肠炎模型,探讨Rho激酶抑制药法舒地尔对TNBS诱导的结肠炎大鼠的治疗作用。
1 材料与方法
1.1 动物 斯泼累格·多雷(Sprague Dawley,SD)大鼠,雌性,体质量220~240 g,武汉大学动物实验中心提供[使用许可证号:SYXK(鄂)2008-0013;合格证号:SCXK(鄂)2008-0004],在武汉大学动物实验中心饲养,温度(25±2) ℃,湿度(60±10)%,12 h光照。
1.2 试剂 TNBS购于美国Sigma公司(批号:111M5001V)。酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)试剂盒购于美国R&D Systems公司。Rho激酶抗体购于武汉博士德公司(批号:O8D01)。盐酸法舒地尔注射液购于天津红日药业股份有限公司(批号:1106021)。
1.3 模型制备与分组给药 SD大鼠30只,据体质量分层随机分成3组,分别为正常对照组(0.9%氯化钠溶液造模+腹腔注射等体积0.9%氯化钠溶液)、模型对照组(TNBS造模+腹腔注射等体积0.9%氯化钠溶液)和法舒地尔组(TNBS造模+腹腔注射法舒地尔4.5 mg·kg-1),每组10只。造模前大鼠禁食24 h,自由饮水。参照文献[8]建立大鼠实验性结肠炎模型,乙醚麻醉大鼠后用一直径2.0 mm硅胶管由肛门轻缓插入8 cm,80 mg·kg-1TNBS溶解于体积分数为50%乙醇溶液,缓慢推入结肠,迅速堵住大鼠肛门并倒拎60 s。正常对照组用0.9%氯化钠溶液代替造模液,其他操作步骤相同。造模后第2天开始给药,每日上午10:00时给药,连续给药14 d,实验期间自由饮水摄食。
1.4 疾病活动指数( disease activity index,DAI) 评分实验过程中每日观察大鼠体质量变化和大便性状,并且每天观察或用粪便隐血试纸检测大便带血情况,参考文献[9]的标准略作改动进行DAI 评分,按下述指标进行积分,大鼠体质量改变百分率(0分:无改变;1分:下降1%~5%;2分:下降~10%;3分:下降~15%;4分:下降>15%)、大便黏稠度(正常为0分;松散大便为2分;腹泻为4分)和血便程度(正常0分;隐血阳性为2分;显性出血为4分),三者相加累计。
1.5 结肠组织大体形态和组织学评分 两位不知实验设计的独立观察者对结肠组织进行大体形态和组织学评分。解剖去结肠,测量结肠长度和质量计算结肠单位长度质量。肛门至盲肠段结肠沿肠系膜纵轴剪开,0.9%氯化钠溶液冲洗干净,进行大体形态评分。参照参考文献[9],0分:无损伤;1分:轻度充血、水肿,无糜烂或溃疡;2分:中度充血、水肿,糜烂或浅溃疡;3分:重度充血、水肿,黏膜表面有坏死及溃疡形成,溃疡直径<1 cm;4分:重度充血、水肿,坏死及溃疡形成,溃疡直径>1 cm。切取距肛门8 cm处结肠组织,10%甲醛溶液固定,常规石蜡包埋,切片(4 μm),苏木精-伊红(hematoxylin and eosin,HE)染色,显微镜下观察,按文献[9]方法行病理评分( histological index,HI) 和结肠组织学损伤评分,指标包括溃疡、肉芽肿,纤维化按无、轻及重计为0,1,2分,病变深度(达黏膜下层1分,肌层2分,浆膜层3分),各项相加得总分。
1.6 结肠匀浆检测髓过氧化物酶(myeloperoxidase,MPO)活性和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)含量 在结肠三等分处切取3段0.5 cm肠段,去除脂肪系膜组织,平均两等分,一份加0.1 mol·L-1磷酸盐缓冲液制备10%匀浆,按操作说明检测MPO活性和TNF-α、IL-1β含量。
1.7 结肠组织Rho激酶含量检测 取上述另一份结肠组织加入5倍RIPA(Radio-Immunoprecipitation Assay)裂解液,匀浆后低温高速离心(4 ℃,12 000 r· min-1,r=5 cm,20 min),取上清液后,二喹啉甲酸法测定并调节蛋白浓度。取预染蛋白Marker 5 μL,蛋白上样量30 μL,10%聚丙烯酰胺凝胶电泳(80 V,30 min;120 V至染料移至凝胶底部),转印至聚偏二氟乙烯膜(200 mA,2 h),5%牛血清清蛋白封闭过夜(4 ℃),加入Rho相关蛋白激酶2(Rho kinase 2,ROCK2)一抗(1:400),β-actin一抗(1:1 000)室温孵育1.5 h,二抗(1:10 000)室温孵育1 h。电化学发光法显色,显影,定影,曝光后,拍照用Quantity One 测定灰度值。
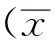
2 结果
2.1 法舒地尔对大鼠DAI及结肠质量长度比的影响 模型对照组有2只大鼠死亡,结肠DAI评分、结肠质量长度比显著高于正常对照组。与模型对照组比较,法舒地尔组DAI评分、结肠质量长度比显著下降(F值分别为4.406,4.424,P<0.05或P<0.01),提示法舒地尔可明显减轻大鼠结肠炎症损伤。见表1。
表1 3组大鼠DAI及结肠质量长度比比较
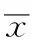
Tab.1 Comparison of DAI and quality-length ratio of colon among three groups of rats±s
与正常对照组比较,*1P<0.01;与模型对照组比较,*2P<0.05
Compared with normal control group,*1P<0.01;compared with model control group,*2P<0.05
2.2 法舒地尔对结肠大体形态及组织病理学影响 大体形态观察:正常对照组大鼠结肠均匀细长,颜色呈嫩粉色且色泽均一;模型对照组大鼠结肠黏膜充血水肿、糜烂,肠壁增厚,伴有溃疡,且形成巨结肠,黏膜表面坏死,病变处黏膜呈黑褐色;法舒地尔组肠黏膜充血、水肿、糜烂明显改善,未见明显巨结肠,仅个别出现小溃疡愈合后的痕迹。大体形态评分见表2。
组织病理学观察及评分:显微镜下放大100倍观察可见,正常对照组无组织学损伤表现,黏膜层表面平滑;模型对照组为典型炎症黏膜表现,肠黏膜上皮细胞坏死脱落,黏膜、黏膜下层甚至肌层有中性粒细胞、淋巴细胞等大量炎性细胞浸润,溃疡形成,边缘腺体增生结构异常,其周边黏膜层及黏膜下层结构紊乱、水肿、血管充血扩张,有炎性渗出物。法舒地尔组未见明显溃疡,个别仍可见黏膜层呈不连续分布,黏膜下层和肌层有炎性细胞浸润,黏膜下层毛细血管扩张、水肿及充血(图1)。半定量结果显示,模型对照组评分与正常对照组相比差异有统计学意义(F=10.995,P<0.01);法舒地尔能显著减轻TNBS引起的结肠组织病理变化(F=8.314,P<0.05)。见表2。
表2 3组大鼠结肠大体形态评分及组织病理学评分
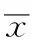
Tab.2 Morphology and histopathology scores on three groups of rats 分,±s
与正常对照组比较,*1P<0.01;与模型对照组比较,*2P<0.05
Compared with normal control group,*1P<0.01;compared with model control group,*2P<0.05
2.3 法舒地尔对大鼠MPO活性和TNF-α、IL-1β水平的影响 与正常对照组比较,模型对照组大鼠结肠匀浆中MPO活性和TNF-α、IL-1β含量明显增高;法舒地尔可降低TNBS引起的大鼠结肠MPO活性和TNF-α、IL-1β含量(F值分别为7.782,6.403,6.031,P<0.01或P<0.01)。见表3。
2.4 法舒地尔对大鼠结肠组织Rho激酶表达的影响 正常对照组、模型对照组和法舒地尔组大鼠结肠组织中Rho激酶的相对表达量分别为0.713±0.170,1.083±0.210,0.907±0.260,模型对照组Rho激酶的相对表达量高于正常对照组(P<0.01);法舒地尔组Rho激酶的相对表达量低于模型对照组(F=4.051,P<0.05)。见图2。

A.正常对照组;B.模型对照组;C.法舒地尔组
表3 3组大鼠结肠MPO、TNF-α与IL-1β含量比较
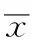
Tab.3 Comparison of colonic content of MPO,TNF- α and IL-1β among three groups of rats±s
与正常对照组比较,*1P<0.05,*2P<0.01;与模型对照组比较,*3P<0.05
Compared with normal control group,*1P<0.05,*2P<0.01;compared with model control group,*3P<0.05

图2 3组大鼠结肠Rho激酶表达
Fig.2 Rho kinase expression in colon of three groups of rats
3 讨论
IBD是一种病因和发病机制尚不明确的慢性肠道非特异性炎症疾病,经典理论认为肠黏膜免疫功能紊乱、感染、遗传和环境等因素共同参与了IBD的发病过程。
Rho激酶在炎症反应中具有相当重要的作用[10],Rho激酶抑制药在临床中主要用于脑梗死等疾病[11]。同时,抑制Rho激酶可改善微循环,加快结肠黏膜修复,降低炎症反应。本研究发现法舒地尔可以降低大鼠DAI、结肠组织病变评分和结肠质量长度比,改善组织病理状态。表明法舒地尔可以改善TNBS诱导的UC的病变程度。MPO是中性粒细胞嗜天青颗粒中的酶之一,与急性炎症的严重程度呈正相关。法舒地尔组MPO活性均较模型对照组明显下降,表明法舒地尔可减轻肠道中性粒细胞浸润的急性炎症反应。
在IBD的发生过程中,释放大量促炎因子,特别是TNF-α和IL-1β为其中的关键因子,促进机体内环境中炎性级联反应的发生。TNF-α作为细胞因子网络中启动递质,主要由激活的单核巨噬细胞产生,可诱导多种细胞产生炎症因子,细胞因子之间形成网络,扩大炎症连锁反应造成肠黏膜损伤,参与IBD炎症反应和免疫应答。IL-1β被公认为是介导UC发病的细胞因子之一[12]。IL-1β可通过激活T、B细胞,促进中性粒细胞浸润,促进IL-2受体表达和其他细胞因子协同作用,促使中性粒细胞和巨噬细胞活化和脱颗粒,同时促进炎症细胞释放前列腺素、血栓素、血小板活化因子等,从而增加上皮细胞和内皮细胞的通透性。本实验结果显示,Rho激酶抑制药法舒地尔可以降低TNBS引起的炎症因子TNF-α和IL-1β释放,降低TNBS引起的大鼠结肠的炎症反应。
Rho激酶增加或活性增高参与多种血管损伤病理过程;在血流动力学紊乱及炎症发生过程中起重要作用;是参与细胞移动、内皮细胞损伤、中性粒细胞增多及血液高黏度的关键成分。降低Rho激酶活性,可抑制中性粒细胞及单核细胞的浸润,降低炎症反应。同时,抑制Rho激酶可以缓解血管收缩、血液高黏滞度及内皮损伤等引起的血流动力学障碍,改善微循环。 盐酸法舒地尔及其活性代谢产物羟化法舒地尔可有效抑制Rho激酶。本实验结果显示,Rho激酶抑制药法舒地尔在下调Rho激酶表达的同时,降低TNBS引起的炎症因子TNF-α和IL-1β释放。
本研究通过Rho激酶抑制药法舒地尔干预TNBS诱导的实验性结肠炎,发现法舒地尔可以改善组织病变状态,下调Rho激酶表达,减少炎症因子的释放。由此可见,法舒地尔可能成为治疗UC的有效药物,Rho激酶抑制药可能是治疗IBD的新方向。
[1] VAN DER MAREL S,MAJOWICZ A,VAN DEVENTER S,et al.Gene and cell therapy based treatment strategies for inflammatory bowel diseases[J].World J Gastrointest Pathophysiol,2011,2(6):114-122.
[2]PAPA A,SCALDAFERRI F,DANESE S,et al.Vascular involvement in inflammatory bowel disease:pathogenesis and clinical aspects[J].Dig Dis,2008,26(2):149-155.
[3] HATOUM O A,BINION D G,GUTTERMAN D D.Paradox of simultaneous intestinal ischaemia and hyperaemia in inflammatory bowel disease[J].Eur J Clin Invest,2005,35(10):599-609.
[4] HOROWITZ S,BINION D G,NELSON V M,et al.Incre-ased arginase activity and endothelial dysfunction in human inflammatory bowel disease[J].Am J Physiol Gastrointest Liver Physiol,2007,292(5):G1323-G1336.
[5] CHATURVEDI L S,MARSH H M,BASSON M D.Role of RhoA and its effectors ROCK and mDia1 in the modulation of deformation-induced FAK,ERK,p38,and MLC motogenic signals in human Caco-2 intestinal epithelial cells[J].Am J Physiol Cell Physiol,2011,301(5):C1224-C1238.
[6] KONO T,OMIYA Y,HIRA Y,et al.Daikenchuto (TU-100) ameliorates colon microvascular dysfunction via endogenous adrenomedullin in Crohn's disease rat model[J].J Gastroenterol,2011,46(10):1187-1196.
[7] MIHAESCU A,SANTEN S,JEPPSSON B,et al.p38 Mito-gen-activated protein kinase signalling regulates vascular inflammation and epithelial barrier dysfunction in an experimental model of radiation-induced colitis[J].Br J Surg,2010,97(2):226-234.
[8] 周燕红,何小飞,白育庭,等.银杏叶提取物对大鼠实验性结肠炎肿瘤坏死因子-α表达的影响[J].中国药理学通报,2007,23(12):1605-1609.
[9]KIHARA N,DE LA FUENTE S G,FUJINO K,et al.Vanilloid receptor-1 containing primary sensory neurones mediate dextran sulphate sodium induced colitis in rats[J].Gut,2003,52(5) :713-719.
[10] KATAOKA C,EGNSHIRA K,INOUE S,et al.Important role of Rho-kinase in the pathogenesis of cardiovascular inflammation and remodeling induced by long-term blockade of nitric oxide synthesis in rats[J].Hypertension,2002,39(2):245-250.
[11] LI Q,HUANG X J,HE W,et al.Neuroprotective potential of fasudil mesylate in brain ischemia—reperfusion injury of rats[J].Cell Mol Neurobiol,2009 ,29(2):169-180.
[12] 李春雷,陈治水.白介素在溃疡性结肠炎发病机制中的研究进展[J].现代消化及介入诊疗,2008,13(2):146-149.
DOI 10.3870/yydb.2015.05.001
Protective Effect of Fasudil on Inflammatory Bowel Disease of Rats
WANG Yunling1,YUE Yuan2,WU Shuangchan2,DING Hong2
(1.DepartmentofPharmacy,theSecondPeople'sHospitalofYichangCity,Yichang443000,China; 2.KeyLaboratoryofCombinatorialBiosynthesisandDrugDiscovery,MinistryofEducation,SchoolofPharmaceuticalSciences,WuhanUniversity,Wuhan430071,China)
Objective To investigate the treatment effect of fasudil on inflammatory bowel disease (IBD) in rats.IBD was induced by using an enema of trinitro-benzene-sulfonic acid (TNBS). Methods A total of 30 female SD rats were randomly divided into normal control group (0.9% sodium chloride for induction and 0.9% sodium chloride for treatment), model control group (TNBS for induction and 0.9% sodium chloride for treatment), and fasudil group (TNBS for induction and fasudil 4.5 mg·kg-1for treatment).The disease activity index(DAI) was estimated 14 days later.The MPO activity, TNF-α content and IL-1β level in the colon were investigated, while Rho kinase expression was detected by Western blot.The pathological changes were detected by HE staining. Results The DAI of the normal control, model control, and fasudil groups were: (0.00±0.00),(7.76±1.32),and (3.20±0.98), respectively.MPO activity was (59.32±9.08),(96.65±16.57),and (69.58±11.40) U·g-1, respectively.TNF-α was (0.15±0.11),(0.28±0.22),and (0.20±0.62) ng·mL-1, respectively.The level of IL-1β was (0.04±0.01),(0.08±0.02),and (0.06±0.02) ng·mL-1, respectively.Rho kinase expression was 0.713±0.170,1.083±0.210,and 0.907±0.260, respectively. Conclusion Fasudil excerts protective effects against IBD in rats by lowering the expression of Rho kinase and attenuating the release of inflammatory mediators, suggesting that Rho kinase could be a new therapeutic target for IBD.
Fasudil; Bowel disease, inflammatory; Rat
2014-03-03
2014-04-29
*国家自然科学基金资助项目(81273523)
望运玲(1963-),女,湖北宜昌人,主管药师,从事临床药学工作。电话:(0)15171486487,E-mail:906290904@qq.com。
丁虹(1963-),女,湖北武汉人,教授,博士生导师,研究方向:神经药理学和炎症性肠病。电话:(0)13667255751,E-mail:dinghong1106@wuhan.edu.cn。
R975;R965
A
1004-0781(2015)05-0565-05

