细茎石斛内生和根围细菌多样性及促生能力分析
张 礼, 童文君, 薛庆云, 丁小余
(南京师范大学生命科学学院, 江苏 南京 210023)
细茎石斛内生和根围细菌多样性及促生能力分析
张 礼, 童文君, 薛庆云, 丁小余①
(南京师范大学生命科学学院, 江苏 南京 210023)
对采自湖北省英山县的细茎石斛〔Dendrobiummoniliforme(Linn.) Sw.〕根、茎和叶中的内生细菌及其根围苔藓内生细菌和根围土壤细菌进行分离,并采用扩增核糖体DNA限制性酶切分析(ARDRA)与UPGMA聚类分析相结合的方法对这些细菌菌株进行鉴定和多样性分析;在此基础上,采用平板检测技术测定了这些细菌菌株的解磷、解钾、产生长素和嗜铁素的能力。结果显示:从细茎石斛根和茎以及根围苔藓和根围土壤中共分离获得75株细菌菌株,从叶中未分离出内生细菌。其中,源自根和茎的内生细菌菌株分别为14和7株;源自根围苔藓的内生细菌菌株偏少,仅14株;源自根围土壤的细菌菌株最多,达到40株。75株菌株可被分成33个ARDRA簇,通过16SrDNA序列测定及比对,它们分别隶属于链霉菌属(Streptomyces)、芽孢杆菌属(Bacillus)、假单胞菌属(Pseudomonas)、拉恩氏菌属(Rahnella)、潘多拉菌属(Pandoraea)、微杆菌属(Microbacterium)、赖氨酸芽孢杆菌属(Lysinibacillus)和泛菌属(Pantoea),其中芽孢杆菌属和假单胞菌属为优势属。在75株内生和根围细菌中,有22株菌株兼具解无机磷和有机磷的能力、25株菌株具有解钾能力、64株菌株具有产生长素能力、39株菌株具有产嗜铁素能力,其中有9株菌株兼具解磷、解钾、产生长素和嗜铁素的能力。总体上看,细茎石斛的内生和根围细菌数量多且多样性较高,其中9株兼具4种促生潜力的菌株可作为促进细茎石斛生长的候选菌株。
细茎石斛; 内生细菌; 根围细菌; ARDRA分析; 多样性; 促生能力
细茎石斛〔Dendrobiummoniliforme(Linn.) Sw.〕属石斛属 (DendrobiumSw.) 多年生附生草本植物,为传统名贵中药材,具有滋阴清热、生津益胃、止咳润肺等功效[1]。由于细茎石斛种子自然萌发困难,加之人们长期、无节制的采挖,其野生资源日渐枯竭[2]。
石斛属植物与其内生菌间存在复杂的微生态关系[3],内生真菌可为石斛属植物提供营养源,因此,相关研究者除对石斛属植物可培养内生真菌进行分离鉴定外[4-5],还对其内生细菌与寄主植物的相关性进行了较多研究。已有研究表明:从杓唇石斛〔D.moschatum(Buch.-Ham.) Sw.〕根部分离出的鞘氨醇菌属(Sphingomonas)和分枝菌属(Mycobacterium)细菌均能够明显提高杓唇石斛的种子萌发率[6];俞婕等[7]将铁皮石斛(D.officinaleKimura et Migo)组培苗接种其内生细菌ZJSH1 后,组培苗的株高、根粗和叶片大小等均优于对照;分离自双色石斛(D.chrysopterumSchuit. et de Vogel)叶片的2株芽孢杆菌属(Bacillus)菌株可以有效防治由镰刀菌属(Fusarium)细菌引起的双色石斛叶斑病[8];童文君等[9]从美花石斛(D.loddigesiiRolfe)体内分离出具有解磷、解钾及产生长素能力的内生细菌,且部分菌株对美花石斛试管苗生长有促进作用。由此可见,细菌在石斛属植物的生长过程中具有重要作用,因此,开展对石斛属植物内生和根围细菌的研究具有十分重要的意义。
然而,目前鲜见关于细茎石斛内生及根围细菌的研究报道。欲明确细茎石斛内生和根围细菌对其生长的影响,首先要明确其内生和根围细菌的多样性。鉴于此,作者对细茎石斛的内生和根围细菌(包括根围苔藓内生细菌和根围土壤细菌)分别进行分离和纯化,采用扩增核糖体DNA限制性酶切分析(amplified ribosomal DNA restriction analysis,ARDRA)法对分离的菌株进行多样性分析,并对所有分离菌株的解磷、解钾、产生长素和嗜铁素能力进行检测,以期初步揭示细茎石斛内生和根围细菌的相互关系及促生潜力,为筛选对细茎石斛有益的促生细菌、提高细茎石斛的药材产量和药用活性成分含量提供研究依据。
1 材料和方法
1.1 材料
于2012年6月,在湖北省英山县细茎石斛种植园内随机采集3份样品,分别置于密封袋中保存、备用。每份样品包括5株细茎石斛(分成根、茎、叶3部分)及附生的根围苔藓和紧附于根系表面的根围土壤。
1.2 方法
1.2.1 细菌的分离和保存 取细茎石斛的根、茎和叶及其根围苔藓样品,每份2 g,先后用体积分数70%乙醇和质量体积分数0.1% HgCl2对样品进行表面消毒[10];将消毒后的样品分别放入灭菌研钵中,加入9倍样品质量的灭菌生理盐水(质量体积分数0.85% NaCl溶液),充分研碎;取0.1 mL研磨液涂于NA培养基平板[11]上,置于28 ℃恒温箱中暗培养1~3 d,挑选形态特征不同的菌落分别进行纯化。
用软毛刷轻轻刷下附着于细茎石斛根系表面的根围土壤,每份土样取3 g,分别置于灭菌离心管中,加入27 mL灭菌生理盐水(质量体积分数0.85% NaCl溶液),涡旋混匀3~5 min后置于200 r·min-1摇床上室温振荡30 min;对振荡后的菌液进行梯度稀释,取0.1 mL 10-4稀释菌液涂于NA培养基平板上,置于28 ℃恒温箱中暗培养1~3 d,挑选形态特征不同的菌落分别进行纯化。
纯化的细菌均分为2份,一份在常温下用无菌水保存,另一份在-80 ℃条件下用体积分数40%甘油保存。
1.2.2 ARDRA分析 细菌基因组DNA提取、细菌16SrRNA片段扩增以及ARDRA分析方法与童文君等[9]的方法一致,扩增片段经质量体积分数1%琼脂糖凝胶电泳检验后用于ARDRA分析。
利用GelCompar Ⅱ软件对ARDRA分析的酶切产物图谱进行聚类分析。基于Pearson相关指数的相似性系数(Pearson correlation indices of similarity)、采用非加权配对算数平均法 (unweighted pair-group method using arithmetic average,UPGMA) 绘制聚类图,具体参数如下:optimization (0.45%),position tolerance (1.5%),chance towards end of fingerprint (0%),minimum height (0%),minimum surface (0%),uncertain bands (ignore)。以80.0%相似度为基准进行聚类分析;从菌株活化到酶切,对5个菌株进行重复,菌株间的相似度均大于80.0%则聚为一簇。
选取各ARDRA簇的代表菌株进行16SrDNA测序,将所得序列与NCBI 数据库中的核苷酸序列进行BLAST比对;选取同源性高的菌株,运用MEGA 5.0软件构建系统发育树。
1.2.3 细菌的促生潜力分析 将所有分离出的细菌菌株分别用NA培养基进行活化[9]。挑取单菌落到含1 mL NA液体培养基的Eppendorf管中,28 ℃、200 r·min-1振荡培养至对数生长期 (18~24 h),备用。
1.2.3.1 解磷能力分析 取10 μL待测菌液,分别滴到含有机磷和无机磷的培养基[12]平板上, 28 ℃恒温暗培养72 h。观察2种培养基平板上有无透明菌圈并测量透明菌圈的半径,能够形成透明菌圈的菌株具有解磷能力,无透明菌圈的菌株则无解磷能力。每个菌株重复检测3次。
1.2.3.2 解钾能力分析 用以钾长石粉为惟一钾源的硅酸盐培养基进行细菌解钾能力检测[13]。取10 μL待测菌液,滴到含钾长石粉的培养基平板上,28 ℃恒温暗培养10 d。观察平板上有无透明光滑油滴,有透明油滴状菌落记为“+”,无透明油滴状菌落记为“-”;能够形成透明油滴状菌落的菌株具有解钾能力,反之则无解钾能力。每个菌株重复检测3次。
1.2.3.3 产生长素能力分析 将待测细菌接种到含有200 mg·L-1L-色氨酸的LB液体培养基中,28 ℃、 200 r·min-1振荡培养24 h, 10 000 r·min-1离心10 min;取1 mL上清液,加入2 mL Salkowski比色液[14],混匀后室温下避光静置30 min,观察溶液颜色变化,溶液呈粉红色表明该菌株能够产生长素。每个菌株重复检测3次。
对具有产生长素能力的菌株进行定量检测。首先测定菌悬液的OD600值,用含有200 mg·L-1L-色氨酸的LB液体培养基将所有菌悬液浓度调节一致;28 ℃、10 000 r·min-1离心10 min;取上清液,分别加入上清液2倍体积的Salkowski比色液,混匀后室温下避光静置30 min,测定溶液的OD530值[15-16],各菌株均重复检测3次。根据Mishra等[17]的方法绘制各菌株生长素产量的标准曲线,并采用EXCEL 2007软件计算各菌株的生长素产量。
1.2.3.4 产嗜铁素能力分析 参照文献[18]配制能够检测嗜铁素的WA培养基;取10 μL待测菌液,滴加到培养基平板上,28 ℃恒温暗培养3 d。观察菌落颜色变化,具橘黄色晕圈说明该菌株具有产嗜铁素的能力, 并测量晕圈半径。每个菌株重复检测3次。
2 结果和分析
2.1 细茎石斛内生和根围细菌的分布特征
依据菌落形态的差异,共分离获得细茎石斛内生细菌和根围细菌75株。其中,源自细茎石斛植株的内生细菌21株,编号为DmB1至DmB21,包括源自根中的菌株14株和源自茎中的菌株7株,从叶中没有获得内生细菌;源自根围苔藓的内生细菌14株,编号为DmBM1至DmBM14,数量偏少;源自根围土壤的菌株数量最多,共40株,编号为DmBR1至DmBR40。
2.2 细茎石斛内生和根围细菌的多样性分析
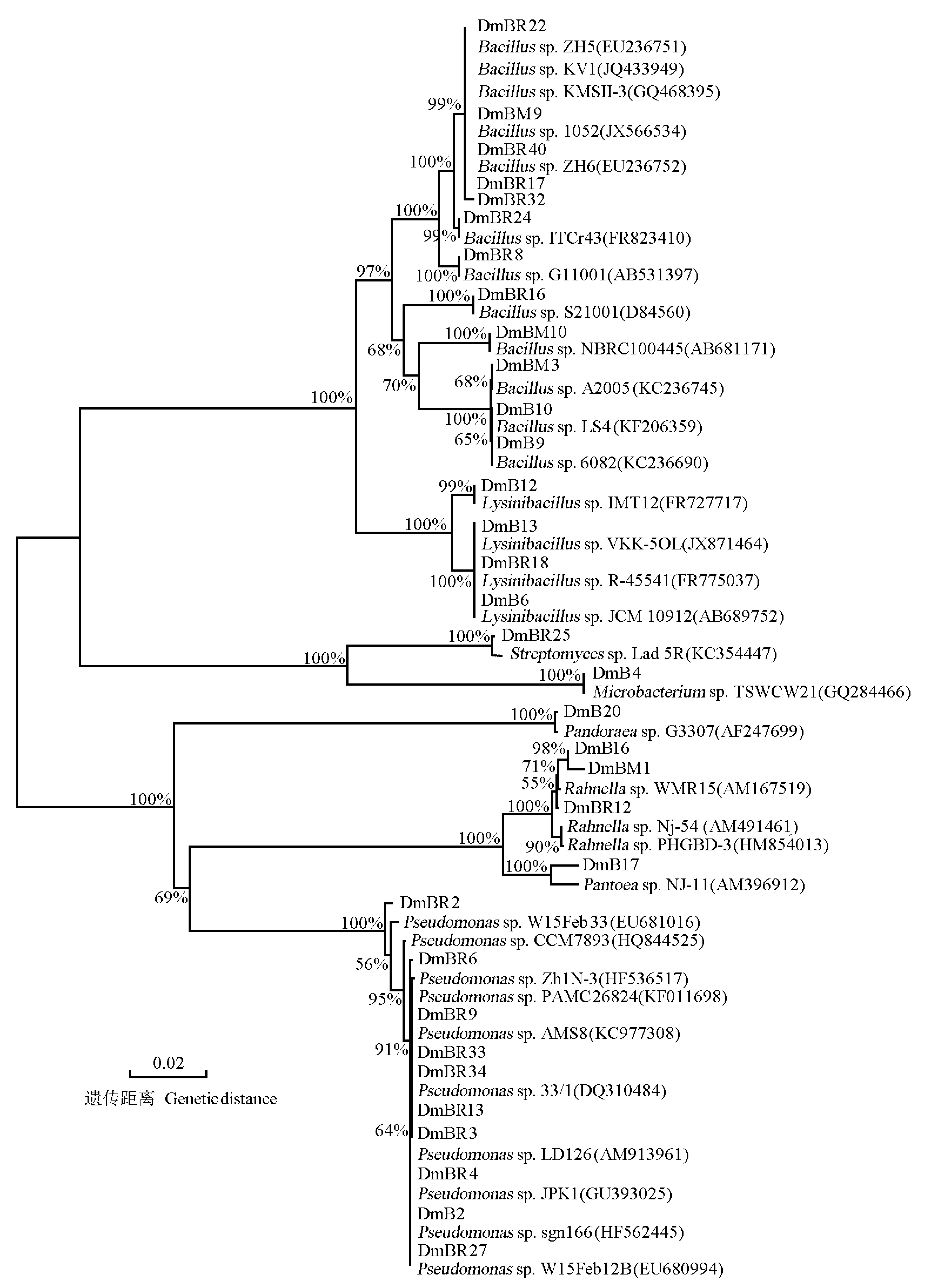
对75株细茎石斛内生和根围细菌的ARDRA分析结果以及基于ARDRA分析结果的UPGMA聚类分析结果见图1。由图1可见:75株细菌菌株共形成37种ARDRA谱型, 根据80%的相似度划分,75株细菌菌株被分为33个ARDRA簇,多样性较高。有17个ARDRA簇只包含1株细菌菌株,其他16个ARDRA簇则包含2株及2株以上的细菌菌株。其中,最大的ARDRA簇 (第31簇) 包含13株细菌菌株,其中2株分离自细茎石斛的根,3株分离自细茎石斛的茎,6株分离自根围土壤,2株分离自根围苔藓。
由图1还可见:细茎石斛根部内生细菌分属于9个ARDRA簇,茎部内生细菌分属于4个ARDRA簇,根围土壤细菌分属于21个ARDRA簇,根围苔藓内生细菌则分属于8个ARDRA簇。
从33个ARDRA簇中分别随机选出1株细菌,对其16SrRNA基因片段(长度约1 500 bp)进行测序,将测序结果登录到GenBank数据库中,登录号分别为KF720904至KF720936。应用MEGA 5.0软件对这些序列及GenBank数据库中与其相似性在99%以上的序列进行序列比对并构建系统发育树,结果见图2。

DmB: 分离自细茎石斛的内生菌株 Endophytic bacterium strains isolated fromDendrobiummoniliforme; DmBR: 分离自根围土壤的菌株 Strains isolated from rhizosphere soil; DmBM: 分离自根围苔藓的内生菌株 Endophytic bacterium strains isolated from rhizosphere moss.
图1 细茎石斛75株内生和根围细菌的ARDRA及聚类分析结果
Fig. 1 Reaults of ARDRA and cluster analyses on 75 strains of endophytic and rhizosphere bacteria ofDendrobiummoniliforme(Linn.) Sw.
分支上的数值代表1 000次重复抽样检测的自展支持率 Datums on the branches indicate the bootstrap value of 1 000 replications. 所有具有登录号的序列均引自GenBank, 括号内为登录号 All of sequences with accession Nos. are induced from GenBank, and the accession Nos. are in brackers. DmB: 分离自细茎石斛的内生菌株 Endophytic bacterium strains isolated fromDendrobiummoniliforme; DmBR: 分离自根围土壤的菌株 Strains isolated from rhizosphere soil; DmBM: 分离自根围苔藓的内生菌株 Endophytic bacterium strains being isolated from rhizosphere moss.
图2 基于16SrDNA 序列构建的细茎石斛内生和根围细菌与相似细菌的NJ系统发育树
Fig. 2 NJ phylogenetic tree of endophytic and rhizosphere bacteria ofDendrobiummoniliforme(Linn.) Sw. and
similar bacteria based on 16SrDNA sequence
从系统发育树可见:分离出的细茎石斛内生和根围细菌隶属于8个属,分别为链霉菌属(Streptomyces)、芽孢杆菌属、假单胞菌属(Pseudomonas)、拉恩氏菌属(Rahnella)、潘多拉菌属(Pandoraea)、微杆菌属(Microbacterium)、赖氨酸芽孢杆菌属(Lysinibacillus)和泛菌属(Pantoea)。其中,芽孢杆菌属(29株)和假单胞菌属(16株)为细茎石斛内生和根围细菌的优势属,并且前者均存在于细茎石斛根和茎内以及根围苔藓体内和根围土壤中,后者仅存在于细茎石斛根内和根围土壤中。此外,微杆菌属(1株)仅分布于细茎石斛根中;泛菌属(2株)仅分布于细茎石斛茎内;拉恩氏菌属(15株)在细茎石斛的茎和根内以及根围苔藓体内和根围土壤中均有分布;链霉菌属(3株)仅分布于细茎石斛的根围土壤中;潘多拉菌属(1株)分布于细茎石斛茎内;赖氨酸芽孢杆菌属(8株)分布于细茎石斛根内以及根围苔藓体内和根围土壤中。
2.3 细茎石斛内生和根围细菌的促生能力分析
对分离自细茎石斛根和茎的内生细菌以及分离自根围土壤和根围苔藓的细菌进行促生能力测定,结果见表1。
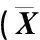

菌株1)Strain1)来源Source簇号ClusterNo.菌圈半径/cm2)Radiusofbacteriumring2)NPAOPA解钾能力3)Abilityofsolubilizingpotassium3)生长素产量/μg·mL-1Productionofauxin晕圈半径/cm4)Radiusofaureola4)DmBM1苔藓Moss310.00±0.002.67±0.58-63.02±0.580.00±0.00DmBM2苔藓Moss290.00±0.003.00±1.00+70.80±3.000.00±0.00DmBM3苔藓Moss182.33±0.580.00±0.00+84.09±2.785.00±0.00DmBM4苔藓Moss272.12±0.588.30±1.15+91.78±3.126.33±1.00DmBM5苔藓Moss150.00±0.000.00±0.00-0.00±0.004.33±0.58DmBM6苔藓Moss150.00±0.001.67±0.58-70.58±2.357.00±0.00DmBM7苔藓Moss150.00±0.002.00±1.00-0.00±0.000.00±0.00DmBM8苔藓Moss90.00±0.001.00±0.00+70.30±3.380.00±0.00DmBM9苔藓Moss270.00±0.008.67±2.08-0.00±0.000.00±0.00DmBM10苔藓Moss151.67±0.581.00±0.00+81.38±2.764.33±0.58DmBM11苔藓Moss150.00±0.000.00±0.00-84.09±4.580.00±0.00DmBM12苔藓Moss310.00±0.009.00±2.00-0.00±0.000.00±0.00DmBM13苔藓Moss302.00±0.0010.67±0.58-70.22±1.156.00±0.00DmBM14苔藓Moss172.00±0.006.00±0.00-49.87±2.364.00±0.00DmBR1土壤Soil310.00±0.000.00±0.00+77.56±4.135.00±0.00DmBR2土壤Soil90.00±0.000.00±0.00-0.00±0.003.00±0.00DmBR3土壤Soil122.00±0.004.67±1.15+49.64±4.016.00±0.00DmBR4土壤Soil132.33±0.587.00±0.00-42.22±3.066.00±0.00DmBR5土壤Soil321.00±0.000.00±0.00-77.91±1.590.00±0.00DmBR6土壤Soil42.00±0.007.00±0.00-105.51±2.642.00±0.00DmBR7土壤Soil210.00±0.000.00±0.00-84.76±3.360.00±0.00DmBR8土壤Soil332.67±1.535.00±0.00+42.53±4.090.00±0.00DmBR9土壤Soil72.00±0.006.00±0.00+77.16±1.954.00±0.00DmBR10土壤Soil73.33±1.536.33±0.58+42.89±3.373.00±0.00DmBR11土壤Soil310.00±0.000.00±0.00-0.00±0.000.00±0.00DmBR12土壤Soil250.00±0.000.00±0.00-112.27±2.012.00±0.00DmBR13土壤Soil112.67±1.154.33±3.79-105.11±3.773.00±0.00DmBR14土壤Soil313.00±1.002.00±3.46+77.56±4.080.00±0.00DmBR15土壤Soil214.00±1.730.33±0.58+105.33±3.464.00±0.00DmBR16土壤Soil66.33±0.582.00±3.46+84.00±3.793.00±0.00DmBR17土壤Soil25.33±0.580.00±0.00-105.33±2.174.00±0.00DmBR18土壤Soil210.00±0.000.00±0.00+119.20±4.192.00±0.00DmBR19土壤Soil313.67±1.530.00±0.00-70.09±2.880.00±0.00DmBR20土壤Soil74.33±3.060.00±0.00+91.38±1.995.00±0.00
续表1 Table 1 (Continued)

菌株1)Strain1)来源Source簇号ClusterNo.菌圈半径/cm2)Radiusofbacteriumring2)NPAOPA解钾能力3)Abilityofsolubilizingpotassium3)生长素产量/μg·mL-1Productionofauxin晕圈半径/cm4)Radiusofaureola4)DmBR21土壤Soil313.00±1.000.00±0.00+0.00±0.005.00±0.00DmBR22土壤Soil324.67±2.080.00±0.00-56.13±3.922.00±0.00DmBR23土壤Soil13.67±2.080.00±0.00-0.00±0.004.00±0.00DmBR24土壤Soil300.00±0.000.00±0.00+105.73±4.863.00±0.00DmBR25土壤Soil13.67±2.087.67±2.08+105.16±3.555.00±0.00DmBR26土壤Soil74.00±1.7310.00±1.00 -98.76±2.114.00±0.00DmBR27土壤Soil234.00±1.737.67±1.15-98.13±3.154.00±0.00DmBR28土壤Soil103.67±2.8910.33±0.58 +105.47±2.334.00±0.00DmBR29土壤Soil320.00±0.000.00±0.00+112.58±3.473.00±0.00DmBR30土壤Soil310.00±0.000.00±0.00-98.71±2.550.00±0.00DmBR31土壤Soil72.33±0.580.00±0.00+84.71±1.135.66±1.53DmBR32土壤Soil282.00±1.000.00±0.00+126.00±4.390.00±0.00DmBR33土壤Soil82.67±0.580.00±0.00-119.07±3.384.00±0.00DmBR34土壤Soil102.33±0.580.00±0.00-105.64±2.904.00±0.00DmBR35土壤Soil12.00±1.000.00±0.00-77.60±2.984.00±0.00DmBR36土壤Soil32.00±1.000.00±0.00+126.27±1.980.00±0.00DmBR37土壤Soil182.00±0.005.00±2.00-84.58±3.783.00±0.00DmBR38土壤Soil181.33±0.583.33±1.53-63.42±1.550.00±0.00DmBR39土壤Soil180.00±0.007.33±1.15-161.69±2.560.00±0.00DmBR40土壤Soil32.33±0.585.00±2.00-112.40±1.535.00±0.00DmB1根Root310.00±0.002.33±0.58-91.33±2.331.00±0.00DmB2根Root200.00±0.000.00±0.00-0.00±0.000.00±0.00DmB3根Root180.00±0.000.00±0.00-119.24±4.980.00±0.00DmB4根Root140.00±0.000.00±0.00-175.47±3.280.00±0.00DmB5根Root310.00±0.000.00±0.00-77.42±2.030.00±0.00DmB6根Root220.00±0.000.00±0.00-136.00±1.630.00±0.00DmB7根Root220.00±0.000.00±0.00-147.33±2.390.00±0.00DmB8根Root180.00±0.000.00±0.00+77.73±1.830.00±0.00DmB9根Root290.00±0.000.00±0.00-70.22±2.761.33±0.16DmB10根Root190.00±0.000.00±0.00-184.04±1.970.00±0.00DmB11根Root180.00±0.000.00±0.00-175.64±3.810.00±0.00DmB12根Root170.00±0.000.00±0.00-168.58±3.020.00±0.00DmB13根Root160.00±0.000.00±0.00-287.47±2.670.00±0.00DmB14根Root180.00±0.0010.00±0.00 -273.02±3.990.00±0.00DmB15茎Stem260.00±0.007.33±0.58-210.24±1.935.00±0.00DmB16茎Stem50.00±0.001.00±1.00+231.51±3.880.00±0.00DmB17茎Stem263.00±1.008.67±1.15-136.42±2.220.00±0.00DmB18茎Stem313.00±1.000.00±0.00-112.71±3.350.00±0.00DmB19茎Stem310.00±0.000.00±0.00-0.00±0.000.00±0.00DmB20茎Stem243.67±1.530.00±0.00-280.04±3.440.00±0.00DmB21茎Stem311.00±1.730.00±0.00-0.00±0.000.00±0.00
1)DmB: 分离自细茎石斛的内生菌株 Endophytic bacterium strains isolated fromDendrobiummoniliforme; DmBR: 分离自根围土壤的菌株 Strains isolated from rhizosphere soil; DmBM: 分离自根围苔藓的内生菌株 Endophytic bacterium strains isolated from rhizosphere moss.
2)用不同培养基上的菌圈半径表示解磷能力 Ability of solubilizing phosphous is showed by radius of bacterium ring on different media; NPA: 无机磷培养基 Inorganic phosphorus medium; OPA: 有机磷培养基 Organic phosphorus medium.
3)+: 具有解钾能力 With ability of solubilizing potassium; -: 无解钾能力 Without ability of solubilizing potassium.
4)用培养基上的晕圈半径表示产嗜铁素能力 Ability of producing siderophore are showed by radius of aureola on medium.
2.3.1 解磷能力分析 测定结果(表1)显示:在分离获得的75株细菌菌株中,有34株细菌(包括细茎石斛内生细菌5株、根围苔藓内生细菌11株、根围土壤细菌18株)能够在有机磷 (OPA) 培养基平板上产生透明菌圈,菌圈半径为0.33~10.67 cm,说明这些菌株具有分解有机磷的能力;有39株细菌(包括细茎石斛内生细菌4株、根围苔藓内生细菌5株、根围土壤细菌30株)能够在无机磷 (NPA) 培养基平板上产生透明菌圈,菌圈半径为1.00~6.33 cm,说明这些菌株具有分解无机磷的能力。统计结果显示,在OPA和NPA培养基平板上都能够产生透明菌圈的菌株共有22株,其中21株分离自根围土壤和根围苔藓,且这22株菌株以假单胞菌属和芽孢杆菌属为优势菌,分别为9和8株。
2.3.2 解钾能力分析 在分离获得的75株细菌菌株中,有25株菌株能够在以钾长石为惟一钾源的硅酸盐培养基上形成油滴状菌落,说明这些菌株具有解钾能力(见表1)。其中,23株菌株分离自根围苔藓和根围土壤,且这25株菌株以芽孢杆菌属和假单胞菌属为优势菌,分别有11和7株。
2.3.3 产生长素能力分析 在分离获得的75株细菌菌株中,有64株菌株能够产生长素,生长素产量为42.22~287.47 μg·mL-1(见表1)。其中,生长素产量高于100 μg·mL-1的菌株有30株,包括细茎石斛内生细菌14株和根围土壤细菌16株。分离自细茎石斛根部的芽孢杆菌属菌株DmB13的产生长素能力最强,生长素产量达到287.47 μg·mL-1。
2.3.4 产嗜铁素能力分析 在分离获得的75株细菌菌株中,有39株菌株能够在WA培养基平板上产生橘黄色晕圈,晕圈半径为1.00~7.00 cm(见表1)。其中,36株菌株分离自根围苔藓和根围土壤,且这39株菌株以芽孢杆菌属和假单胞菌属为优势菌,各为14株;产嗜铁素能力最强的菌株为分离自根围苔藓内的芽孢杆菌属菌株DmBM13。
2.3.5 促生能力综合分析 综合分析结果表明:在分离获得的75株细菌菌株中,有9株细菌兼具解磷、解钾、产生长素和嗜铁素的能力,包括假单胞菌属菌株4株、芽孢杆菌属菌株3株、赖氨酸芽孢杆菌属菌株1株和链霉菌属菌株1株,这些菌株主要分离自细茎石斛的根围土壤(7株)和根围苔藓(2株)。
3 讨论和结论
ARDRA法是通过采用合适的限制性内切酶对细菌的核糖体DNA片段进行酶切分析以研究细菌多样性并在属甚至种水平对菌株进行分类鉴定的研究方法[19],可单独或与其他分子标记联合用于细菌系统发生学和分类学研究[20-21]。将ARDRA用于分析细茎石斛内生和根围细菌的多样性较16SrDNA序列测序更方便、快捷,并且成本较低。
本研究中,最大的2个ARDRA簇(第31簇和第18簇)均包含细茎石斛的内生和根围细菌。据此推测细茎石斛的内生和根围细菌之间存在一定的联系,根围细菌可能通过细茎石斛根部的自然孔洞或伤口进入体内,成为其体内细菌的一部分。16SrDNA序列测定结果表明:分离的75株内生和根围细菌菌株隶属于8个属,且芽孢杆菌属菌株在细茎石斛体内及根围生境中均具有明显优势,这一结果与Tsavkelova等[6,22]的研究结果一致。此外,细茎石斛的根和茎中均存在特有的细菌种类,如根中的微杆菌属菌株、茎中的泛菌属菌株等,说明这些内生细菌菌株可能具有组织特异性。
在本研究分离出的75株细茎石斛内生和根围细菌菌株中,4株假单胞菌属菌株、3株芽孢杆菌属菌株、1株赖氨酸芽孢杆菌属菌株和1株链霉菌属菌株兼具解磷、解钾、产生长素和嗜铁素的能力,这9株菌株均具有释放土壤中的磷和钾元素、螯合铁元素及产生长素的能力,据此认为这些菌株具有促进植物生长的潜能。此外,芽孢杆菌属菌株DmB13虽然不具有解磷、解钾和产嗜铁素的能力,但是其产生长素的能力最强,因此可将其作为进一步促生实验的候选菌株。通常情况下,植物的生长发育需要各种营养元素,而其内生和根围细菌可通过固氮、溶磷、分泌植物激素(生长素、赤霉素、细胞分裂素和乙烯等)等方式直接影响植物的新陈代谢[23-24]。另外,微生物产生的嗜铁素对植物的铁营养调控也具有一定的作用,许多微生物分泌的嗜铁素可作为缺铁植物的铁源[25]。因此,将具有良好促生潜力的细菌应用于农业生产,可以在一定程度上替代化肥和农药[26]。
综上所述,细茎石斛根和茎的内生细菌、根围苔藓细菌和根围土壤细菌种类均较多(75株)且多样性较丰富(8属),共分成33个ARDRA簇,以芽孢杆菌属和假单胞菌属细菌为主。其中,22株菌株兼具解无机磷和有机磷的能力、25株菌株具有解钾能力、64株菌株具有产生长素能力、39株菌株具有产嗜铁素能力,共9株菌株兼具解磷、解钾、产生长素和嗜铁素的能力,因此,可将这些菌株作为促进细茎石斛生长的候选菌株。
[1] 国家药典委员会. 中华人民共和国药典: 2005年版(一部)[M]. 北京: 化学工业出版社, 2005: 62-63.
[2] 郑 伟, 张云伟, 陈龙清. 石斛属植物的菌根研究进展[J]. 湖北农业科学, 2010, 49(9): 2279-2282.
[3] 董丹丹, 汪志平. 石斛属植物内生菌的研究进展[J]. 药物分析杂志, 2012, 32(3): 550-553.
[4] CHEN X M, DONG H L, HU K X, et al. Diversity and anti-microbial and plant-growth-promoting activities of endophytic fungi inDendrobiumloddigesiiRolfe[J]. Journal of Plant Growth Regulation, 2010, 29: 328-337.
[5] CHENJ,WANGH,GUOSX. Isolation and identification of endophytic and mycorrhizal fungi from seeds and roots ofDendrobium(Orchidaceae)[J]. Mycorrhiza, 2012, 22: 297-307.
[6] TSAVKELOVA E A, CHERDYNTSEVA T A, KLIMOVA S Y, et al. Orchid-associated bacteria produce indole-3-acetic acid, promote seed germination, and increase their microbial yield in response to exogenous auxin[J]. Archives of Microbiology, 2007, 188: 655-664.
[7] 俞 婕, 赵凯鹏, 董 飞, 等. 野生铁皮石斛内生菌的分离及促生作用研究[J]. 现代农业科技, 2010(9): 96-97.
[8] 程 萍, 郑燕玲, 黎永坚, 等. 石斛兰镰刀菌叶斑病的生物防治研究[J]. 中国农学通报, 2008, 24(9): 357-361.
[9] 童文君, 张 礼, 薛庆云, 等. 不同产地美化石斛内生细菌分离及促生潜力比较[J]. 植物资源与环境学报, 2014, 23(1): 16-23.
[10] GUO L D, HYDE K D, LIEW E C Y. Identification of endophytic fungi fromLivistonachinensisbased on morphology and rDNA sequences[J]. New Phytologist, 2000, 147: 617-630.
[11] 沈 萍, 范秀容, 李广武. 微生物学实验[M]. 3版. 北京: 高等教育出版社, 1999: 214-215.
[12] ZHENG Y, XUE Q Y, XU L L, et al. A screening strategy of fungal biocontrol agents towardsVerticilliumwiltof cotton[J]. Biological Control, 2011, 56: 209-216.
[13] 杨 柳, 唐旺全, 蒋 艳, 等. 解钾芽孢杆菌的分离、鉴定及其代谢产物分析[J]. 安徽农业科学, 2011, 39(28): 17265-17267.
[14] LIBBERT E, RISCH H. Interactions between plants and epiphytic bacteria regarding their auxin metabolism: Ⅴ. Isolation and identification of the IAA-producing and destroying bacteria from pea plants[J]. Physiologia Plantarum, 1969, 22: 51-58.
[15] GLICKMANNE,DESSAUXY. Acriticalexaminationofthe specificity of the salkowski reagent for indolic compounds produced by phytopathogenic bacteria[J]. Applied and Environmental Microbiology, 1995, 61: 793-796.
[16] 刘 琳, 孙 磊, 张瑞英, 等. 春兰根中可分泌吲哚乙酸的内生细菌多样性[J]. 生物多样性, 2010, 18(2): 182-187.
[17] MISHRA A, CHAUHAN P S, CHAUDHRY V, et al. Rhizosphere competentPantoeaagglomeransenhances maize (Zeamays) and chickpea (CicerarietinumL.) growth, without altering the rhizosphere functional diversity[J]. Antonie van Leeuwenhoek, 2011, 100: 405-413.
[18] SHIN S H, YONG L, LEE S E, et al. CAS agar diffusion assay for the measurement of siderophores in biological fluids[J]. Journal of Microbiological Methods, 2001, 44: 89-95.
[19] LOUWS F J, RADEMAKER J L W, De BRUIJN F J. The three Ds of PCR-based genomic analysis of phytobacteria: diversity, detection, and disease diagnosis[J]. Annual Review of Phytopathology, 1999, 37: 81-125.
[20] PONNUSAMY K, JOSE S, SAVARIMUTHU I, et al. Genetic diversity study ofChromobacteriumviolaceumisolated from Kolli hills by amplified ribosomal DNA restriction analysis (ARDRA) and random amplified polymorphic DNA (RAPD)[J]. Letters in Applied Microbiology, 2011, 53: 341-349.
[21] DUNBAR J, WHITE S, FORNEY L. Genetic diversity through the looking glass: effect of enrichment bias[J]. Applied and Environmental Microbiology, 1997, 63: 1326-1331.
[22] TSAVKELOVA E A, CHERDYNTSEVA T A, NETRUSOV A I. Bacteria associated with the roots of epiphytic orchids[J]. Microbiology, 2004, 73: 710-715.
[23] GAIERO J R, MCCALL C A, THOMPSON K A , et al. Inside the root microbiome: bacterial root endophytes and plant growth promotion[J]. American Journal of Botany, 2013, 100: 1738-1750.
[24] WEYENS N, VAN DER LELIE D, TAGHAVI S, et al. Exploiting plant-microbe partnerships to improve biomass production and remediation[J]. Trends in Biotechnology, 2009, 27: 591-598.
[25] 金崇伟, 俞雪辉, 郑绍建. 微生物在植物铁营养中的潜在作用[J]. 植物营养与肥料学报, 2005, 11(5): 688-695.
[26] BHATTACHARYYAPN,JHADK.Plant growth-promoting rhizobacteria (PGPR): emergence in agriculture[J]. World Journal of Microbiology and Biotechnology, 2012, 28: 1327-1350.
(责任编辑: 佟金凤)
Analyses on diversity and plant-growth-promoting ability of endophytic and rhizosphere bacteria ofDendrobiummoniliforme
ZHANG Li, TONG Wenjun, XUE Qingyun, DING Xiaoyu①
(College of Life Sciences, Nanjing Normal University, Nanjing 210023, China),J.PlantResour. &Environ., 2015, 24(3): 32-40
Endophytic bacteria from root, stem and leaf ofDendrobiummoniliforme(Linn.) Sw. collected from Yingshan County of Hubei Province, endophytic bacteria from rhizosphere moss and rhizosphere bacteria from rhizosphere soil of this species were separated, and these bacterium strains were identified and their diversity were analyzed by means of a combination method of amplified ribosomal DNA restriction analysis (ARDRA) and UPGMA cluster analysis. On these bases, abilities of solubilizing phosphorus, solubilizing potassium, producing auxin and siderophore of these bacterium strains were detected by plate detection technology. The results show that 75 bacterium strains are obtained from root and stem ofD.moniliformeand its rhizosphere moss and soil, endophytic bacterium is not isolated from leaf ofD.moniliforme. In which, endophytic bacteria from root and stem are 14 and 7 strains, respectively, those from rhizosphere moss are less only with 14 strains, bacterium strains from rhizosphere soil are the most with 40 strains. 75 strains are divided into 33 ARDRA clusters, by 16SrDNA sequencing and alignment, they are belonging to genera ofStreptomyces,Bacillus,Pseudomonas,Rahnella,Pandoraea,Microbacterium,LysinibacillusandPantoea, in which,BacillusandPseudomonasare the dominant genera. In 75 strains of endophytic and rhizosphere bacteria, 22 strains possess double abilities of solubilizing inorganic and organic phosphorus, 25 strains do solubilizing potassium ability, 64 strains do producing auxin ability and 39 strains do producing siderophore ability, in which, 9 strains possess all abilities of solubilizing phosphorus and potassium, producing auxin and siderophore. On the whole, endophytic and rhizosphere bacteria ofD.moniliformeare quantity with high diversity, in which, 9 strains with all of four plant-growth-promoting abilities can be used as candidate strains for promoting growth ofD.moniliforme.
Dendrobiummoniliforme(Linn.) Sw.; endophytic bacterium; rhizosphere bacterium; ARDRA analysis; diversity; plant-growth-promoting ability
2015-01-04
国家自然科学基金资助项目(311703000)
张 礼(1988—),女,江苏连云港人,硕士研究生,主要从事植物内生菌方面的研究。
①通信作者 E-mail: dingxynj@263.net
Q948.12+2.3; Q949.71+8.43
A
1674-7895(2015)03-0032-09
10.3969/j.issn.1674-7895.2015.03.05

