低温胁迫下鹅掌楸抗寒性相关基因的差异表达分析
陆 畅, 李 斌, 郑勇奇
(国家林木遗传育种重点实验室 中国林业科学研究院林业研究所 国家林业局林木培育重点实验室, 北京 100091)
低温胁迫下鹅掌楸抗寒性相关基因的差异表达分析
陆 畅, 李 斌, 郑勇奇①
(国家林木遗传育种重点实验室 中国林业科学研究院林业研究所 国家林业局林木培育重点实验室, 北京 100091)
对4 ℃和-30 ℃低温条件下引种自安徽大别山的1株鹅掌楸〔Liriodendronchinense(Hemsl.) Sarg.〕植株顶芽总RNA进行了数字基因表达谱构建和差异表达基因筛选,并对筛选出的抗寒性相关基因进行了实时荧光定量PCR分析。结果表明:获得的总RNA样品质量符合实验要求。数字基因表达谱分析结果表明:每个样品的质量控制后序列的总长度均在0.5 Gbp以上,碱基错误率为0.01%,Q20值超过99%,Q30值为96.99%~97.23%,GC含量为44.97%~47.06%,并且每个样品比对成功的序列条数占质量控制后序列总数的百分率均在90%以上。差异表达基因筛选结果显示:共发现9个与鹅掌楸抗寒性有关的差异表达基因,分别为HSP、MYB、NAC、AP2、Zincfinger、WRKY、FAD、Phospholipase和β-amylase基因。实时荧光定量PCR分析结果表明这9个基因共有3种表达模式,其中,HSP和FAD基因的相对表达量均随着温度的降低而减少,表现为基因下调表达;AP2、NAC和Zincfinger基因的相对表达量随着温度的降低而增多,表现为基因上调表达;而β-amylase、WRKY、Phospholipase和MYB基因的相对表达量则表现为4 ℃时增加、-30 ℃时减少。从基因的相对表达量来看,最大相对表达量超过5的基因有NAC和WRKY,介于2~5之间的基因有AP2、Zincfinger、β-amylase和MYB,低于2的基因有Phospholipase、HSP和FAD。结果显示NAC和WRKY基因可能在鹅掌楸的抗寒过程中起主要作用。
鹅掌楸; 低温胁迫; 抗寒性相关基因; 数字基因表达谱; 差异表达基因; 相对表达量
鹅掌楸〔Liriodendronchinense(Hemsl.) Sarg.〕为木兰科(Magnoliaceae)鹅掌楸属(LiriodendronLinn.)植物,为中国特有种,属于少数花叶共赏树种,并为世界珍贵树种[1];鹅掌楸材性良好,具有一定的药用价值,被列为中国珍稀濒危保护植物[2],自然分布于中国南方江西、贵州、福建等省的山地中。在引种栽培过程中,抗寒性差是限制鹅掌楸向北方推广种植的主要因素。因此,明确鹅掌楸的抗寒机制对于鹅掌楸的推广种植和培育抗寒品种具有重要意义。然而,目前关于鹅掌楸抗寒性的研究主要集中在表型性状评价方面[3-4],尚未见从基因水平上探究鹅掌楸抗寒性的相关研究报道。
目前研究基因功能的方法较多,其中,差减杂交、cDNA代表性差异分析及mRNA差异显示技术等无法全面系统的分析基因功能,基因克隆技术和遗传转化技术则存在实验周期较长的问题[5],只有转录组测序技术可以实现大规模转录本的快速鉴定和功能分析[6]。因此,转录组测序技术已成为研究植物基因功能的重要手段,被广泛应用于植物的冷适应和低温响应基因的研究[7-9]。
为了从基因水平上明确鹅掌楸的抗寒机制,作者对4 ℃和-30 ℃低温条件下来源于鹅掌楸天然分布区北缘的安徽大别山10年生植株的顶芽总RNA进行数字基因表达谱构建和差异表达基因筛选,并对获得的抗寒性相关基因进行实时荧光定量PCR分析,以期比较鹅掌楸各抗寒性相关基因间的表达差异,为从基因水平上研究其抗寒机制提供参考。
1 材料和方法
1.1 材料
供试样株引种自鹅掌楸天然分布区北缘的安徽大别山,种植于中国林业科学研究院内,为10年生植株。于2014年7月中旬分别采集植株树冠上、中、下层北侧的1年生幼嫩枝条(带叶,且枝条顶端保留叶芽),每层各采集3份样品,每份样品10个枝条,根据预实验结果进行低温冻害实验。各取1份树冠上、中、下层枝条,分别混匀后平均分成3组:第1组为对照(CK),于常温下立即采集枝条顶芽,并用锡箔纸包裹后迅速投入液氮中,并用液氮罐带回实验室,置于-80 ℃超低温冰箱中保存、备用;第2组和第3组枝条样品分别用塑料袋包装后置于4 ℃冰箱中,24 h后取出;采集第2组枝条的顶芽,用锡箔纸包裹后迅速投入液氮中,置于-80 ℃超低温冰箱中保存、备用,记为T1;同时将第3组枝条样品迅速放入-30 ℃冰箱中,30 min后取出,采集枝条的顶芽,用锡箔纸包裹后迅速投入液氮中,置于-80 ℃超低温冰箱中保存、备用,记为T2。对各层枝条样品均如此处理,每个温度处理各3个重复,共9份样品。
1.2 方法
1.2.1 总RNA的提取及质量检测 采用离心柱型RNA Prep Pure Plant Kit试剂盒〔天根生化科技(北京)有限公司〕分别提取各样品的总RNA,并利用NanoDrop 2000超微量分光光度计(美国Thermo Fisher Scientific公司)测定获得的总RNA样品溶液的浓度及OD260/OD280,并对获得的总RNA样品质量进行检测。将质量检测合格的总RNA样品分成两部分:一部分用于数字基因表达谱构建;另一部分置于-80 ℃超低温冰箱中保存,用于后期的实时荧光定量PCR分析。
1.2.2 数字基因表达谱的构建 数字基因表达谱构建过程由北京诺禾致源生物信息科技有限公司完成,采用RNA Library Prep Kit for Illumina试剂盒(美国NEBNext®UltraTM公司)、按照操作指南构建表达谱测序文库。使用带有Oligo(dT)的小磁珠分离纯化出总RNA样品中的mRNA;随后加入Fragmentation buffer将mRNA打断成短片段,并使用随机引物将待测的mRNA逆转录合成单链cDNA;加入缓冲液、dNTPs、DNA polymerase Ⅰ和RNase H合成双链cDNA;使用Agencourt AMPure XP核酸纯化试剂盒(美国Backman公司)纯化双链cDNA,并对其进行末端修复、3′末端加polyA尾巴和连接测序接头等工作,对获得的产物进行PCR扩增,并用Agencourt AMPure XP核酸纯化试剂盒纯化获得的PCR产物,得到待测序文库。使用Agilent 2100生物芯片分析系统(美国Agilent公司)并采用Q-PCR方法对待测序文库进行质量检测;使用Illumina HiSeqTM2500高通量测序平台(美国Illumina公司)进行单端测序(single-end, SE),测序的序列标签长度为50 bp。实验共构建了3个数字基因表达谱数据库,分别为CK、T1和T2,每个表达谱样本测序进行3次生物学重复。
1.2.3 差异表达基因的筛选 将上述测序获得的序列与Nr、Nt、SwissProt、GO、KOG和KEGG数据库进行比对,获得上述测序序列的注释信息;对3个表达谱数据库进行两两组合,比较基因的差异表达水平。共3个比较组合,分别为CK vs. T1、CK vs. T2和T1 vs. T2。本研究中的差异基因筛选条件为q-value <0.005并且|log2(foldchange)|>1。对差异检验的p值进行多重假设检验校正,并通过控制错误发现率(false discovery rate, FDR)来决定p值。根据测序获得的转录组数据和表达谱测序数据,按基因功能对转录组数据中的KEGG代谢通路显著富集的序列进行分类。对候选基因序列在GenBank中重新进行BLASTx同源性比对,以获取基因的准确信息。
1.2.4 实时荧光定量PCR分析 从-80 ℃超低温冰箱中取出总RNA样品,室温下解冻后配制逆转录反应体系,包括总RNA 0.5 μg、50 μmol·L-1Oligo(dT) 0.5 μL、100 μmol·L-1random 6mers 0.5 μL、5×PrimeScript buffer 2.0 μL和PrimeScript RT Enzyme Mix Ⅰ 0.5 μL,并用Nuclease-free H2O将反应体系总体积补足至10 μL。将上述反应体系置于9700型PCR仪(美国ABI公司)中于37 ℃保温15 min完成逆转录反应,再于85 ℃保温5 s终止逆转录反应;加入90 μL Nuclease-free H2O,置于-20 ℃冰箱中保存、备用。
采用Roche LCPDS2软件、根据筛选出的差异表达基因序列设计引物,并由上海捷瑞生物工程有限公司合成,各引物序列及其扩增的条带长度见表1。选择稳定表达的18SrRNA作为内参基因进行PCR扩增。在LightCycler®480 Ⅱ型荧光定量PCR仪(瑞士Roche公司)上使用LightCycler®480 SYBR Green Ⅰ Master试剂盒(瑞士Roche公司)进行PCR扩增反应,每个扩增反应重复3次。反应体系总体积为10 μL,包括2×LightCycler®480 SYBR Green Ⅰ Master 5 μL、10 μmol·L-1正向引物 0.2 μL、10 μmol·L-1反向引物 0.2 μL、cDNA模板 1.0 μL和Nuclease-free H2O 3.6 μL。扩增程序为:95 ℃预变性10 min;95 ℃变性10 s,60 ℃退火和延伸各30 s,共40个循环。扩增反应结束后利用熔解曲线检测产物特异性:将该反应体系从60 ℃缓慢升温至97 ℃,每升高1 ℃采集5次荧光信号。
采用2-ΔΔCt法进行基因相对表达量的计算,计算公式为:基因相对表达量=2-ΔΔCt。其中,ΔΔCt计算公式为:ΔΔCt=ΔCt(实验组)-ΔCt(对照组),实验组或对照组的ΔCt计算公式为:ΔCt=Ct(目的基因)-Ct(内参基因)。
表1 用于鹅掌楸差异表达基因实时荧光定量PCR扩增的特异引物序列及扩增条带长度
Table 1 Sequence and amplified band length of special primers used for real-time fluorescence quantitative PCR amplification of differential expression gene ofLiriodendronchinense(Hemsl.) Sarg.

序列编号No.ofsequence引物序列(5′→3′) Primersequence(5′→3′) 正向引物Forwardprimer 反向引物Reverseprimer扩增条带长度/bpLengthofamplifiedbandcomp144834_c1 CATTCTTATGCTCGGTTCTTT TCTCGACTCGAACCATACT114comp118790_c0 CTCCAAGGGCCTTTGATT TCTGCTCCCATCTCCTCTA113comp133557_c0 TTCTCTCCAAATAATCGGCG AGTCAAGCCGTTCGTTCA109comp138270_c0 CCCTCCAATTCGATGACC ACACCTGTTTCCTTTCTTCATA113comp143973_c0 TATGGTCACCCACAACCG ACTAAAGTTCACACATGGCTA109comp132916_c0 CAAACCTGCCCTTAATCTAGT GTTGTGGTTCCCTTCGTAT123comp142526_c0 CATAACAGTATCTGGCAAGGTC TCTGTGTGCTGTGTTGTAGT100comp141644_c0 ATCAATGGATGGGTTAATGCAA AATTCTCCTTCGACGAGAC107comp137127_c0 AGCTTGTTAGCGGTTCTAT CCATTACATTGAGAATCGCC11218SrRNA CGGCTACCACATCCAAGGAA GCTGGAATTACCGCGGCT187
2 结果和分析
2.1 总RNA样品质量的检测结果分析
检测结果(表2)显示:提取获得的鹅掌楸顶芽总RNA样品溶液的OD260/OD280介于1.8~2.1之间,说明提取获得的总RNA样品的纯度较高,杂质污染程度较小,获得的总RNA样品的质量能够满足后续实验的要求;获得的每份总RNA样品的总量为34~117 μg,均可以满足2次或者2次以上后续实验的需要量,便于开展3次重复实验。
电泳检测结果(图1)显示:获得的总RNA样品的18S和28SRNA条带清晰、亮度高,并且后者条带亮度高于前者,说明获得的总RNA样品可用于实时荧光定量PCR分析。
表2 低温胁迫下鹅掌楸顶芽总RNA质量的检测结果
Table 2 Detection result of quality of total RNA from apical buds ofLiriodendronchinense(Hemsl.) Sarg. under low temperature stress
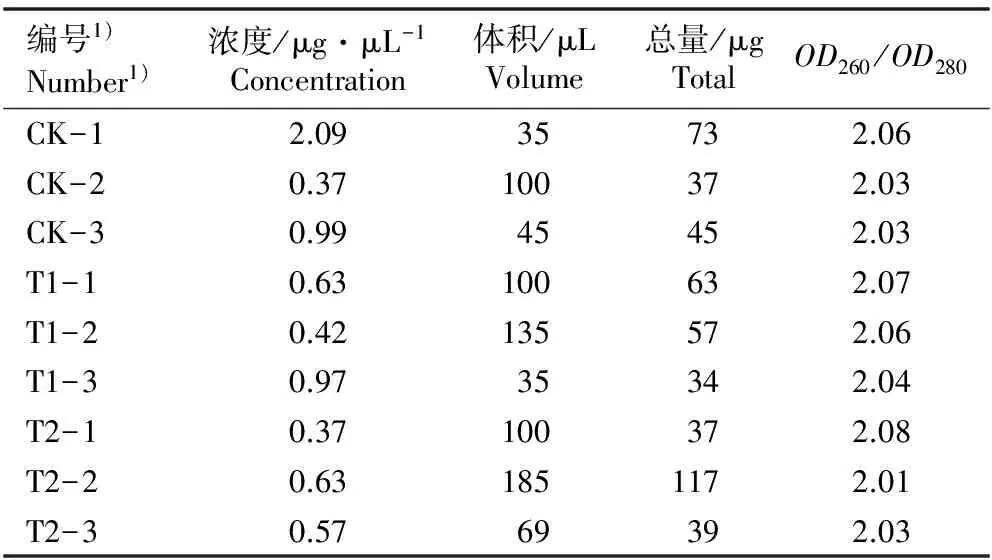
编号1)Number1)浓度/μg·μL-1Concentration体积/μLVolume总量/μgTotalOD260/OD280CK-12.0935732.06CK-20.37100372.03CK-30.9945452.03T1-10.63100632.07T1-20.42135572.06T1-30.9735342.04T2-10.37100372.08T2-20.631851172.01T2-30.5769392.03
1)CK-1,CK-2,CK-3: 表示对照(常温)的3个重复 Representing three replications of the control (normal temperature); T1-1,T1-2,T1-3: 表示4 ℃低温处理的3个重复 Representing three replications of 4 ℃ low temperature treatment; T2-1,T2-2,T2-3: 表示-30 ℃低温处理的3个重复 Representing three replications of -30 ℃ low temperature treatment.
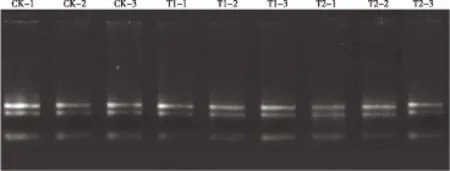
CK-1,CK-2,CK-3: 表示对照(常温)的3个重复 Representing three replications of the control (normal temperature); T1-1,T1-2,T1-3: 表示4 ℃低温处理的3个重复 Representing three replications of 4 ℃ low temperature treatment; T2-1,T2-2,T2-3: 表示-30 ℃低温处理的3个重复 Representing three replications of -30 ℃ low temperature treatment.
图1 低温胁迫下鹅掌楸顶芽总RNA检测的电泳图谱
Fig. 1 Electrophoretogram of detection of total RNA from apical buds ofLiriodendronchinense(Hemsl.) Sarg. under low temperature stress
2.2 数字基因表达谱的测序结果分析
对9份鹅掌楸顶芽总RNA样品的数字基因表达谱进行测序,结果(表3)表明:每个样品的质量控制后序列的总长度均在0.5 Gbp以上,碱基错误率均为0.01%;Q20值均超过99%,Q30值在96.99%~97.23%之间,GC含量为44.97%~47.06%。每个样品比对成功的序列条数占该样品质量控制后序列总数的百分率均在90%以上。
2.3 差异表达基因的筛选结果分析
使用log2(foldchange)表示比较组合中某一基因在2个样品间的表达差异。假设log2(foldchange)值为x,则样品A对比样品B的表达倍数(fold change)为2x倍。使用校正后的p值表现基因表达量变化的统计学显著程度,校正后的p值越小,-log10(校正后的p值)越大,即差异越显著。在实验设置的3个比较组合中,CK vs. T2组合的差异表达基因数最多,共有3 485个差异表达基因,包括2 272个上调基因和1 213个下调基因;CK vs. T1组合的差异表达基因有1 687个,包括1 126个上调基因和561个下调基因;T1 vs. T2组合的差异表达基因数最少,仅有152个,包括28个上调基因和124个下调基因。
结合前人关于植物抗寒性相关基因的研究结果[7-9],共筛选出9个与鹅掌楸抗寒性相关的差异表达基因(表4)。与GenBank数据库中的相关信息进行同源比对,其中6个差异表达基因(序列编号分别为comp144834_c1、comp118790_c0、comp133557_c0、comp138270_c0、comp143973_c0和comp132916_c0)被认为是潜在的转录因子,推测其分别为HSP、MYB、NAC、AP2、Zincfinger和WRKY基因;推测序列编号comp141644_c0的差异表达基因为脂肪酸去饱和酶(fattyaciddesaturase,FAD)基因;推测序列编号comp142526_c0的差异表达基因为与β-淀粉酶合成相关的基因,即β-amylase基因;推测序列编号comp137127_c0的差异表达基因为磷脂酶(Phospholipase)基因。
表3 低温胁迫下鹅掌楸顶芽总RNA的数字基因表达谱的分析结果1)
Table 3 Analysis result of digital gene expression profile of total RNA from apical buds ofLiriodendronchinense(Hemsl.) Sarg. under low temperature stress1)
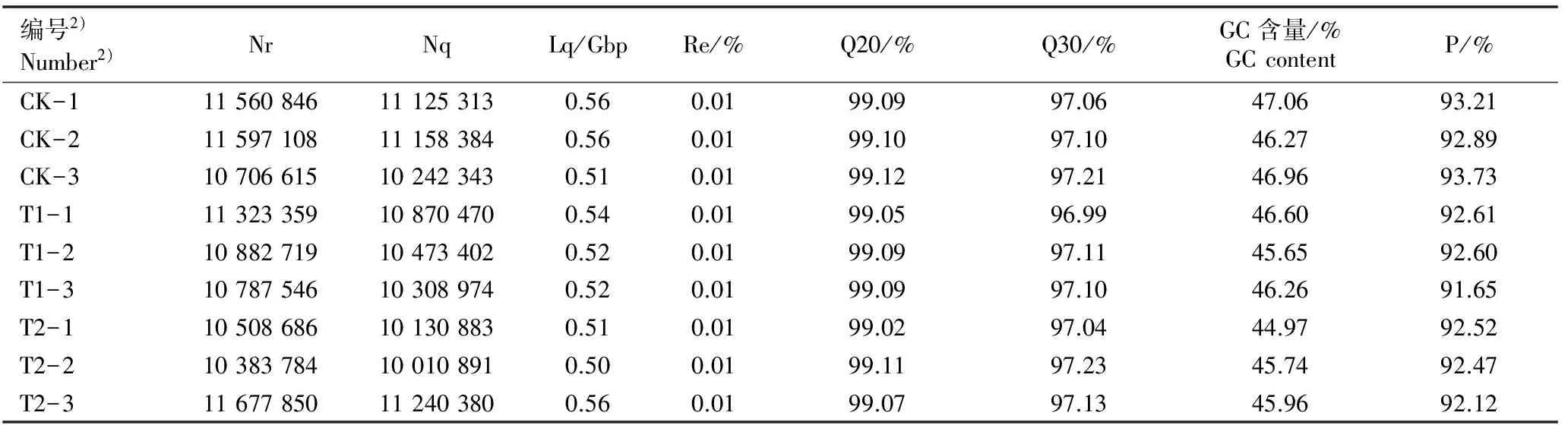
编号2)Number2)NrNqLq/GbpRe/%Q20/%Q30/%GC含量/%GCcontentP/%CK-111560846111253130.560.0199.0997.0647.0693.21CK-211597108111583840.560.0199.1097.1046.2792.89CK-310706615102423430.510.0199.1297.2146.9693.73T1-111323359108704700.540.0199.0596.9946.6092.61T1-210882719104734020.520.0199.0997.1145.6592.60T1-310787546103089740.520.0199.0997.1046.2691.65T2-110508686101308830.510.0199.0297.0444.9792.52T2-210383784100108910.500.0199.1197.2345.7492.47T2-311677850112403800.560.0199.0797.1345.9692.12
1)Nr: 原始序列总条数 Total number of raw reads; Nq: 质量控制后的序列总条数Total number of reads after quality control; Lq: 质量控制后序列的总长度Total length of reads after quality control; Re: 碱基错误率Error rate of base; P: 比对成功的序列条数占质量控制后序列总数的百分率Percentage of successfully mapped read number to total read number after quality control.
2)CK-1,CK-2,CK-3: 表示对照(常温)的3个重复 Representing three replications of the control (normal temperature); T1-1, T1-2, T1-3: 表示4 ℃低温处理的3个重复 Representing three replications of 4 ℃ low temperature treatment; T2-1,T2-2,T2-3: 表示-30 ℃低温处理的3个重复 Representing three replications of -30 ℃ low temperature treatment.
表4 低温胁迫下鹅掌楸差异表达基因的筛选结果
Table 4 Selection result of differential expression gene ofLiriodendronchinense(Hemsl.) Sarg. under low temperature stresses

序列编号No.ofsequenceGenBank中相似序列的蛋白名称NameofproteinwithsimilarsequenceinGenBank基因名称Genename序列长度/bpLengthofsequencecomp144834_c1HSF30(葡萄Vitisvinifera)HSP2668comp118790_c0MYB124(大豆Glycinemax)MYB866comp133557_c0NAC(苹果Malusdomestica)NAC1141comp138270_c0AP2/ERF(predicted)(可可Theobromacacao)AP21491comp143973_c0Zincfingerprotein(拟南芥Arabidopsisthaliana)Zincfinger3633comp132916_c0WRKY6(野大豆Glycinesoja)WRKY2116comp142526_c0β-amylase9(predicted)(葡萄Vitisvinifera)β-amylase2176comp141644_c0UncharacterizedproteinLOC100245192(predicted)(葡萄Vitisvinifera)FAD753comp137127_c0HypotheticalproteinVITISV_043921(葡萄Vitisvinifera)Phospholipase1232
2.4 实时荧光定量PCR检测结果分析
对筛选出的9个鹅掌楸抗寒性相关基因进行实时荧光定量PCR检测,结果(图2)表明:筛选出的9个鹅掌楸抗寒性相关基因共有3种表达模式:其中,HSP和FAD基因的相对表达量均随着温度的降低而逐渐减少,表现为基因下调表达;AP2、NAC和Zincfinger基因的相对表达量随着温度的降低而逐渐增多,表现为基因上调表达;β-amylase、WRKY、MYB和Phospholipase基因的相对表达量则随着温度降低表现为4 ℃时增多、-30 ℃时减少。
由图2还可以看出:在不同低温胁迫条件下,在9个鹅掌楸抗寒性相关基因中,最大基因相对表达量超过5的高表达基因为NAC和WRKY;最大基因相对表达量在2~5的基因为AP2、Zincfinger、β-amylase和MYB;最大基因相对表达量低于2的低表达基因为HSP、FAD和Phospholipase。
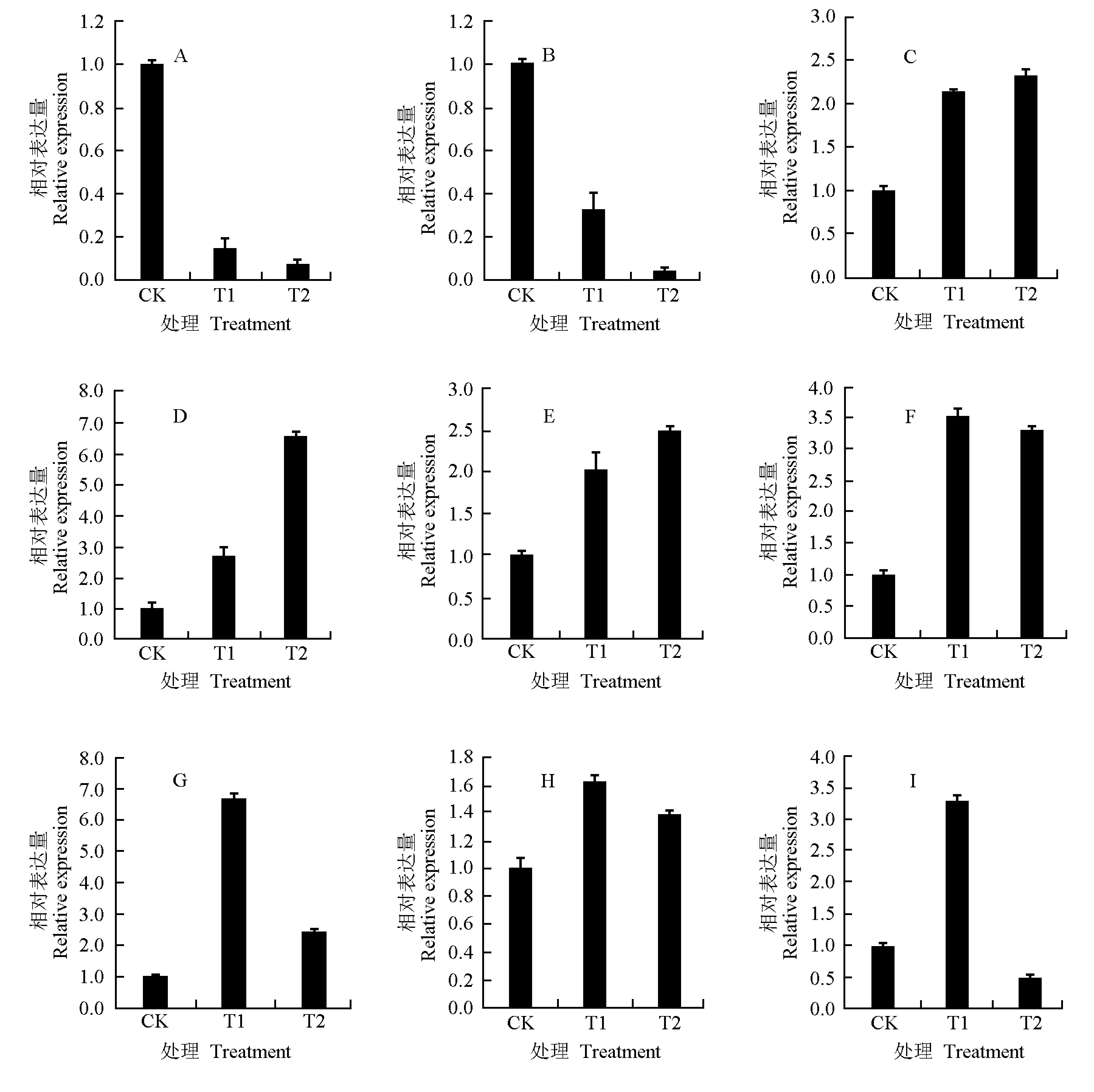
CK: 对照(常温) The control (normal temperature); T1: 低温处理(4 ℃) Low temperature treatment (4 ℃);
A:HSP基因HSPgene; B:FAD基因FADgene; C:AP2基因AP2 gene; D:NAC基因NACgene; E:Zinicfinger基因Zinicfingergene; F:β-amylase基因β-amylasegene; G:WRKY基因WRKYgene; H:Phospholipase基因Phospholipasegene; I:MYB基因MYBgene.
图2 低温胁迫下鹅掌楸9个抗寒性相关基因相对表达量的变化
Fig. 2 Change in relative expression of nine cold resistance related genes ofLiriodendronchinense(Hemsl.) Sarg. under
low temperature stress
3 讨 论
转录因子(transcription factor)既是植物对冷胁迫特异性反应的开关,又是信号传导的终点[6]。上调表达的转录因子很可能在植物防御和应激反应中起到重要作用[10-11]。本研究中,随着低温胁迫温度的降低,基因表达上调的3个基因AP2、NAC和Zincfinger均为转录因子类基因,其中AP2和Zincfinger基因的相对表达量变化幅度在25 ℃降温至4 ℃的过程中最大,而NAC基因的相对表达量变化幅度则在4 ℃降温至-30 ℃的过程中最大;并且,NAC基因的最大相对表达量超过5。陈新[12]的研究结果表明:NAC基因能够参与植物对冷胁迫的响应,并调控植物的开花过程,而且还能够诱导SNAC2等基因的表达,提高植物对冷和盐胁迫的抗性。据此推测该基因可能与鹅掌楸的抗寒性密切相关。
为了达到渗透平衡,植物体可积累包括可溶性糖、糖醇和低分子量化合物在内的物质作为应对冷胁迫的低温保护剂[13]。因此,参与上述物质相关新陈代谢的基因同样会在植物对低温胁迫的响应过程中发生表达量的变化。β-淀粉酶可以将淀粉降解为可溶性糖,鹅掌楸的β-淀粉酶基因在25 ℃降温至4 ℃的过程中表现为上调表达,而在4 ℃降温至-30 ℃的过程中则表现为下调表达。根据邓菊庆等[14]的研究结果推断:温度下降初期,淀粉酶活性提高,可溶性糖含量随之升高,细胞膜流动性增强,从而提高鹅掌楸的抗寒性;但是,当温度持续下降至极端低温时,淀粉酶活性受到抑制,可溶性糖合成受阻,细胞膜流动性减弱,从而使鹅掌楸的抗寒性也随之减弱。植物遇冷害后,冻害造成细胞脱水致使膜系统首先受到伤害,脂肪酸去饱和酶起到调节不饱和脂肪酸的作用,从而进一步调节细胞膜的流动性。徐呈祥[15]认为:植物细胞膜中的不饱和脂肪酸含量越高,其抗寒性越强。本研究中鹅掌楸的FAD基因在低温胁迫过程中始终表现为下调表达,说明随着温度的降低,鹅掌楸体内的脂肪酸去饱和酶活性降低,不饱和脂肪酸合成减少,细胞膜的流动性减弱,从而使鹅掌楸的抗寒性减弱。磷脂酶是植物体内重要的磷脂水解酶,兼具跨膜信号转导的作用,能够影响植物的抗冻性[16]。鹅掌楸的Phospholipase基因在25 ℃降温至4 ℃的过程中表现为上调表达,说明在对低温环境的响应过程中鹅掌楸的抗寒性增强,但是该基因在4 ℃降温至-30 ℃的过程中表现为下调表达,这一变化是否与-30 ℃造成鹅掌楸细胞组织损伤、致使该基因无法正常表达有关,尚待进一步研究。
总体而言,通过数字基因表达谱技术从鹅掌楸顶芽总RNA中共筛选出9个差异表达基因,这9个基因均与鹅掌楸的抗寒性有关,表现为3种表达模式,其中NAC和WRKY基因的相对表达量最大,推测这2个基因可能在鹅掌楸的抗寒过程中起到主要作用。
[1] 中国科学院中国植物志编辑委员会. 中国植物志: 第三十卷第一分册[M]. 北京: 科学出版社, 1980: 196-198.
[2] 傅立国. 中国植物红皮书: 稀有濒危植物(第一册)[M]. 北京: 科学出版社, 1992: 408-409.
[3] 吴 君, 李庆卫, 王 悦. 不同小气候对杂种鹅掌楸冻害情况的影响[J]. 江苏农业科学, 2013, 41(3): 165-167.
[4] 姜 磊, 王恭祎. 华北地区鹅掌楸属树种苗木生长特性初探[J]. 林业应用技术, 2007(6): 4-6.
[5] WANG J M, YANG Y, LIU X H, et al. Transcriptome profiling of the cold response and signaling pathways inLiliumlancifolium[J]. BMC Genomics, 2014, 15: 203-222.
[6] ZHANG G J, GUO G W, HU X D, et al. Deep RNA sequencing at single base-pair resolution reveals high complexity of the rice transcriptome[J]. Genome Research, 2010, 20: 646-654.
[7] PANG T, YE C Y, XIA X L, et al. De novo sequencing and transcriptome analysis of the desert shrub,Ammopiptanthusmongolicus, during cold acclimation using Illumina/Solexa[J]. BMC Genomics, 2013, 14: 488-502.
[8] XU W R, LI R M, ZHANG N B, et al. Transcriptome profiling ofVitisamurensis, an extremely cold-tolerant Chinese wildVitisspecies, reveals candidate genes and events that potentially connected to cold stress[J]. Plant Molecular Biology, 2014, 86: 527-541.
[9] WANG X C, ZHAO Q Y, MA C L, et al. Global transcriptome profiles ofCamelliasinensisduring cold acclimation[J]. BMC Genomics, 2013, 14: 415-430.
[10] SINGH K B, FOLEY R C, OATE-SNCHEZ L. Transcription factors in plant defense and stress responses[J]. Current Opinion in Plant Biology, 2002, 5: 430-436.
[11] SARAH F, THOMASHOW MF. Arabidopsis transcriptome profiling indicates that multiple regulatory pathways are activated during cold acclimation in addition to the CBF cold response pathway[J]. Plant Cell, 2002, 14: 1675-1690.
[12] 陈 新. 榛子花芽转录组文库的Solexa测序及冷调节基因的表达谱分析[D]. 北京: 中国林业科学研究院林业研究所, 2011: 35-38.
[13] XIN Z, BROWSE J. Cold comfort farm: the acclimation of plants to freezing temperatures[J]. Plant, Cell and Environment, 2000, 23: 893-902.
[14] 邓菊庆, 蹇洪英, 李淑斌, 等. 五种野生蔷薇属植物抗寒力的综合评价[J]. 西南师范大学学报: 自然科学版, 2012, 37(4): 70-75.
[15] 徐呈祥. 提高植物抗寒性的机理研究进展[J].生态学报, 2012, 32(24): 7966-7980.
[16] 曾正兵, 梅旭荣, 钟秀丽, 等. 磷脂酶Dα在拟南芥低温驯化过程中的作用途径分析[J]. 基因组学与应用生物学, 2009, 28(4): 703-708.
(责任编辑: 佟金凤)
Analysis on differential expression of cold resistance related genes ofLiriodendronchinenseunder low temperature stress
LU Chang, LI Bin, ZHENG Yongqi①
(State Key Laboratory of Forest Genetics and Tree Breeding, Research Institute of Forestry of Chinese Academy of Forestry, Key Laboratory of Tree Breeding and Cultivation of State Forestry Administration, Beijing 100091, China),J.PlantResour. &Environ., 2015, 24(3): 25-31
Under 4 ℃ and -30 ℃ low temperature conditions, digital gene expression profile of total RNA from apical buds of one individual ofLiriodendronchinense(Hemsl.) Sarg. introduced from Dabieshan of Anhui was constructed and differential expression genes were selected, and cold resistance related genes selected were analyzed by real-time fluorescence quantitative PCR. The results show that qualities of total RNA samples obtained meet the experimental requirements. Analysis results of digital gene expression profile show that total length of reads after quality control of each sample is above 0.5 Gbp, error rate of base is 0.01%, Q20 value is more than 99%, Q30 value is 96.99%-97.23%, GC content is 44.97%-47.06%, and percentage of successfully mapped read number to total read number after quality control of each sample is above 90%. Selection result of differential expression genes shows that nine differential expression genes related to cold resistance ofL.chinenseare founded totally, they areHSP,MYB,NAC,AP2,Zincfinger,WRKY,FAD,Phospholipaseandβ-amylasegenes, respectively. Real-time fluorescence quantitative PCR analysis result shows that these nine genes have three expression modes, in which, relative expressions ofHSPandFADgenes both decrease with decreasing of temperature, appearing gene down-regulated expression; those ofAP2,NACandZincfingergenes increase with decreasing of temperature, appearing gene up-regulated expression; while those ofβ-amylase,WRKY,PhospholipaseandMYBgenes appear increasing at 4 ℃ and decreasing at -30 ℃. On the view of gene relative expression, genes with maximum relative expression over 5 areNACandWRKY, genes with that between 2-5 areAP2,Zincfinger,β-amylaseandMYB, and genes with that under 2 arePhospholipase,HSPandFAD. It is suggested thatNACandWRKYgenes may play a major role in the process of cold resistance ofL.chinense.
Liriodendronchinense(Hemsl.) Sarg.; low temperature stress; cold resistance related gene; digital gene expression profile; differential expression gene; relative expression
2015-05-31
“十二五”国家科技支撑计划项目(2013BAD01B06)
陆 畅(1986—),女,安徽蚌埠人,博士研究生,主要研究方向为林木遗传育种。
①通信作者 E-mail: zyq8565@126.com
Q948.112+.2; Q946-33; S792.21
A
1674-7895(2015)03-0025-07
10.3969/j.issn.1674-7895.2015.03.04

