2个Sh2甜玉米自交系种子萌发过程中关键水解酶活性及相关基因表达的动态分析
程昕昕, 牛永胜, 刘 正
(安徽科技学院, 安徽 凤阳 233100)
2个Sh2甜玉米自交系种子萌发过程中关键水解酶活性及相关基因表达的动态分析
程昕昕①, 牛永胜, 刘 正
(安徽科技学院, 安徽 凤阳 233100)
为阐明Sh2甜玉米(Zeamayssubsp.saccharataSturt.)种子萌发过程中关键水解酶对种子贮藏物质利用的作用,以Sh2甜玉米自交系BF109和Q267的种子为材料,对种子萌发2、4、6、8和10 d时贮藏物质的消耗量和利用率以及总淀粉酶和蔗糖合成酶的活性进行了测定,并采用实时荧光定量PCR技术对9个相关基因的表达特性进行了分析。结果表明:种子萌发6 d时2个自交系的单粒种子贮藏物质消耗量大幅度提高,说明种子内的贮藏物质进入快速分解阶段。随萌发时间的延长,2个自交系的单粒种子贮藏物质消耗量逐渐升高,而贮藏物质利用率则呈先升高后降低的趋势;总体上看,自交系BF109的单粒种子贮藏物质消耗量显著高于自交系Q267(P<0.05),而其贮藏物质利用率则显著低于后者。随萌发时间的延长,2个自交系种子内的总淀粉酶和蔗糖合成酶活性也总体呈先升高后降低的趋势,并且自交系BF109种子内2种酶活性基本上低于或显著低于自交系Q267。实时荧光定量PCR分析结果表明:在种子萌发2~10 d期间,2个自交系种子中9个α-淀粉酶和蔗糖合成酶相关基因的相对表达量均有较大差异,但7个α-淀粉酶相关基因(包括α-Amy1A、α-Amy2A、α-Amy3A、α-Amy3B、α-Amy3C、α-Amy3D和α-Amy3E)的相对表达量均在萌发前期较高,利于合成α-淀粉酶并参与淀粉水解;α-Amy1A、α-Amy2A、α-Amy3D和SuSy-2基因的相对表达量在种子萌发2~10 d均较高,而α-Amy3A、α-Amy3B、α-Amy3C、α-Amy3E和SuSy-3基因的相对表达量仅在种子萌发2 d时较高,说明α-Amy1A、α-Amy2A、α-Amy3D和SuSy-2基因可能是Sh2甜玉米种子萌发过程中的关键水解酶基因。总体来看,自交系Q267种子中相关基因的相对表达量显著高于自交系BF109,这可能是导致自交系Q267种子中总淀粉酶和蔗糖合成酶活性及贮藏物质利用率较高的主要原因。
Sh2甜玉米; 种子萌发; 贮藏物质利用率; 淀粉酶; 蔗糖合成酶; 基因表达
甜玉米(Zeamayssubsp.saccharataSturt.)为玉米属(ZeaLinn.)中因基因突变而产生的1个亚种,主要包括su1、su2、sh1、sh2、sh4、du、ae、bt1、bt2、se和wx共11个隐性突变基因,其中sh1、sh2、sh4、bt1和bt2基因突变体的蔗糖向淀粉的转变过程明显受阻,致使其胚乳的含糖量较高,乳熟期胚乳的可溶性糖含量高达15%以上,由此也造成甜玉米种子的干物质积累不充足,种子皱缩干秕、发芽率低、拱土能力差,对其种植和生产产生不利影响。因此,甜玉米生产的首要条件是提高其种子活力,使之拥有较强的种子萌发和成苗能力。
植物种子萌发主要包括胚萌动和幼苗形成2个阶段[1]。通常,种子在萌发期间需要的营养和能量主要来自其对贮藏物质的转化和利用。吸胀后,种子的呼吸作用明显加强,在淀粉酶和蔗糖合成酶等一系列酶的作用下,淀粉和蛋白质等内部贮藏物质的代谢活动逐渐活跃并发生转变,为幼苗早期生长提供必需的营养和能量[2-4]。因此,在种子萌发过程中,幼苗生长主要受种子贮藏物质消耗量和利用率的影响。
淀粉酶和蔗糖合成酶是影响种子萌发和幼苗生长的2个关键酶。其中,α-淀粉酶(EC3.2.1.1)可将种子中贮藏的淀粉水解为糖类物质,为幼根和幼苗形成提供能量[5-7];蔗糖合成酶(EC2.4.1.13)是种子贮藏物质代谢过程中必需的关键酶之一,既可催化蔗糖合成又可催化蔗糖分解,是一种可逆酶,其作用就是催化蔗糖和UDP转化为UDP-葡萄糖和果糖[8-10]。相关的研究结果[6,11-12]表明:α-淀粉酶在种子萌发过程中合成,并且主要受赤霉素(GA)和脱落酸(ABA)的调控。在水稻(OryzasativaLinn.)种子萌发过程中,α-淀粉酶基因(包括α-Amy1A、α-Amy3B、α-Amy3C、α-Amy3D和α-Amy3E)在不同组织中的表达具有较大差异[6,13]。蔗糖合成酶是由多基因编码的酶类,目前在玉米(ZeamaysLinn.)中已经发现了3个与籽粒生长相关的蔗糖合成酶编码基因,分别为Sh1、Sus1和Sus3[14]。
为了明确α-淀粉酶和蔗糖合成酶对甜玉米种子萌发过程中贮藏物质利用的作用,作者以2个Sh2甜玉米自交系BF109和Q267的种子为供试材料,对种子萌发过程中贮藏物质的消耗量和利用率、淀粉酶和蔗糖合成酶活性及9个相关基因(包括α-Amy1A、α-Amy2A、α-Amy3A、α-Amy3B、α-Amy3C、α-Amy3D、α-Amy3E、SuSy-2和SuSy-3)表达特性的动态变化进行了分析和比较,以期为甜玉米优良品种的培育研究提供理论依据。
1 材料和方法
1.1 材料
实验用Sh2甜玉米自交系BF109和Q267种子均由安徽玉米工程技术研究中心提供。前者为从美国先锋种业引进的自交系,百粒质量9.08 g;后者是利用二环系法选育出的自交系,百粒质量11.75 g。
实验使用的主要仪器有7500型实时荧光定量PCR仪(美国ABI公司)、5427R高速冷冻离心机(德国Eppendorf公司)和JS-680D电泳凝胶成像分析系统(上海培清科技有限公司);淀粉酶和蔗糖合成酶活性检测试剂盒均由南京建成生物工程研究所研发,Trizol试剂盒为北京天为时代科技有限公司产品,PrimeScript RT reagent Kit为上海华舜生物公司产品,buffer、dNTPs和TaqDNA聚合酶等购自生工生物工程(上海)股份有限公司;所有引物合成均交由生工生物工程(上海)股份有限公司完成。
1.2 方法
1.2.1 种子萌发 按照GB/T 3543.1—1995至GB/T 3543.7—1995中的方法进行种子萌发实验。将种子用质量体积分数0.1%HgCl2溶液消毒15 min,然后用蒸馏水冲洗3次,每次1 min;用高温灭菌滤纸吸干表面水分,挑选大小均匀且健康饱满的种子,置于104 ℃烘箱中处理至种子含水率为13%;将种子置于铺有3层湿润滤纸的发芽盒(长度30 cm、宽度20 cm)中,每盒50粒种子;每个自交系15盒,各自分成3组,视为3个重复。将发芽盒置于(25±1) ℃条件下暗培养,每天观察种子萌发情况,每2天取1盒萌发种子进行相关指标检测和基因表达量分析。
1.2.2 种子贮藏物质消耗量和利用率分析 种子萌发前,首先称量50粒已经去除剩余13%水分的种子的总质量,并计算单粒种子质量,记为种子原始干质量(W0)。分别于种子萌发2、4、6、8和10 d时各取1个发芽盒,将发芽盒内种子萌发出的幼苗(包括胚根和胚芽)与剩余籽粒分开,分别用锡纸包好并置于104 ℃烘箱中持续干燥处理24 h后称量,分别记为单株幼苗干质量(W1)和单粒种子剩余干质量(W2)。参照Soltani等[15]的方法计算单粒种子贮藏物质消耗量(W3)和单粒种子贮藏物质利用率(R),计算公式分别为“W3=W0-W2”和“R=W1/W3”。实验设3次重复,结果取平均值。
1.2.3 酶活性测定 采用淀粉酶活性(碘-淀粉比色法)检测试剂盒和蔗糖合成酶活性检测试剂盒分别测定种子萌发过程中的总淀粉酶和蔗糖合成酶活性。在种子萌发2、4、6、8和10 d时分别取样,清洗并吸干种子表面水分后,称取1 g种子,加入9 mL总淀粉酶(或蔗糖合成酶)提取剂,于冰浴中研磨成匀浆;4 ℃、4 000 r·min-1离心10 min,上清液即为总淀粉酶(或蔗糖合成酶)粗提液。按照各自检测试剂盒说明书中的操作流程分别测定种子萌发过程中总淀粉酶和蔗糖合成酶活性。每个指标重复检测3次,结果取平均值。
1.2.4 实时荧光定量PCR分析 在种子萌发2、4、6、8和10 d时分别取样(其中,萌发2 d时取种胚,萌发4~10 d时取幼苗),参照Trizol试剂盒说明书中的操作流程提取种子胚中的总RNA,采用质量体积分数1%琼脂糖凝胶电泳检测总RNA的质量和浓度,并用PrimeScript RT reagent Kit将总RNA反转录成cDNA。以玉米18SrRNA基因的转录水平为内参、采用9个α-淀粉酶和蔗糖合成酶基因的特异引物(引物序列见表1)进行实时荧光定量PCR反应,每个样品重复扩增3次。
扩增反应在7500型实时荧光定量PCR仪上进行。反应体系总体积20.0 μL,包括14.5 μL ddH2O、0.5 μLdNTPs、 正向和反向引物各1.0 μL、 2.5 μL 10×buffer、0.5 μLTaqDNA聚合酶及1.0 μL cDNA模板。扩增程序为:95 ℃预变性1 min;95 ℃变性15 s,65 ℃退火15 s,72 ℃延伸5 min,共40个循环;最后于72 ℃再延伸10 min。扩增产物于4 ℃保存、备用。采用2-ΔΔCt计算目的基因的相对表达量。
表1 用于Sh2甜玉米9个α-淀粉酶和蔗糖合成酶基因实时荧光定量PCR扩增的特异引物序列
Table 1 Sequence of special primers used for real-time fluorescence quantitative PCR amplification of nine genes ofα-amylase and sucrose synthase ofSh2 sweet corn

基因名称Genename引物类型1)Primertype1)引物序列(5′→3′)Primersequence(5′→3′)α-Amy1AFACCCAGGAGTACCATGCATCTTCRGTTCGTTCTCTAGTTGCGCGACα-Amy2AFGGCAACCCATGCATCTTCTACGRGAGTTCTAGTACGACGTGCTGCα-Amy3AFAATCTGGCTGTGAGGAGGTGACRCAGCAAACCCAAAGTAGGCTCGTα-Amy3BFACAACCATGACACTGGCTCCACRGTGTGGGACCTCATGGGACGTA⁃AAα-Amy3CFACACAGAACTCATGGCCGTTCCRGTGTGGGACCTCATGGGACGTA⁃AAα-Amy3DFATAGCGGGCTCAAGCCCTA⁃AACTGRCGAGTTTGGTCAAAGATGTGCCGTα-Amy3EFAGCTTCGATCGATGTACGCTTCGRGCCTTACATGGGACAATTAG⁃GACGSuSy-1FCATCTCAGGCTGAGACTCTGARCAAATTCAATCGACCTTACTTSuSy-2FTCGGAGTTCAACCACAGGTTCCRGTTTCGCACACGAACTGTGGTA
1)F: 正向引物 Forward primer; R: 反向引物 Reverse primer.
1.3 数据处理及统计分析
采用EXCEL 2007和DPS 7.05统计分析软件进行相关数据的处理和统计学分析。
2 结果和分析
2.1 贮藏物质消耗量和利用率的动态变化
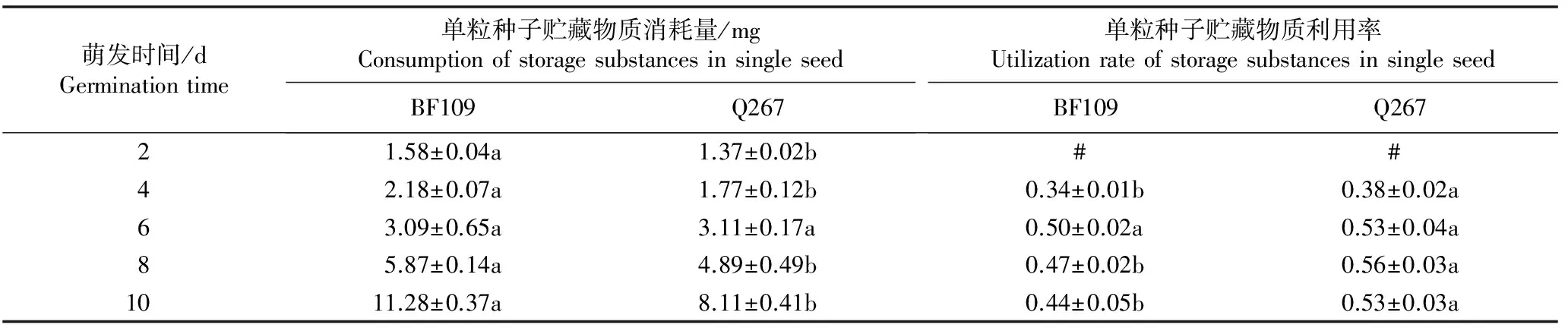
种子萌发过程中Sh2甜玉米自交系BF109和Q267单粒种子贮藏物质消耗量和利用率的动态变化见表2。由表2可以看出:随着种子萌发时间的延长,自交系BF109和Q267的单粒种子贮藏物质消耗量均逐渐升高,而单粒种子贮藏物质利用率则呈现先升高后降低的变化趋势,且2个自交系的单粒种子贮藏物质利用率最高值出现的时间不同,分别为种子萌发6和8 d。
由表2还可见:与自交系BF109相比,自交系Q267的单粒种子贮藏物质消耗量较低,但单粒种子贮藏物质利用率却较高。种子萌发2、4、8和10 d,2个自交系间的单粒种子贮藏物质消耗量均存在显著差异(P<0.05);种子萌发4、8和10 d,2个自交系的单粒种子贮藏物质利用率也存在显著差异。种子萌发10 d时,自交系BF109和Q267的单粒种子贮藏物质消耗量分别较各自种子萌发2 d时增加了9.70和6.74 mg,说明在种子萌发过程中Sh2甜玉米不同自交系因种子萌发而消耗的贮藏物质总量明显不同。
2.2 总淀粉酶和蔗糖合成酶活性的动态变化
种子萌发过程中Sh2甜玉米自交系BF109和Q267种子中总淀粉酶和蔗糖合成酶活性的变化见表3。由表3可见:种子萌发2~10 d,自交系BF109和Q267种子中的总淀粉酶和蔗糖合成酶活性总体呈先升高后降低的趋势。在自交系BF109和Q267种子中,总淀粉酶酶活性分别在种子萌发6和8 d时达到最高值,分别为6.68和7.63 U·g-1;蔗糖合成酶酶活性则分别在种子萌发4和8 d时达到最高值,分别为1.59和1.50 U·g-1。
萌发时间/dGerminationtime单粒种子贮藏物质消耗量/mgConsumptionofstoragesubstancesinsingleseedBF109Q267单粒种子贮藏物质利用率UtilizationrateofstoragesubstancesinsingleseedBF109Q26721.58±0.04a1.37±0.02b# # 42.18±0.07a1.77±0.12b0.34±0.01b0.38±0.02a63.09±0.65a3.11±0.17a0.50±0.02a0.53±0.04a85.87±0.14a4.89±0.49b0.47±0.02b0.56±0.03a1011.28±0.37a8.11±0.41b0.44±0.05b0.53±0.03a
1)#: 数值接近0 The values are close to 0. 同行中不同的小写字母表示2个自交系间同一指标差异显著(P<0.05) Different small letters in the same row indicate the significant difference in the same index between two inbred lines (P<0.05).
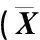

萌发时间/dGerminationtime总淀粉酶活性/U·g-1ActivityoftotalamylaseBF109Q267蔗糖合成酶活性/U·g-1ActivityofsucrosesynthaseBF109Q26721.88±0.17b4.11±0.95a1.35±0.05a1.42±0.06a44.09±0.37b5.83±0.09a1.59±0.03a1.40±0.03b66.68±0.09a7.19±0.37a1.48±0.01a1.40±0.13a85.84±0.21b7.63±0.04a1.37±0.11a1.50±0.06a105.86±0.56b6.70±0.11a1.34±0.05b1.47±0.07a
1)同行中不同的小写字母表示2个自交系间同一指标差异显著(P<0.05) Different small letters in the same row indicate the significant difference in the same index between two inbred lines (P<0.05).
由表3还可见:在种子萌发过程中,自交系Q267种子中的总淀粉酶活性均高于BF109,种子萌发2、8和10 d时前者的蔗糖合成酶活性也高于后者。其中,种子萌发2、4、8和10 d时Q267种子中的总淀粉酶活性显著高于BF109(P<0.05);Q267种子中的蔗糖合成酶活性在种子萌发4 d时显著低于BF109,而在种子萌发10 d时则显著高于BF109,即在种子萌发后期,Sh2甜玉米自交系Q267种子的总淀粉酶和蔗糖合成酶活性总体上高于自交系BF109。
2.3α-淀粉酶和蔗糖合成酶相关基因相对表达量的动态变化
采用实时荧光定量PCR技术对种子萌发过程中Sh2甜玉米自交系BF109和Q267种子中9个α-淀粉酶和蔗糖合成酶相关基因的表达量进行检测,结果见表4。
由表4可以看出:Sh2甜玉米自交系BF109和Q267种子萌发过程中α-淀粉酶相关基因(包括α-Amy1A、α-Amy2A、α-Amy3A、α-Amy3B、α-Amy3C、α-Amy3D和α-Amy3E基因)和蔗糖合成酶相关基因(包括SuSy-2和SuSy-3基因)的相对表达量变化差异较大。其中,α-Amy1A、α-Amy2A、α-Amy3D和SuSy-2基因的相对表达量在种子萌发2~10 d时相对较高,而α-Amy3A、α-Amy3B、α-Amy3C、α-Amy3E和SuSy-3基因的相对表达量仅在种子萌动期(萌发2 d)较高,说明α-Amy1A、α-Amy2A、α-Amy3D和SuSy-2基因可能是影响Sh2甜玉米种子萌发的关键水解酶基因。
由表4还可见:种子萌发2 d时Sh2甜玉米自交系BF109和Q267的α-淀粉酶基因和蔗糖合成酶相关基因的相对表达量间均存在显著差异(P<0.05)。总体上看,种子萌发期间自交系BF109种子中9个α-淀粉酶和蔗糖合成酶相关基因的相对表达量低于自交系Q267。
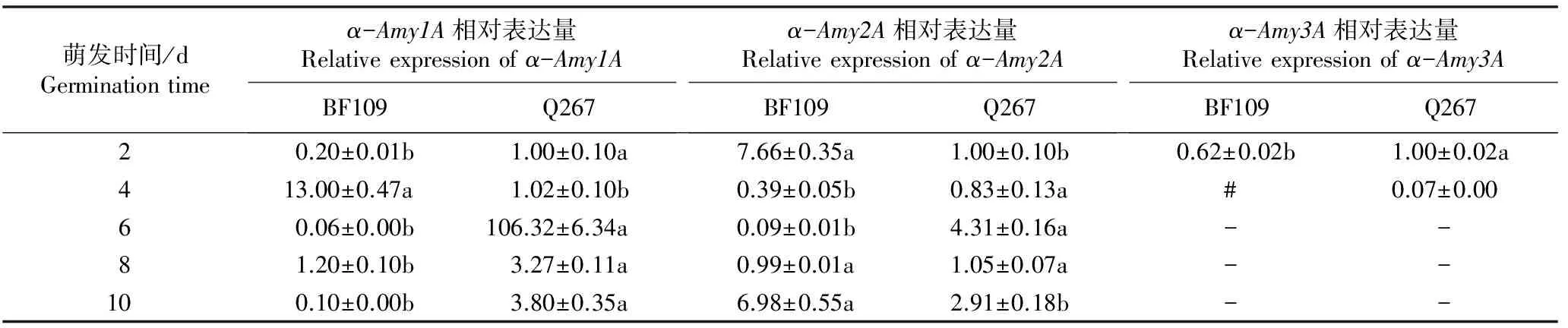
萌发时间/dGerminationtimeα-Amy1A相对表达量Relativeexpressionofα-Amy1ABF109Q267α-Amy2A相对表达量Relativeexpressionofα-Amy2ABF109Q267α-Amy3A相对表达量Relativeexpressionofα-Amy3ABF109Q26720.20±0.01b1.00±0.10a7.66±0.35a1.00±0.10b0.62±0.02b1.00±0.02a413.00±0.47a1.02±0.10b0.39±0.05b0.83±0.13a# 0.07±0.0060.06±0.00b106.32±6.34a0.09±0.01b4.31±0.16a- - 81.20±0.10b3.27±0.11a0.99±0.01a1.05±0.07a- - 100.10±0.00b3.80±0.35a6.98±0.55a2.91±0.18b- -
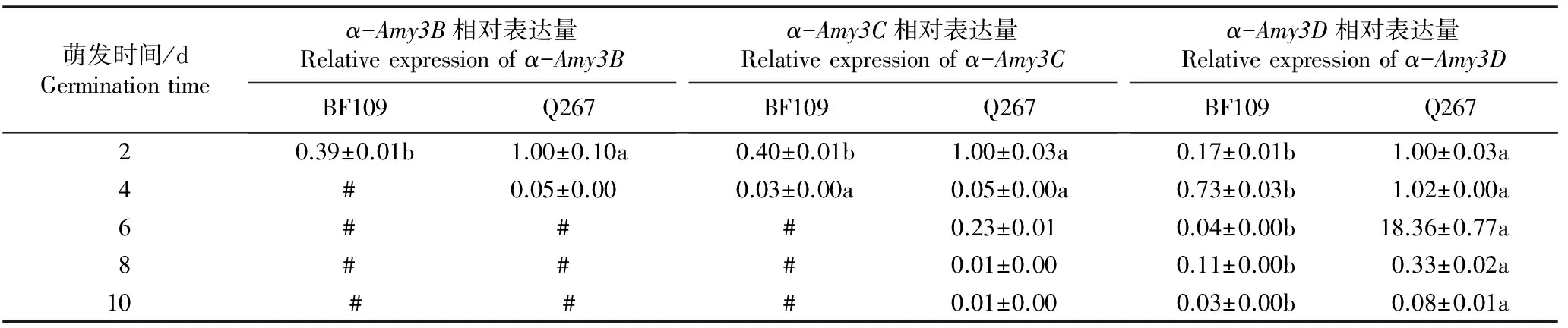
萌发时间/dGerminationtimeα-Amy3B相对表达量Relativeexpressionofα-Amy3BBF109Q267α-Amy3C相对表达量Relativeexpressionofα-Amy3CBF109Q267α-Amy3D相对表达量Relativeexpressionofα-Amy3DBF109Q26720.39±0.01b1.00±0.10a0.40±0.01b1.00±0.03a0.17±0.01b1.00±0.03a4# 0.05±0.000.03±0.00a0.05±0.00a0.73±0.03b1.02±0.00a6# # # 0.23±0.010.04±0.00b18.36±0.77a8# # # 0.01±0.000.11±0.00b0.33±0.02a10### 0.01±0.000.03±0.00b0.08±0.01a

萌发时间/dGerminationtimeα-Amy3E相对表达量Relativeexpressionofα-Amy3EBF109Q267SuSy-2相对表达量RelativeexpressionofSuSy-2BF109Q267SuSy-3相对表达量RelativeexpressionofSuSy-3BF109Q26720.44±0.03b1.00±0.01a0.54±0.01b1.00±0.03a0.02±0.00b1.00±0.01a40.01±0.00b0.05±0.00a0.68±0.02b1.08±0.00a- - 6# 0.31±0.010.07±0.00b3.30±0.14a- - 8- - 0.52±0.10a0.02±0.00b- - 10--# 0.01±0.00- -
1)#: 数值接近0 The values are close to 0; -: 未测出 Undetected. 同行中不同的小写字母表示2个自交系间同一基因的相对表达量差异显著(P<0.05) Different small letters in the same row indicate the significant difference in relative expression of the same gene between two inbred lines(P<0.05).
3 讨 论
种子萌发主要是指胚乳中的贮藏物质在酶的作用下水解并形成新组织或新器官[15]。Cheng等[16]发现,水稻种子萌发4 d时其胚乳中的贮藏物质进入快速分解阶段;而在本研究中,Sh2甜玉米自交系BF109和Q267种子胚乳中的贮藏物质在种子萌发6 d时进入快速分解阶段。种子萌发过程中(萌发2~10 d),Sh2甜玉米自交系BF109和Q267的种子贮藏物质消耗量和利用率存在较大差异,其中BF109的种子贮藏物质消耗量基本上高于Q267,而其贮藏物质利用率却低于Q267,并且在种子萌发4、8和10 d时2个自交系的种子贮藏物质消耗量和利用率均存在显著差异(P<0.05)。表明在种子萌发过程中,物质消耗量高的种子,其种子贮藏物质利用率不一定高,即种子萌发过程中贮藏物质消耗量与利用率间不相关。
植物种子中的淀粉酶包括α-淀粉酶和β-淀粉酶,其中,α-淀粉酶主要影响种子萌发后期幼苗生长的速率[2,7,17-19],而β-淀粉酶则主要在种子萌发早期通过降解淀粉促进种子萌发及幼苗生长。本研究结果表明:Sh2甜玉米自交系BF109和Q267种子中的总淀粉酶活性存在一定差异,分别在种子萌发的2~6 和2~8 d持续升高,其中BF109种子中的总淀粉酶活性在种子萌发6 d时达到最高(6.68 U·g-1),而Q267种子中的总淀粉酶活性则在种子萌发8 d时达到最高(7.63 U·g-1),这可能与种子萌发前期β-淀粉酶的不断释放及α-淀粉酶的大量合成有关。
植物种子中的α-淀粉酶合成主要受GA和ABA的调控[12,19-20],并且种子中的α-淀粉酶相关基因(包括α-Amy1A、α-Amy3B、α-Amy3D和α-Amy3E基因)在不同组织中具有表达特异性[6,13]。Sh2甜玉米自交系BF109和Q267种子中的7个α-淀粉酶相关基因 (包括α-Amy1A、α-Amy2A、α-Amy3A、α-Amy3B、α-Amy3C、α-Amy3D和α-Amy3E基因)主要在种子萌发前期表达,这一表达特性有利于种子在萌发前期尽快合成α-淀粉酶以便将胚乳中的淀粉水解为小分子的碳水化合物,为幼苗生长提供充足的能量。相比较而言,在种子萌发过程中,自交系Q267种子中的α-淀粉酶相关基因的相对表达量大多显著高于自交系BF109,致使Q267种子中的总淀粉酶活性较高,推测这可能与萌发后期自交系Q267种子中不需要为合成新的α-淀粉酶而消耗大量贮藏物质有关。
蔗糖合成酶在作物生长发育过程中具有重要作用。相关研究结果显示蔗糖合成酶能够影响豆科(Fabaceae)植物根瘤的固氮代谢及其韧皮部的运输能力[8,21];另外,蔗糖合成酶还是受多基因编码调控的酶类[14]。本研究中,种子萌发期间2个Sh2甜玉米自交系种子的蔗糖合成酶活性存在明显差异,在种子萌发过程中SuSy-2基因的相对表达量一直高于SuSy-3基因,提示该基因可能在种子萌发过程中对贮藏物质利用具有重要作用。自交系Q267种子中的SuSy-2基因相对表达量显著高于自交系BF109,使Q267种子中的蔗糖合成酶活性相对较高,推测这可能与萌发后期Q267种子中不需要合成新的蔗糖合成酶而消耗大量贮藏物质有关。
[1] BEWLEY J D. Seed germination and dormancy[J]. The Plant Cell, 1997, 9: 1055-1066.
[2] POTOKINAE, SREENIVASULUN,ALTSCHMIEDL,etal. Differential gene expression during seed germination in barley (HordeumvulgareL.)[J]. Functional and Integrative Genomics, 2002, 2: 28-39.
[3] BOTHAFC,POTGIETERGP,BOTHAA-M.Respiratory metabolism and gene expression during seed germination[J]. Plant Growth Regulation, 1992, 11: 211-224.
[4] HANLEY M E, FENNER M, WHIBLEY H, et al. Early plant growth: identifying the end point of the seedling phase[J]. New Phytologist, 2004, 163: 61-66.
[5] LAWRENCE D M, HALMER P, BOWLES D J. Mobilisation of storage reserves during germination and early seedling growth of sugar beet[J]. Physiologia Plantarum, 1990, 78: 421-429.
[6] KARREREE, LITTSJC,RODRIGUEZRL.Differential expression ofα-amylase genes in germinating rice and barley seeds[J]. Plant Molecular Biology, 1991, 16: 797-805.
[7] KANEKO M, ITOH H, UEGUCHI-TANAKA M, et al. Theα-amylase induction in endosperm during rice seed germination is caused by gibberellin synthesized in epithelium[J]. Plant Physiology, 2002, 128: 1264-1270.
[8] GORDON A J, MINCHIN F R, JAMES C L, et al. Sucrose synthase in legume nodules is essential for nitrogen fixation[J]. Plant Physiology, 1999, 120: 867-878.
[9] HORST I, WELHAM T, KELLY S, et al. Tilling mutants ofLotusjaponicusreveal that nitrogen assimilation and fixation can occur in the absence of nodule-enhanced sucrose synthase[J]. Plant Physiology, 2007, 144: 806-820.
[10] HIROSE T, SCOFIELD G N, TERAO T. An expression analysis profile for the entire sucrose synthase gene family in rice[J]. Plant Science, 2008, 174: 534-543.
[11] BETHKEPC, LIBOUREL GL,AOYAMAN, et al.The arabidopsis aleurone layer responds to nitric oxide, gibberellin, and abscisic acid and is sufficient and necessary for seed dormancy[J]. Plant Physiology, 2007, 143: 1173-1188.
[12] XIE Z, ZHANG Z L, HANZLIK S, et al. Salicylic acid inhibits gibberellin-inducedα-amylase expression and seed germinationviaa pathway involving an abscisic-acid-inducibleWRKYgene[J]. Plant Molecular Biology, 2007, 64: 293-303.
[13] HUANG N, SUTLIFF T D, LITTS J C, et al. Classification and characterization of the riceα-amylase multigene family[J]. Plant Molecular Biology, 1990, 14: 655-668.
[14] CARLSON S J, CHOUREY P S, HELENTJARIS T, et al. Gene expression studies on developing kernels of maize sucrose synthase (SuSy) mutants show evidence for a thirdSuSygene[J]. Plant Molecular Biology, 2002, 49: 15-29.
[15] SOLTANI A, GHOLIPOOR M. Seed reserve utilization and seedling growth of wheat as affected by drought and salinity[J]. Environmental and Experimental Botany, 2006, 55: 195-200.
[16] CHENG X, CHENG J, HUANG X, et al. Dynamic quantitative trait loci analysis of seed reserve utilization during three germination stages in rice[J]. PLoS One, 2013, 8: e80002.
[17] ZIEGLER P. Cerealβ-amylases[J]. Journal of Cereal Science, 1999, 29: 195-204.
[18] NANDI S, DAS G, SEN-MANDI S.β-amylase activity as an index for germination potential in rice[J]. Annals of Botany, 1995, 75: 463-467.
[19] ZHANG N, XU Y, AKASH M, et al. Identification of candidate markers associated with agronomic traits in rice using discriminant analysis[J]. Theoretical and Applied Genetics, 2005, 110: 721-729.
[20] LOVEGROVEA, HOOLEYR.Gibberellinandabscisicacid signalinginaleurone[J]. Trends inPlantScience, 2000, 5: 102-110.
[21] NOLTE K D, KOCH K E. Companion-cell specific localization of sucrose synthase in zones of phloem loading and unloading[J]. Plant Physiology, 1993, 101: 899-905.
(责任编辑: 佟金凤)
欢迎订阅2016年《植物科学学报》
双月刊 大16开 国内定价50元 全年300元
邮发代号38-103(国内) BM872(国外)
国内统一连续出版物号CN 42-1817/Q 国际标准连续出版物号ISSN 2095-0837
《植物科学学报》是中国科学院主管、中国科学院武汉植物园主办、科学出版社出版、国内外公开发行的植物学综合性学术期刊,主要刊载植物学及各分支学科的原始研究论文。本刊为中国自然科学核心期刊,已被中国科学引文数据库核心库、《中文核心期刊要目总览》、中国科技论文与引文数据库、中国生物学文献数据库、中国核心期刊(遴选)数据库、中国知识资源总库《中国科技期刊精品数据库》、中国期刊全文数据库、《中国药学文摘》、美国《化学文摘》、美国《生物学文摘》、美国《剑桥科学文摘:自然科学》、俄罗斯《文摘杂志》、日本《科学技术文献速报》、英国《国际农业与生物科学研究中心》文摘、波兰《哥白尼索引》、万方数据——数字化期刊群和中国学术期刊(光盘版)等20多种国内外检索期刊、数据库作为核心期刊或统计源期刊收录。本刊曾相继荣获全国优秀科技期刊奖、中国科学院优秀期刊奖、湖北省优秀期刊奖。
栏目设置:系统与进化、生态与生物地理、遗传与育种、生理与发育、资源与植物化学、技术与方法、综述、研究快报、学术讨论、重要书刊评介和学术动态等。读者对象:科研院所和高等院校从事植物科学研究的科研人员、教师和研究生,以及相关学科、交叉学科的科技工作者。
本刊已开通网站和远程稿件管理系统,网址为http:∥www.plantscience.cn,可免费下载从创刊(1983年)到当期所刊载论文的PDF,并欢迎作者和读者在线投稿及查询稿件进度。全国各地邮局均可订阅(邮发代号38-103),也可直接与本刊编辑部联系订阅(免收邮挂费)。通信地址:湖北省武汉市武昌磨山 中国科学院武汉植物园内 《植物科学学报》编辑部(邮编430074);电话:027-87510755,027-87510579;QQ:424353337;E-mail: editor@wbgcas.cn,zwkxbjb@wbgcas.cn。
欢迎赐稿!欢迎订阅!欢迎刊登广告!
Dynamic analyses on key hydrolytic enzyme activity and related gene expression of two inbred lines ofSh2 sweet corn during seed germination process
CHENG Xinxin①, NIU Yongsheng, LIU Zheng
(Anhui Science and Technology University, Fengyang 233100, China),J.PlantResour. &Environ., 2015, 24(3): 18-24
In order to clarifying the effect of key hydrolytic enzymes on storage substance utilization in seed ofSh2 sweet corn (Zeamayssubsp.saccharataSturt.) during seed germination process, taking seeds of inbred line BF109 and Q267 ofSh2 sweet corn as materials, consumption and utilization rate of storage substances and activities of total amylase and sucrose synthase were detected when seed germinated for 2, 4, 6, 8 and 10 d, and expression characteristics of nine related genes were analyzed by real-time fluorescence quantitative PCR technology. The results show that consumption of storage substances in single seed of two inbred lines increases greatly when seed germinates for 6 d, meaning that storage substances in seed enter fast decomposition stage. With prolonging of germination time, consumption of storage substances in single seed of two inbred lines increases gradually, while utilization rate of storage substances appears the trend of firstly increasing and then decreasing. On the whole, consumption of storage substances in single seed of inbred line BF109 is significantly higher than that of inbred line Q267 (P<0.05), while its utilization rate of storage substances is significantly lower than that of the latter. With prolonging of germination time, activities of total amylase and sucrose synthase in seed of two inbred lines also generally appear the trend of firstly increasing and then decreasing, and activities of two enzymes in seed of inbred line BF109 are basically lower or significantly lower than those of inbred line Q267. Analysis result of real-time fluorescence quantitative PCR shows that during seed germination for 2-10 d, there is a great difference in relative expression of nine genes related toα-amylase and sucrose synthase in two inbred line seeds, but relative expressions of seven genes related toα-amylase includingα-Amy1A,α-Amy2A,α-Amy3A,α-Amy3B,α-Amy3C,α-Amy3Dandα-Amy3Eall are higher at the early germination stage, which is beneficial to synthetizeα-amylase and involve in starch hydrolysis. Relative expressions ofα-Amy1A,α-Amy2A,α-Amy3DandSuSy-2 genes all are higher during seed germination for 2-10 d, while those ofα-Amy3A,α-Amy3B,α-Amy3C,α-Amy3EandSuSy-3 genes are higher only when seed germinates for 2 d, meaning thatα-Amy1A,α-Amy2A,α-Amy3DandSuSy-2 genes are probably key hydrolytic enzyme genes ofSh2 sweet corn during seed germination process. Overall, relative expressions of related genes in seed of inbred line Q267 are significantly higher than those of inbred line BF109; it may be the main reason for causing higher activities of total amylase and sucrose synthase and higher utilization rate of storage substances in seed of inbred line Q267.
Sh2 sweet corn (Zeamayssubsp.saccharataSturt.); seed germination; utilization rate of storage substances; amylase; sucrose synthase; gene expression
2015-01-19
国家自然科学基金委员会生命科学部应急管理项目(31440066); 国家自然科学基金青年科学基金资助项目(31101598); 安徽省教育厅自然科学资金项目(KJ2013B79); 安徽科技学院省级科研平台开放课题资助项目(ZRC2013392)
程昕昕(1978—),女,山西浮山人,博士,副教授,主要从事甜玉米种子科学与技术方面的研究。
①通信作者 E-mail: chenxin0901@163.com
Q946-33; S513.032
A
1674-7895(2015)03-0018-07
10.3969/j.issn.1674-7895.2015.03.03

