衰老模型联合β-淀粉样蛋白1-42建立大鼠阿尔茨海默病模型研究
张淑萍,刘璐,王秀梅,黄作义,宣兆博,杨丽敏,吴成吉,刘文娟
·论著·
衰老模型联合β-淀粉样蛋白1-42建立大鼠阿尔茨海默病模型研究
张淑萍,刘璐,王秀梅,黄作义,宣兆博,杨丽敏,吴成吉,刘文娟
目的以3月龄大鼠用D-半乳糖制作衰老模型后联合β-淀粉样蛋白1-42(Aβ1-42)制作模拟程度更高、更理想的阿尔茨海默病(AD)大鼠模型。方法2013年3月—2014年3月选取SD清洁级雄性3月龄大鼠60只,12月龄大鼠40只,通过Morris水迷宫实验后,采用随机数字表法分为5组:3月龄假手术组20只、3月龄对照组20只、3月龄造模组20只、12月龄对照组20只、12月龄造模组20只。3月龄造模组大鼠采用D-半乳糖皮下注射制作衰老模型,观察一般状态、体质量变化,检测血中超氧化物歧化酶(SOD)及脂质过氧化物(MDA)表达水平。3月龄造模组与12月龄造模组大鼠采用Aβ1-42脑内海马区注射制作AD模型,Morris水迷宫实验测试各组大鼠逃避潜伏期和航行距离,观察各组大鼠海马区神经元形态改变,对比3月龄对照组、3月龄造模组与12月龄造模组大鼠胸腺指数及脾脏指数。结果大鼠体质量比较,造模与时间有交互作用(P<0.05);3月龄对照组与3月龄造模组大鼠组间体质量比较,差异有统计学意义(P<0.05);时间间比较,差异有统计学意义(P<0.05)。3月龄对照组与3月龄造模组大鼠第4、5周体质量比较,差异有统计学意义(P<0.05);3月龄对照组大鼠不同时间体质量比较,差异有统计学意义(F=85.302,P<0.05);3月龄造模组大鼠不同时间体质量比较,差异无统计学意义(F=1.371,P>0.05)。3月龄造模组和12月龄对照组大鼠血清SOD水平较3月龄对照组降低,MDA水平较3月龄对照组升高(P<0.05);3月龄造模组与12月龄对照组大鼠血清SOD、MDA水平比较,差异无统计学意义(P>0.05)。3月龄造模组、12月龄造模组大鼠逃避潜伏期和航行距离较3月龄假手术组、3月龄对照组和12月龄对照组延长(P<0.05)。组织病理学检查示,各造模组海马CA1区可见神经元受损,呈现退行性改变,细胞核形态不规则,细胞结构被破坏,线粒体、内质网肿胀,线粒体塉消失。3月龄造模组和12月龄造模组大鼠胸腺指数和脾脏指数较3月龄对照组降低(P<0.05);3月龄造模组与12月龄造模组大鼠胸腺指数和脾脏指数比较,差异无统计学意义(P>0.05)。结论以3月龄大鼠通过皮下注射D-半乳糖制作衰老模型的基础上,在大鼠双侧海马区注射Aβ1-42制备的AD模型,更能耐受后续抗AD药物的干预实验。
阿尔茨海默病;D-半乳糖;淀粉样β肽类;模型,动物
张淑萍,刘璐,王秀梅,等.衰老模型联合β-淀粉样蛋白1-42建立大鼠阿尔茨海默病模型研究[J].中国全科医学,2015,18(36):4459-4463.[www.chinagp.net]
Zhang SP,Liu L,Wang XM,et al.Building rat Alzheimer disease model by combining aging model andβ-amyloid peptide 1-42[J].Chinese General Practice,2015,18(36):4459-4463.
中国已步入老龄化社会,痴呆的发病率逐年递增,阿尔茨海默病(AD)作为痴呆的主要类型,占痴呆总数的70%[1]。目前治疗AD无特效药物,不能治愈,仅能缓解病情[2]。AD发病机制尚不清楚,有多种学说试图阐明其病因:胆碱能性假说、淀粉样蛋白质假说、微管相关蛋白质假说及最新提出的轴突漏假说[3]等。学者们建立了多种制作AD模型的方法,灵长类存在记忆、认知功能障碍的老年动物过于昂贵,数量太少[4]。慢性缺血痴呆模型制作比较简单,但病理改变广泛,不适于做AD模型,以自然衰老为基础的AD动物模型存在记忆、认知功能障碍,但老年大鼠较难得到,实验耐受能力差,因此在幼鼠致衰老基础上制作AD模型更为理想。制作衰老模型的研究中,有代谢学说、免疫系统退化学说和自由基学说[5]等。代谢学说是我国学者最早提出的致衰老学说[6],认为在限定时间内给予动物注射大剂量D-半乳糖使其达到较高水平进而出现代谢紊乱、细胞肿胀和功能障碍,达到衰老模型标准[7]。海马和皮质出现大量的细胞外老年斑(SP)和细胞内神经纤维缠结(NFT)是AD的主要病理学特征。β-淀粉样蛋白(Aβ)为SP的主要成分,Aβ的生成和蓄积是AD发病的关键环节[8]。鉴于此,本实验以皮下注射D-半乳糖制作大鼠衰老模型为基础联合Aβ1-42,获得模拟程度高、更耐受实验的AD大鼠模型。
1材料与方法
1.1主要试剂Aβ1-42的配制:称取Aβ1-42 10 g溶于无菌0.9%氯化钠溶液,稀释并定容至1 000 ml。恒温水浴箱中37℃孵育5 d,使其聚合成凝集状态。Aβ在可溶状态下是相对无毒的,但Aβ转变为不溶状态是AD发病中的一个关键环节[9]。
1.2模型制作2013年3月—2014年3月选取Sprague Dawley(SD)清洁级雄性3月龄大鼠60只,体质量320~380 g,12月龄大鼠40只,体质量350~420 g,由长春亿斯实验动物技术有限公司提供,合格证号scxk (吉)-2013-0006,均在佳木斯大学动物实验中心饲养,自由饮食,明暗各12 h。而后进行Morris水迷宫实验,将大鼠面向池壁从东南西北4个方向放入水中,计算大鼠在120 s内找到平台的时间,若大鼠超过120 s仍未找到平台,则由实验操作者引导大鼠至平台后重新实验,若仍不能找到则剔除。每天训练3次,共训练2 d。将通过筛选的大鼠采用随机数字表法分为5组:3月龄假手术组20只、3月龄对照组20只、3月龄造模组20只、12月龄对照组20只、12月龄造模组20只。3月龄造模组大鼠颈背部皮下注射D-半乳糖0.125 g·kg-1·d-1,连续40 d,建立衰老模型[10]。3月龄假手术组大鼠颈背部皮下注射等量0.9%氯化钠溶液,3月龄对照组大鼠不做处理。监测注射期间3月龄对照组及3月龄造模组大鼠的一般状态及体质量变化,40 d后选取3月龄对照组、3月龄造模组及12月龄对照组大鼠各10只,10%水合氯醛麻醉,心腔穿刺取血,测血清中超氧化物歧化酶(SOD)及脂质过氧化物(MDA)表达水平。将3月龄造模组和12月龄造模组大鼠固定于大鼠立体定位仪上,头顶正中做纵向切口,以前囟为基准,从正中旁2.2 mm前囟后3.0 mm,以牙科钻钻开颅骨[11],用微量注射器吸取孵育好的Aβ1-42,双侧海马缓慢注射10 min,留针5 min。在缝合切口处撒少许青霉素粉剂,连续3 d腹腔注射青霉素4万U;3月龄假手术组大鼠注射等量0.9%氯化钠溶液,3月龄对照组和12月龄对照组大鼠不做处理。
1.3 Morris水迷宫实验[12]14 d后进行Morris水迷宫实验,水迷宫为一不锈钢圆形水池,直径120 cm、高50 cm、水深30 cm。池壁标明W、S、E、N作为个4入水点,由此以通过水池中心的2条垂直交叉线将水池等分为东北、西北、西南、东南4个象限。任选其中1个象限,正中放立1个直径10 cm、高28 cm的平台。各组取10只大鼠头背部用苦味酸标记颜色,便于摄像跟踪记录。池壁上方悬挂一标志物作为近距离视觉暗示,水池周围有一些位置不变的参照物,作为远距离视觉暗示,大鼠可凭此来定位平台。自动记录系统包括监视器、摄像机和计算机,摄像机安放在水池上方,与监视器和计算机系统相连接。水温控制在25℃左右,将大鼠面向池壁分别从4个入水点放入水中,记录其在120 s内寻找到平台的时间(逃避潜伏期)。如果大鼠未找到平台,潜伏期算作120 s。而后撤除平台,将大鼠从任选的非平台象限入水点面向池壁放入水中,记录大鼠120 s内在平台象限的游泳距离(航行距离)。
1.4组织病理学观察Morris水迷宫实验后,每组采用随机数字表法选取5只大鼠,10%水合氯醛麻醉后,开胸暴露心脏,找到升主动脉并插管至根部,再以4℃的4%多聚甲醛磷酸盐缓冲液(PBS)灌注固定,剥离脑组织,置入4℃冰箱。次日切取视交叉后4 mm小脑之间的部分,即海马部位的组织块1 cm3作为电镜标本,浸入2%戍二醛溶液中。固定后超薄切片机切片,使用枸橼酸铅和醋酸铀染色,透射电镜拍照。
1.5胸腺指数及脾脏指数将3月龄对照组、3月龄造模组和12月龄造模组大鼠各10只腹腔注射麻醉后,称量每只大鼠的体质量,通过心腔穿刺取血液后解剖大鼠,取出大鼠的胸腺和脾脏,并用电子天平称量胸腺和脾脏的重量,通过如下公式算出大鼠的胸腺指数和脾脏指数。胸腺(脾脏)指数=胸腺(脾脏)湿重(g) /体质量(g)×100%。
1.6统计学方法采用SPSS 13.0统计学软件进行数据处理,计量资料以(x±s)表示,3月龄对照组与3月龄造模组大鼠不同时间体质量比较采用重复测量方差分析,多组间比较采用单因素方差分析,组间两两比较采用q检验。以P<0.05为差异有统计学意义。
2结果
2.1 3月龄对照组与3月龄造模组大鼠一般状态及体质量比较3月龄造模组大鼠造模后精神状态逐渐变差,活动及进食逐渐减少,毛色发暗发黄且体质量增加缓慢,第4、5周时体质量增加接近停止。大鼠体质量比较,造模与时间有交互作用,差异有统计学意义(P<0.05);3月龄对照组与3月龄造模组大鼠组间体质量比较,差异有统计学意义(P<0.05);时间间比较,差异有统计学意义(P<0.05)。3月龄对照组与3月龄造模组大鼠第4、5周体质量比较,差异有统计学意义(P<0.05);3月龄对照组大鼠不同时间体质量比较,差异有统计学意义(F=85.302,P<0.05);3月龄造模组大鼠不同时间体质量比较,差异无统计学意义(F =1.371,P>0.05,见表1)。
2.2 3月龄对照组、3月龄造模组与12月龄对照组大鼠血清SOD、MDA水平比较3月龄对照组、3月龄造模组与12月龄对照组大鼠血清SOD、MDA水平比较,差异有统计学意义(P<0.05);其中3月龄造模组和12月龄对照组大鼠血清SOD水平较3月龄对照组降低,MDA水平较3月龄对照组升高,差异有统计学意义(P<0.05);3月龄造模组与12月龄对照组大鼠血清SOD、MDA水平比较,差异无统计学意义(P>0.05,见表2)。提示衰老模型建造成功。
2.3 5组大鼠逃避潜伏期和航行距离比较5组大鼠逃避潜伏期和航行距离比较,差异均有统计学意义(P<0.05);其中3月龄造模组和12月龄造模组大鼠逃避潜伏期和航行距离较3月龄假手术组、3月龄对照组和12月龄对照组延长,差异有统计学意义(P<0.05,见表3)。
2.4各组大鼠海马CA1区神经元结构3月龄假手术组、3月龄对照组和12月龄对照组大鼠海马CA1区神经元细胞膜完整光滑,线粒体结构清楚,内质网整齐排列。3月龄造模组、12月龄造模组海马CA1区可看到神经元受损,呈现退行性改变,细胞核形态不规则,细胞结构被破坏,线粒体、内质网肿胀,线粒体塉消失(见图1)。
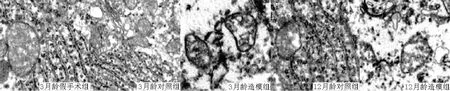
图1各组大鼠海马CA1区神经元超微结构(枸橼酸铅和醋酸铀染色,×12 000)Figure 1 Ultrastructure of nerve cells in hippocampus CA1 area of each group
表1 3月龄对照组与3月龄造模组大鼠不同时间体质量比较(±s,g)Table1 Comparison of bodymassbetween 3-month controlgroup and 3-month model-building group at different time points

表1 3月龄对照组与3月龄造模组大鼠不同时间体质量比较(±s,g)Table1 Comparison of bodymassbetween 3-month controlgroup and 3-month model-building group at different time points
注:与3月龄对照组比较,aP<0.05
组别只数第1周第2周第3周第4周第5周3月龄对照组20 325±12 346±16 382±15 417±11 436±18 3月龄造模组20 323±13 336±11 339±12 332±13a327±16aF 值<0.001 F交互=44.226,F组间=245.633,F时间=37.337 P值P交互<0.001,P组间<0.001,P时间
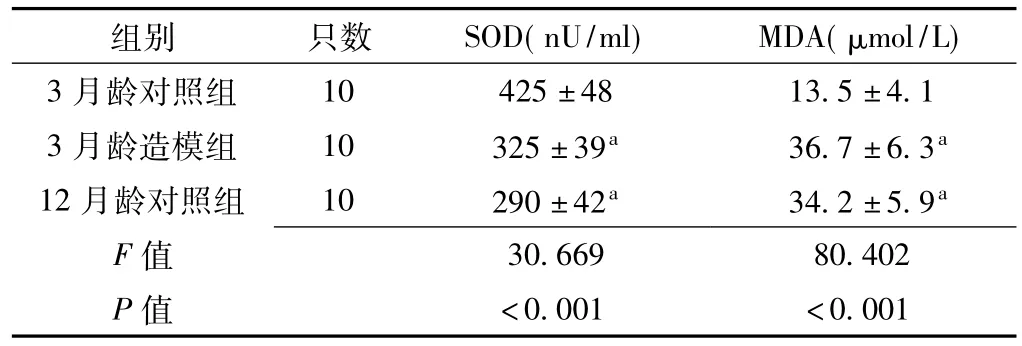
表2 3月龄对照组、3月龄造模组与12月龄对照组大鼠血清SOD、MDA水平比较(x±s)Table2 Comparison of serum SOD and MDA levelamong3-month control group,3-month model-building group and 12-month control group
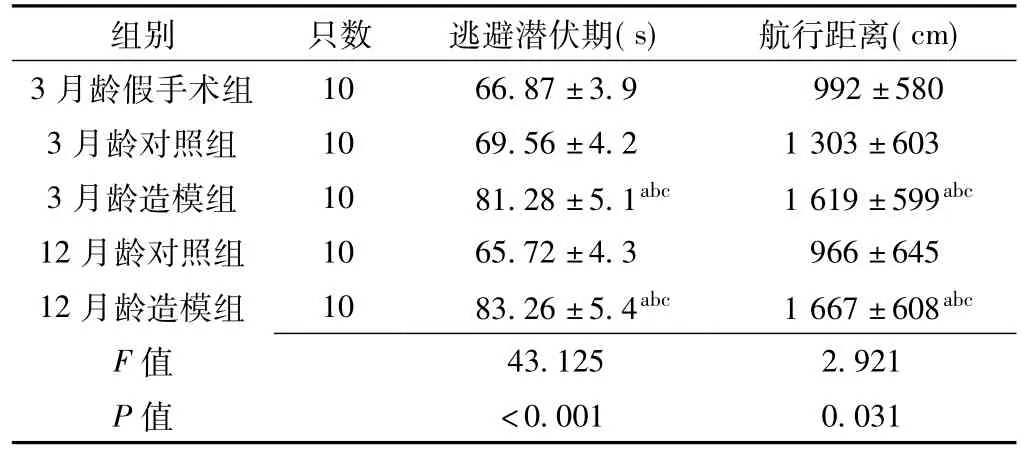
表3 5组大鼠逃避潜伏期和航行距离比较(x±s)Table 3 Comparison of escape latency and sailing distance among the five groups
2.5 3月龄对照组、3月龄造模组与12月龄造模组大鼠胸腺指数和脾脏指数比较3月龄对照组、3月龄造模组与12月龄造模组大鼠胸腺指数和脾脏指数比较,差异均有统计学意义(P<0.05);其中3月龄造模组和12月龄造模组大鼠胸腺指数和脾脏指数较3月龄对照组降低,差异均有统计学意义(P<0.05);3月龄造模组与12月龄造模组大鼠胸腺指数和脾脏指数比较,差异无统计学意义(P>0.05,见表4)。
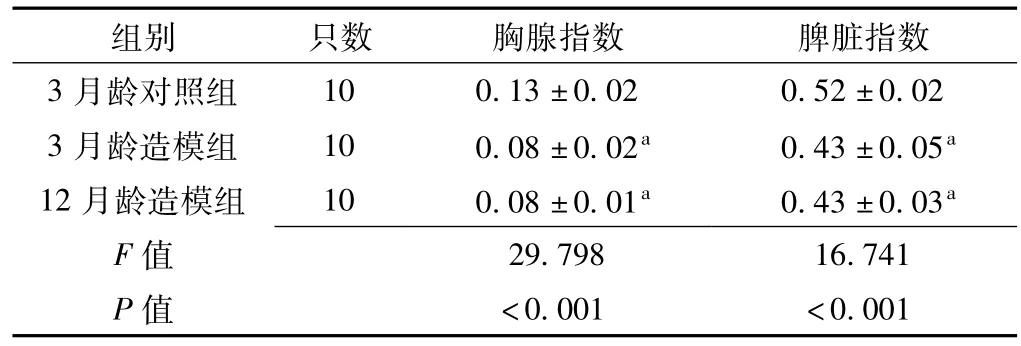
表4 3月龄对照组、3月龄造模组与12月龄对照组大鼠胸腺指数及脾脏指数比较(x±s,g/100 g)Table 4 Comparison of thymus and spleen index among 3-month control group,3-month model-building group and 12-month control group
3讨论
如今AD发病率上升极快,严重危害人类健康。在科研中制造理想的衰老后的AD模型势在必行。有文献表明,SD大鼠连续注射大剂量D-半乳糖可使其行动缓慢和学习记忆能力下降[13],脑内超氧阴离子自由基水平增高,MDA、脂褐素水平升高,SOD活性降低,加速细胞凋亡,使机体出现衰老现象。本实验结果显示,3月龄造模组大鼠与3月龄对照组比较,血清中SOD水平降低、MDA水平升高,与12月龄对照组大鼠无差异,提示3月龄大鼠衰老模型建立成功。
“Aβ级联学说”[14]认为,Aβ有极其复杂的神经毒性作用,其生成与清除失衡是细胞内神经元纤维缠结的最主要原因[15]。Hardy等[16]在大鼠脑室内灌入Aβ,经Morris水迷宫实验证实,大鼠出现认知功能障碍,结果显示,Aβ灌注导致了中枢神经系统功能障碍。Aβ主要包括Aβ1-40、Aβ1-42和Aβ25-35等。通常所认为的Aβ多是指Aβ1-40或Aβ1-42[17],黄涛波等[18]研究发现,Aβ1-40占90%,Aβ1-42占10%,Aβ1-42容易集聚而不易降解,毒性极大,是构成AD SP的最主要成分。在AD患者SP形成过程中,Aβ1-42是启动因素,在模型动物脑室、海马区注射孵育好的Aβ溶液,可使模型动物产生与AD相同的学习和记忆能力减低症状。所以本实验在大鼠衰老模型基础上脑内注射Aβ1-42旨在复制出最接近AD的痴呆模型。
本实验结果显示,3月龄造模组及12月龄造模组与12月龄对照组比较,大鼠平均逃避潜伏期和航行距离明显延长,大鼠海马CA1区神经元受损,呈退行性改变,提示造模成功。3月龄造模组和12月龄造模组大鼠胸腺指数和脾脏指数较3月龄对照组降低,由于12月龄大鼠活动及适应能力下降,抗应激能力较低,在实验耐受方面明显不如3月龄造模组,不能耐受后续的抗AD的药物干预实验。其次,3月龄大鼠较12月龄大鼠更容易获得,节省实验时间。
综上所述,以3月龄大鼠注射D-半乳糖制作衰老模型后联合Aβ1-42建立的AD模型是一种容易获得且较为理想的动物模型,为进一步深入研究AD的发病机制及治疗提供了更好的实验平台。脑内Aβ的沉积是引起AD退行性病变的重要因素,使学习记忆能力下降,但其确切作用机制还没有很明确,有待于以后更深一步的实验研究。
[1]Brookmeyer R,Johnson E,Ziegler-Graham K,et al.Forecasting the global burden of Alzheimer's disease[J].Alzheimers Dement,2007,3(3):186-191.
[2]Pleckaityte M.Alzheimer's disease:a molecular mechanism,new hypotheses,and therapeutic strategies[J].Medicina(Kaunas),2010,46(1):70-76.
[3]Syring C,Drögemüller C,Oevermann A,et al.Degenerative axonopathy in a Tyrolean grey calf[J].JVet Intern Med,2010,24(6):1519-1523.
[4]Torres-Aleman I.Mouse models of Alzheimer's dementia:current concepts and new trends[J].Endocrinology,2008,149(12): 5952-5957.
[5]陈灏珠.实用内科学[M].10版.北京:人民卫生出版社,2000:2269-2270.
[6]Qiu BC,Liu QF.The assessment of the D-galactose rat agingmodel[J].Guangxi Medical Journal,2009,31(7):918-220.(in Chinese)邱柏程,刘庆丰.D-半乳糖大鼠衰老模型的评价[J].广西医学,2009,31(7):918-220.
[7]陈勤.抗衰老研究实验方法[M].北京:中国医药科技出版社,1996:46-47.
[8]Fu HJ,Liu B,Frost JL,et al.Amyloid-beta immunotherapy for Alzheimer's disease[J].CNSNeurol Disord Drug Targets,2010,9 (2):197-206.
[9]Selkoe DJ.Alzheimer's disease:genes,protein,and therapy[J].Physiol Rev,2001,81(2):741-766.
[10]周金黄.中药免疫药理学[M].北京:人民卫生出版社,1994:60-61.
[11]包新民,舒斯云.大鼠脑立体定位图谱[M].北京:人民卫生出版社,1991:44-45.
[12]Tanzi RE.Novel therapeutics for Alzheimer's disease[J].Neurotherapeutics,2008,5(3):377-380.
[13]崔旭,李文彬,张炳烈,等.D-半乳糖脑老化模型的脂质过氧化机理[J].中国老年学杂志,1998,18(2):38-40.
[14]Pimplikar SW.Reassessing the amyloid cascade hypothesis of Alzheimer's disease[J].Int J Biochem Cell Biol,2009,41 (6):1261-1268.
[15]Fleisher AS,Truran D,Mai JT,et al.Chronic divalproex sodium use and brain atrophy in Alzheimer disease[J].Neurology,2011,77(13):1263-1271.
[16]Hardy J,Selkoe DJ.The amyloid hypothesis of Alzheimer's disease: progress and problems on the rode to therapeutics[J].Science,2002,297(5580):353-356
[17]Volpe M,Savoia C,Panina G,et al.Therapeutic applications of angiotensinⅡreceptor antagonists[J].Ann Endocrinol(Paris),2000,61(1):47-51.
[18]黄涛波,吕诚,胡小令,等.β-淀粉样蛋白所致神经细胞凋亡在阿尔茨海默病中的作用[J].实用临床医学,2010,11 (6):127-130.
Building Rat A lzheimer Disease M odel by Combining Aging M odel andβ-am yloid Peptide 1-42
ZHANG Shu-ping,LIU Lu,WANG Xiu-mei,et al.Department of Neurology,the First Affiliated Hospital of Jiamusi University,Jiamusi 154002,China
ObjectiveTo build ideal rat Alzheimer disease(AD)modelwith superior simulation on three-month rats using agingmodel built by D-galactose combiningβ-amyloid peptide 1-42(Aβ1-42).M ethods We enrolled 60 threemonth cleaningmale SD rats and 40 twelve-month rats from March 2013 to March 2014.After the selection by Morris water maze,random number tablemethod was used to divide the subjects into 5 groups:3-month sham-operation group(n=20),3-month control group(n=20),3-month model-building group(n=20),12-month control group(n=20)and 12-monthmodel-building group(n=20).For 3-month rats,aging model was built using the subcutaneous infection of D-galactose,general state and changes in body mass were observed,and the expression of SOD and MDA in the blood were detected.For 3-month model-building group and 12-month model-building group,AD model was made in brain hippocampus by the injection of Aβ1-42;morris water maze was employed to measure mean escape latency and total sailing distance,morphological changes in neurons of hippocampus in rats of each group were observed.Comparison wasmade in thymus index and spleen index among 3-month control group,3-month model-building group and 12-month model-building group.Results In the comparison of body mass,there was interaction between model building and time with significant differences(P<0.05);3-month control group and 3-month model building group were significantly different in body mass (P<0.05);significant differences existed in bodymass at different time points(P<0.05);3-month control group and 3-month model-building group were significantly different in the bodymass at4 weeks and 5 weeks(P<0.05);3-month control group had significantly different bodymass at different time points(F=85.302,P<0.05);3-month model-building group had not significantly different body mass at different time points(F=1.371,P>0.05).Compared with 3-month control group,3-month model-building group and 12-month control group were lower in serum SOD level and higher in MDA level (P<0.05);3-month model-building group and 12-month control group were not significantly different in serum SOD level and MDA level(P>0.05).Three-month model-building group and 12-month model-building group had longer escape latency or sailing distance,compared with 3-month sham-operation group,3-month control group and 12-month control group(P<0.05).By histopathological examination,neuron damage could be observed in the hippocampus CA1 area of each model-building group with degenerative changes,irregular nucleus morphology,damaged cellular structure,swollen mitochondria and endoplasmic reticulum and disappeared mitochondria ridges.Compared with 3-month control group,3-month model-building group and 12-month model-building group were lower in thymus and spleen index(P<0.05);3-month model-building group and 12-month model-building group were not significantly different in thymus and spleen index(P>0.05).Conclusion After agingmodel was built in 3-month rats by the subcutaneous injection of D-galactose,AD model was builtusing Aβ1-42 in bilateralhippocampus areas,which wasmore tolerant to the following intervention experiments ofanti-AD drug.
Alzheimer disease;D-galactose;Amyloid beta-peptides;Models,animal
R 741
A
10.3969/j.issn.1007-9572.2015.36.012
2015-02-24;
2015-09-01)
(本文编辑:陈素芳)
黑龙江省自然科学基金资助项目(C201242)
154002黑龙江省佳木斯市,佳木斯大学附属第一医院神经内科(张淑萍,王秀梅,黄作义,宣兆博,吴成吉,刘文娟);佳木斯大学(刘璐,杨丽敏)
黄作义,154002黑龙江省佳木斯市,佳木斯大学附属第一医院神经内科;E-mail:blcldxn@163.com

