高活性降解羽毛角蛋白菌株鉴定及发酵条件优化
王东方,王庆忠
(潍坊学院山东省高校生物化学与分子生物学重点实验室,山东潍坊 261061)
高活性降解羽毛角蛋白菌株鉴定及发酵条件优化
王东方,王庆忠
(潍坊学院山东省高校生物化学与分子生物学重点实验室,山东潍坊 261061)
通过对已筛选到的产生角蛋白酶的H菌株形态观察、生理生化试验分析最终确定该菌为枯草芽孢杆菌(bacillus subtilis),对该菌的发酵条件进行优化,同时将显著影响条件进行正交试验。试验结果表明,最佳发酵培养基:玉米粉10g,豆粕10g,MgCl20.1g,CaCl20.06g,NaCl 0.5g,K2HPO41.4g,KH2PO40.7 g,羽毛粉10g,水1 000mL,培养基pH 7.5~8.0;最适培养条件:接种量为2%,培养温度37℃,180r/min摇床培养96h,其产角蛋白酶活性最高为2.56×10-3kat/L(153.7U/mL)。
角蛋白酶鉴定;枯草芽孢杆菌;发酵条件
随着我国畜牧养殖业的迅速发展,蛋白质饲料严重短缺。羽毛蛋白被认为是一种有独特价值的优质蛋白质饲料,禽类羽毛中角蛋白的粗蛋白含量高达85%~89%,并且含有多种必需氨基酸[1-2],因此若将废弃的羽毛加以适当的加工处理使其转化为良好的蛋白质资源,对经济发展和环境保护都具有重要意义[3-4]。
角蛋白(keratin)是一种不溶性蛋白质,肽链之间形成许多二硫键,不能被动物直接利用。目前,我国处理羽毛等角蛋白废弃物的方法主要有化学处理法、高温高压水解法等,这些方法转化率低、耗能高、环境污染严重[5-6]。利用产生角蛋白酶的微生物将羽毛废弃物分解为可利用的氨基酸等物质,具有消化率高、对环境污染小的优点。近几年发表的降解羽毛的微生物有细菌[7-8]、放线菌[9-10]、真菌[11-12]等,但在羽毛角蛋白分解菌的培养和筛选的研究领域仅处在初级阶段,还没有能够有效提高羽毛角蛋白的生物学利用率的菌株,也没有加工工艺简单且成本低的产品工艺。
本研究利用已得到的分解羽毛高产菌株H菌,进行菌种鉴定并通过其培养基成分和培养条件的优化,使得H菌的产酶能力有很大提升,进而为使其应用于饲料等领域提供条件。
1 材料与仪器
1.1 材料
样品来源:菌种H菌株由微生物实验室筛选得到;羽毛采集于羽毛加工厂废弃的完整羽毛。
羽毛培养基:NaCl 0.5g,MgCl20.1g,CaCl20.06g,K2HPO41.4g,KH2PO40.7g,羽毛粉10g,水1 000mL,培养基pH7.5~7.8。
种子培养基为LB培养基:蛋白胨10g,酵母提取5g,氯化钠10g,水1 000mL,培养基pH7.0~7.2。
1.2 试验仪器
智能生化培养箱(PHX-270N,宁波海曙来福仪器厂);双层恒温摇床(THZ-052D,上海博彩生物科技有限公司);双人双面净化工作台(CSW-CJ-2F型,苏州净化设备有限公司);立式压力蒸汽灭菌器(LD2X-50FB,上海申安医疗器械厂);台式大容量高速冷冻离心机(Centrifuge 5810R,eppendorf);紫外可见分光光度计(UV-2480,日本岛津公司);显微镜(BX53日本Olympus公司)。
2 方法
2.1 菌株的鉴定
形态观察:在LB平板上37℃培养24h后观察菌落形态、色泽、边缘、表面凹凸度、透明度等;进行革兰氏染色和芽孢染色,显微镜观察菌体形态和芽孢形状。生理生化性质的测定参考《伯杰氏细菌鉴定手册》[13]。
2.2 角蛋白酶活性测定
角蛋白测定参考Gradisar等[14]的方法并稍做修改。在试管中加入10mg羽毛粉作为反应底物,取1.0 mL粗酶液,再加入2.0mL、0.05mol/L的Tris·HCl(pH7.5),50℃反应30min后取出并加入2.0mL、10%的TCA以终止反应,过滤离心10min,取上清液于280 nm处测定吸光度。酶活性单位定义:在上述反应条件下,测得的D280nm值每升高0.01所需要的酶量定义为1个酶活性单位(U)。
2.3 发酵条件的优化
(1)发酵时间对菌株产酶的影响:分别在摇瓶发酵24、48、72、96、120h时测定酶活性。
(2)发酵温度对菌株产酶的影响:分别设置摇瓶发酵温度为34、37、40、43、46℃,测定发酵酶活性。
(3)不同碳源对菌株产酶的影响:选择葡萄糖、蔗糖、麸皮、可溶性淀粉和玉米粉作为碳源,在羽毛培养基中分别添加1%的上述几种碳源后摇瓶发酵,测定发酵酶活性;确定最佳碳源后,再在羽毛培养基中分别添加0.5%,1.0%,1.5%,2.0%,2.5%的最佳碳源。
(4)辅助氮源对菌株产酶的影响:选择NaNO3、(NH4)2SO4、(NH4)2HPO4、蛋白胨、牛肉膏、酵母粉、豆粕作为辅助氮源,在羽毛培养基中分别添加1%的上述几种氮源后摇瓶发酵,测定发酵酶活性,再进行最佳氮源的单因子分析(参照③最佳碳源实验)。
(5)初始pH对菌株产酶的影响:不同初始pH(6.0,7.0,7.5,8.0,8.5,9.0)的羽毛培养基中培养,测定发酵酶活性。
3 结果与分析
3.1 菌株鉴定
3.1.1 形态特征
菌株H经平板划线培养出的菌落形态特征如图1所示:菌落形状不规则、乳白色、质地润泽、边缘缺刻状、不透明,经革兰氏染色法镜检菌体呈杆状,常以链状排列,具圆端,为革兰氏阳性,能产芽孢,芽孢形状呈椭圆形。

图1 H菌形态
3.1.2 生理生化特征
菌株的生理生化鉴定结果见表1。芽孢杆菌属的菌体呈直杆状,常成对或链状排列,具圆端或方端,大多数细胞在幼龄培养时染色呈现革兰氏阳性;菌体以周生鞭毛运动,芽孢具椭圆、卵圆、柱状、圆形的多种形态,可以抗多种不良环境;每个菌体能产一个芽孢且不被氧气所抑制,为好氧或兼性厌氧异养菌,具有多种发酵或呼吸代谢类型。通过形态特征及生理生化试验结果,可以确定菌株H为枯草芽孢杆菌。

表1 菌株H的生理生化试验结果

表1 (续)
3.2 发酵条件的优化
3.2.1 发酵时间对菌株产酶的影响
菌体生长需要一定的时间,当菌生长到达稳定期时,微生物经过一段时间的生长,由于营养物质已不多,只能维持菌体基本新陈代谢和合成次级代谢产物的需要,一些重要的次级代谢产物是在稳定期开始大量生成的。所以,发酵时间是影响菌株产酶的重要因素。分别在摇瓶发酵24、48、72、96、120h时,测定的酶活性结果见图2。可以看出,在发酵96h后,菌株的产酶活性浓度最高为1.76×10-3kat/L(105.5U/mL)。

图2 不同发酵时间下H菌的发酵酶活性浓度
3.2.2 发酵温度对菌株产酶的影响
微生物的生长及代谢产物的合成都需要酶的参与,适宜的温度可以促进微生物的生长,不适宜的温度使菌体生命活力降低,甚至会造成微生物的死亡。此外,在不同的培养温度下,微生物的代谢产物也不尽相同,并且微生物生长繁殖和产酶的最适温度也不一样。分别设定摇瓶发酵温度为34、37、40、43、46℃,测得的发酵酶活性浓度见图3。由图3可知,H菌的最适发酵温度为37℃,此时酶活性浓度为1.84×10-3kat/L(110.6U/mL)。

图3 不同发酵温度下H菌的发酵酶活性浓度
3.2.3 不同碳源对菌株产酶的影响
在微生物发酵过程中,碳源不仅是细胞分子的组成部分,也是合成多糖、蛋白的能量来源。不同细胞对碳源的利用差异很大,碳源的代谢速率影响到微生物的生长和初级及次级代谢产物的形成[15]。在碳源的选择方面要注意到微生物营养的需求和是否存在对合成代谢的诱导及阻遏作用,故选择合适的碳源将提高菌株的产酶能力。在羽毛培养基中分别添加1%葡萄糖、蔗糖、麸皮、可溶性淀粉和玉米粉作为辅助碳源后,分别测得的酶活见表2。结果表明辅助碳源中的最佳碳源为玉米粉。这可能是玉米粉除碳水化合物外,还富含蛋白质,在提供了碳源的同时,还提供了氮源,进而提高了菌株发酵产酶的能力。另外,从工业生产降低成本的角度看,玉米粉也是比较理想的碳源。在培养基中分别添加0.5%,1.0%,1.5%,2.0%,2.5%的玉米粉后测定的酶活变化趋势见图4。由图4得出,在培养基中添加1.0%的玉米粉时H菌的发酵酶活性最大,酶活性浓度为2.09×10-3kat/L(125.6 U/mL),低于或高于1%时酶活性浓度均有所下降。

表2 添加不同辅助碳源时H菌的发酵酶活性浓度

图4 添加不同含量玉米粉后H菌的发酵酶活性浓度
3.2.4 辅助氮源对菌株产酶的影响
氮源主要用于菌体细胞物质如氨基酸、蛋白质、核酸等和含氮代谢物的合成。H菌所产的角蛋白酶本质是蛋白质,故而外加氮源可以影响酶的合成。通常能被细菌利用的氮源有铵盐、硝酸盐及尿素等,但在吸收速度与利用程度上有所差别[16]。本试验利用在羽毛培养基中分别添加1%的NaNO3、(NH4)2SO4、(NH4)2HPO4、蛋白胨、酵母膏、豆粕作为辅助氮源后,分别测得的酶活性浓度见表3。结果表明辅助氮源中的最佳氮源为豆粕。在培养基中分别添加0.5%,1.0%,1.5%,2.0%,2.5%的豆粕后测定的酶活变化趋势见图5。由图5得出,在培养基中添加1%的豆粕时 H 菌的发酵酶活性最大,酶活性浓度为2.138×10-3kat/L(128.3U/mL)。

表3 添加不同辅助氮源时H菌的发酵酶活
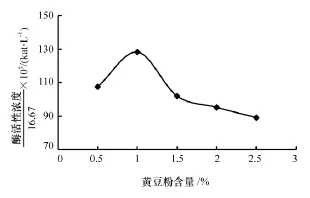
图5 添加不同含量的豆粕后H菌的发酵酶活性浓度
3.2.5 培养基初始pH对菌株产酶的影响
培养基初始pH不仅会引起细胞膜电荷的变化,同时也会改变培养基中化合物的解离程度,影响营养物质的吸收,即使是同一微生物,由于pH不同,所得到的产物也不相同[17]。将菌株置于不同初始pH(6.0,7.0,7.5,8.0,8.5,9.0)的羽毛培养基中摇瓶发酵后,测得的酶活变化趋势见图6。由图6可知,H菌在培养基初始pH为7.5时产酶能力最强,酶活性浓度为1.81×10-3kat/L(108.4U/mL)。
3.2.6 正交试验优化产酶条件
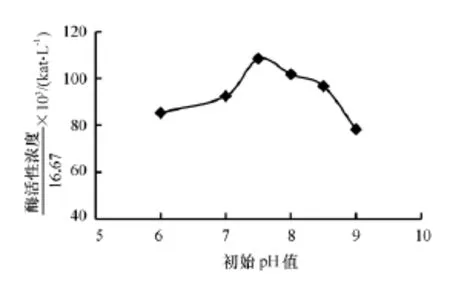
图6 不同初始pH下H菌的发酵酶活性浓度
根据上述单因子实验结果设计正交试验以确定菌株发酵的最佳条件,结果见表4,培养基中不同水平的玉米粉、豆粕对菌株产酶能力影响显著。正交试验结果,表明在培养温度为37℃、添加玉米粉为1%、豆粕1%、初始pH为7.5~8.0时发酵产酶能力最强,酶活性浓度为2.56×10-3kat/L(153.7U/mL)。

表4 正交试验结果
4 结论
得到的一株可降解羽毛角蛋白的菌株H具有高效降解羽毛角蛋白活性。根据菌种H的表型及生理生化反应方面的结果,可以确定该降解羽毛角蛋白菌株为枯草芽孢杆菌;通过对其发酵条件研究,综合各单因素试验及正交试验,分析得到其最佳发酵条件:最佳发酵培养基为玉米粉10g、豆粕10g,MgCl20.1g,CaCl20.06g,NaCl 0.5g,K2HPO41.4g,KH2PO40.7g,羽毛粉10g,水1 000mL,培养基pH 7.5~8.0;最适培养条件:接种量为2%,培养温度37℃,180r/min摇床培养96h,在该优化条件下该菌的产酶能力最强,最高酶活性浓度为2.56×10-3kat/L(153.7U/mL),比初始酶活提高了45.7%。此外,得到的最佳碳源、氮源不仅能使其酶活得到大幅提高,而且来源广泛、价格低,为角蛋白酶投入大规模工业生产奠定了基础。
在今后的研究中,可以进行角蛋白的提取分离、纯化等方面的研究,并且可以应用基因工程等技术将产酶基因克隆并接合到生长较快速的菌体中,进一步提高角蛋白酶的表达量和活性并拓宽其应用范围,以更好地应用于工业生产中。
(References)
[1]Cedrola S M L,de Melo A C N,Mazotto A M,et al.Keratinases and sulfide from bacillus subtilis SLC to recycle feather waste[J].World Journal of Microbiology &Biotechnology,2012,28(3):1259-1269.
[2]McGovern V.Recycling poultry feathers:more bang for the cluck[J].Environmental Health Perspectives,2000,108(8):366-369.
[3]Brandelli A.Bacterialkeratinases:useful enzymes for bioprocessing agroindustrial Wastes and Beyond[J].Food and Bioprocess Technology,2008,1(2):105-116.
[4]Gupta R,Ramnani P.Microbial keratinases and their prospective applications:an overview[J].Applied Microbiology and Biotechnology,2006,70(1):21-33.
[5]汪国和,张日俊,丁丽敏.家禽羽毛废弃物高值化利用研究进展[J].饲料工业,2005,26(1):46-48.
[6]何伟.羽毛膨化加工技术[J].畜产品加工,2002,29(6):54-56.
[7]Gessesse A,Hatti Kaul R,Gashe B A.et al.Novel alkaline proteases from alkaliPhilic bacteria grown on chicken feather[J].Enz-ymeand Mierobial Teehnology,2003,32(5):519-524.
[8]Pathange P,Senigala K,Jayalakshmi K S.Purification and characterization of extreme alkaline,thermostable keratinase,and keratin disulfide reductase produced by Bacillus halodurans PPKS-2[J].Appl Microbiol Biotechnol,2010,87(2):625-633.
[9]Tawfik M M,Rawa B H.Degradation of keratin substrates by fungi isolated from sewage sludge[J].MycoPathologia,2001(154):185-189.
[10]Anbu P,Gopinath S C,Hilda A,et al.Purifieation of keratinase from poultry farm isolate-scopulariopsis breicaulis and statistical optimization of enzyme activity[J].Enzyme and Microbial Technology,2005,36(5/6):639-647.
[11]SzabóI,Benedek,SzabóI M,et al.Feather degradation with a thermotolerant streptomyces graminofaciens strain[J].World Journal of Microbiology&Biotechology,2000,16(3):253-255.
[12]Gushterova A,Vaileva-Tonkova E,Dimova E,et al.Keratinase Produetion by newly isolated Antaretic catinomycete strains[J].World Journal of Microbiology &Biotechology,2005,21(6):831-834.
[13]希坎南R E.伯杰氏细菌鉴定手册[M].北京:科学出版社,1989.[14]Gradiar H,Kern S,Friedrich J.Keratinase of doratomyces microsporus[J].Applied Microbiology and Biotechnology,2000,53(2):196-200.
[15]Stanbury P,Whitaker A,Hall S.Principles of fermentation technology[M].Second edition.New Delhi,India:Aditya books Private Limited,1997:93-105.
[16]张诚,邹景忠.尖刺拟菱形藻吸收动力学以及氮磷限制下的增殖特征[J].海洋与湖沼,1997,28(6):599-603.
[17]Klein J,Rosenberg M,Markos J,et al.Biotransformation of glucose to gluconic acid by Aspergillus niger study of mass transfer in an airlift bioreactor[J].Biochemical Engineering Journal,2002, 10(3):197-205.
Identification and optimization of fermentation conditionsfor astrain of highly active degradation of feather keratin
Wang Dongfang,Wang Qingzhong
(Key Laboratory of Biochemistry &Molecular Biology in Universities of Shandong Province,Weifang University,Weifang 261061,China)
The strain H is identified as bacillus subtilis,based on morphology,physiological and biochemical characteristics.And the fermentation conditions of the strain are optimized,while significantly affecting the conditions which are optimized by orthogonal test.The results show that the optimal fermentation medium will be corn powder 5g,soybean meal 10g,MgCl20.1g,CaCl20.06g,NaCl 0.5g,K2HPO41.4g,KH2PO40.7g,10g feather powder,water 1 000mL,pH 7.5-8.0,and the optimal culture conditions are as follows:inoculation the amount of 2%,temperature 37℃,180r/min shaking culture 96h,the production of keratinase activity up to 2.56×10-3kat/L 153.7(U/mL).
identification of feather keratin;keratinasebacillus subtilis;fermentation conditions
S816.48
B
1002-4956(2015)3-0063-05
2014-08-31 修改日期:2014-09-24
山东省星火计划项目(2012XH06031);潍坊市科技发展计划资助项目(2011022、20111023);潍坊学院科技发展计划项目(2012z07)
王东方(1970—),男,山东潍坊,硕士,讲师,研究方向为微生物生理生化及发酵.
E-mail:wangdf@wfu.edu.cn

