鸡α干扰素/白细胞介素18基因的融合表达及抗病毒活性研究
何 静,张盼盼,孙敏华,康银峰,谢 鹏,向 斌,韩 翡,谭阳通,任 涛
(华南农业大学兽医学院/人兽共患病防控制剂国家地方联合工程实验室/农业部兽用疫苗创制重点实验室/广东省动物源性人兽共患病预防与控制重点实验室,广东广州510642)
鸡α干扰素/白细胞介素18基因的融合表达及抗病毒活性研究
何 静,张盼盼,孙敏华,康银峰,谢 鹏,向 斌,韩 翡,谭阳通,任 涛
(华南农业大学兽医学院/人兽共患病防控制剂国家地方联合工程实验室/农业部兽用疫苗创制重点实验室/广东省动物源性人兽共患病预防与控制重点实验室,广东广州510642)
何 静,张盼盼,孙敏华,等.鸡α干扰素/白细胞介素18基因的融合表达及抗病毒活性研究[J].华南农业大学学报,2015,36(1):18-22.
【目的】构建原核表达载体pET28a-rChIFN-α-ChIL-18、大肠埃希菌Escherichia coli表达及产物纯化与活性检测,研究高效广谱鸡基因工程重组复合抗病毒制剂,以对鸡的病毒性疾病进行防治.【方法】采用融合PCR(Fusion PCR)方法,利用具有互补末端的引物,形成具有重叠链的PCR产物,通过PCR产物重叠链的延伸将鸡α干扰素(Chicken interferon alpha,ChIFN-α)与鸡白细胞介素18(Chicken interleukin-18,ChIL-18)基因构建ChIFN-α-ChIL-18融合基因并克隆入pET-28a原核表达载体中进行原核表达.通过镍柱亲和层析法纯化可溶性蛋白,并进行SDSPAGE分析、Western-blot鉴定.采用细胞病变抑制法检测rChIFN-α-ChIL-18蛋白在细胞上抑制水泡性口炎病毒(VSV)及新城疫病毒(NDV)增殖活性.【结果和结论】成功构建并克隆了pET28a-rChIFN-α-ChIL-18融合基因.融合基因在大肠埃希菌中表达的rChIFN-α-ChIL-18蛋白相对分子质量约为38 000,蛋白经纯化后纯度在90%以上.rChIFN-α-ChIL-18蛋白在鸡胚成纤维(CEF)细胞上具有明显抗病毒活性,其抗VSV和NDV的活性明显高于单一rChIFN-α、rChIL-18蛋白的抗病毒活性.
鸡α干扰素;鸡白细胞介素18;融合PCR;抗病毒活性
α干扰素(IFN-α)具有广谱抗病毒活性[1],其主要作用是抑制病毒繁殖、抗肿瘤活性、加强NK细胞杀伤病毒感染细胞的能力从而抑制病毒的增殖和扩散、增强机体细胞免疫应答水平等[2].白细胞介素18 (IL-18)是20世纪80年代发现的一类细胞因子,由单核巨噬细胞系统的细胞分泌,在细胞的活化、增殖和分化中起调节作用.ChIL-18除了能明显诱导IFN-γ基因表达外,还可诱导诸如 IL-2、TNF-α及 GMCSF等多种细胞因子的产生,同时,IL-18也可增强CTL细胞和NK细胞的活性,上调细胞毒活性作用,促进T细胞增殖,在细胞免疫反应中发挥重要作用[3].近年来有关IL-18的研究非常活跃,其应用领域包括抗肿瘤、抗感染及作为免疫调节剂治疗一些免疫性疾病,具有重要的临床应用价值.
本研究采用融合PCR(Fusion PCR)方法,将鸡ChIFN-α与Ch IL-18基因构建成Ch IFN-α-Ch IL-18融合基因并克隆入pET-28a原核表达载体中进行表达,该蛋白具有很好的免疫原性和很强的抗水泡性口炎病毒(VSV)和新城疫病毒(NDV)活性.这项研究可有效地降低研制成本,易于生产,且具有叠加的ChIFN-α和ChIL-18抗病毒功能,为生产高活性及高效基因工程重组复合抗病毒制剂奠定了基础.
1 材料与方法
1.1 材料
1.1.1 菌(毒)株与质粒 大肠埃希菌Escherichia coli BL21、DH5α菌株由华南农业大学兽医学院动物传染病实验室保存;VSV由广东省农业科学院惠赠; NDV及质粒载体pET-28a均由华南农业大学兽医学院动物传染病实验室保存.
1.1.2 试剂 PCR扩增用试剂、内切酶、T4连接酶、dNTP均为大连(宝)生物(TaKaRa)工程有限公司产品;DNA回收试剂盒、琼脂糖凝胶DNA纯化试剂盒等试剂均为Omega公司产品;TRIzol试剂为Invitrogen公司产品;淋巴细胞分离液为杭州灏洋生物工程公司产品;DM EM培养基和小牛血清均为Hyclone公司产品.
1.1.3 主要仪器设备 PTC-200型PCR仪为美国MJReSearch公司产品;凝胶成像分析系统为英国Gyndene公司产品;Galaxy 300 L CO2培养箱为英国Rsbiotech公司产品;分光光度计(ND-1000)为Nano-Drop公司产品;恒温CO2培养箱为英国Rsbiotech公司产品;超声波裂解仪为美国Scientz公司产品.
1.2 方法
1.2.1 引物的设计与合成 参照GenBank登录的ChIFN-α基因序列(DQ226092)、ChIL-18基因序列(AJ277865)及pET-28a(+)多克隆位点,用Oligo 7 (Molecular Biology Insights Inc.,Cascade,CO)辅助设计2对具有互补末端的引物,分别为P1/P2、P3/ P4引物对,引物均由英潍捷基(广州)贸易有限公司(Life technologies)合成.本试验所用引物见表1.
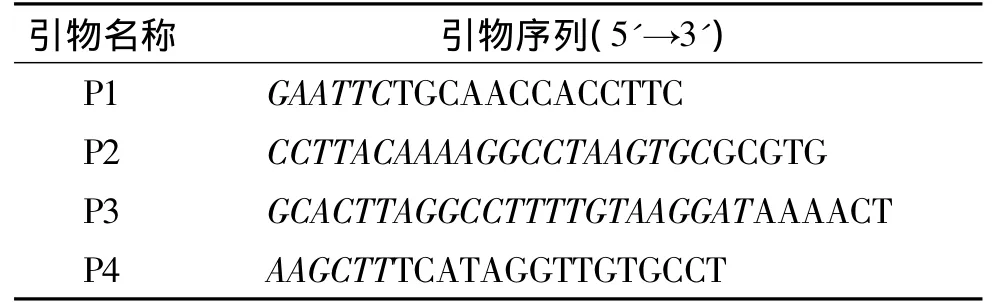
表1 试验所用引物1)Tab.1 PCR primers used in this study
1.2.2 Ch IFN-α-ChIL-18融合基因的构建 参照李敏等[4]报道的方法进行ChIFN-α-ChIL-18融合基因的构建.首先采用 P1/P2引物对,以 rpMD19-T/ ChIFN-α质粒为模板对ChIFN-α基因片段进行扩增后,采用P3/P4引物对,以rpMD19-T/ChIL-18质粒为模板扩增ChIL-18基因片段.使用低熔点琼脂糖凝胶回收试剂盒分别回收ChIFN-α、ChIL-18基因片段,将上述2个回收产物混合,取0.5μg混合物用于ChIFN-α与ChIFN-γ基因的融合反应.采用P2/P3引物对,依据上述融合反应片段为模板进行ChIFN-α与ChIL-18融合片段的PCR扩增.回收约996 bp的PCR产物.
1.2.3 ChIFN-α-ChIL-18融合基因的克隆、测序与表达 将“1.2.2”回收的996 bp左右的PCR产物定向克隆至 pMD19-T载体,后筛选阳性克隆质粒(pMD19-T/ChIFN-α-ChIL-18)送英潍捷基(上海)贸易有限公司测序,阳性克隆质粒经Eco RⅠ和Hin dⅢ双酶切后连接到经相同酶双切后的表达载体pET-28a(+),将构建好的重组pET-28a/ChIFN-α-ChIL-18表达质粒分别转入宿主菌E.coli BL21中,筛选阳性重组菌送英潍捷基(广州)贸易有限公司(Life technologies)测序.选取核苷酸序列和插入方向都正确的重组菌、pET-28a/ChIFN-α-ChIL-18空载体菌对照、BL21空菌对照进行IPTG诱导表达,采用SDSPAGE分析表达蛋白.
1.2.4 重组ChIFN-α-ChIL-18融合蛋白的诱导表达及 Western-blot分析 将测序正确的 pET-28a/ ChIFN-α-ChIL-18于10 mL含Kna+的LB液体培养基中,37℃、150 r/min扩大培养12 h.取培养物5 mL接种于500 mL LB液体培养基中,37℃、150 r/min振荡培养至D600nm达到0.6~0.8时,加入IPTG至终浓度为0.5 mmol/L,16℃诱导表达10 h,同时,设立37℃诱导表达(IPTG至终浓度为1.0 mmol/L)的对照组、未诱导的菌液和pET-28a/BL21空载体菌作为阴性对照.制备12%分离胶和5%浓缩胶,利用SDSPAGE电泳检查目的蛋白表达情况.将凝胶上的蛋白转印至硝酸纤维素膜(NC),将His标签抗体(1∶2 000)作为一抗,然后用辣根过氧化物酶标记的羊抗鼠(1∶10 000)作二抗,进行Western-blot反应.
1.2.5 重组ChIFN-α-ChIL-18融合蛋白的纯化 通过试验证明pET-28a/ChIFN-α-ChIL-18原核表达载体表达的融合蛋白于上清液中以可溶性形式存在,按GE公司Ni-NTA纯化系统说明书的Native purifycation方法纯化融合蛋白.
用紫外分光光度计分别测定D260nm和D280nm,根据下式计算蛋白质质量浓度[ρ(蛋白质)][5]: ρ(蛋白质)=(1.45×D280nm-0.74×D260nm).
1.2.6 rChIFN-α-ChIL-18蛋白抗病毒活性检测 采用微量细胞病变抑制法在鸡胚成纤维(CEF)细胞上测定rChIFN-α-ChIL-18蛋白的抗VSV及NDV活性.同时设rChIFN-α、rChIL-18蛋白对照.CEF细胞在96孔细胞培养板培养至单层后,将纯化的ChIFN-α-ChIL-18、rChIFN-α、rChIL-18用维持液(DMEM+体积分数为2%的FCS)进行4倍倍比稀释,每个稀释度重复8孔,于37℃,体积分数为5%CO2培养箱中培养12 h后,弃上清液,用PBS洗涤后,分别加入100μL 100TCID50 VSV和100μL 100TCID50NDV的病毒稀释液,同时设置只用病毒攻毒对照组和正常细胞对照组,继续培养48~72 h后观察细胞病变情况,待阳性对照细胞出现明显细胞病变时判定结果,能抑制50%细胞病变的细胞因子的最高稀释度的倒数作为其抗VSV、NDV活性单位.采用Reed-Muench法[6]计算 rChIFN-α-ChIL-18蛋白抗VSV及NDV活性,同时与rChIFN-α、rChIL-18蛋白进行比较.
2 结果与分析
2.1 Ch IFN-α-Ch IL-18融合基因的构建
以重组质粒 pMD19-T/ChIFN-α和 pMD19-T/ ChIL-18为模板PCR扩增IFN-α和IL-18片段,得到ChIFN-α和ChIL-18 PCR扩增产物,大小分别为489和510 bp;采用P2/P3引物对扩增到了大小为996 bp左右的ChIFN-α-ChIL-18融合基因,这些扩增产物大小均与预期的相一致(图1).说明采用融合PCR方法成功构建了ChIFN-α-ChIL-18融合基因.

图1 融合PCR扩增ChIFN-α-ChIL-18融合基因Fig.1 Fusion PCR amplification of ChIFN-α-ChIL-18 fusion gene
2.2 Ch IFN-α-Ch IL-18基因表达载体的构建
ChIFN-α-ChIL-18融合基因成功克隆入pMD19-T载体,测序结果表明,融合基因序列全长为996 bp,对比原模板质粒中的ChIFN-α和ChIL-18核苷酸序列没有发生变异.对阳性rpET-28a/ChIFN-α-ChIL-18质粒测序表明,插入 pET-28a载体中的 ChIFN-α-ChIL-18融合基因长度为 996 bp,与 pMD19-T/ ChIFN-α-ChIL-18克隆质粒中的相应基因序列完全一致.以上结果表明成功构建了pET-28a/ChIFN-α-ChIL-18表达质粒.
2.3 rCh IFN-α-Ch IL-18蛋白的表达及鉴定
重组菌BL21(pET-28a/ChIFN-α-ChIL-18)经IPTG诱导后,经SDS-PAGE和Western-blot分析,结果表明,表达的重组蛋白相对分子质量为38 000左右,与预期大小相一致;且该融合蛋白具有可溶性,由SDS-PAGE电泳结果可知,16℃比37℃更利于蛋白在上清液中的表达.对照BL21空菌和含pET-28a空载体的BL21菌在相应位置均无条带(图2).
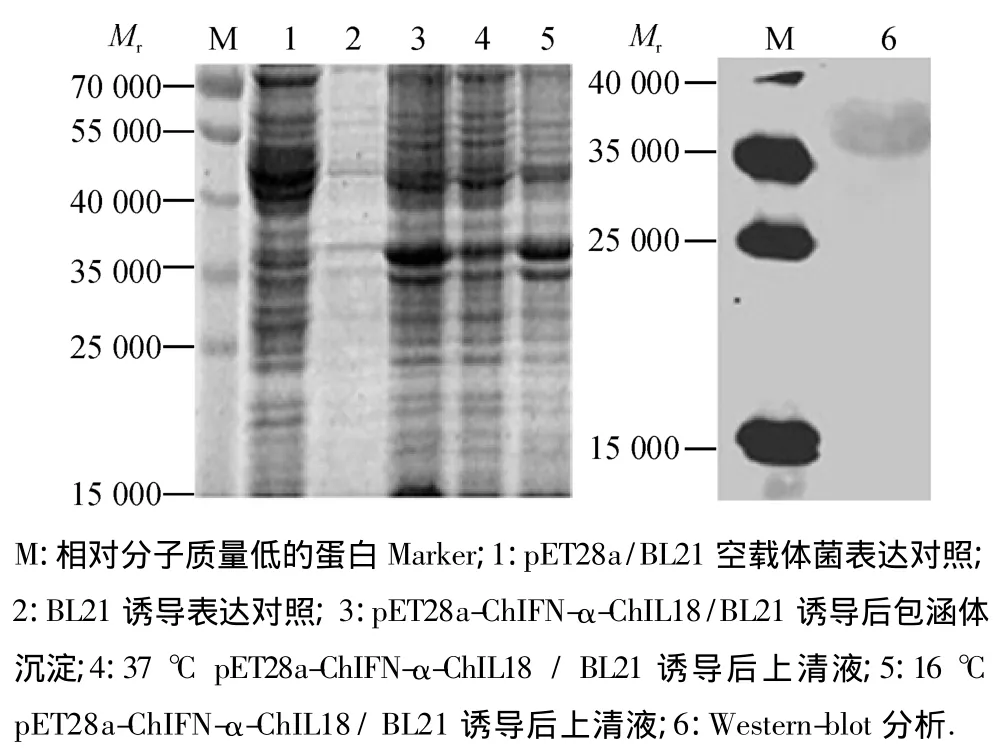
图2 pET28a-ChIFN-α-ChIL18/BL21 SDS-PAGE和Westernblot分析Fig.2 SDS-PAGE and Western-blot analyses of pET28a-ChIFN-α-ChIL18
2.4 重组Ch IFN-α-Ch IL-18融合蛋白的纯化
将诱导后的菌体超声裂解,纯化后经SDS-PAGE电泳检测,结果显示目的蛋白由Native-100的咪唑洗涤液洗脱下来,用凝胶扫描分析,蛋白纯度高达90%以上(图3).经紫外分光光度计测定融合蛋白ChIFNα-IL18质量浓度为0.350 mg/mL.
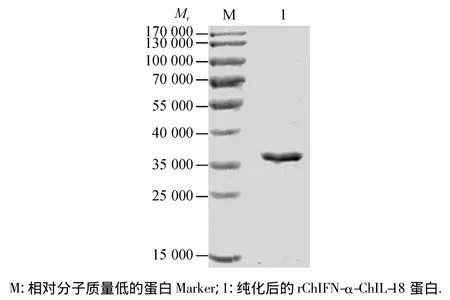
图3 rChIFN-α-ChIL18蛋白纯化结果Fig.3 SDS-PAGE analyses of the purified protein rChIFN-α-ChIL18
2.5 rCh IFN-α-Ch IL-18蛋白抗病毒活性检测
2.5.1 rChIFN-α-ChIL-18蛋白抗VSV活性 将抑制50%细胞病变的干扰素稀释度的倒数作为干扰素抗VSV活性单位.计算得rChIFN-α-ChIL-18、rChIFN-α以及rChIL-18的活性分别约为4.67×106、2.58× 105、5.9×103IU/mg.试验结果表明,分别经rChIFN-α-ChIL-18、rChIFN-α及 rChIL-18蛋白作用后感染VSV的正常CEF细胞,正常的CEF细胞均无细胞病变,而病毒对照组感染VSV的CEF细胞基本死亡(图4).说明rChIFNα-IL18和rChIFN-α、rChIL-18均有明显的抗病毒活性,且融合蛋白的抗病毒效果要高于单一蛋白.

图4 rChIFN-α-ChIL-18蛋白对VSV的抑制作用Fig.4 rChIFN-α-ChIL-18 antiviral activities against VSV
2.5.2 rChIFN-α-ChIL-18蛋白抗NDV活性 将可以抑制50%细胞病变的干扰素的稀释浓度的倒数作为干扰素抗NDV活性单位.计算得rChIFN-α-ChIL-18、rChIFN-α及rChIL-18抗NDV的活性分别约为3.17×106、2.0×103、1.19×103IU/mg.试验结果表明,分别经 rChIFN-α-ChIL-18、rChIFN-α及 rChIL-18蛋白作用后感染NDV的正常CEF细胞,正常的CEF细胞均无细胞病变,而病毒对照组感染VSV的 CEF细胞基本死亡(图5).说明rCh IFNα-IL18和rChIFN-α、rChIL-18均有明显的抗病毒活性,且融合蛋白的抗病毒效果要高于单一蛋白.

图5 rChIFN-α-ChIL-18蛋白对NDV的抑制作用Fig.5 rChIFN-α-ChIL-18 antiviral activities against NDV
3 讨论
目前禽类病毒性传染病依然严重威胁着养禽业,但是仍然没有有效的药物可以预防,人们的防控依然主要依靠疫苗免疫.由于疫苗的单一血清型而导致无法有效地对快速变异的病毒进行防控,而大量药物的使用,引起一系列的药物残留和抗药性的问题.因此研发广谱、高效、安全、无毒副作用的抗病毒药物对促进养鸡业健康发展具有重要意义.干扰素因具有广谱的抗病毒活性,一方面可以促进机体加强对病毒的抵抗,另一方面也能促进疫苗的免疫效果.因此重组干扰素的研究和应用将成为病毒性疾病防治的重要方向.
rIFN-α具有广谱的抗病毒活性,基因工程rIFN-α作为抗病毒制剂对多种病毒性疾病的疗效已明确[7].rChIFN-α蛋白对NDV[8]、禽流感H9N2型病毒及马立克氏病毒[9-11]均具有抑制作用,rChIL-18蛋白可调节机体免疫功能,明显诱导IFN-γ基因表达,增强疫苗的免疫效果.本研究通过融合PCR方法成功将ChIFN-α、ChIL-18基因融合成ChIFN-α-ChIL-18融合基因并进行了融合表达,经对比rChIFN-α-ChIL-18融合蛋白进行生物学活性测定结果表明,rChIFN-α-ChIL-18蛋白在 CEF细胞上具有明显优于单一rChIFN-α和rCh IL-18的生物学活性,说明rCh IFN-α-ChIL-18具有单一rChIFN-α蛋白和rChIL-18蛋白的双重生物学活性,调动了机体强大的免疫功能,发挥抗病毒效果,这与闫若潜等[7]的相关报道一致.
本研究采用的融合PCR方法,与传统利用酶切位点将各个片段逐个连接到载体上的方法相比,此技术在不需要内切酶消化和连接酶处理的条件下实现DNA片段的体外连接,大大缩短了反应时间,降低了操作难度.
重组蛋白绝大部分以可溶的形式存在于上清液中.正常的诱导表达中,蛋白主要以包涵体的形式存在,由于包涵体纯化难度高、纯化产物不易保存,本试验经过多次探索,发现在16℃低温诱导条件下,上清液中可检测到可溶性蛋白表达.
本研究证明,rChIFN-α-Ch IL-18蛋白对NDV和VSV具有有效的抑制效应,本试验为临床上新城疫的防治提供了新的思路和方法,对病毒性疫病的防控具有重要意义[10].同时为下一步将rChIFN-α-ChIL-18蛋白用于鸡体内抗病毒感染研究奠定了基础.
[1] MEAGER A,LEUNG H,WOOLLEY J,et al.Assays for tumour necrosis factor and related cytokines[J].J Immunol Methods,1989,116(1):1-17.
[2] JOHNSON H M,BAZE FW,SZENTE B E.How interferons fight disease[J].Sci Am,1994,270(5):68-75.
[3] 王宪文,刘兴友,王岩.鸡白细胞介素18研究进展[J].安徽农业科学,2008,36(16):6776-6777.
[4] 李敏,杨谦.一种高效构建同源重组DNA片段的方法—融合PCR[J].中国生物工程杂志,2007,27(8): 53-58.
[5] 韦琴,彭贵青,金梅林,等.鸡α干扰素基因的克隆、原核表达及抗病毒效果研究[J].生物工程学报,2006,22 (5):737-743.
[6] SAGANUWAN SA.Amodified arithmeticalmethod of reed and muench for determination of a relatively idealmedian dose(LD50)[J].Afr JPharm Pharmacol,2011,5(12): 1543-1546.
[7] 闫若潜,谢彩华,吴志明.鸡α干扰素/白细胞介素2基因的融合表达及活性研究[J].中国农业科学,2010,43 (3):594-604.
[8] YEH H Y,WINSLOW B J,JUNKER D E,et al.In vitro effects of recombinant chicken interferon-gamma on immune cells[J].J Interf Cytok Res,1999,19(6):687-691.
[9] MEAGER A.Biological assays for interferons[J].J Immunol Methods,2002,261(1/2):21-36.
[10]VOLPINI L M,CALNEK B W.Interferon modulation of marek's disease virus genome expression chicken cell lines[J].Avian Dis,1996,40(1):78-87.
[11]XING Z,SCHATK A.Inhibitory effects ofnitric oxide and gamma interferon on in vitro and in vivo replication of Marek's disease virus[J].J Virol,2000,74(8):3605-3612.
【责任编辑 柴 焰】
Expressions and antiviral bioactivities of chicken interferon α/chicken interleukin-18 fusion protein
HE Jing,ZHANG Panpan,SUN Minhua,KANG Yinfeng,XIE Peng,XIANG Bin,HAN Fei,TAN Yangtong,REN Tao
(College of Veterinary Medicine,South China Agricultural University/National and Regional Joint Engineering Laboratory for Medicament of Zoonosis Prevention and Control/Key Laboratory of Animal Vaccine Development,Ministry of Agriculture/Key Laboratory of Zoonosis Prevention and Control of Guangdong Province,Guangzhou 510642,China)
【Objective】This study was conducted to explore a highly efficient chicken gene engineering antiviral agent to prevent and control the chicken viral disease.A recombinant plasmid pET28a-rChIFNα-IL18 was constructed,which was expressed in Escherichia coli,purified by Ni-NTA and tested for antiviral bioactivitiy.【Method】This study introduced a novelmethod for constructing vectors by fusion PCR,which generated PCR productswith overlapping chain using Primers complementary to the end.Through the extension of PCR products,ChIFN-αand ChIL-18 constituted the ChIFN-α-ChIL-18 fusion gene when cloned into the vector pET-28a,induced the expression in E.coli strain BL21(DE3).This protein was purified by Ni-NTA and detected by SDS-P AGE and Western-blot.Cytopathic effects(CPE)were applied to examine the potency of recombination rChIFN-α-ChIL-18 against vesicular stomatitis virus (VSV)and newcastle disease virus(NDV)proliferation.【Result and conclusion】The fusion gene of ChIFN-α-ChIL-18 was successfully constructed and cloned into pET-28a vector.The rChIFN-α-ChIL-18 protein was expressed in E.coli and successfully purified with a molecular mass of about 38 000 and more than 90%on SDS-PAGE,which indicated that the correct rChIFN-α-ChIL-18 fusion protein had been obtained.The antiviral activity units of rChIFN-α-ChIL-18 protein inhibiting the reproduction of VSV and NDV on chicken embryo fibroblast(CEF)cellsweremuch higher than those of the recombinant rChIFN-α,rChIL-18 protein.
chicken interferon alpha;chicken interleukin-18;fusion PCR;antiviral activity
S852.65
A
1001-411X(2015)01-0018-05
2014-02-24 优先出版时间:2014-12-02
优先出版网址:http://www.cnki.net/kcms/doi/10.7671/j.issn.1001-411X.2015.01.004.html
何 静(1988—),女,硕士研究生,E-mail:amilyjingjing@163.com;通信作者:任 涛(1968—),男,教授,博士,E-mail:rentao@scau.edu.cn
广东省战略性新兴产业核心技术攻关(2012A020800006)

