不同硒源对泌乳期母猪生产性能、甲状腺激素水平和免疫功能的影响
林金玉,林长光,,3,詹桂兰,林枣友,刘亚轩,郑金贵
(1福建光华农牧科技开发有限公司,福建福州350100;2福建农林大学作物科学学院,福建福州350100; 3福建省农业科学院畜牧兽医研究所,福建福州350100)
不同硒源对泌乳期母猪生产性能、甲状腺激素水平和免疫功能的影响
林金玉1,林长光1,2,3,詹桂兰1,林枣友1,刘亚轩1,郑金贵2
(1福建光华农牧科技开发有限公司,福建福州350100;2福建农林大学作物科学学院,福建福州350100; 3福建省农业科学院畜牧兽医研究所,福建福州350100)
【目的】探索不同硒源对泌乳期母猪生产性能、免疫功能和甲状腺激素水平的影响.【方法】选用健康、体况相似、预产期相近的3~6胎次长×大杂交二元经产母猪200头,随机分为10组,每组20个重复,每个重复1头母猪,分别饲喂不同处理的日粮.1组为对照组,饲喂不添加硒源的基础日粮;其余9组为试验组,分别以亚硒酸钠、酵母硒和纳米硒的形式添加,各形式硒的添加量均分别为0.3、0.5、0.7 mg·kg-1.试验期为58 d.【结果和结论】0.3、0.5mg·kg-1硒添加量的酵母硒组和0.5、0.7mg·kg-1硒添加量的纳米硒组母猪的后代初生窝质量显著高于空白对照组(P<0.05);0.5 mg·kg-1硒添加量的酵母硒组仔猪断奶窝质量、窝增质量、日增质量均显著高于空白对照组和亚硒酸钠组(P<0.05);硒源对哺乳母猪和哺乳仔猪血清3,3',5-三碘甲腺原氨酸(T3)、3,5,3',5'-四碘甲腺原氨酸(T4)质量浓度的影响极显著(P<0.01);纳米硒组母猪血清T3质量浓度比对照组、亚硒酸钠组和酵母硒组依次提高了29.52%、17.24%和23.63%(P<0.01);纳米硒组母猪血清T4质量浓度比对照组、亚硒酸钠组和酵母硒组依次降低了24.71%、30.88%和33.86%(P<0.01);纳米硒组母猪血清IgA质量浓度比亚硒酸钠组、酵母硒组依次提高了85.39%、79.35%(P<0.01),血清IgM质量浓度比亚硒酸钠组、酵母硒组依次提高了24.19%、50.98%(P<0.01);与对照组相比,亚硒酸钠、纳米硒和酵母硒组哺乳仔猪血清IgG质量浓度分别提高了19.11%、43.39%和34.63%(P<0.01),血清IgA质量浓度分别提高了93.67%、160.75%、132.91%(P<0.01),血清IgM质量浓度分别提高了90.91%、140.91%、102.27%(P<0.01).结果表明:在泌乳期母猪日粮中添加纳米硒和酵母硒能显著提高母猪的繁殖性能、免疫功能并调节血清甲状腺激素水平.
硒;硒源;母猪;生产性能;甲状腺激素;免疫功能
硒是生物体不可缺少的微量元素,硒主要参与谷胱甘肽过氧化物酶的合成,促进过氧化氢或脂类等过氧化物转化成水,防止脂质过氧化反应,保护细胞膜不受过氧化物的侵害,以维持细胞的正常结构和功能.此外,硒还参与了动物机体甲状腺激素代谢以及维持机体发挥正常的免疫功能.因此,让动物体摄取足够的硒非常重要.研究表明硒能够提高母畜的生殖力,促进母畜子宫处于最佳状态[1];在泌乳期保证充足的硒摄入量,仔猪可通过母乳获得足够的硒源,提高自身免疫力[2].亚硒酸钠硒源存在毒性大、吸收率低和潜在亲氧化等缺点.相比之下,有机硒、纳米硒这些新型的硒源具有生物活性强、吸收率高、低毒等优势.本试验旨在探索不同的硒源(亚硒酸钠、酵母硒、纳米硒)及其添加水平对泌乳期母猪生产性能、免疫功能和甲状腺激素水平的影响,为母猪在泌乳期合理应用硒源,提高生产水平提供依据.
1 材料与方法
1.1 试验材料
纳米硒:由广州博仕奥生物技术有限公司生产,品名奥尔硒,为纳米级的单质硒,单质硒质量分数为0.5%.酵母硒:由北京奥特奇生物制品有限公司生产,品名赛乐硒,有机硒质量分数为0.2%.亚硒酸钠(Na2SeO3):由衡阳市石鼓区华地饲料添加剂厂生产,饲料级Na2SeO3,硒质量分数1%.
1.2 试验设计与试验日粮
试验选用健康、体况相似、预产期相近的3~6胎次长×大杂交二元经产母猪200头,随机分为10组,每组20个重复,每个重复1头母猪.1组为对照组,饲喂不添加硒源的基础饲粮,其余9组为试验组,分别以亚硒酸钠、酵母硒和纳米硒的形式添加,各形式硒的添加量均分别为0.3、0.5、0.7 mg·kg-1,试验期从母猪妊娠85 d开始至泌乳期28 d结束,共58 d.
母猪妊娠后期和泌乳期均饲喂相同的饲粮(哺乳母猪料),试验饲粮参照NRC母猪泌乳期的营养需要进行配制,基础饲粮组成及营养水平见表1.
1.3 饲养管理
试验于2013年1月在福建光华农牧科技开发有限公司大湖猪场进行,专人负责.将选定的试验母猪于妊娠80 d左右集中在同一幢妊娠舍,挑选体况相似,预产期相近的3~6胎二元杂交母猪,按胎次一致原则随机分成10组,同组安排在产房的同一侧,每2组安排同一产房,便于饲喂和管理.母猪在预产期前5 d转入分娩舍,预产期前1 d注射氯前列烯醇钠0.2 mg·头-1,使母猪间隔20 h后生产,每间分娩舍有40床分娩床,清洁干燥、通风良好,试验期间猪舍温度为(23±2)℃,仔猪采用250W红外灯+ 100W电热板保温.母猪分娩当天不喂料,分娩后第1天饲喂1.5 kg,以后每天增加1 kg至自由采食,母猪饲喂湿拌料,自由饮水,哺乳期仔猪不补料,仔猪23日龄断奶,断奶后留栏饲养,母猪转到配怀舍饲养,其他饲养管理按常规操作进行.
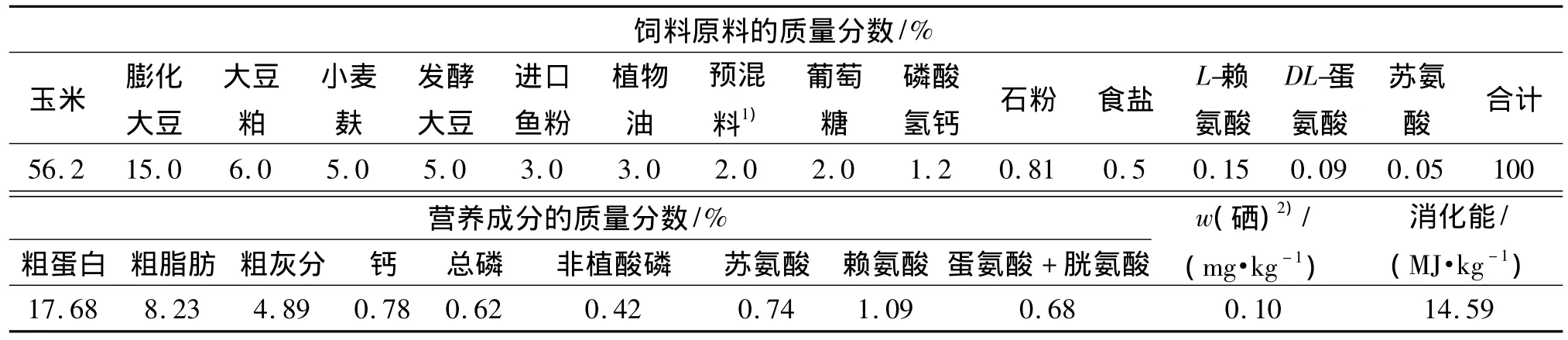
表1 试验饲粮配方及营养水平Tab.1 The basic diet composition and nutrional levels of the experiment
1.4 样品采集和测试方法
1.4.1 血浆和血清样品采集 哺乳母猪分娩后第14天上午8:00喂料前,每组选择5头母猪和5头它们的后代,前腔静脉采血10 mL,置于空离心管,经3 500 r·min-1离心15 min,分离血清,于-20℃条件下保存待测.
1.4.2 哺乳仔猪生长性能测定 初生仔猪于出生后2 h内(吃初乳前)称体质量,不交叉寄养,采取原窝原地饲养方式.23 d断奶(转走母猪)后2 h,称量仔猪个体质量,记录每窝断奶活仔数,计算仔猪初生窝质量、23日龄窝质量、平均日增质量和成活率.
1.4.3 血清甲状腺激素的测定 血清3,3',5-三碘甲腺原氨酸(T3)、3,5,3',5'-四碘甲腺原氨酸(T4)质量浓度的测定采用放射免疫分析法(RIA),采用r-911全自动放免计数仪测定(试剂盒由南京建成生物工程研究所提供).
1.4.4 血清免疫球蛋白测定 血清IgG、IgA、IgM的测定采用快速免疫比浊法,用南京建成生物工程研究所提供的试剂盒在自动生化分析仪上测定.
1.5 数据处理
试验数据用 Excel整理,数据统计分析采用SPSS 16.0软件包中的ANOVA程序进行单因素方差分析,用Univariate of GLM检测硒源和硒水平的主效应,采用Duncan's法对各组平均数进行多重比较,结果以平均数±标准差表示.
2 结果与分析
2.1 不同硒源对母猪繁殖性能及仔猪生长性能的影响
由表2可知,与对照组相比,0.3和0.5 mg·kg-1硒添加量酵母硒组、0.5和0.7 mg·kg-1硒添加量纳米硒组的仔猪初生窝质量分别提高了16.13%和23.88%、25.98%和29.70%(P<0.05).饲粮硒添加量为0.5 mg·kg-1的酵母硒组仔猪断奶窝质量、窝增质量、平均日增质量分别较对照组提高了38.44%、42.96%和17.07%(P<0.05);饲粮硒添加量为0.5 mg·kg-1的酵母硒组仔猪断奶窝质量、窝增质量、平均日增质量分别与亚硒酸钠各硒水平组相比,差异显著(P<0.05);亚硒酸钠、纳米硒组内各硒水平组间的仔猪初生个体质量、断奶窝质量、窝增质量和平均日增质量差异不显著(P>0.05).
2.2 不同硒源和硒水平对母猪、仔猪血清甲状腺激素水平的影响
2.2.1 不同硒源和硒水平对母猪血清T3、T4质量浓度的影响 由表3可知,硒源、硒水平以及硒源和硒水平的交互作用对母猪血清T3质量浓度的影响极显著(P<0.01);从不同硒源看,与对照组相比,亚硒酸钠组、酵母硒组和纳米硒组母猪血清T3质量浓度分别提高10.47%、4.76%和29.52%;其中纳米硒组母猪血清T3质量浓度分别较亚硒酸钠组和酵母硒组提高了17.24%和23.64%(P<0.01).从不同硒水平分析,与0.7 mg·kg-1硒添加量组相比,0.3、0.5 mg·kg-1硒添加量组母猪血清T3质量浓度分别提高了33.00%和29.00%(P<0.01).从硒源和硒水平分析,纳米硒0.3、0.5 mg·kg-1硒添加量组母猪血清T3质量浓度略高于0.7 mg·kg-1硒添加量组,但差异未达显著水平(P>0.05).酵母硒0.3、0.5mg·kg-1硒添加量组母猪血清T3质量浓度显著高于0.7 mg·kg-1硒添加量组(P<0.01).
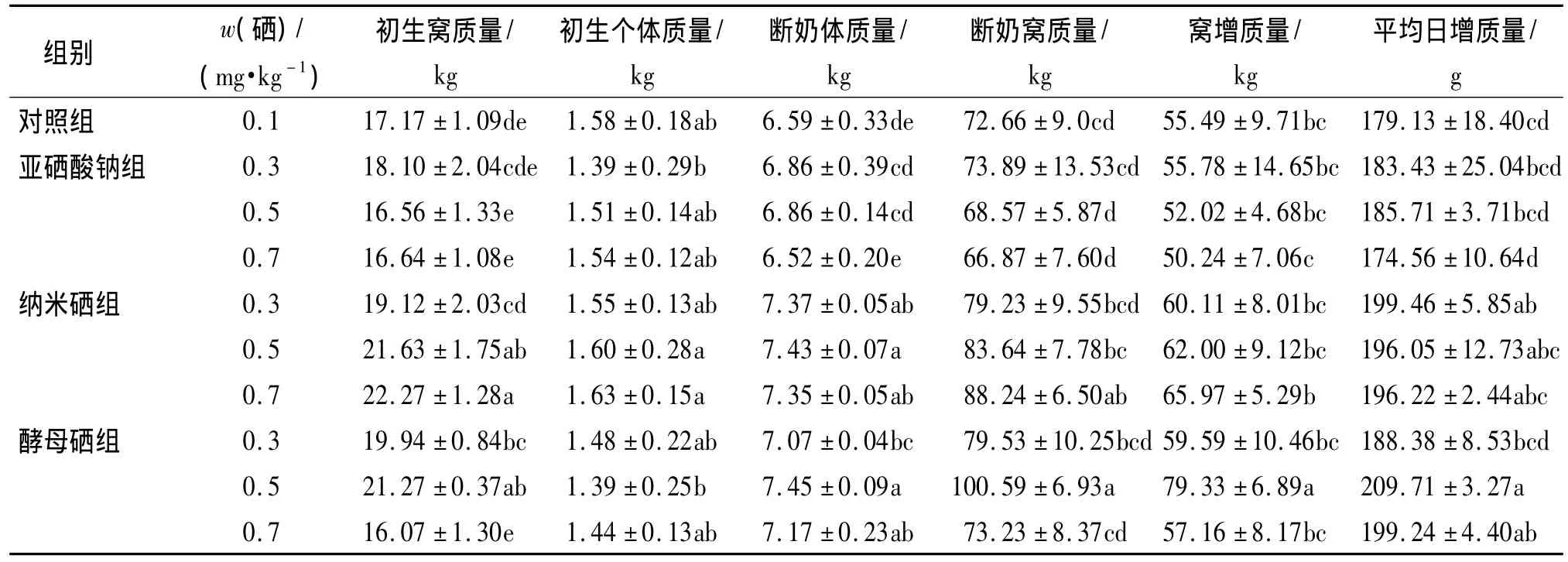
表2 不同硒源和硒水平对哺乳仔猪生长性能的影响1)Tab.2 Effects of different selenium sources and levels on the piglet grow th performance
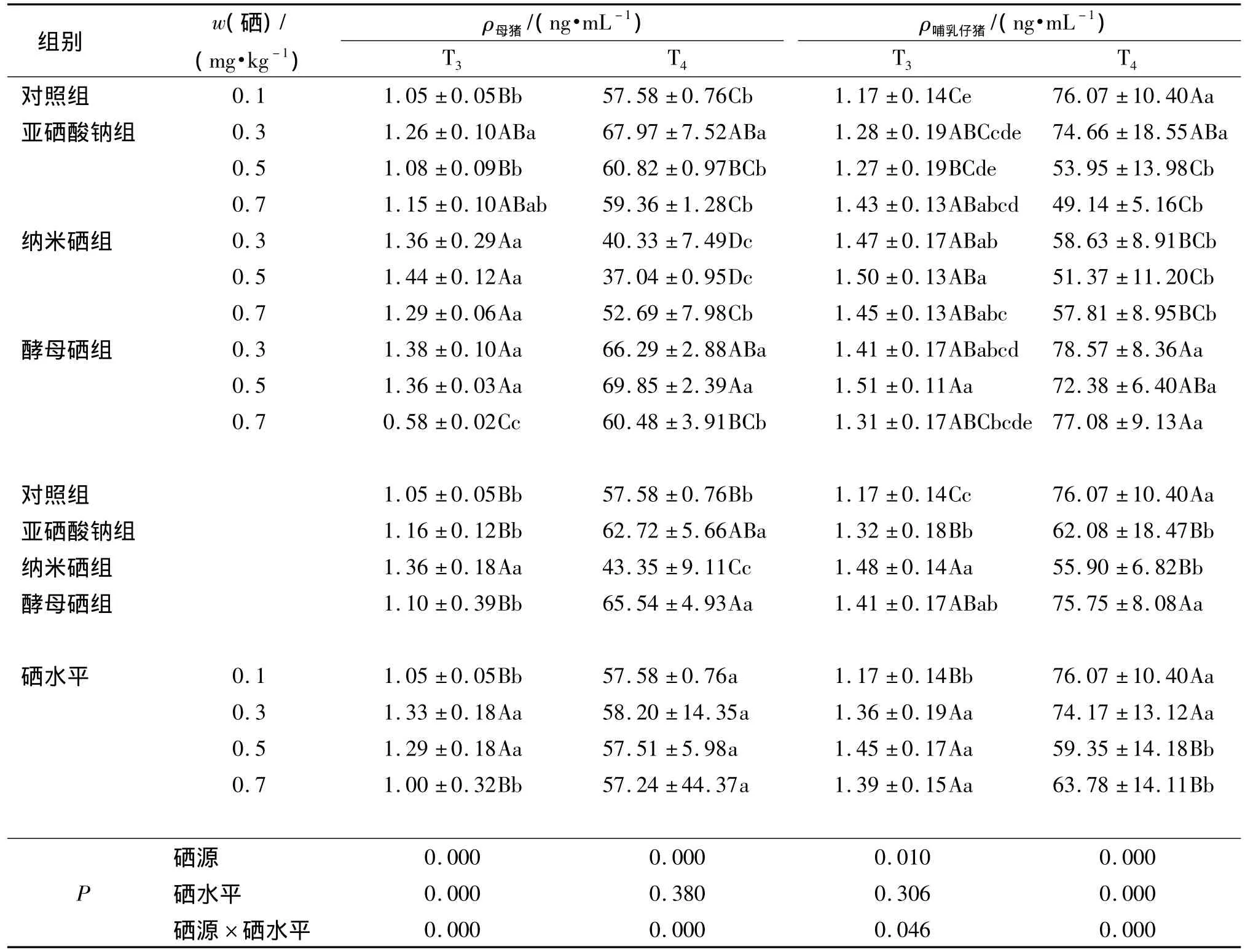
表3 不同硒源和硒水平对母猪及哺乳仔猪血清T3和T4质量浓度的影响1)Tab.3 Effects of different selenium sources and levels on serum T3and T4mass concentration of sows and suckling pigs
硒源、硒源和硒水平的交互作用对母猪血清T4质量浓度影响极显著(P<0.01).从不同硒源分析,纳米硒组母猪血清T4质量浓度分别较对照组、亚硒酸钠组和酵母硒组降低了24.71%、30.88%和33.86% (P<0.01).且纳米硒0.3、0.5 mg·kg-1硒添加量组的母猪血清T4质量浓度极显著低于0.7 mg·kg-1硒添加量组(P<0.01)(见表3).
2.2.2 不同硒源和硒水平对哺乳仔猪血清T3、T4质量浓度的影响 由表3可以看出,硒源、硒源和硒水平间的交互作用对哺乳仔猪血清T3质量浓度影响显著(P<0.05);从不同硒源分析,与对照组相比,亚硒酸钠组、纳米硒组和酵母硒组哺乳仔猪血清T3质量浓度分别提高12.82%、26.50%和20.51%(P<0.01).纳米硒0.5 mg·kg-1硒添加量组哺乳仔猪血清T3质量浓度略高于0.3、0.7 mg·kg-1硒添加量组(P>0.05);酵母硒0.5 mg·kg-1硒添加量组哺乳仔猪血清T3质量浓度高于0.3、0.7 mg·kg-1硒添加量组,与0.7mg·kg-1硒添加量组差异显著(P<0.05).
由表3可见,硒源、硒水平、硒源和硒水平间的交互作用对哺乳仔猪血清T4质量浓度影响极显著(P<0.01);从硒源分析,与对照组相比,亚硒酸钠组和纳米硒组哺乳仔猪血清T4质量浓度分别降低了18.39%和26.52%(P<0.01).从硒源和硒水平分析,纳米硒组和酵母硒组中0.5 mg·kg-1硒水平组仔猪T4质量浓度低于0.7 mg·kg-1硒水平组(P>0.05).
2.3 不同硒源和硒水平对母猪、哺乳仔猪血清免疫球蛋白含量的影响
2.3.1 不同硒源和硒水平对母猪血清IgG、IgA、IgM的影响 由表4可知,饲粮中硒源和硒水平对母猪血清IgG质量浓度无显著影响(P>0.05),但硒源和硒水平的交互作用对母猪血清IgG质量浓度影响极显著(P<0.01);随着硒水平的增加,纳米硒组母猪血清IgG质量浓度呈升高趋势,而亚硒酸钠组母猪血清IgG质量浓度呈下降趋势.0.5 mg·kg-1硒添加量酵母硒组IgG质量浓度极显著高于对照组(P<0.01).
由表4可见,硒源、硒源和硒水平的交互作用对母猪血清IgA质量浓度的影响极显著(P<0.01).从硒源分析,亚硒酸钠组、酵母硒组和纳米硒组母猪血清IgA质量浓度均极显著高于对照组(P<0.01),其中纳米硒组极显著高于亚硒酸钠和酵母硒组(P<0.01);从饲粮硒水平看,饲粮中0.3、0.5、0.7 mg·kg-13个硒添加量组间母猪血清IgA质量浓度差异不显著(P>0.05);随着硒水平的增加,纳米硒组母猪血清IgA质量浓度呈升高趋势,而亚硒酸钠组母猪血清IgA质量浓度呈下降趋势.酵母硒组中,0.5 mg·kg-1硒添加量组母猪血清 IgA质量浓度显著高于 0.3 mg·kg-1硒添加量组(P<0.05),极显著高于0.7 mg·kg-1硒添加量组(P<0.01).
由表4可见,硒源对母猪血清IgM质量浓度影响极显著(P<0.01),硒水平、硒源和硒水平的交互作用对母猪血清 IgM质量浓度无显著影响(P>0.05).从不同硒源看,与对照组相比,亚硒酸钠组和纳米硒组母猪血清 IgM质量浓度分别提高了31.91%和63.83%(P<0.01);从饲粮硒水平看,0.3、0.5、0.7 mg·kg-13个硒添加量各组间母猪血清IgM质量浓度差异不显著(P>0.05);从硒源和硒水平看,纳米硒0.7 mg·kg-1硒添加量组的母猪血清IgM质量浓度略高于0.3、0.5 mg·kg-1硒添加量组(P>0.05);而酵母硒0.7 mg·kg-1硒添加量组母猪血清IgM质量浓度略低于0.3、0.5 mg·kg-1硒添加量组(P>0.05).
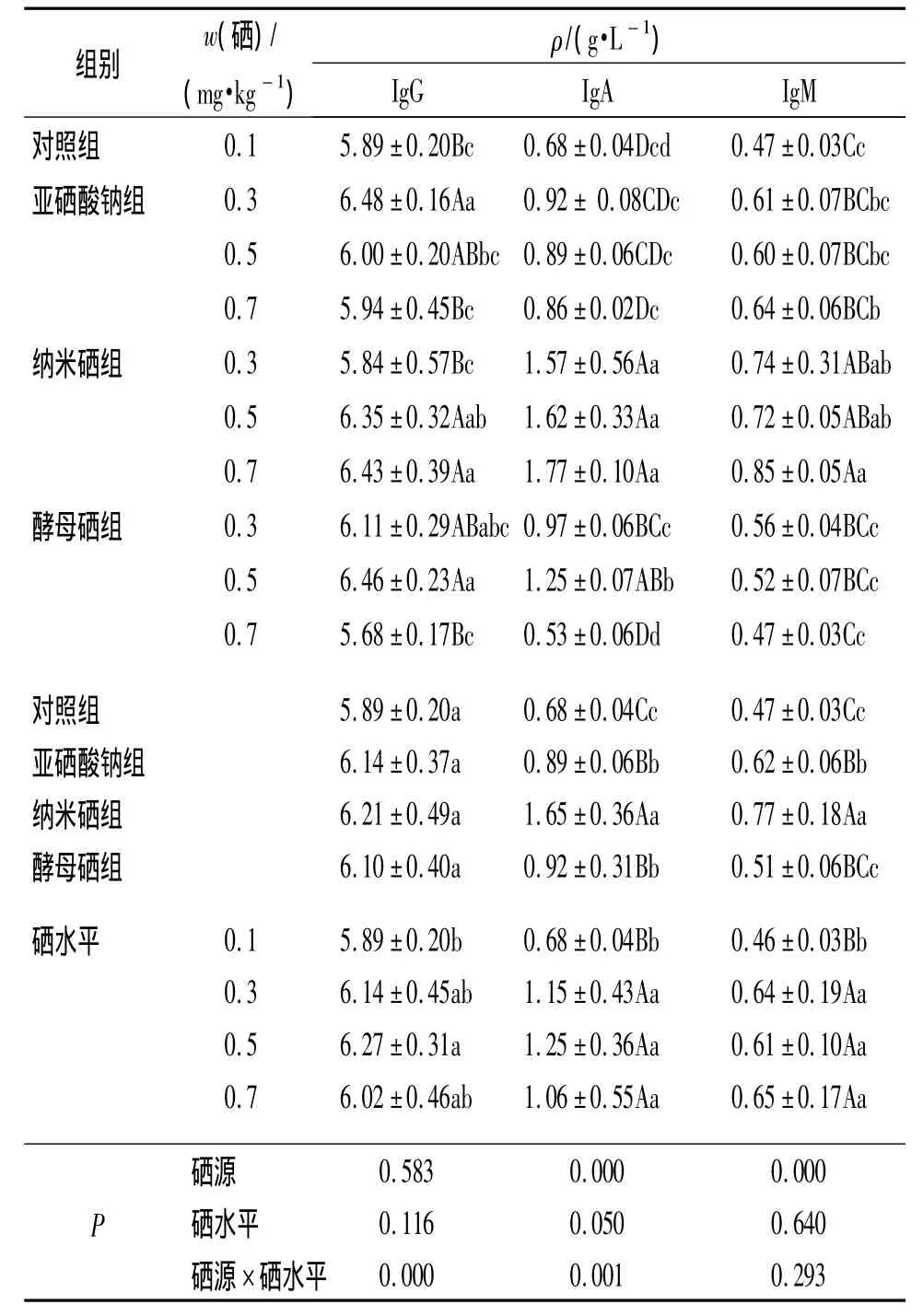
表4 不同硒源和硒水平对母猪血清IgG、IgA、IgM质量浓度的影响1)Tab.4 Effects of different selenium sources and levels on serum IgG,IgA,IgM mass concentration of sows
2.3.2 不同硒源和硒水平对哺乳仔猪血清IgG、IgA、IgM的影响 由表5可以看出,硒源、硒源和硒水平间的交互作用对哺乳仔猪血清IgG质量浓度有极显著的影响(P<0.01).从不同硒源分析,与对照组相比,哺乳母猪饲粮添加亚硒酸钠、纳米硒和酵母硒组仔猪血清IgG质量浓度分别提高了19.11%、43.39%、34.63%(P<0.01).从饲粮硒源和硒水平看,纳米硒0.3mg·kg-1硒添加量组血清IgG质量浓度较0.7 mg·kg-1硒添加量组提高了11.24%(P<0.05).酵母硒各硒水平添加量组间哺乳仔猪血清IgG质量浓度差异不显著(P>0.05).
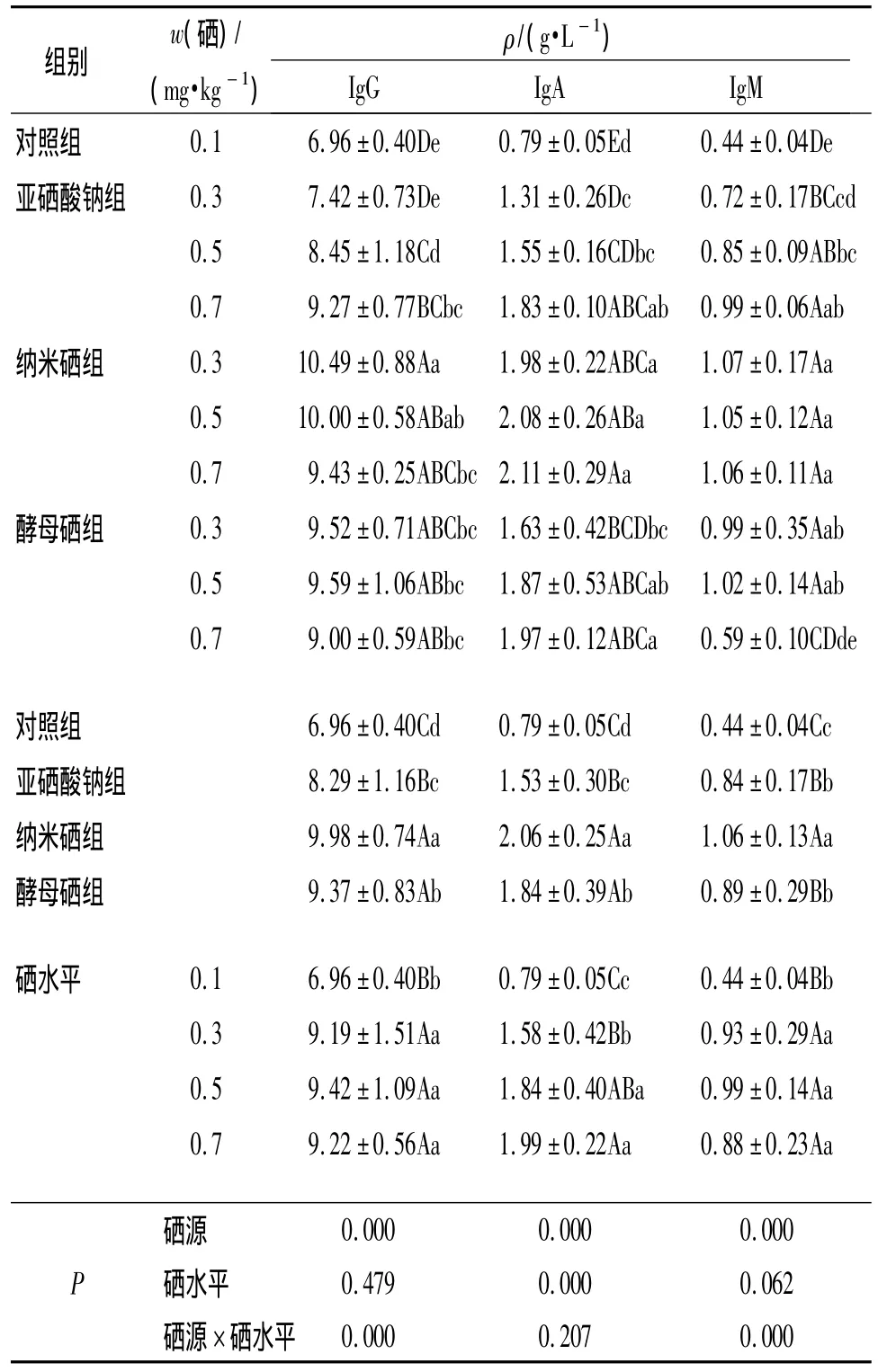
表5 不同硒源和硒水平对哺乳仔猪血清IgG、IgA、IgM质量浓度的影响1)Tab.5 Effects of different selenium sources and levels on serum IgG,IgA,IgM mass concentration of suckling pigs
由表5可见,硒源、硒水平对哺乳仔猪血清IgA质量浓度的影响极显著(P<0.01).从不同硒源分析,与对照组相比,哺乳母猪饲粮添加亚硒酸钠、纳米硒和酵母硒组仔猪血清IgA质量浓度分别提高了 93.67%、160.75%、132.91%(P<0.01).从饲粮硒水平看,哺乳仔猪血清IgA质量浓度随着母猪饲粮硒水平的增加而提高,硒添加量为0.5 mg·kg-1时其后代仔猪血清IgA质量浓度较硒添加量为0.3 mg·kg-1时提高了16.45% (P<0.05);从硒源和硒水平看,酵母硒0.7 mg·kg-1硒添加量组哺乳仔猪血清 IgA质量浓度比0.3 mg·kg-1硒添加量组提高了20.86%(P<0.05),与0.5 mg·kg-1硒添加量组差异不显著(P>0.05).
由表5可见,硒源、硒源和硒水平的交互作用对哺乳仔猪血清IgM质量浓度影响极显著(P<0.01).从不同硒源看,与对照组相比,亚硒酸钠组、纳米硒组和酵母硒组哺乳仔猪血清IgM质量浓度分别提高了90.91%、140.91%、102.27%(P<0.01);从硒源和硒水平看,亚硒酸钠组中,仔猪血清IgM质量浓度随硒水平的提高而升高,0.7 mg·kg-1硒添加量组极显著高于0.3 mg·kg-1硒添加量组(P<0.01);纳米硒组中,各硒水平添加量组仔猪血清IgM质量浓度差异不显著(P>0.05);酵母硒0.7 mg·kg-1硒添加量组仔猪血清IgM质量浓度反而比0.5 mg·kg-1硒添加量组低42.16%(P<0.01),0.5 mg·kg-1硒添加量组与0.3 mg·kg-1硒添加量组间无显著差异(P>0.05).
3 讨论与结论
3.1 不同硒源对母猪繁殖性能及哺乳仔猪生长性能的影响
硒能够提高母畜繁殖力,使母畜子宫处于最佳状态[1].母猪自身沉积的硒不能满足胎儿发育需要,在一定程度上影响胎儿生长.亚硒酸钠在小肠中是被动吸收,吸收率低,在体内不容易沉积.然而,酵母硒和纳米硒则以主动运输的方式通过肠壁被机体吸收利用,其吸收率高于无机硒,能更有效地增加母猪体内硒的存留量,改善母猪硒营养,并且能更有效地穿过母猪胎盘屏障、发挥硒的生物学功能[3].在妊娠后期给母猪补硒,硒通过胎盘屏障或乳汁进入到仔猪体内,能够提高仔猪的抗氧化能力且有机硒具有更好的效果[4].有研究证明,从母猪生长到繁殖整个过程中,饲喂0.15 mg·kg-1有机硒(富硒酵母),死胎率更低,当饲粮有机硒水平增加到0.3 mg·kg-1时,母猪体内会滞留更多的硒并转移到孕体组织[5].王宇萍等[6]的试验结果表明,与无机硒相比,给母猪饲喂0.5 mg·kg-1酵母硒能够显著提高断奶仔猪的个体质量(P<0.01),而对仔猪的初生窝质量,酵母硒有一定的改善作用.本试验结果与前人[4-6]研究相符,妊娠后期,母猪饲粮添加酵母硒、纳米硒均可提高其后代的出生窝质量,且0.5 mg·kg-1酵母硒可提高仔猪断奶窝质量、窝增质量、平均日增质量,可见在妊娠后期(85 d)到哺乳期,母猪日粮中添加酵母硒有利于胎儿生长发育和提高初生仔猪的生长性能.
3.2 不同硒源和硒水平对母猪、哺乳仔猪血清甲状腺激素水平的影响
硒是甲状腺原氨酸脱碘酶I(ID-I)的主要组成成分,ID-I控制着机体甲状腺激素、T3的活性.ID-I主要存在于肝、肾组织中,能催化T4脱碘转变为活性强的T[7]3.缺硒引起动物生长受阻,其有可能是由体内调整正常代谢和生长发育的某些激素合成量不足造成的.缺硒导致脱碘酶Ⅰ活性下降,降低了T4向T3的转化速度,使血液中T3下降而T4上升.熊莉等[8]报道,硒添加量为0.3~1.0 mg·kg-1时,纳米硒组脱碘酶Ⅰ活性和血清T3质量浓度显著高于亚硒酸钠组(P<0.05),血清T4质量浓度显著低于亚硒酸钠组(P<0.05).秦顺义等[9]报道,在羔羊饲粮中添加富硒酵母和亚硒酸钠0.1 mg·kg-1,在试验30和60 d时,富硒酵母试验组和亚硒酸钠试验组血浆T3质量浓度均极显著高于对照组(P<0.01),血浆T4质量浓度显著或极显著低于对照组(P<0.05或P<0.01),但与添加亚硒酸钠试验组相比无显著差异(P>0.05).此外,有研究表明,母猪饲粮中添加硒可提高母乳中的硒含量,而纳米硒和酵母硒在动物体内的吸收效果较好,母猪饲粮添加纳米硒或酵母硒,其乳中硒含量高于添加亚硒酸钠组,进而影响仔猪的硒摄入量[10].本研究结果表明:与对照组相比,亚硒酸钠组、酵母硒组和纳米硒组母猪血清T3质量浓度分别提高10.47%、4.76%和29.52%,纳米硒组血清T4质量浓度降低了24.71%(P<0.01);同时纳米硒组仔猪血清 T3质量浓度较对照组提高了26.50%(P<0.01),T4质量浓度对应降低了26.52%(P<0.01),结果与秦顺义等[9]的报道相符.
3.3 不同硒源和硒水平对母猪、哺乳仔猪免疫功能的影响
大量的研究表明,硒能提高畜禽机体的免疫机能[11-13].此外,日粮中添加酵母硒和纳米硒能显著提高仔猪抗氧化能力[14],抗氧化能力的提高在一定程度上也促进机体免疫机能.硒可通过提高畜禽体内的吞噬细胞数量、促进淋巴细胞的增殖及畜禽抗体和免疫球蛋白的合成,提高免疫反应.由浆细胞产生具有免疫功能的球蛋白(抗体)是体液免疫的关键,研究发现硒能刺激免疫球蛋白的形成,提高机体的抗体滴度,增强体液免疫[15-16].此外,有研究报道,硒缺乏对T细胞在免疫反应中的克隆增殖作用有不良影响,补充一定剂量的硒可使动物对有丝分裂原的敏感性提高,促进T淋巴细胞(Tc)的增殖和转化,提高自然杀伤细胞(NK)的活性[17-18].
Julian等[19]证明鼠饲粮里添加亚硒酸钠可以提高血清中IgG、IgM抗体滴度.饲粮添加硒增强了血中淋巴细胞的转化率及其调节的免疫功能[20-21].高学云等[22]以小鼠为试验动物的研究表明,纳米硒高剂量组小鼠的细胞免疫功能、体液免疫功能和吞噬细胞吞噬功能明显升高,而亚硒酸钠各剂量组的上述免疫功能无明显变化,显示纳米硒对小鼠免疫功能有明显的调节作用.胥保华[23]报道,肉鸡在硒添加量为0.2、0.3、0.4、0.5 mg·kg-1时,纳米硒组血清IgG、IgM质量浓度显著高于硒代蛋氨酸组和亚硒酸钠组(P<0.05).王秀娜等[24]在断奶仔猪饲粮中添加纳米硒、酵母硒和亚硒酸钠3种硒源,均分别以0.1、0.3、0.5 mg·kg-13个水平添加,结果表明:血清中IgA、IgG、IgM和C3的质量浓度均以0.5 mg·kg-1的纳米硒组最高,且显著高于纳米硒、酵母硒、亚硒酸钠的 0.1 mg·kg-1添加量组,显著高于 0.5 mg·kg-1的亚硒酸钠组及对照组.肖鹏等[15]研究表明饲粮中添加硒对断奶仔猪免疫指标有提高的作用,且酵母硒的作用效果较亚硒酸钠更明显.袁施彬等[16]在饲粮中添加0.6 mg·kg-1的硒,能使猪日增质量提高,料肉比降低;血清IgG、IgA和IgM质量浓度提高,猪瘟抗体滴度随着试验期的延长,几乎呈直线上升,在免疫后28 d,阳性保护率达到100%.本试验中纳米硒组母猪血清IgA、IgM质量浓度极显著高于对照组、亚硒酸钠组和酵母硒组;亚硒酸钠、纳米硒和酵母硒组哺乳仔猪血清IgG、IgA、IgM质量浓度极显著高于对照组;其中添加纳米硒 0.3~0.7 mg·kg-1可有效提高哺乳母猪和仔猪的血清 IgG、IgA、IgM质量浓度,本试验结果与王秀娜等[24]、袁施彬等[16]的研究结果基本一致,亚硒酸钠、纳米硒、酵母硒对于提高猪的免疫功能方面能起到良好的效果,且纳米硒的效果优于酵母硒和亚硒酸钠.
3.4 结论
在妊娠后期母猪饲粮中添加酵母硒能够提高母猪的繁殖性能,其中0.5 mg·kg-1硒添加量的酵母硒效果较好.在泌乳期母猪饲粮中添加亚硒酸钠、纳米硒和酵母硒,对于提高泌乳期母猪和哺乳仔猪血清T3质量浓度及免疫功能均能起到一定作用,但不同的硒源间效果差异大,添加0.5 mg·kg-1纳米硒对提高哺乳母猪、哺乳仔猪的血清中T3质量浓度效果最好,在增强免疫方面,纳米硒优于酵母硒、亚硒酸钠,0.3~0.7 mg·kg-1饲粮硒水平为佳.
[1] MAHAN D C,PETERS JC.Long-term effects of dietary organic and inorganic selenium sources and levels on reproducing sows and their progeny[J].JAnim Sci,2004,82(5):1343-1358.
[2] CLOSEW H.Organic selenium may improve sow,piglet performance[J].Feedstuffs,2003,75(8):12.
[3] 岳增华.不同来源硒对母猪繁殖性能的影响[J].中国猪业,2012(10):49-51.
[4] 耿忠诚,王秀娜,王燕,等.不同硒源对仔猪生产性能和抗氧化能力的影响[J].黑龙江八一农垦大学学报,2010,22(6):31-35.
[5] 胡东志,唐保国.硒的营养作用及对动物生殖性能影响的研究进展[J].湖南畜牧兽医,2008(3):1-2.
[6] 王宇萍,杨鹏标.酵母硒、无机硒对不同品种母猪繁殖性能、仔猪组织中硒沉积影响的研究[J].中国畜牧兽医,2013,40(12):161-164.
[7] URSINIF,MAIORINO M,BRIGELIUSFLOHE R,et al.Diversity of glutathione peroxidases[J].Meth Enzymol,1995,252:38-53.
[8] 熊莉,胡彩虹,夏枚生,等.不同硒添加剂对仔猪生长肝脱碘酶Ⅰ活性和血清甲状腺激素水平的影响[J].中国兽医科技,2004,34(10):29-33.
[9] 秦顺义,黄克和,高建忠.富硒酵母对羔羊生产性能和组织硒含量及血浆T3、T4浓度的影响[J].江苏农业科学,2007(3):134-136.
[10]林长光,林金玉,林枣友.不同硒源对母猪泌乳期生产性能、血浆和乳中硒含量的影响[J].中国畜牧杂志,2013,49(21):48-52.
[11]冯婧,王安,霍思远.饲粮添加硒对生长期蛋鸭生长性能、免疫机能及内分泌的影响[J].动物营养学报,2011,23(10):1697-1702.
[12]李岩,霍娇,吕晓华,等.硒多糖对小鼠免疫功能的影响[J].四川大学学报,2014,45(3):512-514.
[13]弓剑,闫素梅.硒对奶牛乳腺氧化应激与乳腺免疫功能的调节作用[J].动物营养学报,2014,26(3):557-564.
[14]林长光,林金玉,刘东霞,等.不同硒源对断奶仔猪生长性能、血清抗氧化能力和血浆硒含量的影响[J].畜牧兽医学报,2013,44(11):1790-1796.
[15]肖鹏,曹雪瑾,罗世乾,等.不同硒源及添加水平对断奶仔猪血清免疫指标的影响[J].养猪,2014(3):30-32.
[16]袁施彬,余冰,陈代文.硒添加水平对氧化应激仔猪生产性能和免疫功能影响的研究[J].畜牧兽医学报,2008,39(5):677-681.
[17]王茜,姚继广,杨子森,等.硒的作用机理及对动物免疫的影响[J].黑龙江畜牧兽医,2010(3):23-24.
[18]黄克和,陈万芳.硒对雏鸡T淋巴细胞转化和自然杀伤细胞活力的影响[J].南京农业大学学报,1999,22(2): 76-79.
[19]JULIAN E S,JOHN L M,MARLENE L G,et al.Enhanced immunoglobulin M and immunoglobulin G antibody titers inmice fed selenium[J].Infec Immun,1973,8(5): 841-842.
[20]KIREMIDJIAN-SCHUMACHER L,ROY M,WISHEH I,et al.Selenium and immune cell functions:I:Effect on lymphocyte proliferation and production of interleukin 1 and interleukin 2[J].Proc Soc Exp Biol Med,1990,193 (2):136-142.
[21]ROY M,KIREMIDJIAN-SCHUMACHER L,WISHE H I,et al.Selenium and immune cell functions:II:Effect on lymphocyte-mediated cytotoxicity[J].Proc Soc Exp Bio Med,1990,193(2):143-148.
[22]高学云,张劲松,张立德,等.纳米红色元素硒对小鼠的免疫功能的调节作用[J].中国公共卫生,2000,16(5): 421-422.
[23]胥保华.纳米硒对Avian肉鸡的生物学效应及其分子机理研究[D].杭州:浙江大学,2003.
[24]王秀娜,耿忠诚,武志敏.不同硒源对仔猪生长性能及体液免疫指标的影响[J].黑龙江八一农垦大学学报,2010,22(1):61-64.
【责任编辑 柴 焰】
Effects of different selenium sources on production performance,thyroid level and immune function in sows during lactation
LIN Jinyu1,LIN Changguang1,2,3,ZHAN Guilan1,LIN Zaoyou1,LIU Yaxuan1,ZHENG Jingui2
(1 Fujian Guanghua Agriculture and Animal Husbandry Technology Development Company Limited,Fuzhou 350100,China; 2 College of Crop Science,Fujian Agriculture and Forestry University,Fuzhou 350100,China; 3 Institue of Animal Science and Veterinary Medicine,Academy of Agricultural Science of Fujian Province,Fuzhou 350100,China)
【Objective】This experimentwas conducted to study the effects of different Se sources on production performance,thyroid level and immune function in sows during lactation.【Method】A total of200 LY(Landrace×Yorkshire)binary hybrid multiparous sows(healthy,with similar body condition,close due date,3-6 parities)were allotted to 10 groups randomly,with 20 replications in each group.Groupone was the control group fed with basal dietwithout supplementation of Se.The other 9 groupswere supplemented with 0.3,0.5 or 0.7 mg·kg-1Se-containing sodium selenite,yeast selenium or nano-selenium respectively.The whole feeding experiment lasted for 58 days.【Result and conclusion】The birth mass of group supplemented with yeast selenium by 0.3,0.5 mg·kg-1or nano-selenium by 0.5,0.7 mg·kg-1was significantly higher than thatof the control group(P<0.05).The group with 0.5mg·kg-1selenium yeastwas significantly higher than those of the control group and the group with sodium selenite inmass of weaning litter,littermass gain and daily gain(P<0.05).The effect of different sources of selenium on 3,3',5-triiodothyronine(T3)and 3,5,3',5'-thyroxine(T4)mass concentrations in serum of lactation sows and sucking pigletswas extremely significant(P<0.01).Compared with the control group,groups with sodium selenite or selenium yeast,the serum T3mass concentration of sows fed on the diets supplemented with nano-selenium group significantly(P<0.01)increased by 29.52%,17.24%or 23.63%,respectively,but the serum T4mass concentration significantly(P<0.01)decreased by 24.71%,30.88%or 33.86%respectively.Compared with the group with sodium selenite or selenium yeast,the serum IgA and IgM mass concentration of sows fed on the dietswith nano-selenium increased by 85.39% and 79.35%(P<0.01)or 24.19%and 50.98%(P<0.01)respectively.Compared with the control group,the serum IgG mass concentration of sucking piglets from the sows fed on the diets with sodium selenite,nano-selenium or selenium yeast significantly(P<0.01)increased by 19.11%,43.39%or 34.63%respectively,while the serum IgA and IgM mass concentration increased by 93.67%,160.75% or 132.91%and 90.91%,140.91%or 102.27%respectively.The results indicate that nano-selenium or selenium yeast supplemented in diets can significantly improve the reproductive performance and immune function of sows,and regulating the secretion of thyroxine.
selenium;selenium source;sow;production performance;thyroid hormone;immune function
S828.9
A
1001-411X(2015)01-0001-08
林金玉,林长光,詹桂兰,等.不同硒源对泌乳期母猪生产性能、甲状腺激素水平和免疫功能的影响[J].华南农业大学学报,2015,36(1):1-8.
2014-06-13 优先出版时间:2014-12-02
优先出版网址:http://www.cnki.net/kcms/doi/10.7671/j.issn.1001-411X.2015.01.001.html
林金玉(1982—),女,兽医师,硕士,E-mail:applelin82@163.com;通信作者:郑金贵(1949—),男,教授,博士,E-mail:jinguizheng@126.com
福建省星火计划(2012S0011)

