清开灵硬胶囊和软胶囊中黄芩苷的大鼠药代动力学比较研究
张靖悦,江云霞,刘 卉,陈秋宇,盖聪昊,许 卉
(烟台大学药学院,山东烟台264005)
清开灵硬胶囊和软胶囊中黄芩苷的大鼠药代动力学比较研究
张靖悦,江云霞,刘 卉,陈秋宇,盖聪昊,许 卉
(烟台大学药学院,山东烟台264005)
研究2种不同清开灵胶囊制剂中重要药效成分黄芩苷在大鼠体内的药代动力学特征,为清开灵制剂的临床合理应用提供科学依据.健康雄性大鼠随机分为2组,每组6只,分别灌胃给予清开灵胶囊和软胶囊,给药剂量按黄芩苷计均为60 mg/kg.于不同时间点采集血浆样品,HPLC法测定血浆中黄芩苷药物浓度,根据药-时曲线计算主要药动学参数,并比较组间差异.黄芩苷血浆药物浓度在0.05~10 μg/mL范围内呈线性关系,方法准确度与精密度良好,适用于血浆黄芩苷药物浓度测定.在相同给药剂量下,清开灵软胶囊和胶囊给药后大鼠血浆黄芩苷的Tmax分别为1.5±0.2 h、2.0±0.3 h,Cmax分别为1.72±0.24 μg/mL、1.10±0.16 μg/mL,AUC分别为11.76±1.53(mg/L)·h、7.58 ±0.89(mg/L)·h、MRT分别为7.25±0.88 h、5.10±0.69 h,均存在显著的组间差异(P<0.05).与硬胶囊制剂相比,清开灵软胶囊在大鼠体内的黄芩苷药动学上显示明显优势,可能是一种更具治疗优势的清开灵口服制剂.
清开灵;胶囊制剂;黄芩苷;药代动力学;高效液相色谱法
清开灵是在中医治疗急性热病传统处方“温病三宝”中的安宫牛黄丸配方基础上改良而成的纯中药复方制剂,由牛黄、水牛角、珍珠母、黄芩、桅子、金银花、板蓝根等7味中药组成.全方以苦寒、甘寒、咸寒并用,达到清热解毒、泻火除烦、化痰通络、醒神开窃之功效,主要用于外感热证、实证、痰热、癖血为主之病证,尤其对缺血性中风、急性上呼吸道感染、全身炎症反应综合征以及急救中毒等内科急症起效快,疗效显著,广泛应用于中医及中西医结合临床[1-2].
清开灵方在20世纪70年代首先以注射液成功研制,并成为国家首批公布的中药保护品种和急症必备中成药[3].2001年11月,国家药品不良反应监测中心首次通报了清开灵注射剂引起的过敏反应,随着临床应用不断扩展,其严重不良反应事件报告也日益增多[4-5].以提高安全性为目标的各种清开灵口服剂型研发因此引起广泛关注,目前已形成由口服液、颗粒、滴丸、分散片、泡腾片、胶囊、软胶囊等诸多口服制剂组成的清开灵产品系列[6],多为现行《中华人民共和国药典》(一部)[7]收载.其中,清开灵软胶囊是神威药业的独家品种.
尽管各种清开灵口服制剂组方基本相同,但辅料和生产工艺的不同,可能导致不同剂型在吸收、代谢、排泄以及作用机理和不良反应上的差异,临床使用也应随之调整.但目前这方面的研究较少,特别是不同口服剂型间药动学的比较研究尚未见文献报道.黄芩苷是清开灵方中含量最高的质量控制成分,也是其药效指标成分[8-10].本研究以其黄芩苷为对象,首次针对当前临床应用广泛的2种清开灵口服胶囊制剂——普通硬胶囊和软胶囊中黄芩苷的体内药代动力学过程进行比较,以期为清开灵口服新制剂的临床合理应用提供科学依据.
1 材料
Agilent 1100型高效液相色谱仪(美国,二元高压泵,VWD检测器),TGL-20M型台式高速冷冻离心机(湖南湘仪实验室仪器开发有限公司).
黄芩苷对照品、内标槲皮素均由中国药品生物制品检定所提供,纯度大于99.5%,清开灵胶囊(广州白云山明兴制药有限公司,每粒装0.25 g,含黄芩苷10 mg,批号:120956),清开灵软胶囊(神威药业有限公司,每粒装0.4 g,含黄芩苷20 mg,批号: 12032911),甲醇(色谱纯,北京百灵威科技有限公司),其余均为市售分析纯,实验用水为超纯水.
健康SD大鼠,雄性,体重220±20 g,山东绿叶制药有限公司实验动物中心提供,合格证号SYXK(鲁)20030020.
2 方法与结果
2.1 对照品及内标溶液配制
精密称取黄芩苷10 mg,用甲醇溶解定容制得1 mg/mL黄芩苷对照品溶液.同时精密称取内标槲皮素10 mg,用甲醇溶解定容,制得1 mg/mL槲皮素溶液.上述溶液置4℃冰箱保存,备用.对照品溶液在临用前用甲醇稀释,制备所需浓度的标准使用溶液.
2.2 血浆样品采集
SD大鼠随机分为两组,每组6只,给药前禁食12 h,自由饮水,分别灌胃给予清开灵胶囊和清开灵软胶囊内容物的0.5%CMC-Na混悬液,剂量以黄芩苷计均为60 mg/kg[11-12].分别于给药前及给药后0.083,0.25,0.5,1,1.5,2,3,4,6,8,12,24 h经眼眶静脉丛取血约0.3 mL,置肝素处理的离心管中,立即于4℃8 000 r/min离心10 min(当血浆样品采集的转速小于8 000 r/min时,上清液和沉淀分离效果不佳,上清液不容易吸取)[13-14].精确吸取上层血浆100 μL于EP管中,置-80℃冰箱中保存待测.
2.3 色谱条件
Agilent ZORBAX SB-C18色谱柱(250 mm× 4.6 mm,5 μm),柱温30℃,流动相甲醇-水(含0.2%磷酸)47∶53(V/V),流速1 mL/min,检测波长278 nm,进样量20 μL.
2.4 血浆样品预处理与专属性考察
取100 μL空白血浆,先后加入黄芩苷标准溶液和内标溶液各10 μL,涡旋震荡30 s,加入20 μL 3 mol/L HCl和100 μL乙腈,涡旋震荡1 min,超声1 min,12 000 r/min离心20 min,取上清液20 μL,按上述色谱条件进行HPLC分析.同法处理空白血浆、仅加入黄芩苷对照品的空白血浆以及给药大鼠血浆样品,分别测定并记录色谱图,如图1所示.结果表明,在所建立的色谱条件下,黄芩苷和槲皮素的色谱保留时间分别为13 min和18 min,二者分离度良好,且均不受血浆内源性物质的干扰,适用于含药血浆样品中黄芩苷血药浓度的测定.
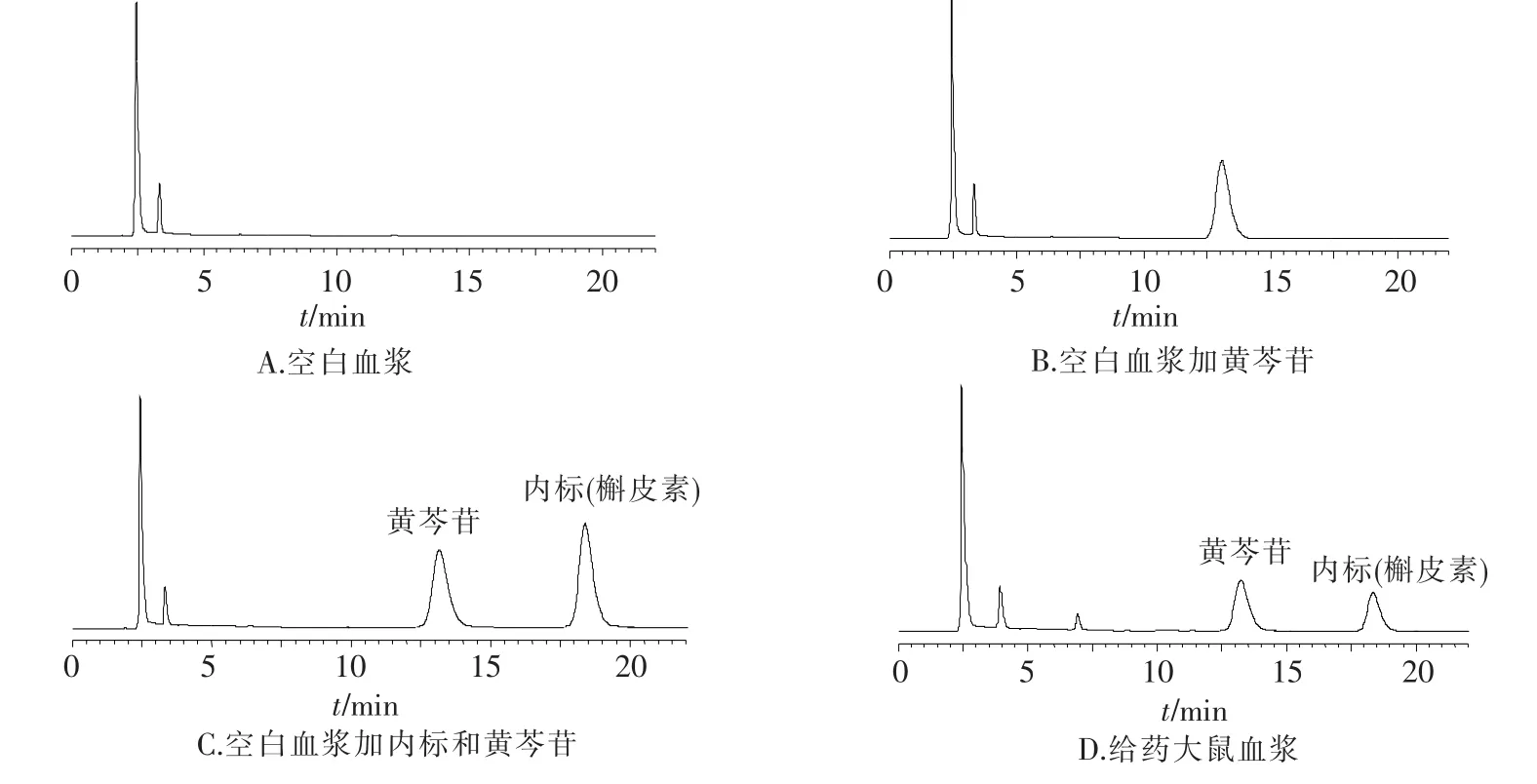
图1 HPLC法测定大鼠血浆黄芩苷药物浓度的典型色谱图Fig.1 Typical HPLC chromatograms for assay of baicalin in rat plasma
2.5 标准曲线与线性范围
取空白血浆100 μL,加入黄芩苷系列标准溶液10 μL,涡旋混匀,制成含黄芩苷分别为0.05,0.1,0.5,1.0,2.0,5.0,10 μg/mL的血浆样品,再加入10 μL内标溶液,然后按2.4项下方法处理后测定.以黄芩苷与内标的色谱峰面积比值Y对黄芩苷的血浆药物浓度X采用加权最小二乘法(1/X2为权)进行线性回归,得典型的回归方程为Y=27.018X+ 0.014(r=0.999 1).结果表明,黄芩苷的血浆药物浓度在0.05~10 μg/mL范围内线性关系良好,最低检出限和最低定量限分别为0.015 μg/mL、0.05 μg/mL.
2.6 回收率试验
取空白大鼠血浆100 μL,加入黄芩苷对照品溶液10 μL,分别配制低(0.1 μg/mL)、中(1 μg/mL)、高(10 μg/mL)浓度的质控(QC)样品各6份,按2.4项下方法处理后测定黄芩苷的色谱峰面积,并与未经提取处理的相同浓度黄芩苷标准溶液的色谱峰面积相比,计算得3个浓度下血浆中黄芩苷的提取回收率分别为(89.5±3.0)%、(93.3±2.1)%、(91.6±1.4)%.结果表明,所建立的样品处理方法对血浆中黄芩苷具有稳定较高的提取回收率,适用于黄芩苷血药浓度测定的样品处理.
2.7 精密度试验
取空白大鼠血浆100 μL,加入黄芩苷对照品溶液10 μL,分别配制低(0.1 μg/mL)、中(1 μg/mL)、高(10 μg/mL)浓度的QC样品,按2.4项下方法处理后测定,根据随行标准曲线计算浓度.在同1 d内分别测定5次,计算日内精密度;每天测定一次,连续测定5 d,计算日间精密度.结果日内、日间RSD均小于5%,符合生物样品测定要求.
2.8 准确度试验
取空白大鼠血浆100 μL,加入黄芩苷对照品溶液10 μL,分别配制低(0.1 μg/mL)、中(1 μg/mL)、高(10 μg/mL)浓度的QC样品各6份,按2.4项下方法处理后测定,根据随行标准曲线计算浓度,并计算浓度测定值与理论值的比值,即相对回收率.结果低、中、高3个质量浓度的相对回收率分别为(101.5 ±3.4)%、(100.2±2.5)%、(98.9±2.7)%,均在85%~115%范围内,表明准确度符合生物样品测定要求.
2.9 稳定性试验
取空白大鼠血浆100 μL,加入黄芩苷对照品溶液10 μL,分别配制低(0.1 μg/mL)、中(1 μg/mL)、高(10 μg/mL)浓度的QC样品各3份,分别于室温下放置12 h、-20℃冷冻保存7 d、-20℃冷冻保存24 h后室温融化,然后按2.4项下方法处理后测定,根据随行标准曲线计算浓度,重复操作3次.结果浓度测定值与理论值间的相对偏差(RE)<5%,表明黄芩苷含药血浆样品在上述条件下保存和测定是可行的.
2.10 药时曲线及药动学参数
2组大鼠在分别灌胃给予清开灵胶囊和清开灵软胶囊后,将各时间点采集的血浆样品按2.4项下方法处理后测定,根据随行标准曲线计算黄芩苷的血药浓度,绘制平均血药浓度-时间曲线,结果见图2.进一步采用DAS2.1药动学软件对黄芩苷的血药浓度-时间数据进行分析,计算主要药动学参数,并采用t检验法进行组间差异比较,结果见表1.

图2 SD大鼠灌胃不同清开灵胶囊制剂的黄芩苷血浆药-时曲线(n=6)Fig.2 Plasma baicalin concentration-time curve in rats by intragastric administration of different Qingkailing capsules(n=6)
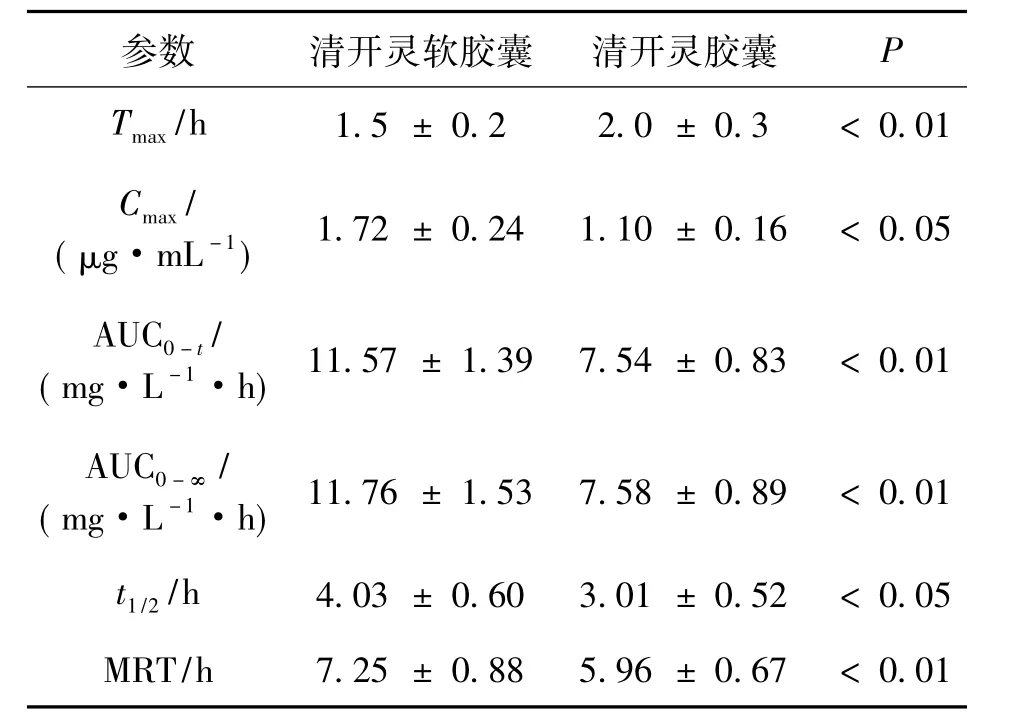
表1 SD大鼠灌胃不同清开灵胶囊制剂的黄芩苷动力学参数(Mean±SD,n=6)Tab.1 Pharmacokinetic parameters of baicalin by intragastric administration different capsule to SD rats (Mean±SD,n=6)
3 讨论
3.1 血浆样品的保存与处理方法
黄芩苷化学性质不稳定,其分子结构中的苷键易水解、邻二酚羟基易氧化,这些反应在弱酸性条件下被抑制,在碱性及高温条件下则被催化[15].黄芩苷在有机溶剂中稳定,但在血浆、磷酸缓冲盐的组织匀浆液等生物样品中不稳定[8].因此,本研究选择在血样采集后立即于低温(4℃)下离心分离血浆,并置-80℃冰箱中保存,以保证含药血浆中黄芩苷的稳定性.
在溶解性上,黄芩苷易溶于甲醇、乙腈和乙酸乙酯[16].因此,本研究以回收率为指标,分别考察了蛋白沉淀法(甲醇、乙腈)和乙酸乙酯溶剂萃取法对血浆样品分析前的预处理效果.结果发现,乙酸乙酯萃取处理的黄芩苷提取回收率较低(<50%),且随血浆药物浓度变化有较大波动;采用甲醇沉淀蛋白时,内源性物质对分析物和内标的色谱峰有明显的干扰,特别对于低浓度样品的测定结果有较大影响;当用乙腈沉淀时,血浆的内源性物质几乎无干扰.因此,本研究选择以乙腈沉淀蛋白处理血浆样品,并提前加入适量HCl溶液,以提高蛋白沉淀效率,同时维持酸性环境以保证血浆中黄芩苷的稳定性.进一步的方法学考察结果显示,本研究建立的血浆样品保存和处理方法,在稳定性、回收率和准确度等指标上均符合药典对于生物样品测定的要求,适用于血浆黄芩苷药物浓度测定.
3.2 2种清开灵胶囊制剂的药动学特征
近年来开发上市了多种清开灵口服制剂,其中,胶囊剂包括有普通的硬胶囊和软胶囊.本研究以清开灵方中的质量控制和药效指标成分黄芩苷为对象,首次测定了灌胃给予清开灵胶囊和软胶囊的大鼠血浆药物浓度经时变化,并分析了二者的药动学差异.结果显示,从药时曲线和主要药动学学参数可知,黄芩苷在SD大鼠内的药动学行为符合二室开放模型.在相同的黄芩苷给药剂量下(60 mg/kg),软胶囊组大鼠血浆的峰值药物浓度(Cmax)、药-时曲线下面积(AUC)以及平均驻留时间(MRT)均明显高于胶囊组,而达峰时间(tmax)低于胶囊组,且各参数的组间差异具有统计学意义(P<0.05).这一结果表明,清开灵软胶囊在主要药效成分黄芩苷上具有明显优于普通硬胶囊制剂的药动学特征.软胶囊与硬胶囊相比,制备工艺先进,为棕褐色粘稠状混悬油状液(脂溶性物),体现为吸收更快,吸收程度更高,体内驻留时间更长,在临床应用时可能起效更快,药效更强且更为持久,因而可能是一种更具治疗优势的清开灵口服制剂.
清开灵是一种多组分中药复方制剂,方中胆酸猪、去氧胆酸清热镇惊开窍,水牛角、珍珠母解热镇静安神,金银花、栀子、板蓝根、黄芩清热解毒除烦,诸药相加,共奏良效.按照君臣佐使的中药组方理论,胆酸、异去氧胆酸等胆汁酸成分为方中君药,也是除黄芩苷外的主要药效成分[17].因此,对于清开灵软胶囊的药动学及潜在的治疗优势,后续尚有必要就胆汁酸、栀子苷等其他药效成分开展进一步的验证研究,并在此基础上进行人体药动学的比较研究,以期为清开灵口服新制剂的临床合理应用提供切实可靠的科学依据.
[1]邓玲玲,田莉,王洪才.安宫牛黄丸及其演化方剂的临床研究进展[J].中国实验方剂学杂志,2010,16(12): 215-219.
[2]徐孝麟.清开灵制剂的临床应用进展[J].中国实用医药,2007,2(28):101-102.
[3]张桂芝,陈豪君.清开灵在中医内科急症的临床应用[J].实用医学杂志,1994,10(2):153-154.
[4]国家药品不良反应监测中心,国家食品药品监督管理局药品评价中心.警惕清开灵注射剂严重不良反应[J].中国执业药师,2009,6(5):22-23.
[5]王芬.清开灵注射液在临床应用中的不良反应[J].中国药物警戒,2011,8(8):495-497.
[6]钟月平.不同剂型的清开灵药物研究[J].中国现代药物应用,2009,3(19):192-194.
[7]国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2010.
[8]肖兰,王峰,李焕德,等.清开灵注射液中黄芩苷在大鼠体内代谢动力学的研究[J].中国中药杂志,2007,32 (23):2534-2538.
[9]张妙媛,姚金成,赵绪元,等.清开灵不同制剂的高效液相指纹特征比较[J].时珍国医国药,2007,18(2): 442-444.
[10]李玲玲,赵兰芬.清开灵不同制剂中黄芩苷的含量测定[J].药物分析杂志,2011,31(5):950-953.
[11]邢杰.黄芩苷在动物体内的吸收和代谢研究[D].沈阳:沈阳药科大学,2005.
[12]杨新建,王雷,王学艳.黄芩苷滴丸的体内药动学研究[J].中国医院药学杂志,2006,26(4):445-447.
[13]郭慧娟,任淑萌,李艳荣,等.功劳去火片中黄芩苷和小檗碱在大鼠体内的药物动力学[J].华西药学杂志,2009,24(1):56-58.
[14]黄萍,高静雯,邹佳丽,等.大黄黄连泻心汤不同配伍下黄芩苷和汉黄芩苷在大鼠体内的药动学比较研究[J].世界科学技术-中医药现代化,2012,14(2):1445-1450.
[15]于波涛,张志荣,刘文胜,等.黄芩苷稳定性研究[J].中草药,2002,33(3):218-220.
[16]鞠解奇.清开灵片中黄芩苷体内药代动力学研究[J].国际中医中药杂志,2011,33(12):1104-1107.
[17]张加余,张倩,张红霞,等.清开灵注射液中14种胆汁酸的HPLC-ESI-MS/MS快速鉴定[J].中国中药杂志,2013,38(7):990-994.
Pharmacokinetics of Baicalin from Qingkailing Hard Capsules and Soft Capsules in Rats
ZHANG Jing-yue,JIANG Yun-xia,LIU Hui,CHEN Qiu-yu,GAI Cong-hao,XU Hui
(School of Pharmacy,Yantai University,Shandong,Yantai 264005,China)
The pharmacokinetic properties of baicalin from Qingkailing soft capsules and hard capsules in rats are investigated.Healthy male SD rats are randomly divided into two groups(n=6).Through intragastric administration,the animals receive a single oral dose of Qingkailing soft and hard capsules,respectively(both equivalent to 60 mg·kg-1baicalin).Plasma samples are collected at different time points and the concentrations of baicalin in plasma are determined using HPLC method.Pharmacokinetic parameters are calculated according to the plasma concentration versus time profiles,and then the difference in these parameters between groups is statistically analyzed using student’s t-test.The results show that the HPLC assay has a linear range of 0.05 to 10 μg·mL-1baicalin in rat plasma,suggesting satisfied precision and accuracy for the quantification of baicalin in rat plasma.At the same dosage,the main pharmacokinetic parameters of baicalin are Tmax1.5±0.2 h and 2.0±0.3 h,Cmax1.72±0.24 μg/mL and 1.10±0.16 μg/mL,AUC 11.76±1.53(mg/L)·h and 7.58±0.89(mg/L)· h,and MRT 7.25±0.88 h and 5.10±0.69 h for the rats administered Qingkailing soft capsule and hard capsules,respectively.There are statistically significant differences in all these parameters between the two groups(P<0.05).Compared with Qingkailing hard capsules,Qingkailing soft capsules distribute obvious pahramcokinetic advantages of baicalin in rats,thus may be more appropriate for therapeutic use.
Qingkailing preparation;capsule;baicalin;pharmacokinetics;high-performace liquid chromatography (HPLC)
R285.5
A
(责任编辑 周雪莹)
1004-8820(2015)02-0103-05
10.13951/j.cnki.37-1213/n.2015.02.005
2014-08-23
烟台大学学生科技创新基金项目(131406).
张靖悦(1990-),女,吉林松源人,硕士研究生.
许卉(xuhui33@sina.com),教授,博士,研究方向:中药药效物质基础及代谢研究.

