肝尾叶血管平滑肌脂肪瘤1例报告
胥 楠,姚辉华,杨 厄,杨 洁
(成都市第一人民医院普外科, 四川 成都 610041)
肝尾叶血管平滑肌脂肪瘤1例报告
胥 楠,姚辉华,杨 厄,杨 洁
(成都市第一人民医院普外科, 四川 成都 610041)
患者,男,63岁。因“反复右上腹胀痛不适1年”于2013年3月18日入院。入院后腹部彩超检查提示:肝门部查见一大小约4.5 cm×4.3 cm×5.6 cm稍弱回声团块。行上腹部磁共振检查提示:肝肾间隙一大小约67 mm×55 mm肿块,边界清,周围部分结构受推挤。考虑肿瘤性病变,腹膜后肿瘤待排(图1)。血常规、血生化均无异常,AFP、CEA、CA125、CA19-9值均正常,HBsAg(-)、HBsAb(+)、HBeAg(-)、HBeAb(-)、HBcAb(-)。经完善术前准备后行剖腹探查,术中发现胆囊三角后方可见一直径约5 cm类圆形质软包块,包块呈暗红色,表面有血管怒张。包块呈膨胀性生长,与周围组织轻度粘连。包块内侧紧贴胆总管右缘及门静脉主干前方,其上缘位于肝脏尾状突(图2)。术中超声确定肿瘤未侵犯第三肝门。行肝尾叶肿瘤切除术。术中未行第一肝门阻断,失血约800 ml,未输血,手术持续时间约3.8 h。术后经过平稳,无出血、胆漏等并发症发生,术后14天痊愈出院。随访26个月未见局部肿瘤复发征象。术后病检显示肿瘤多数为实性片状上皮样细胞与不等量的成熟脂肪细胞区域和血管成分呈地图样穿插排列,大部分血管呈薄壁血窦状,偶见厚壁畸形血管伴部分透明变性(图3)。免疫组化结果:肿瘤平滑肌样细胞HMB-45(+),平滑肌肌动蛋白SMA(+),S-100(+),CD68(+),PCK(-)。最后诊断肝脏血管平滑肌脂肪瘤(HAML)。
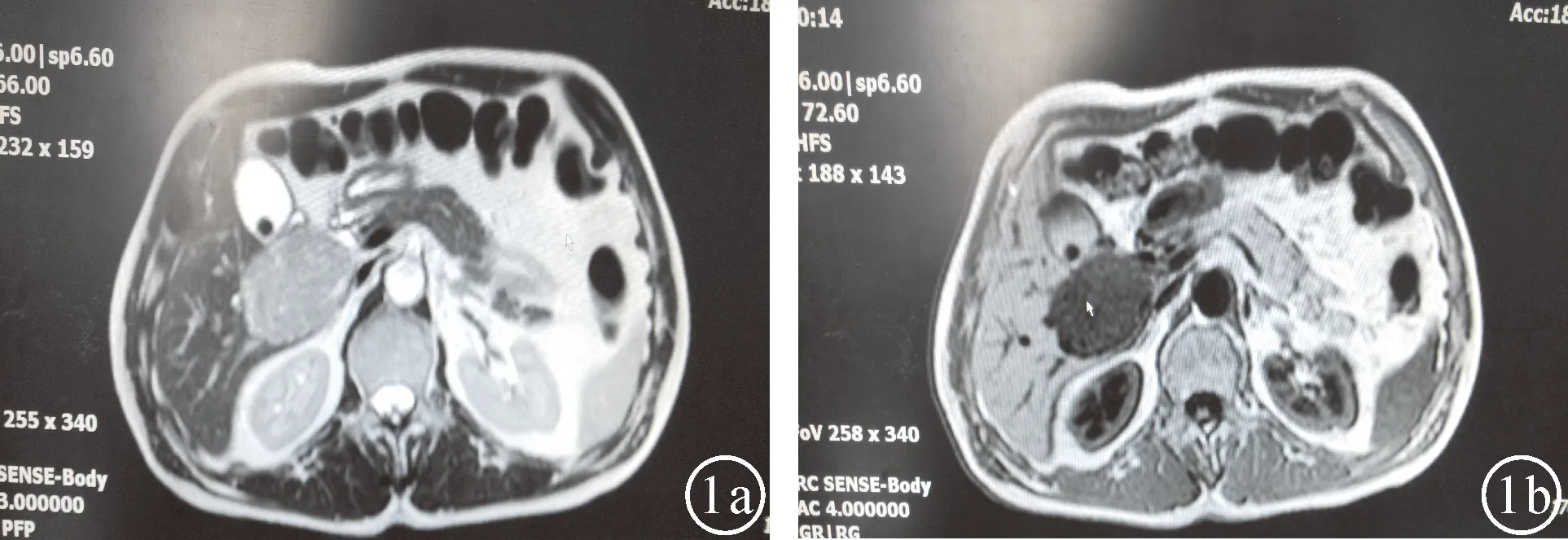
图1 肝尾叶血管平滑肌脂肪瘤MRI影像 a.MRI显像T1WI SE序列肿瘤显示高信号,其内似有不均匀增强信号;b.MRI显像T2WI压脂序列肿瘤显示低信号
讨论 HAML是一种少见的肝脏良性肿瘤,好发于中年女性,男、女发病比例约为1∶3[2~4]。肿瘤多为单发,以发生在右肝为主。发生在肝尾状叶的HAML占总体比例极少[2,4]。肝血管平滑肌脂肪瘤由于其缓慢发展的特性,一般无明显特征性临床症状。按厚壁血管、平滑肌细胞和脂肪细胞在肿瘤组织中所占的比例及分布,HAML可分为经典型或混合型、肌瘤型(脂肪成分≤10%)、脂肪瘤型(脂肪成分≥70%)和血管型4个亚型.肌瘤型又进一步按其细胞形态细分为上皮样细胞型、中间细胞型、梭形细胞型、嗜酸细胞型及多形细胞型[3]。肌瘤型临床上最易误诊为肝细胞性肝癌。截至目前,国内外共计约400余例病例报道,国内最大宗的病例分析报告来自2009年对第二军医大学东方肝胆外科医院经术后病理证实确诊为HAML的79例病历资料[4]。

图2 肝尾叶血管平滑肌脂肪瘤手术图 术中见肿瘤位于肝脏尾叶,富血供
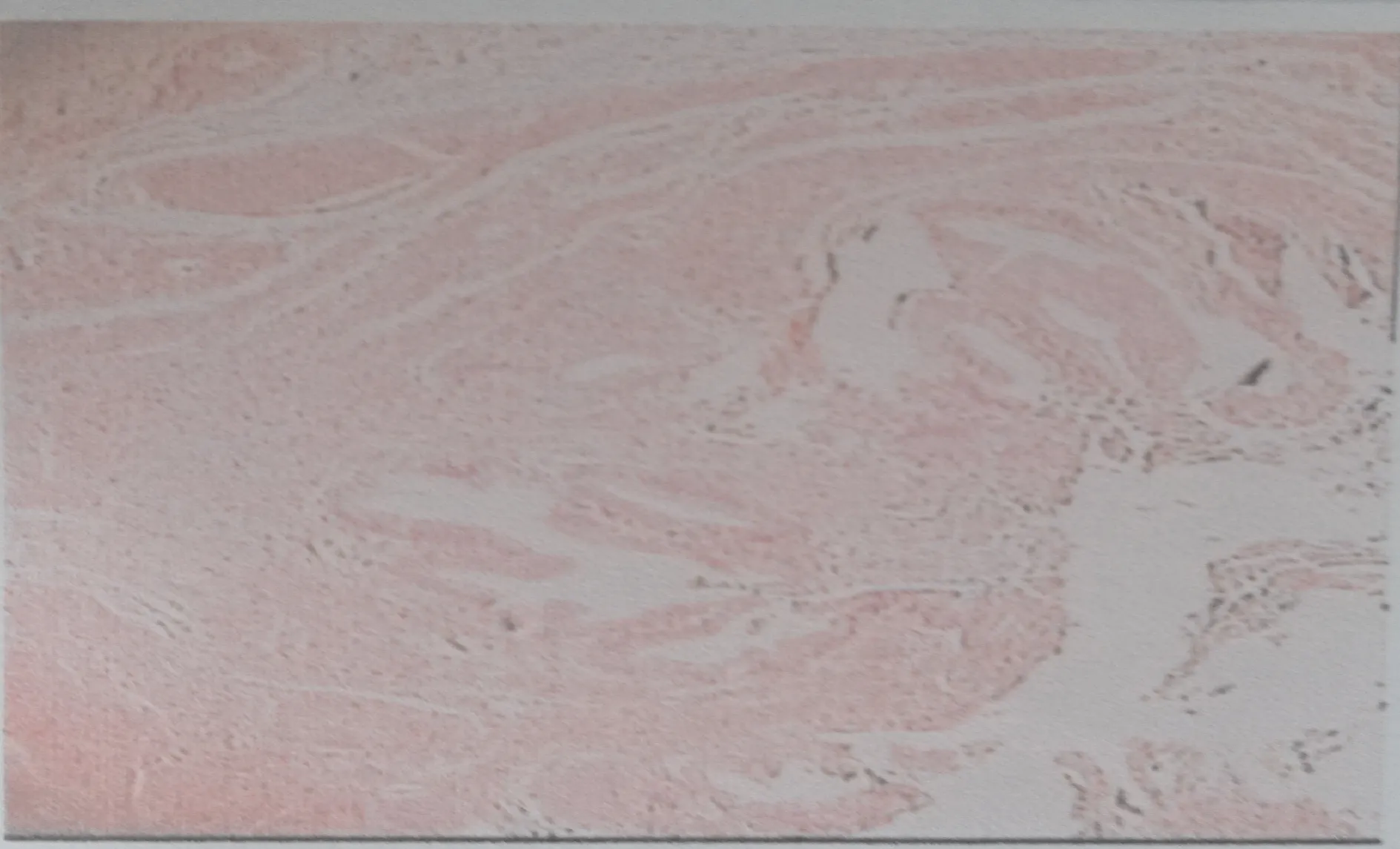
图3 肝尾叶血管平滑肌脂肪瘤镜下图像 可见厚壁血管、成熟脂肪细胞及平滑肌组织(HE染色,х40)
HAML影像学表现多种多样,术前明确诊断多较困难。超声检查敏感性高但特异性较低。本例中超声显示为低回声团块提示非富血管成分居多。超声造影可能有较多鉴别信息提供[5]。目前术前明确诊断方法主要依靠腹部增强CT或MRI检查。不同的病理类型CT影像表现有显著区别[6]。磁共振诊断HAML亦受到肿瘤内成分不同的影响。肝内的脂肪成分是其特征性的表现之一。在T1加权像和T2加权像中肿瘤均可显示高信号,如果利用脂肪抑制技术或反相位扫描技术则可呈现出低信号[7]。MRI增强扫描可显示HAML强化峰值事时间晚于原发性肝癌而又早于肝海绵状血管瘤,同时它的强化持续时间>4 min,长于原发性肝癌[8]。因此,动态增强MRI有助于鉴别HAML与其他富血管肿瘤。HMB-45是抗人黑色素特异性抗体,是诊断HAML的可靠依据。大多数的肝血管平滑肌脂肪瘤在免疫组化检查时均显示HMB-45阳性特征[2~4]。其他的相关分子标记物如SMA、HMSA5、MART-1、HMB-50以及CD63(NKI/C3)也在部分HAML肿瘤中有所表达。
HAML的组织发生机制尚不清楚,既往认为肿瘤生长缓慢且发生癌变机率较低,但部分个案病例报告显示HAML具有恶性转变潜能[9],且具有自发性破裂出血可能,尤其是较大肝脏占位时,由于其内血管、平滑肌、脂肪组织构成比例发生变化,可合并瘤内坏死出血[10]。因此,HAML不是一种稳定性病变,对于诊断明确的HAML应积极手术治疗。
对于肿瘤直径小于5 cm的HAML可密切随访观察,对于短期内肿瘤迅速增大或肿瘤出现血管或周围组织浸润性生长的则需积极手术治疗。手术方式以局部切除为主,切除范围包括全部肿瘤及其周围部分正常肝脏组织。切缘定位可依据术中超声确定,避免肿瘤组织残留及复发。经根治性手术切除后,绝大多数患者能够获得满意的长期生存。本例患者术后随访2年余未见肿瘤复发。
[1] Ishak KG.Hepatocellular carcinoma[M].New York, NY: John Wiley & Sons, 1976:247-307.
[2] Hoffman AL, Emre S, Verham RP, et al.Hepatic angiomyolipoma: two case reports of caudate-based lesions and review of the literature[J].Liver Transpl Surg, 1997,3(1):46-53.
[3] Tsui WM, Colombari R, Partmann BC, et al.Hepatic angiomyolipoma: a clinicopathologic study of 30 cases and delineation of unusual morphologic variants[J].Am J Surg Pathol, 1999,23(1):34-48.
[4] 丁光辉, 吴孟超, 杨广顺, 等.肝脏血管平滑肌脂肪瘤的诊断和治疗[J].第二军医大学学报, 2010,31(6):615-620.
[5] Li T, Wang L, Yu HH, et al.Hepatic angiomyolipoma: a retrospective study of 25 cases[J].Surg Today, 2008,38(6):529-535.
[6] Yang B, Chen WH, Li QY, et al.Hepatic angiomyolipoma:dynamic computed tomography features and clinical correlation[J].World J Gastroenterol, 2009,15(27):3417-3420.
[7] 袁湘芝, 李建策, 单云峰.肝脏血管平滑肌脂肪瘤的MRI表现[J].温州医学院学报, 2005,35(4):315-317.
[8] Ahmadi T, Itai Y, Takahashi M, et al.Angiomyolipoma of the liver:significance of CT and MR dynamic study[J].Abdom Imaging, 1998,23(5):520-526.
[9] Dalle L, Sciot R, de Vos R, et al.Malignant angiomyolipoma of the liver: a hitherto unreported variant[J].Histopathology, 2000,36(5):443-450.
[10] Guidi G, Catalano O, Rotondo A.Spontaneous rupture of a hepatic angiomyolipoma:CT findings and literature review[J].Eur Radiol,1997,7(3):335-337.
R604
D
1672-6170(2015)05-0250-02
2015-06-01)

