高浓度铀胁迫对植物叶绿素荧光特性的影响
李华丽+唐永金+曾峰
摘要:在含500 mg/kg铀的核素溶液和清水浇施(CK)的土壤中,分别种植水花生、菊苣、木耳菜、黄秋葵和灰灰菜,出苗后65~70 d测定叶绿素荧光参数和快速光合曲线参数。结果表明,铀胁迫能降低植物PSⅡ的最大光化学效率(Fv/Fm),提高最低荧光F0;高浓度铀能胁迫降低植物的快速光曲线初始斜率α、最大相对电子传递速率ETRmax和半饱和光强Ik,极显著降低ETRmax;铀胁迫对不同植物荧光特性有不同的响应,在铀胁迫下,灰灰菜的Fv/Fm略有增加,而菊苣和黄秋葵显著下降。
关键词:铀;胁迫;植物;叶绿素;荧光特性;响应
中图分类号: Q945.78;Q945.11 文献标志码: A
文章编号:1002-1302(2015)04-0360-03
收稿日期:2014-06-06
基金项目:国防基础重点科研(编号:B3120110001)。
作者简介:李华丽(1989—),女,硕士,从事环境污染生物修复研究。
通信作者:唐永金,教授,从事核污染环境的植物修复研究。E-mail:tangyongjin@swust.edu.cn。
叶绿素荧光常被用来评估植物受环境胁迫的效应[1],目前在评鉴植物耐旱力、辐射、热冷害、涝害、酸雨、盐胁迫、重金属等方面[2-18]有不少研究。铀(U)是核武器、核电站等的重要材料,铀矿开采形成的铀尾矿库和铀加工排除的铀废物会影响植物的生长发育,有研究表明,铀既能影响植物种子萌发、幼苗生长和酶活性[19-21],也能影响植物叶绿素含量、植株体积大小等[22]。目前,铀对植物叶绿素荧光特性影响未见报道。本试验主要探讨植物被高浓度铀土壤污染后叶绿素荧光特性的影响,以探寻高浓度铀对植物光合作用的影响机理,为植物治理土壤铀污染提供科学依据。
1 材料与方法
1.1 试验材料
供试植物有水花生[Alternanthera philoxeroides (Mart.) Griseb.]、菊苣(Cichorium intybus L.)、木耳菜[Gynura cusimbua (D. Don) S. Moore]、黄秋葵(Hibiscus esulentus L.)和灰灰菜(Chenopodium album L.);试验药剂有UO2(CH3CO2)2·2H2O,分析纯;试验土壤为农田紫色壤土,土 ∶ 水为1 ∶ 1时pH 值为7.5,有机质含量31.6 g/kg,全氮、全磷、全钾的含量分别为2.57、0.985、17.9 g/kg,碱解氮、有效磷和速效钾含量分别为302、33、288 mg/kg。
1.2 试验方法
试验于2011年3月5日进行,土壤过1.4 cm筛,装盆,每盆装1 kg干土,分别浇施含500 mg/kg U的核素溶液 340 mL,以浇施清水为CK,使土壤刚好达到饱和持水量;在阴凉处放置8周[23],经土壤充分吸附,于5月1日分别播种5种植物,水花生种植地下茎,重复3次;出苗后2周进行定苗,使得6株/盆;每隔1~2 d浇水1次,保持土壤湿度为田间持水量的60%~70%;7月16日测量叶绿素荧光。
1.3 测定方法
用德国产Dual-PAM-100荧光仪,根据说明书和文献[6]的方法,暗处理20 min,测定植物倒3张展开叶叶片PSⅡ的最小荧光(F0)、暗下最大荧光(Fm)、最大光化学效率(Fv/Fm)、半饱和光强(Ik)、快速光曲线的初始斜率(α)和相对最大电子传递速率(ETRmax),重复3次,各参数生物学意义参见文献[6,24-25]。
1.4 数据分析
由Excel、DPS 9.50软件对数据进行统计分析。
2 结果与分析
2.1 高浓度铀胁迫对植物叶绿素荧光F0、Fm和Fv/Fm的影响
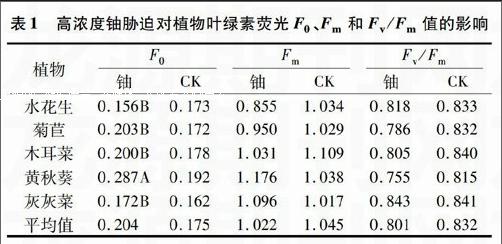
2.1.1 高浓度铀胁迫对植物F0和Fm的影响 由表1可知,高浓度铀使植物的F0平均提高16.57%,但水花生的F0降低了;高浓度铀使植物Fm平均降低2.20%,但黄秋葵和灰灰菜均有所增加;黄秋葵与其他植物之间的F0差异极显著,其他植物之间差异不显著;水花生的Fm 明显低于黄秋葵和灰灰菜。方差分析表明,铀对植物的F0影响极显著(F=12.14>F0.01=8.28),但对Fm影响不显著(F=0.93F0.01=458,F=515>F0.01=4.58)、Fm(F=5.61>F0.01=4.58,F=5.45>F0.01=4.58)影响极显著。
表1 高浓度铀胁迫对植物叶绿素荧光F0、Fm和Fv/Fm值的影响
植物
F0 Fm Fv/Fm
铀 CK 铀 CK 铀 CK
水花生 0.156B 0.173 0.855 1.034 0.818 0.833
菊苣 0.203B 0.172 0.950 1.029 0.786 0.832
木耳菜 0.200B 0.178 1.031 1.109 0.805 0.840
黄秋葵 0.287A 0.192 1.176 1.038 0.755 0.815
灰灰菜 0.172B 0.162 1.096 1.017 0.843 0.841
平均值 0.204 0.175 1.022 1.045 0.801 0.832
注:同列数据后不同大写字母表示处理间差异极显著。
2.1.2 高浓度铀胁迫对植物Fv/Fm的影响 Fv/Fm表示最大光化学效率,反映植物PSⅡ光合中心内禀光能转换效率[6],是评价植物遭受胁迫的最重要指标。由表1可知,植物在高浓度铀胁迫下,Fv/Fm平均下降3.73%,但灰灰菜略有提高,黄秋葵明显低于其他植物。方差分析结果表明,铀胁迫、不同植物对Fv/Fm影响极显著(F=18.38>F0.01=8.28,F=7.04>F0.01=4.58),但核素和植物的互作影响不显著(F=2.34 2.2 高浓度铀胁迫对植物快速光曲线拟合参数的影响endprint
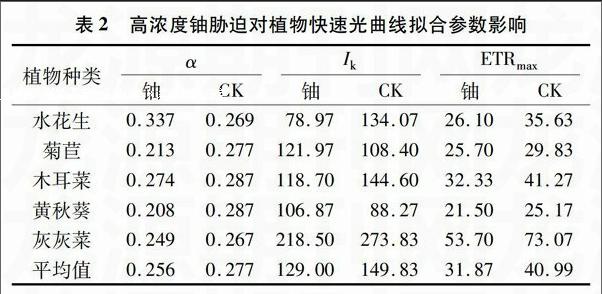
2.2.1 高浓度铀胁迫对植物α的影响 快速光曲线的初始斜率可以对植物的光能利用效率进行评价。由表2可知,在高浓度铀胁迫下,植物平均初始斜率降低7.58%,但水花生却增加25.28%,明显高于菊苣和黄秋葵。方差分析结果表明,铀胁迫对α的影响接近显著(F=4.34F0.05=2.93),二者互作对α影响极显著(F=6.17>F0.01=4.58)。
表2 高浓度铀胁迫对植物快速光曲线拟合参数影响
植物种类
α Ik ETRmax
铀 CK 铀 CK 铀 CK
水花生 0.337 0.269 78.97 134.07 26.10 35.63
菊苣 0.213 0.277 121.97 108.40 25.70 29.83
木耳菜 0.274 0.287 118.70 144.60 32.33 41.27
黄秋葵 0.208 0.287 106.87 88.27 21.50 25.17
灰灰菜 0.249 0.267 218.50 273.83 53.70 73.07
平均值 0.256 0.277 129.00 149.83 31.87 40.99
2.2.2 高浓度铀胁迫对植物Ik的影响 植物光合作用的半饱和光强反映植物对光强的耐受能力。由表2可知,在高浓度铀胁迫下,5种植物的Ik都发生了变化,黄秋葵Ik提高,其他植物降低,5种植物Ik平均降低13.90%。这说明高浓度铀会使植物在强光下的光合作用减弱,但黄秋葵例外。方差分析结果表明,核素对Ik影响不显著(F=3.53F0.01=4.58),互作影响不显著(F=2.09 2.2.3 高浓度铀胁迫对植物ETRmax的影响 最大相对电子传递速率可以评价植物的光合电子传递能力。由表2可知,在高浓度铀胁迫下,5种植物ETRmax均有所降低,平均降低2225%。铀和植物对ETRmax均影响极显著(F=1765>F0.01=8.28,F=42.56>F0.01=4.58 ),但互作影响不显著(F=169 3 结论与讨论
有研究表明,土壤铀含量在200 mg/kg以上时能使植物叶色变淡、茎叶变小[22],在250 mg/kg以上时就对陆生植物产生化学毒害[26];铀浓度超过50.0 mg/L时,对蚕豆种子萌发率、胚根生长、SOD 和 CAT 活性均有抑制作用[19];高浓度铀溶液抑制大豆主根生长,≥100 μmol/L铀溶液会抑制大豆POD 活性[20];在100%的铀尾沙处理下,油菜幼苗叶绿素含量降低,且叶片MDA含量明显升高[21]。本试验结果表明,在含500 mg/kg 铀的土壤中,植物F0提高,Fm、Fv/Fm、α、Ik和ETRmax降低,不同植物的表现有所不同。U和Cu、Cd[16-17]一样,会影响植物的叶绿素荧光特性。
Fv=Fm-F0,F0的提高或Fm的下降会导致Fv和Fv/Fm的下降。俞慧娜等研究发现,铝胁迫使Fv/Fm下降,是提高F0和降低Fm的共同结果[18]。本研究结果表明,铀胁迫使植物的最大光化学效率(Fv/Fm)降低,主要是最低荧光(F0)提高所致,这与香蕉缺水[5]、向日葵盐害[14]使Fm下降导致Fv/Fm下降有所不同。
铀胁迫对植物α的影响与植物种类密切相关,不同植物在铀胁迫下的光能利用效率差异很大,水花生增加,菊苣和黄秋葵下降。有研究表明,盐胁迫使番茄幼苗光合电子传递速率(ETR)降低[27];UV-B辐射胁迫使大豆最大相对电子传递速率Pm(即ETRmax)、半饱和光强Ik显著下降[6]。本研究结果表明,铀对植物ETRmax和Ik均有降低作用,对ETRmax的降低极其显著。
Santos 等认为,盐(NaCl)胁迫能抑制向日葵5-氨基酮戊酸即叶绿素前体的合成,从而显著影响叶绿素的合成[14]。Rau等利用EEL-光谱测定结果表明,铜危害水藓是因为铜和细胞质中的SH-基团形成螯合铜,并在液泡中与磷酸盐一起沉淀[16],这可能会影响叶绿素荧光参数的变化。Ouzounidou指出,Cu对PSⅡ质体醌受体的减少有影响,这种影响也许与Fv变化有关[28]。李涵茂等认为,UV-B辐射胁迫使大豆电子传递能力下降的可能原因是破坏了电子醌受体功能、酪氨酸氧化还原能力、放氧化合物及D1蛋白[6]。铀胁迫引起植物叶绿素荧光参数的变化,可能与某个或多个原因有关,例如光合机构被破坏,这可能是导致最低荧光(F0)提高的重要原因[25]。
植物叶绿素荧光参数变化可能会导致不同的后果。在高硼浓度下,植物叶片光合活性降低,在PSⅡ水平上过度激发能量散失减少[29],使叶绿素荧光降低严重形成叶斑。Maksymiec等研究认为,红花菜豆在铜胁迫下,因PSⅡ稳定性丧失,引起Cu在功能位点负向行为增加,从而降低了光合机构的活性,使光合作用暗期酶的活性受到抑制[17],严重时会导致植物死亡。本研究结果表明,铀胁迫严重威胁植物存活,在高浓度铀胁迫下,即使植物存活下来,植物的最大光化学效率(Fv/Fm)等荧光特性也会降低,从而使植物生物产量显著下降。
参考文献:
[1]Shangguan Z P,Shao M G,Dyckmans J. Effects of nitrogen nutrition and water deficit on net photosynthetic rate and chlorophyll fluorescence in winter wheat[J]. Journal of Plant Physiology,2000,156(1):46-51.
[2]Li R H,Guo P P,Baum M,et al. Evaluation of chlorophyll content and fluorescence parameters as indicators of drought tolerance in barley[J]. Agricultural Sciences in China,2006,5(10):751-757.endprint
[3]Faraloni C,Cutino I,Petruccelli R,et al. Chlorophyll fluorescence technique as a rapid tool for in vitro screening of olivecultivars (Olea europaea L.) tolerant to drought stress[J]. Environmental and Experimental Botany,2011,73:49-56.
[4]Ow L F,Yeo T Y,Sim E K. Identification of drought-tolerant plants for roadside greening—an evaluation of chlorophyll fluorescence as an indicator to screen for drought tolerance[J]. Urban Forestry & Urban Greening,2011,10(3):177-184.
[5]Tomas D S,Turner D W. Banana(Musa sp.) leaf gas exchange and chlorophyll fluorescence in response to soil drought,shading,and lamina folding[J]. Scientia Horticulturae,2001,90(1/2):93-108.
[6]李涵茂,胡正华,杨燕萍,等. UV-B辐射增强对大豆叶绿素荧光特性的影响[J]. 环境科学,2009,30(12):3669-3675.
[7]Petkova V,Denev I D,Cholakov D,et al. Field screening for heat tolerant common bean cultivars(Phaseolus vulgaris L.) by measuring of chlorophyll fluorescence induction parameters[J]. Scientia Horticulturae,2007,111(2):101-106.
[8]Meir S,Ronen R,Lurie S,et al. Assessment of chilling injury during storage:chlorophyll fluorescence characteristics of chilling-susceptible and triazole-induced chilling tolerant basil leaves[J]. Postharvest Biology and Technology,1997,10(3):213-220.
[9]Panda D,Sharma S G,Sarkar R K. Chlorophyll fluorescence parameters,CO2 photosynthetic rate and regeneration capacity as a result of complete submergence and subsequent re-emergence in rice (Oryza sativa L.)[J]. Aquatic Botany,2008,88(2):127-133.
[10]Mielke M S,de Almeida A F,Gomes F P,et al. Leaf gas exchange,chlorophyll fluorescence and growth responses of Genipa americana seedlings to soil flooding[J]. Environmental and Experimental Botany,2003,50(3) 221-231.
[11]Siffel P,Braunova Z,Sindelkova E,et al .The effect of simulated acid rain on chlorophyll fluorescence spectra of spruce seedlings [Picea abies (L.) Karst.][J]. Journal of Plant Physiology,1996,148(3/4):271-275 .
[12]Misra A N,Srivastava A,Strasser R J. Utilization of fast chlorophyll a fluorescence technique in assessing the salt/ion sensitivity of mung bean and brassica seedlings[J]. Journal of Plant Physiology,2001,158(9):1173-1181.
[13]Zribi L,Fatma G,Fatma R,et al. Application of chlorophyll fluorescence for the diagnosis of salt stress in tomato ‘Solanum lycopersicum (variety Rio Grande)[J]. Scientia Horticulturae,2009,120(3):367-372.
[14]Santos C V. Regulation of chlorophyll biosynthesis and degradation by salt stress in sunflower leaves[J]. Scientia Horticulturae,2004,103(1):93-99.endprint
[15]Drazkiewicz M,Tukendorf A,Baszynski T. Age-dependent response of maize leaf segments to cadmium treatment:effect on chlorophyll fluorescence and phytochelatin accumulation[J]. Journal of Plant Physiology,2003,160(3):247-254.
[16]Rau S,Miersch J,Neumann D,et al. Biochemical responses of the aquatic moss Fontinalis antipyretica to Cd,Cu,Pb and Zn determined by chlorophyll fluorescence and protein levels[J]. Environmental and Experimental Botany,2007,59(3):299-306.
[17]Maksymiec W,Baszynski T. Chlorophyll fluorescence in primary leaves of excess Cu-treated runner bean plants depends on their growth stages and the duration of Cu-action[J]. Journal of Plant Physiology,1996,149(1/2):196-200.
[18]俞慧娜,刘 鹏,徐根娣. 大豆生长及叶绿素荧光特性对铝胁迫的反应[J]. 中国油料作物学报,2007,29(3):257-265.
[19]胡劲松,吴彦琼,谭清清,等. 铀对蚕豆种子萌发及幼苗SOD和CAT活性的影响[J]. 湖南农业科学,2009(10):15-17.
[20]聂小琴,李广悦,吴彦琼,等. 铀胁迫对大豆和玉米种子萌发和幼苗生长及SOD与POD活性的影响. 农业环境科学学报,2010,29(6):1057-1064.
[21]严明理,冯 涛,向言词,等. 铀尾沙对油菜幼苗生长和生理特征的影响[J]. 生态学报,2009,29(8):4215-4222.
[22]Singh S,Malhotra R,Bajwa B S. Uranium uptake studies in some plants[J]. Radiation Measurements,2005,40(2-6):666-669.
[23]Massas I,Skarlou V,Haidouti C. 134Cs uptake by four plant species and Cs-K relations in the soil-plant system as affected by Ca(OH)2 application to an acid soil[J]. Journal of Environmental Radioactivity,2010,101(3):250-257.
[24]Maxwell K,Johnson G N. Chlorophyll fluorescence-a practical guide[J]. Journal of Experimental Botany,2000,51(345):659-668.
[25]张守仁. 叶绿素荧光动力学参数的意义及讨论[J]. 植物学通报,1999,16(4):444-448.
[26]Sheppard S C,Sheppard M I,Gallerand M O,et al. Derivation of ecotoxicity thresholds for uranium[J]. Journal of Environmental Radioactivity,2005,79(1):55-83.
[27]罗黄颖,高洪波,夏庆平,等. γ-氨基丁酸对盐胁迫下番茄活性氧代谢及叶绿素荧光参数的影响[J]. 中国农业科学,2011,44(4):753-761.
[28]Ouzounidou G. The use of photoacoustic spectroscopy in assessing leaf photosynthesis under copper stress:correlation of energy storage to photosystem Ⅱ fluorescence parameters and redox change of P700[J]. Plant Science,1996,113(2):229-237.
[29]Guidi L,Innocenti E D,Carmassi G,et al. Effects of boron on leaf chlorophyll fluorescence of greenhouse tomato grown with saline water[J]. Environmental and Experimental Botany,2011,73:57-63.endprint

