氨丙基离子液体水溶液CO2吸收特性及计算模型
李松,杨翠莲,毕崟,郭开华
(中山大学工学院,广东 广州510006)
引 言
近年来,全世界的天然气消耗量不断增加,正在成为最重要的能源之一[1]。天然气作为一种低碳环保、储量丰富的洁净能源,成为21世纪能源消费结构的重要组成部分。天然气被液化前,必须脱除其中的酸性气体 (CO2,H2S等),否则会导致设备和管道腐蚀。离子液体 (ionic liquids)对二氧化碳具有良好选择性吸收特性[2-3],这一特性发现后,离子液体在二氧化碳吸收领域的应用引起广泛的关注。
用于CO2吸收的离子液体主要有常规离子液体和功能型离子液体。Blanchard等[2,4]研究发现超临界CO2极易溶于 [BMim][PF6],并获得多种烷基咪唑离子液体与CO2的相平衡特性。Jacquemin等[5-6]研究发现气体在离子液体中的溶解度与气体以及离子液体的类型有关。近年来多个课题组研究了常规离子液体对CO2的吸收特性[7-10]。总的来说增加烷基取代链的长度[11-13]或者在阴 (或阳)离子增加氟烷基团[10]均可以提高离子液体对CO2的吸收特性,且阴离子对吸收性能的影响大于阳离子的作用[14-16]。
常规离子液体吸收CO2主要是物理吸收,吸收能力有限,受压力影响明显,CO2分压较低时,常规离子液体无法发挥对CO2的吸收功能。为了提高CO2在离子液体中的溶解度,人们通过引入功能型基团,以化学吸收的方式固定CO2。Bates等[17]合成并证实氨基功能型离子液体 [NH2p-bim][BF4],常温常压下吸收量接近理论值0.5mol(基于每摩尔离子液体)。阴离子相同时,阳离子氨基功能化后,吸收 CO2能力有较大的提高[18-19],约为非氨基化离子液体溶解度的2倍。
然而功能型离子液体在CO2吸收过程中黏度会成倍增大,限制了工业应用性能。通过加入一定量的水形成水溶液,可有效改善其流动性和对CO2吸收性能[20-21]。Zhang等[22]研究了胍盐功能型离子液体对CO2吸收性能,证实加入一定量水可显著改善溶液体系对CO2的溶解度。吴永良等[23]和 阳 涛 等[24]分 别 测 定 了 含 水 量 为 55% 和68.84%的 [APMim]Br水溶液对CO2的吸收能力,表明在大气压力下对CO2有优良的吸收特性。阳涛等[24]还用实验证实当水含量小于60%时,[APMim]Br溶液对CO2的吸收能力急剧衰减,但没能说明在有效吸收区域 (水含量大于55%)水含量对溶液体系CO2吸收效率可能产生的影响。
本文依据最近发表的 [APMim]Br离子液体水溶液对CO2的吸收特性数据[25],对溶液体系的化学吸收和物理吸收模型进行分析研究。通过对实测数据进行回归分析,得到能够正确反映化学吸收和物理吸收的计算模型,为其工业应用提供可靠的计算基础。
1 实验数据
实验方法和获得的数据详见文献 [25]。测试采用1-氨丙基-3-甲基咪唑溴盐 ([APMim]Br):纯度为99%,相对分子质量220.11,由中科院兰州物理化学研究所提供,去离子水为实验室自制,其电导率小于1μS·cm-1,使用前抽真空2h,除去水中可能溶解的气体杂质。CO2由广州气体公司提供,纯度99.99%。离子液体中初始水存留量由微量水分滴定仪测定。微量水分滴定仪,SFY-3A型,购自淄博海分仪器厂,测量值小于1mg时,精度为±3μg,大于1mg时,精度为±0.5%。测得的 [APMim]Br离子液体样品的残留含水量为(4500±300)mg·kg-1。
实验测试系统[25]如图1所示。高低温实验箱(空气浴)为实验提供稳定的温度环境,控温精度为±0.5℃。反应釜整体置于在空气浴内的水浴中,用恒温水槽控制温度,温控范围-20~100℃,精度±0.01℃。反应釜采用透明石英玻璃套筒,适用温度-10~120℃,适用压力0~10MPa。反应釜温度测量采用铂金热电阻 (Pt100),测温不确定度±10mK,压力测量使用瑞士凯勒PAA-33X高精度压力传感器,量程10MPa,不确定度 ±1kPa。系统中CO2气量由计量手泵控制和测定,容积不确定度为±0.01ml。
实验过程[25]简述如下:
用精密电子天平 (CP225D,量程0~220g,精度±0.1mg,德国赛多利斯股份公司)称取一定量的离子液体和水,配制成所需浓度的离子液体水溶液,倒入反应釜内密闭。打开阀门V5~V7,启动真空泵,达到1Pa的真空后再抽真空1min,关闭阀门,其间可抽走的水分量为0.03g±0.001g。综合考虑离子液体残留水量以及离子液体溶液配置和抽真空过程中的水量误差,测试溶液的水含量不确定度小于±0.12%。
当系统的起始温度达到稳定 (5℃),打开阀门V6、V7以及手泵阀门V2、V3,往釜内缓慢通入CO2气体,并在CO2吸收过程中通过手泵活塞推进保持压力不变,完成等压吸收,其间保持温度恒定。当系统压力平衡后,关闭V7,计量通入CO2气体量并计算离子液体溶液体系的CO2吸收量。此后在等容条件下升高空气浴和水浴的温度,进行升温实验,待反应釜压力温度平衡后,记录系统温度、压力。根据釜内气相状态,可以计算溶液中CO2的吸收量,获得单位离子液体对CO2吸收量的不确定度小于±0.76%。在5~75℃之间,每隔10℃测试一个吸收平衡点。完成一个等容升温测试后,将系统再次恒温在5℃,通过手泵活塞注入CO2气体至一较高的压力等级,重复上述的等压和等容CO2吸收平衡测试,获得较高压力的CO2溶解度平衡数据。
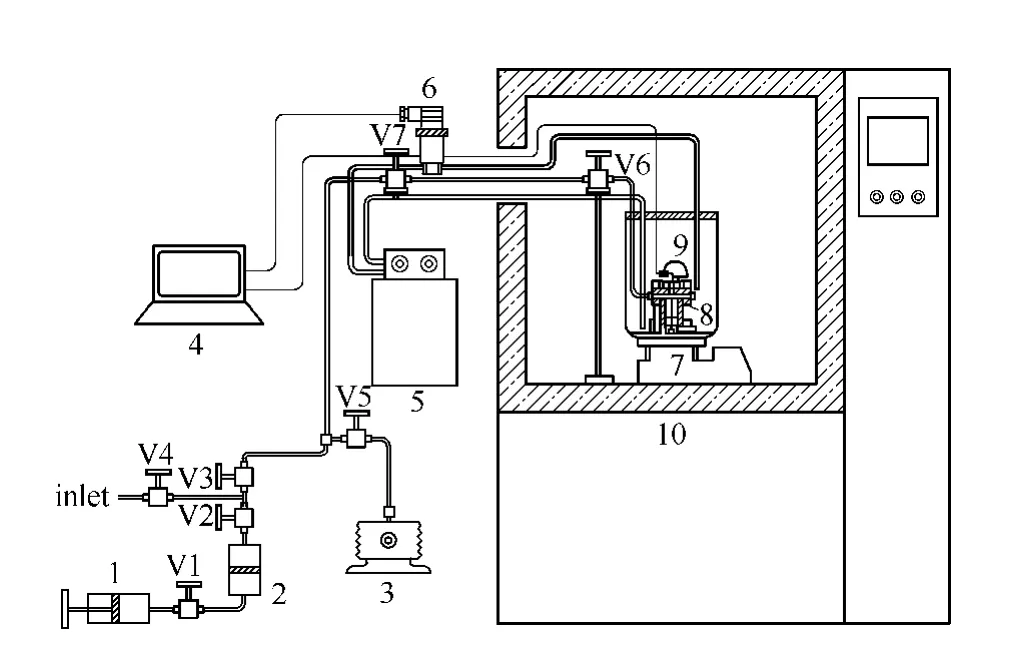
图1 试验系统[25]Fig.1 Schematic diagram of experimental apparatus[25]
2 数学模型
功能型离子液体对CO2的吸收包括两部分:化学吸收和物理吸收。在低压的时候,化学吸收起主导作用;反之,物理吸收起主导作用。总的表达式为:
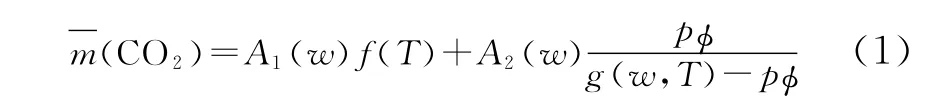
式 (1)中化学吸收部分为
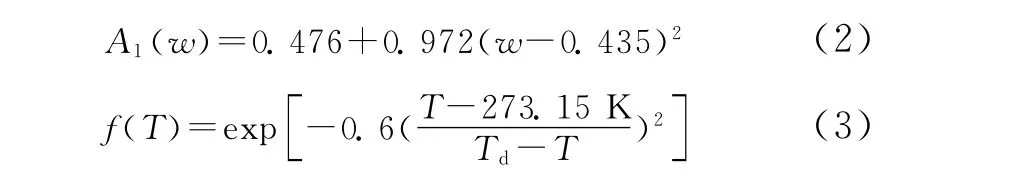
式中,Td为离子液体的分解温度,[APMim]Br的Td为440.85K。
物理吸收部分主要是受到温度、压力、水含量的影响,表达式可以写成
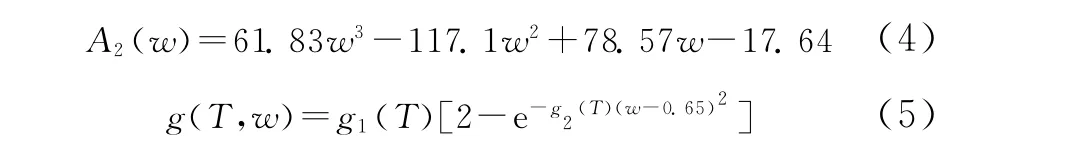
其中
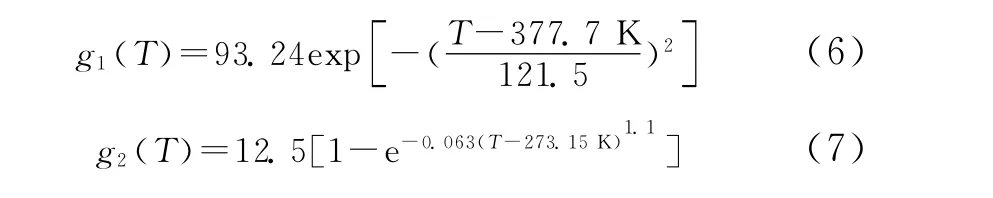
3 结果与讨论
通过测定水质量分数为55.90%、64.50%、76.50%和85.80%的 [APMim]Br水溶液对CO2吸收特性,获得不同温度和压力条件下溶液体系单位 [APMIm]Br中CO2的溶解度的数据,公布于文献 [25],从图2~图4可知拟合模型的正确性。
由图2给出在不同温度条件下,离子液体水溶液对CO2吸收量随水含量变化特性曲线。可知,当压力较低时 (0.1MPa)离子液体对CO2的吸收量已相当显著,为0.4~0.75mol,这主要归功于[APMim]Br对CO2的化学吸收。随着压力增加,溶液体系对CO2的物理吸收能力显著提升。含水量较低 (w=55.9%),当温度较高时 (337.84 K),在小于3.0MPa的压力段仍是化学吸收为主,吸收量为0.37~0.4mol,说明体系中化学吸收部分在较低压力下也难以释放出来。当溶液体系中水含量增加 (w=64.50%),物理吸收能力在整个压力区间 (0.1~6.0MPa)呈强势,约为化学吸收量的2倍。当溶液体系的含水量进一步提高 (w=85.80%),在较高压力时,离子液体水溶液对CO2的吸收能力会趋于饱和。由此可见在实际应用中,离子液体溶液体系在水含量为65%~85%区间时,对CO2具有优异的吸放气特性。
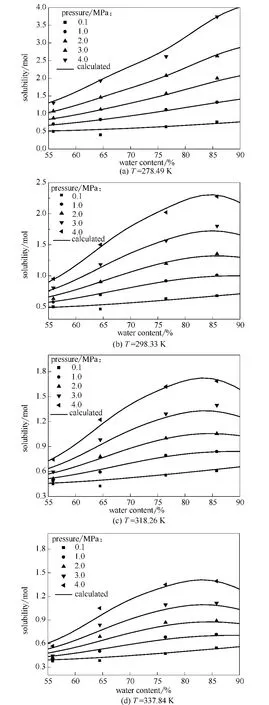
图2 不同温度条件下水含量对 [APMim]Br溶液对CO2吸收量的影响Fig.2 Curve of CO2absorbability of[APMim]Br aqueous solutions varies against water content at various temperatures
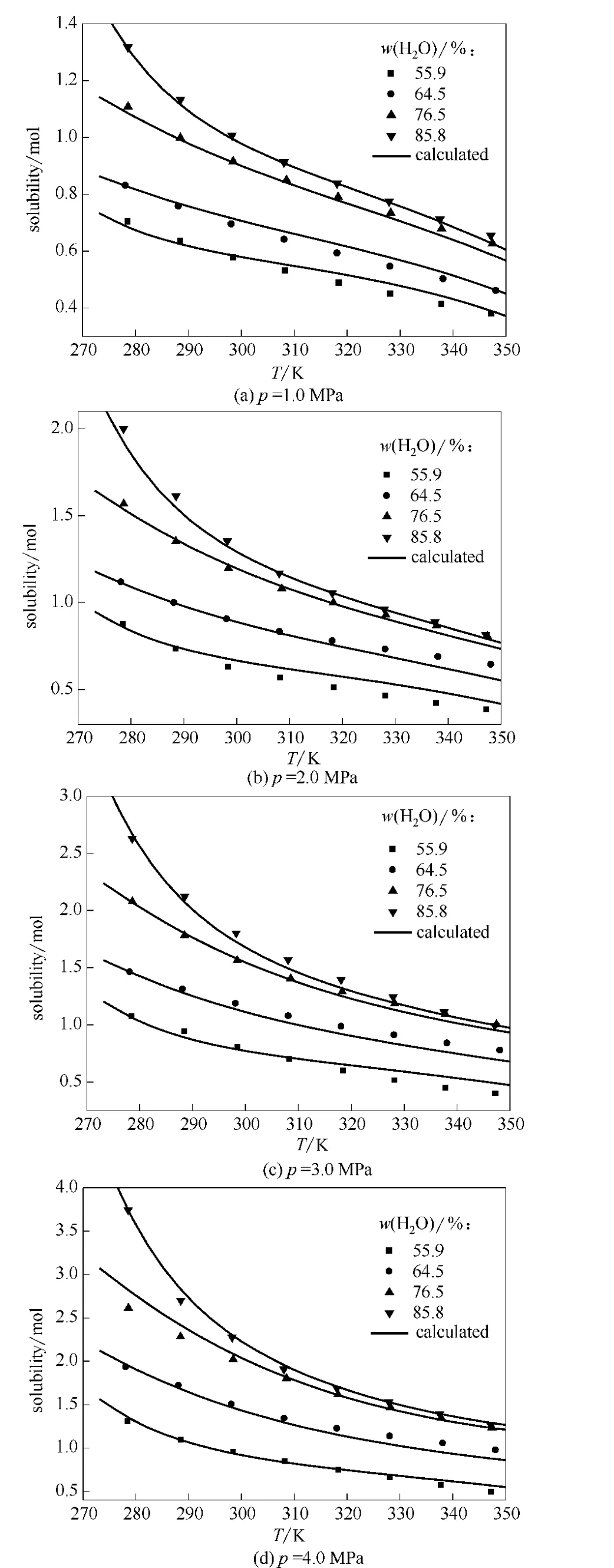
图3 不同压力下 [APMim]Br水溶液对CO2吸收随温度变化特性Fig.3 Absorbing-desorbing curves of[APMim]Br aqueous solutions to CO2at different pressure
同时可知,随着水含量的增加,溶液体系单位摩尔离子液体对CO2溶解度显著增大,表明溶液体系中, 离子液体在水的稀释作用下发挥其对CO2的吸收能力。在278.49K、3.0MPa时,在水含量55%~85%区间,CO2的溶解度由1.1mol增加至2.8mol;在337.84K、4.0MPa时,在同样水含量区间,CO2的溶解度由0.6mol增加至1.4mol。溶液对CO2吸收量随水含量增大的趋势受压力的影响较大,当压力较低时,溶液对CO2的吸收主要为化学吸收,水含量对CO2溶解度的影响有限,溶解度增量仅为0.2mol左右。由此可见水含量增大主要改善了溶液体系的物理吸收能力。大于水含量85.80%之后,溶液体系存在一个最佳的水含量,使CO2溶解度达到最大值,而且不同的压力最佳水含量都不一样。大于最佳水含量时,溶解度开始随水含量增大而减小;当水含量增至100%时,溶解度即为纯水中该压力下的CO2溶解度。
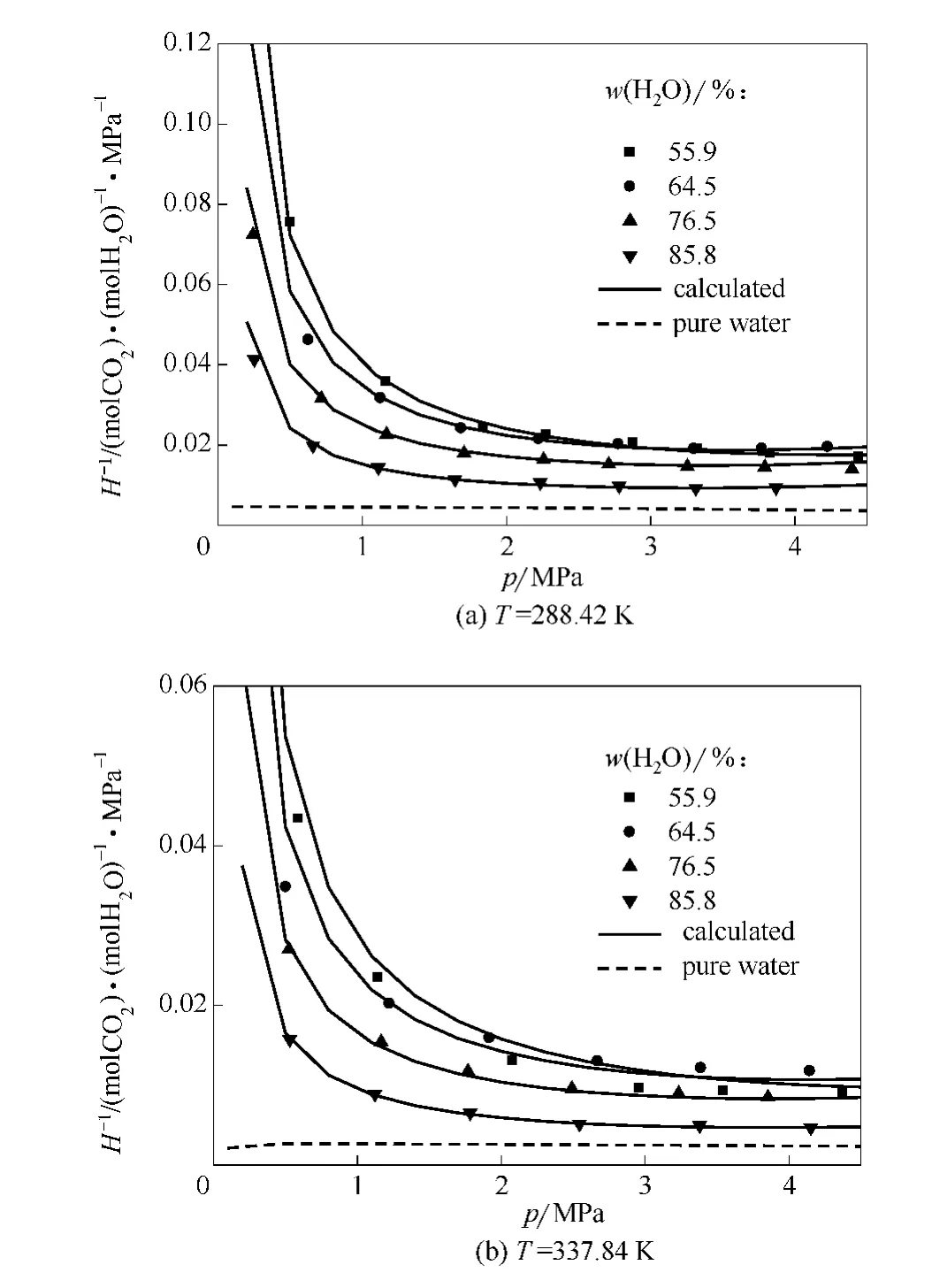
图4 [APMim]Br水溶液对CO2吸收能力的亨利系数表示Fig.4 CO2solubility of[APMim]Br aqueous solutions expressed with Henry constant
为了进一步说明 [APMim]Br水溶液对CO2等压吸放气特性,图3给出几个压力下离子液体水溶液对CO2吸收量随温度变化曲线。由不同水含量溶液对CO2吸收量温度特性曲线可见,压力一定时,[APMim]Br的放气范围随着水含量的增大而增大。以p=1.0MPa为例,水质量分数为55.90%时,溶液对 CO2放气范围仅为0.3mol;而当水质量分数为85.80%时,其放气范围则约为0.6mol。在压力为2.0、3.0和4.0MPa时,溶液体系对CO2的吸放气也表现了同样的特征,且水含量相同时压力越高,放气范围越宽。将[APMim]Br水溶液与醇胺溶液的 CO2吸收[27]相比,在40℃、1.0MPa时,单位离子液体吸收的CO2量较大,吸收特性优于醇胺溶液;5~75℃,[APMim]Br水溶液的CO2吸放范围约为0.57mol,对比醇胺溶液,40~120℃时其CO2吸放范围不大于0.5mol。由此可见,离子液体水溶液在同等条件下单位物质的量的CO2吸收能力优于醇胺溶液,且再生温度较低。
离子液体水溶液对CO2的吸收特性也可用亨利系数的倒数来表征。图4给出在不同水含量条件下 [APMim]Br水溶液中 CO2等温 (288.42和337.84K)吸收的亨利系数倒数特性以及与纯水[28]时的比较。由图可见,[APMim]Br的存在使得单位压力下溶液对CO2的溶解度 (即亨利系数倒数H-1)显著提高,特别当压力较低时,比较纯水,单位压力溶解度可提升10~20倍。
4 结 论
本文给出 [APMim]Br离子液体水溶液在5~75℃、0.1~4.5MPa范围内,水含量分别为55.70%、64.50%、76.50%和85.80%的溶液体系的CO2溶解度测试数据,并依据实验数据回归分析,获得了能够正确反映化学吸收和物理吸收的计算模型。计算和实验结果表明 [APMim]Br离子液体水溶液体系水含量对离子液体CO2的吸收特性有显著的影响。随着水的质量分数的增加,溶液体系对CO2溶解度成倍增加,而且产生的物理吸收效应远大于离子液体本身的化学吸收能力。在水质量分数为65%~85%区间,[APMim]Br溶液体系在相当大的温度和压力范围具有优良的CO2吸放气特性,显示出良好的工程应用前景。
[1] Energy Information Administration.International energy outlook [R].Washington,D.C.:Energy Information Administration,2008.
[2] Blanchard L A,Gu Zhiyong,Brennecke J F.High-pressure phase behavior of ionic liquid/CO2systems[J].TheJournal ofPhysicalChemistryB,2001,105 (12):2437-2444.
[3] Huang Junhua,Rüther T.Why are ionic liquids attractive for CO2absorption[J].AustralianJournalofChemistry,2009,62 (4):298-308.
[4] Blanchard L A,Hancu D,Beckman&Amp E J,etal.Green processing using ionic liquids and CO2[J].Nature,1999,399 (6731):28-29.
[5] Jacquemin J,Husson P,Majer V,etal.Influence of the cation on the solubility of CO2and H2in ionic liquids based on the bis (trifluoromethylsulfonyl)imide anion [J].JournalofSolutionChemistry,2007,36 (8):967-979.
[6] Hong G,Jacquemin J,Deetlefs M,etal.Solubility of carbon dioxide and ethane in three ionic liquids based on the bis{(trifluoromethyl)sulfonyl}imide anion [J].Fluid PhaseEquilibria,2007,257 (1):27-34.
[7] Pérez-Salado KampsÁ,Tuma D,Xia Jianzhong,etal.Solubility of CO2in the Ionic Liquid [bmim][PF6] [J].JournalofChemical&EngineeringData,2003,48 (3):746-749.
[8] Husson-Borg P,Majer V,Costa Gomes M F.Solubilities of oxygen and carbon dioxide in butyl methyl imidazolium tetrafluoroborate as a function of temperature and at pressures close to atmospheric pressure [J].Journalof Chemical&EngineeringData,2003,48 (3):480-485.
[9] Baltus R E,Culbertson B H,Dai Sheng,Luo Huimin,etal.Low-pressure solubility of carbon dioxide in roomtemperature ionic liquids measured with a quartz crystal microbalance[J].TheJournalofPhysicalChemistryB,2004,108 (2):721-727.
[10] Muldoon M J,Aki S N,Anderson J L,etal.Improving carbon dioxide solubility in ionic liquids[J].TheJournalof PhysicalChemistryB,2007,111 (30):9001-9009.
[11] Shariati A,Peters C J.High-pressure phase equilibria of systems with ionic liquids[J].TheJournalofSupercritical Fluids,2005,34 (2):171-176.
[12] Gutkowski K I,Shariati A,Peters C J.High-pressure phase behavior of the binary ionic liquid system 1-octyl-3-methylimidazolium tetrafluoroborate+carbon dioxide[J].TheJournalofSupercriticalFluids,2006,39 (2):187-191.
[13] Shariati A,Peters C J.High-pressure phase behavior of systems with ionic liquids (Ⅲ):The binary system carbon dioxide+1-hexyl-3-methylimidazolium hexafluorophosphate[J].TheJournalofSupercriticalFluids,2004,30 (2):139-144.
[14] Anthony J L,Anderson J L,Maginn E J,etal.Anion effects on gas solubility in ionic liquids[J].TheJournalof PhysicalChemistryB,2005,109 (13):6366-6374.
[15] Cadena C,Anthony J L,Shah J K,etal.Why is CO2so soluble in imidazolium-based ionic liquids?[J].Journalof theAmericanChemicalSociety,2004,126 (16):5300-5308.
[16] Aki S N,Mellein B R,Saurer E M,etal.High-pressure phase behavior of carbon dioxide with imidazolium-based ionic liquids[J].TheJournalofPhysicalChemistryB,2004,108 (52):20355-20365.
[17] Bates E D,Mayton R D,Ntai I,etal.CO2capture by a task-specific ionic liquid [J].JournaloftheAmerican ChemicalSociety,2002,124 (6):926-927.
[18] Galan Sánchez L M,Meindersma G W,de Haan A B.Solvent properties of functionalized ionic liquids for CO2absorption[J].ChemicalEngineeringResearch&Design,2007,85 (1):31-39.
[19] Zhang Yi, Wu Zaikun, Chen Shaoli, Yu Ping, Luo Yunbai.CO2capture by imidazolate-based ionic liquids:effect of functionalized cation and dication[J].Industrial&EngineeringChemistryResearch,2013,52 (18):6069-6075.
[20] Goodrich B F,de la Fuente J C,Gurkan B E,etal.Effect of water and temperature on absorption of CO2by aminefunctionalized anion-tethered ionic liquids[J].TheJournal ofPhysicalChemistryB,2011,115 (29):9140-9150.
[21] Romanos G E,Zubeir L F,Likodimos V,etal.Enhanced CO2capture in binary mixtures of 1-alkyl-3-methylimidazolium tricyanomethanide ionic liquids with water[J].TheJournalofPhysicalChemistryB,2013,117(40):12234-12251.
[22] Zhang Feng, Fang Chenggang, Wu Youting, Wang Yuantao,Li Aimin,Zhang Zhibing.Absorption of CO2in the aqueous solutions of functionalized ionic liquids and MDEA [J].ChemicalEngineeringJournal,2010,160(2):691-697.
[23] Wu Yongliang (吴 永 良 ),Jiao Zhen (焦 真 ),Wang Guannan(王冠楠),Wu Youting(吴有庭),Zhang Zhibing(张 志 炳 ).Synthesis characterization and absorption efficiency of an ionic liquid for the absorption of CO2[J].FineChemicals(精细化工),2007,24 (4):324-327.
[24] Yang Tao(阳涛),Bi Yin (毕崟),Guo Kaihua(郭开华).Carbon dioxide absorption in 1-aminopropyl-3-methylimidazolium bromide aqueous solutions[J].CIESCJournal(化 工 学报),2012,63 (10):3152-3157.
[25] Yang Cuilian (杨翠莲),Li Song (李松),Bi Yin (毕崟),Guo Kaihua (郭 开 华 ).Absorption property of 1-aminopropyl-3-methylimidazolium bromide aqueous solutions to carbon dioxide[J].PetrochemicalTechnology(石油化工),2014,43 (12):1433-1438.
[26] Peng D Y,Robinson D B.A new two-constant equation of state [J].Industrial&EngineeringChemistry Fundamentals,1976,15 (1):59-64.
[27] Liu Yanxin (刘延鑫),Dong Lihu (董立户),Mi Jianguo(密建国),Chen Jian (陈健).Study on molecular structure of alkanolamines and their CO2capture ability [J].SCIENTIASINICAChimica(中国科学 化学),2012,42(3):291-296.
[28] Duan Zhenhao,Sun Rrui.An improved model calculating CO2solubility in pure water and aqueous NaCl solutions from 273to 533Kand from 0to 2000bar [J].Chemical Geology,2003,193 (3/4):257-271.

