花椒精油对HaCaT 细胞增殖和凋亡的影响
周 瑞,杨文化,李科友
(西北农林科技大学生命科学学院,陕西杨凌712100)
银屑病是一种免疫调节的慢性炎症性皮肤疾病,全世界人群发病率约为2%~3%,亚洲成人染病率较低,低于0.1%[1]。同时,有证据表明中重度银屑病病人患心血管疾病、肥胖、糖尿病、代谢综合征等疾病的几率相对较高[2]。目前对于银屑病的治疗方式包括传统治疗、光线疗法、维生素A 等,尽管这些方法对于抑制银屑病病症有一定效果,但是许多药物都具有严重的副作用,且长期用药会引起银屑病药物耐受性。现已知在银屑病发生和发展中,角化细胞起到至关重要的作用。因此,抑制角化细胞过度增殖,诱导其发生凋亡,对于治疗银屑病具有重要的作用,长久以来也被作为银屑病治疗的靶向目标[3]。
在我国,中草药已被广泛用于银屑病的治疗,已经过临床试验,并证明有一定的疗效[4]。花椒是一种来源较广的木本植物,主要种植在我国陕西、青海和甘肃等省,其果皮主要用作辛辣调味品和作料[5]。《本草纲目》中亦有记载,花椒是一种传统的中草药,可用于治疗呕吐、风邪、牙痛、腹痛、湿疹和腹泻等疾病[6-7]。此外,有文献报道花椒精油具有抗肿瘤[8]、抗炎[9]以及抗菌[10]等功效。近年来,从植物中获得的精油作为处理一些皮肤问题的配方中的活性成分得到了研究者的高度关注[11]。
尚未见到花椒精油抗银屑病活性方面的报道,本研究选取体外研究银屑病相关试验的模式细胞HaCaT 细胞作为研究对象,研究花椒精油对其增殖抑制的影响以及诱导凋亡效应及的内在机制,为更好地了解银屑病致病机理提供理论基础,也为该类疾病提供新的治疗方法。
1 材料与方法
1.1 材料
HaCaT 细胞购于中科院昆明动物研究所;前列腺癌细胞株(PC-3)、人喉癌上皮细胞株(HEp-2)、宫颈癌细胞株(Hela)以及人乳腺癌细胞株(MCF-7)由西北农林科技大学雷鸣教授馈赠;花椒果皮(陕西凤县大红袍)采购自陕西杨凌;花椒精油经水蒸气蒸馏法提取并保存于-20 ℃备用;Tween-80 购于MP Biomedicals公司;DMEM 培养液、RPMI-1640培养液、胎牛血清(fetal bovine serum,FBS)购自Gibico公司;胰蛋白酶、台盼蓝染液、SRB 购自英国Sigma Aldrich公司;100×青霉素及链霉素溶液、40mL/L多 聚 甲 醛 溶 液、Caspase-8、Caspase-9、Caspase-3、PARP、Bcl-2、Bax、β-actin抗体、山羊抗兔、山羊抗鼠二抗购买于碧云天公司;凋亡检测试剂盒、细胞周期检测试剂盒购于南京凯基公司;硝酸纤维素膜和ECL发光液购自Bio-Rad公司。
1.2 方法
1.2.1 精油提取 将干燥的花椒果皮研磨成粉,过50目筛。每100g粉末加双蒸水1L 于圆底烧瓶中,利用油水分离器蒸馏提取3h 制备精油。制备的精油用无水硫酸钠干燥后0.22μm 微膜过滤,置-20 ℃保存备用。
1.2.2 细胞培养与处理 HaCaT 细胞作为体外模式细胞,已广泛用于抗银屑病药物研究。HaCaT、HEp-2、Hela、MCF-7 细 胞 培 养 于DMEM 培 养 基中,PC-3 细 胞 于RPMI-1640 培 养 基 中 培 养。所 有培养基中添加100mL/L 的FBS和抗生素,在体积分数为5%的CO2培养箱中37 ℃恒温培养,培养基隔天更换。待细胞融合达70%~80%,不同含量精油处理进行试验分析。花椒精油采用添加Tween-80的DMEM 培养液助溶,Tween-80终含量不超过0.1mL/L,保证对细胞无毒性。
1.2.3 形态学观察 HaCaT 细胞接种至6 孔板,待贴壁后,用不同含量精油(0.1、0.25、0.5mL/L)处理24h,Tween-80 作为阴性对照。倒置显微镜(Leica,Germany)观察细胞形态学变化。
1.2.4 细胞毒性与生长曲线测定HaCaT 细胞以每孔5×103个接种于96孔板中,培养至贴壁。加入不同含量(0.05、0.1、0.25、0.5、1、2mL/L)花椒精油,每个含量3 孔重复,分别处理24、48、72h,Tween 80作为阴性对照。达到处理时间后,取出培养板,每孔加入100mL/L 冰三氯乙酸(TCA),4 ℃放置1h。去离子水洗涤5次后并自然风干后,加入4g/L的SRB 溶液,室温避光处染色30 min。10 mL/L冰醋酸洗涤5次后自然风干。给SRB染色的细胞中加入10mmol/L 的Tris-base溶解蛋白并用多功能酶标仪测定540nm 处吸光值(OD)。细胞生长抑制率(%)=[(对照组OD 平均值-试验组OD平均值)/对照组OD 平均值]×100%计算生长抑制率。应用SPSS 19.0软件分析计算IC50。为了测定HaCaT 细胞生长曲线,将细胞以每孔5×104个种在24孔板中,培养至贴壁后用不同含量精油(0.1、0.25、0.5mL/L)处理。小心将细胞用胰酶消化并加入,并取适量细胞悬液加入台盼蓝染色。利用细胞计数器每24h计数1次,持续6d。根据细胞数变化利用Sigma plot 10.0 软件绘制生长曲线。
1.2.5 细胞周期试验 细胞在添加不同含量精油(0.1、0.25、0.5 mL/L)的6 孔 板 中 培 养24 h,Tween 80 作为阴性对照。离心收集细胞后用700 mL/L冰乙醇温和混匀,4 ℃过夜。用冰的PBS 溶液洗两次,并用5μL RNase 37℃水浴处理30min,随后加入400μL 碘化丙啶(PI)4 ℃染色处理30 min。染色完成后,利用流式细胞仪分析细胞周期,数据采用Flow JO 7.6.5软件进行分析。
1.2.6 AnnexinV-PI双染色和细胞凋亡试验HaCaT 细胞在添加不同含量精油(0.1、0.25、0.5 mL/L)的6孔板中培养24h,Tween 80作为阴性对照。细胞离心收集后用缓冲液进行重悬浮后,添加FITC 和PI室温避光反应15min。采用流式细胞仪进行分析,利用FlowJO 7.6.5软件进行数据分析。
1.2.7 Western blot试验 利用Western blot方法检测凋亡相关蛋白表达情况。HaCaT 细胞用不同含量精油(0.1、0.25、0.5mL/L)处理24h后,离心收集细胞后,用含有0.5 mmol/L 苯甲基磺酰氟(PMSF)和蛋白酶抑制剂(PI)混合物的裂解液裂解细胞,BCA 法进行蛋白定量。相同剂量的蛋白样品进行120mL/L 的SDS-聚丙烯酰胺凝胶电泳后转至硝酸纤维素膜。转膜结束后用50g/L 脱脂牛奶室温封闭2h,TBST 缓冲液洗膜,各自加入到相应的β-actin、Bcl-2、Bax、PARP、Caspased-8、Caspased-9、Caspased-3一抗中(1∶1 000),4 ℃过夜。TBST洗膜后,加入50g/L脱脂牛奶稀释至1∶2 000的山羊抗兔或山羊抗鼠二抗室温孵育1h。向膜上滴加ECL发光液后,Bio-Rad化学发光成像系统成像分析,用β-actin作蛋白上样量标准对照。
1.2.8 数据处理 数据来自至少3次相近结果的独立试验,以平均值±标准差形(¯x±SD)式表示。数据统计学差异采用SPSS 19.0软件进行单因素方差分析。P<0.05被认为具有统计学差异。
2 结果
2.1 细胞形态学变化
与对照组相比,低含量精油(0.1 mL/L)处理后,细胞密度和形态学没有明显变化。用0.25 mL/L或0.5mL/L精油处理后,HaCaT 细胞密度急剧降低,细胞出现皱缩,胞间粘连消失现象,表明花椒精油能诱导细胞形态发生变化(图1)。
2.2 花椒精油抑制HaCaT 细胞增殖
为了进一步检测精油对HaCaT 细胞增殖的影响,通过SRB试验测定精油对细胞的增殖抑制率。花椒精油对于HaCaT 细胞毒性作用试验结果如图2A 所示。不同含量花椒精油处理24h 后,活细胞分别减少至95.3%、86.49%、68.38%、31.06%、6.51%、5.89%。作 用HaCaT 细 胞48h 的 精 油IC50值为199.2μg/mL(0.24mL/L)(图2B),台盼蓝染色试验表明,0.25 mL/L 和0.5 mL/L 的花椒精油作用细胞后,HaCaT 细胞活力显著降低。上述结果表明,花椒精油能显著抑制HaCaT 细胞增殖,其抑制效应呈现时间-剂量依赖型。同时,花椒精油被证实能有效抑制肿瘤细胞增殖。因此,试验比较了花椒精油对于四种癌细胞系(PC-3、HEp-2、Hela、MCF-7细胞系)的抑制率(图2C),花椒精油对上述癌细胞均具有抗性,同时,花椒精油对HEp-2抑制效果 较 为 明 显,其IC50为174.3 μg/mL(0.21 mL/L)相 对 较 低。花 椒 精 油 作 用 于 MCF-7 和HaCaT 细胞后的制率最为相近,IC50分别为190.9 μg/mL(0.23mL/L)和199.2μg/mL(0.24 mL/L)。花椒精油作用于不同细胞株系的IC50见表1。以上结果共同表明花椒精油是具有抑制HaCaT 细胞和其他癌细胞增殖的活性。

图1 花椒精油处理后的HaCaT 细胞形态学变化(200×)Fig.1 The morphology changes of HaCaT cells treated with ZBEO(200×)
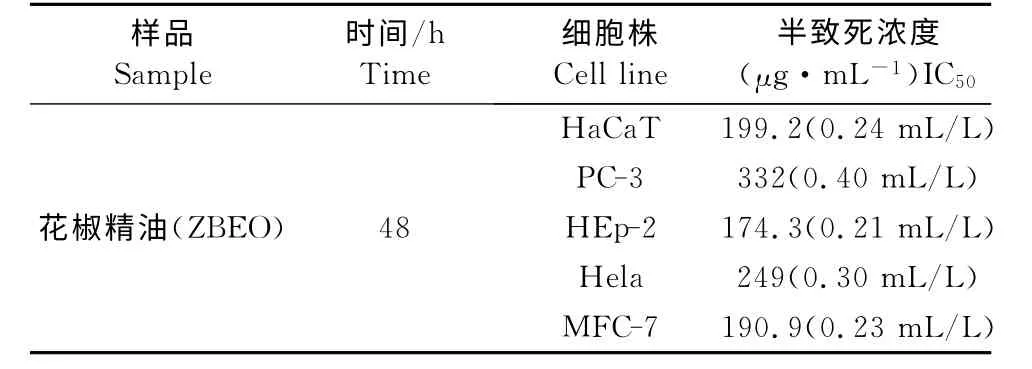
表1 花椒精油作用于HaCaT 细胞以及PC-3、HEp-2、Hela、MFC-7细胞48h的IC50值比较Table 1 Comparison of the IC50values of ZBEO on cultured HaCaT,PC-3,HEp-2,Hela,and MFC-7cells for 48h
2.3 花椒精油对HaCaT 细胞周期的影响
为检测花椒精油对HaCaT 细胞细胞周期的影响,本试验采用流式细胞仪分析细胞周期分布,研究花椒精油对HaCaT 细胞周期转换的影响(图3),阴性对照组在G0/G1期、S期和G2/M 期细胞比例分别为46.67%、34.48%、18.85%。0.1 mL/L 精油处理后,S期细胞增加至37.67%,同时伴随G0/G1期细胞减少至41.87%。阴性对照与0.1mL/L 精油处理细胞周期变化并无显著性差异(P>0.05)。精油含量升高至0.25 mL/L,S期细胞数显著增加至41.73%(P<0.05),伴随G2/M 期细胞减少至15.92%。然 而,0.5 mL/L 精 油 处 理 后,只 有40.80%的HaCaT 细胞都停滞在S期。上述结果显示花椒精油能诱导HaCaT 细胞周期停滞在S期,该诱导效应具有剂量依赖性。
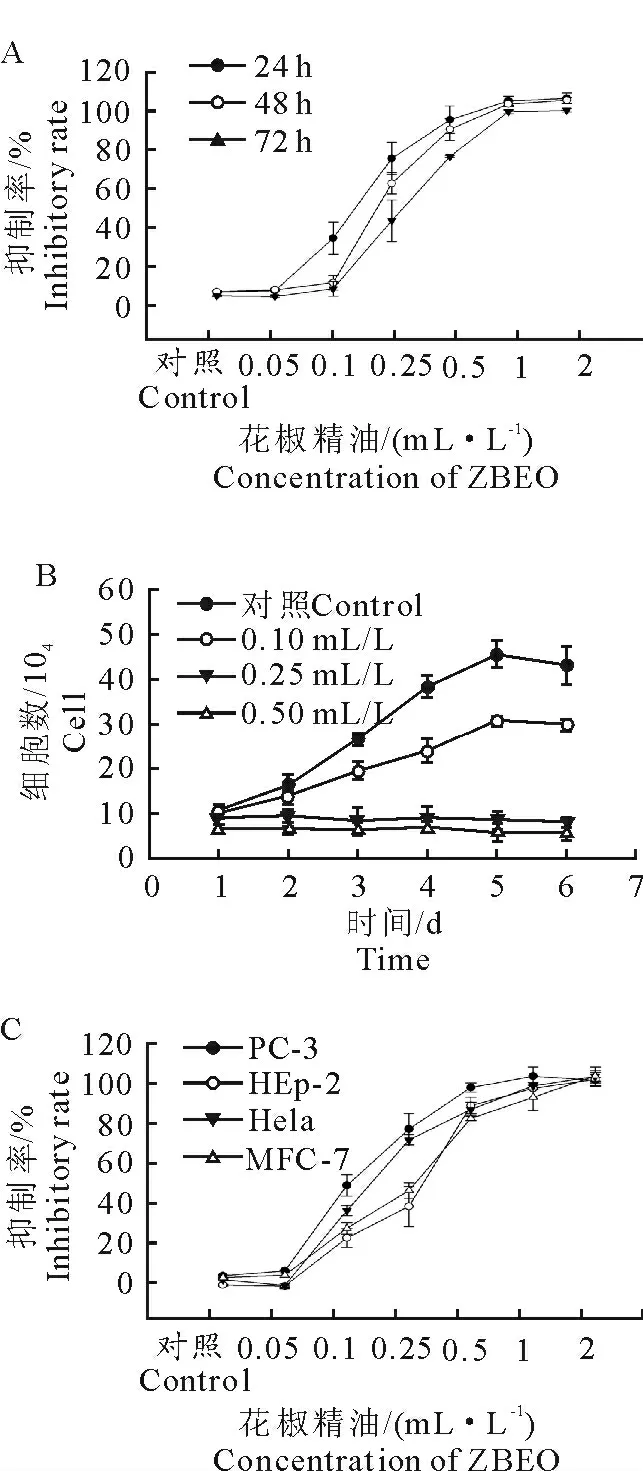
图2 花椒精油对HaCaT 细胞以及癌细胞的抗增殖活性Fig.2 Anti-proliferative activity of ZBEO on cultured HaCaT and different cancer cell lines
2.4 花椒精油诱导HaCaT 细胞凋亡
为进一步检测不同含量精油处理后HaCaT 细胞凋亡发生情况,采用AnnexinV 和PI双染色法分析不同凋亡状态细胞数目百分比(图4A 和图4B),阴性对照和低含量精油(0.1mL/L)处理后,大部分细胞未发生凋亡现象。然而,当精油含量升高至0.25mL/L和0.5 mL/L 时,凋亡细胞数目分别剧增至18.54%(P<0.01)和32.28%(P<0.01),活细胞数目分别减少到78.9%和50.51%。阴性对照和0.25mL/L精油处理后,坏死细胞百分数没有明显差别(P>0.05)。然而,0.5mL/L 精油处理组中坏死细胞百分比增加至17.22%,具有显著性差异(P<0.01)。以上结果明确表明,花椒精油可诱导HaCaT 细胞发生凋亡,且凋亡效应具有剂量依赖性。
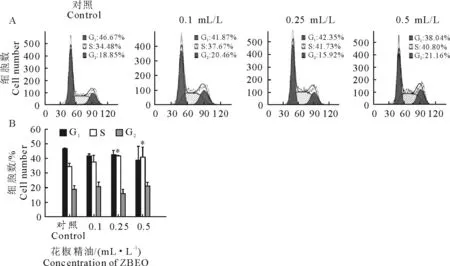
图3 花椒精油诱导HaCaT 细胞发生细胞周期停滞Fig.3 ZBEO induced cell cycle arrest in HaCaT cells
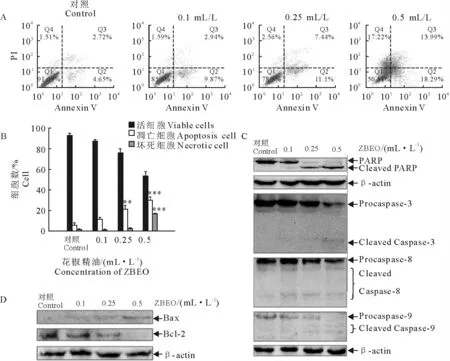
图4 花椒精油诱导HaCaT 细胞发生细胞凋亡Fig.4 ZBEO induced apoptosis on HaCaT cells

图5 花椒精油诱导HaCaT 细胞发生凋亡的模式机理图Fig.5 Schematic diagram of hypothetic mechanisms underlying ZBEO induction of apoptosis in HaCaT cells
在细胞凋亡过程中,Caspase蛋白家族和Bcl-2蛋白家族分别在内源途径与外源途径发挥重要作用。为了进一步研究凋亡中涉及的信号通路,采用Western blot 试验分析经花椒精油处理后的HaCaT 细胞凋亡相关蛋白的表达情况。花椒精油作用细胞后可诱导Caspase-8/9/3 发生剪切,且为浓度依赖型(图4C)。此外,细胞凋亡过程中,Caspase-3的一个重要的底物PARP 同样发生了剪切。从细胞水平来说,细胞凋亡受众多因素调控,线粒体膜功能紊乱也可以导致凋亡性细胞死亡。Bcl-2蛋白家族中Bax和Bcl-2蛋白表达水平的扰乱也是引发细胞凋亡的一个重要因素[12]。花椒精油作用HaCaT 细胞后,Bax和Bcl-2蛋白的表达情况如图4D 所示。结果显示,花椒精油显著减少HaCaT细胞中抗凋亡蛋白Bcl-2 的表达量,同时使促凋亡蛋白Bax 表达量升高。综上,花椒精油可诱导HaCaT 细胞发生凋亡,其潜在机制可能是通过内源途径与外源途径来共同调节的。
3 讨论
银屑病被普遍认为是一种免疫调节的慢性炎症性皮肤疾病,其准确的病因和发病机理仍不清楚。由于现今的一些可选用的治疗方法与药物都存在如效率不高以及出现耐药性的缺点,所以对于新的治疗方法的研究仍需不懈地努力。在中国,花椒果皮常被用来作为一种调味品使用,同时也是一种传统中药被用于治疗呕吐、牙痛以及胃痛。最近,由于花椒精油在很多疾病中的潜在作用已备受关注。本研究以HaCaT 细胞为载体,进行了花椒精油对HaCaT 细胞增殖的影响以及在其诱导下HaCaT 细胞发生凋亡的潜在机制的研究。
SRB试验结果说明花椒精油拥有明显抑制HaCaT 细胞增殖的作用,同时伴有时间和剂量依赖性,IC50为199.2μg/mL(0.24 mL/L)。花椒精油被认为具有潜在的抗癌活性,因此对于花椒精油的抗癌活性也进行了检测。结果表明,0.25mL/L 的花椒精油之作用细胞后,4种癌细胞株的活力均有显著的下降。相比其他细胞株,HEp-2细胞受到的抑制最为明显,IC50仅174.3μg/mL(0.21mL/L)。此结果表明,花椒精油对于癌细胞同样具有一定的抗增殖作用,另一方面也说明了在相同的外界作用条件下不同细胞会出现不同的应激反应。
细胞周期检查点是一种生化途径,可确保如DNA 复制、染色体分离等关键事件的有序及时进展以及完成[13]。已有报道证明细胞周期的停滞可能会诱导凋亡[14]。因此,对于发展新的疾病治疗方法,阻滞细胞周期被认为是一种有效的策略。此研究中,流式细胞仪结果显示花椒精油可诱导HaCaT细胞在S期受到阻滞,同时伴随G0/G1期细胞的减少,同时抑制作用具有剂量依赖性。此结果表明花椒精油对HaCaT 细胞的增殖抑制影响可能是通过阻滞细胞于S期,进而导致细胞发生凋亡。
深入地了解抗银屑病药物诱导凋亡的潜在机制对于加快开发有效的银屑病治疗策略有着重要意义。一般认为细胞的生长抑制可能是由细胞凋亡或细胞坏死导致,同时细胞凋亡的不充分被认为在银屑病的发病机理中有着重要的作用[15]。细胞凋亡又称程序性死亡,是细胞自毁的一种有效的生理过程,和细胞坏死有着明显的区别,不伴随有炎症反应。一般来说,细胞凋亡受调节于内源和外源两个主要途径。其中Caspase-9和Caspase-8首先被激活,然后诱导激活效应蛋白Caspase-3。在细胞凋亡中,Caspase-3是一个重要的执行蛋白,被激活后的Caspase-3剪切其底物PARP 蛋白,进而引起细胞凋亡[15]。线粒体途径可被Bcl-2 家族蛋白紧密调节[17],这些蛋白在细胞凋亡中有着重要的作用,包括促凋亡蛋白Bax以及抑凋亡蛋白Bcl-2。在正常细胞中,这两种蛋白的存在一个适当的平衡,通过整合不同的细胞死亡与存活信号以此来控制细胞的命运[18]。在已有的文献中报道花椒精油可诱导癌细胞发生凋亡,但对于HaCaT 细胞的研究还未出现报道。为了研究花椒精油诱导HaCaT 细胞发生凋亡的情况以及其潜在机制,本研究首先利用流式细胞仪检测了花椒精油作用后HaCaT 细胞发生细胞凋亡的比率,结果显示随着花椒精油含量的升高细胞凋亡比率也随之增加。为了进一步探究其潜在机制,利用Western blot方法分析了Caspase家族和Bcl-2家族中的关键蛋白在花椒精油作用后的HaCaT 细胞中的表达情况。结果表明HaCaT 细胞经不同含量花椒精油处理24h后,procaspase-8/9/3蛋白表达逐渐降低,Caspase-8/9/3蛋白表达逐渐增高,同时PARP 蛋白也发生了切割。此外,花椒精油可调节HaCaT 细胞增加Bax蛋白表达,减少Bcl-2 蛋白表达。上述结果表明花椒精油诱导HaCaT 细胞发生的细胞凋亡受到了内源以及外源途径的共同调节。
综上,此研究表明经水蒸气蒸馏法从花椒果皮中提取的精油具有显著抑制HaCaT 细胞增殖和改变细胞周期转换的活性,同时可通过内源途径和外源途径共同调控相关蛋白表达来诱导HaCaT 细胞发生凋亡。由于花椒精油抑制HaCaT 细胞增殖与细胞凋亡的诱发有着密切关联,依据试验结果,本研究假设了其模式机理图,如图5所示。因此,通过研究花椒精油对HaCaT 细胞的增殖抑制情况以及对其诱导HaCaT 细胞发生细胞凋亡潜在机制的初步探索,进而为更好地了解银屑病致病机理提供理论基础,也为该类疾病提供新的治疗方法。
[1] Goldminz A M,Au S C,Kim N,et al.NF-kappaB:an essential transcription factor in psoriasis[J].J Dermatol Sci,2013,69:89-94.
[2] Ryan C,Kirby B.Psoriasis is a systemic disease with multiple cardiovascular and metabolic comorbidities[J].Dermatol Clin,2015,33:41-55.
[3] Lin J R,Liu X M,Bao Y M,et al.Effects of isocamptothecin,a novel camptothecin analogue,on proliferation,apoptosis and telomerase activity in HaCaT cells[J].Exp Dermatol,2008,17:530-536.
[4] Mok C F,Xie C M,Sham K W,et al.1,4-dihydroxy-2-naphthoic acid induces apoptosis in human keratinocyte:potential application for psoriasis treatment[J].Evid Based Compl Alternat Med,2013:792840.
[5] Gong Y W,Huang Y F,Zhou L G,et al.Chemical composition and antifungal activity of the fruit oil of Zanthoxylum bungeanum Maxim.(Rutaceae)from China[J].J Essential Oil Res,2014,21:174-178.
[6] Lan Y,Wu Q,Mao Y Q,et al.Cytotoxicity and enhancement activity of essential oil fromZanthoxylum bungeanum Maxim.as a natural transdermal penetration enhancer[J].J Zhejiang Univ Sci B,2014,15(2):153-164.
[7] Huang S,Zhao L,Zhou X L,et al.New alkylamides from pericarps of Zanthoxylum bungeanum[J].Chinese Chem Lett,2014,23:1247-1250.
[8] Lin Z D,Han S N,Jiang J L,et al.Antitumor compound identification fromZanthoxylum bungeanum essential oil based on composition-activity relationship[J].Chem Res Chin Unvi,2013,29(6):1068-1071.
[9] Tezuka Y,Irikawa S,Kaneko T,et al.Screening of Chinese herbal drug extracts for inhibitory activity on nitric oxide production and identification of an active compound of Zanthoxylum bungeanum[J].J Ethnopharmacol,2001,77:209-217.
[10] Zhu R,Wang K,Zeng W,et al.Essential oil composition and antibacterial activity of Zanthoxylum bungeanum[J].African J Microbiol Res,2015,(26):4631-4637.
[11] Koba K,Sanda K,Guyon C,et al.In vitro cytotoxic activity of Cymbopogon citratus L.and Cymbopogon nardus L.essential oils from Togo[J].Bangladesh J Pharmacol,2009,4:29-34.
[12] Jeong H W,Han D C,Son K H,et al.Antitumor effect of the cinnamaldehyde derivative CB403through the arrest of cell cycle progression in the G2/M phase[J].Biochem Pharmacol,2003,65:1343-1350.
[13] Huang L W,Hsieh B S,Cheng H L,et al.Arecoline decreases interleukin-6production and induces apoptosis and cell cycle arrest in human basal cell carcinoma cells[J].Toxicol Appl Pharmacol,2012,258:199-207.
[14] Vermeulen K,Van Bockstaele D R,Berneman Z N.The cell cycle:a review of regulation,deregulation and therapeutic targets in cancer[J].Cell Prolif,2003,36:131-149.
[15] Boehm I.Apoptosis in physiological and pathological skin:implications for therapy[J].Curr Mol Med,2006,6:375-394.
[16] Zhao F,Huang W W,Ousman T,et al.Triptolide induces growth inhibition and apoptosis of human laryngocarcinoma cells by enhancing p53activities and suppressing E6-mediated p53degradation[J].PLoS ONE,2013,8(11):e80784.
[17] Moghadamtousi S Z,Kadir H A,Paydar M,et al.Annona muricataleaves induced apoptosis in A549cells through mitochondrial-mediated pathway and involvement of NF-kappaB[J].BMC Compl Altern Med,2014,14:299.
[18] Chou S T,Peng H Y,hang C T,et al.Zanthoxylum ailanthoides Sieb and Zucc.extract inhibits growth and induces cell death through G2/M-phase arrest and activation of apoptotic signals in colo 205human colon adenocarcinoma cells[J].Anticancer Res,2011,31:1667-1676.

