钙蛋白酶抑制剂对大鼠局灶性脑缺血再灌注损伤的保护作用*
匡重伸 许航 黄征 朱桂云 王胜
钙蛋白酶(calpain)广泛分布于神经系统中,对调控人体正常的生理功能起着重要的作用[1]。属于半胱氨酸蛋白酶超家族中番木瓜蛋白酶家族成员。正常情况下,calpain以无活性的酶原形式存在于休止期细胞中,脑缺血后导致细胞内Ca2+超载而激活,激活后的calpain可通过多种途径导致缺血性脑损伤。随着对缺血性脑损伤分子机制的深入了解,发现calpain在缺血性脑损伤中起着重要作用[2]。本实验采用大鼠大脑中动脉栓塞实验动物模型及侧脑室注射技术,研究calpain抑制剂calpeptin对缺血再灌注后不同时相大鼠神经功能评分、缺血侧海马CA1区神经元凋亡及脑梗死体积,探讨calpain抑制剂在脑缺血再灌注损伤中的神经保护作用及其机制。
1 材料与方法
1.1 材料 健康成年雄性SD大鼠144只,体重250~280 g,由石河子大学实验动物中心提供。随机分为四组,每组36只:缺血/再灌注对照组(MACO组),calpeptin治疗组(calpeptin组),溶剂二甲基亚砜对照组(DMSO组),假手术组(sham组)。每组又分为再灌注后12、24和48 h三小组,每组12只,每个时间点分别取6只大鼠行TTC染色检测脑梗死体积,6只检测海马CA1区神经元凋亡。Calpeptin及DMSO购至calbiochem公司,TUNEL试剂盒购至博士德公司。
1.2 方法
1.2.1 给药方法 手术前大鼠用1%的戊巴比妥钠(40 mg/kg)腹腔注射麻醉后,俯卧固定于脑立体定位仪上,暴露前囟,调节微调旋钮,使微量注射器针尖正对左侧侧脑室(前囟左侧1.8 mm,后0.8 mm),钻孔,将微量注射器下移至软脑膜,缓慢进针4.5 mm,注射calpeptin 50 μg(溶于DMSO 5 μL中)或DMSO 5 μL,注射时间5 min,留针5 min,注射后即进行造模手术。
1.2.2 MCAO模型的建立 参照Belayev等[3]改良的Longa方法制作大鼠大脑中动脉栓塞模型,假手术组尼龙线插入的深度为10 mm,其余步骤相同。手术期间用100 W的白炽灯照射,保持大鼠肛温在36.5~37.5 ℃。2 h后小心拉出尼龙线10 mm即造成再灌注模型,再次扎紧CCA及其内的尼龙线。
1.2.3 神经功能评价 大鼠麻醉清醒后,参考Longa 5分制评分标准在相应的时间点对其进行神经功能评定,0分:无神经损伤体征;1分:不能完全伸展对侧前爪;2分:向对侧转圈;3分:向对侧倾倒;4分:不能自发行走,意识丧失[4]。分值越高说明大鼠行为障碍越严重。
1.2.4 TTC染色测量脑梗死体积 神经功能行为评价完成后,动物麻醉后断头处死,迅速取脑,生理盐水冲洗残血,置0 ℃生理盐水中15 min,再取出置于大鼠脑垫中,去掉鼠脑嗅球、小脑和部分低位脑干,剩余部分由前向后行2 mm厚冠状切片,迅速放入2%TTC溶液中,37 ℃恒温孵育30 min,染色后置10%甲醛中固定。24 h后取出用数码相机拍照脑片两面,输入计算机,用多功能真彩色病理图像分析仪及计算机病理图像分析仪测量脑片两个面的梗死面积(玫瑰红色区为正常脑组织,苍白色区为梗死区),根据梯形法计算出梗死灶体积,各脑片梗死体积之为总的梗死体积。同时计算出每个脑片的体积,每个脑片的体积之和为整个脑体积,梗死体积和脑体积之比为梗死体积百分比。
1.2.5 原位细胞凋亡检测(TUNEL法) 实验动物在设定时间点神经功能评分后经戊巴比妥钠腹腔注射麻醉后,依次用4 ℃生理盐水200 mL及4 ℃ 4%多聚甲醛400 mL经左心室升主动脉灌注,灌注完立即断头取脑,置于4%多聚甲醛中后固定10 h,酒精梯度脱水,石蜡包埋,在海马与齿状回互抱处取材,每隔100 μm连续6 μm切片6张,切片贴附于预处理的载玻片上,用前脱蜡至水。用TUNEL技术检测大鼠缺血侧海马CA1区的神经元凋亡,具体操作方法按说明书进行。在高倍镜(×400)下观察海马CA1区中相互不重叠的4个视野,细胞核中有棕黄色颗粒者为阳性细胞,计数其中阳性细胞数,取均值。每一批实验中设立阳性对照和阴性对照。阳性对照为在TUNEL标记反应前用DNaseⅠ(1 mg/mL)37 ℃温箱孵育切片20 min,结果细胞核呈阳性。阴性对照为TUNEL标记反应液中省去TUNEL反应混合液,而只加标记液,结果细胞不显色。
1.3 统计学处理 所有数据使用SPSS 17.0统计软件包进行统计分析,计量资料以(x-±s)表示,数据比较用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 大鼠神经功能学评分 sham组大鼠苏醒后未见明显的神经功能学缺失,MCAO组麻醉苏醒后即有明显的神经功能缺失,再灌注24 h神经功能缺失最为严重。DMSO组与MCAO对照组相比较差异无统计学意义,各时间点的calpeptin处理组与同时间点MCAO组及DMSO组相比神经功能有明显改善,但仍高于sham组。见表1。
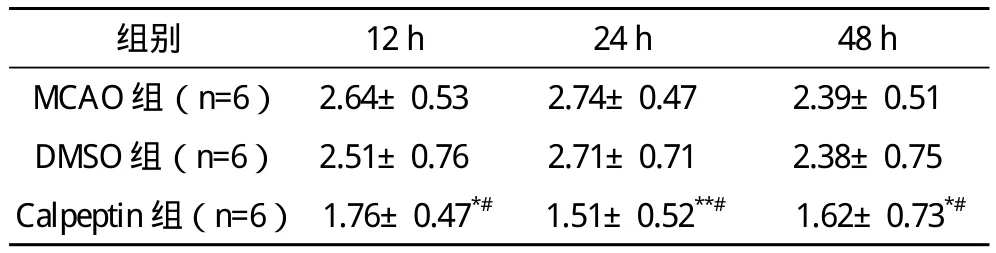
表1 各组大鼠不同再灌注时间点的神经功能评分比较(x-±s) 分
2.2 海马CA1区神经元凋亡 TUNEL技术检测发现,sham组有少量的神经元凋亡,MCAO组在缺血2 h再灌注12 h即可检测到明显的神经元凋亡,在24 h达高峰,DMSO组与同时间点的MCAO组相比差异无统计学意义,各时间点calpeptin组与同时间点MCAO组及DMSO组比较,凋亡的神经元显著减少。见表2。
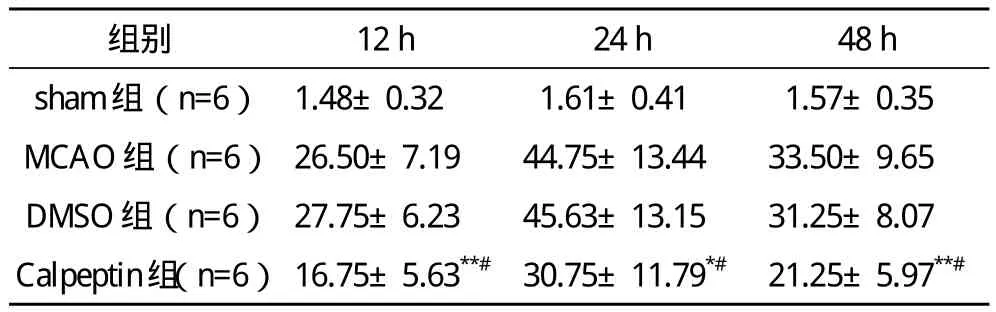
表2 各组大鼠不同时间点缺血侧海马CAN1区神经元凋亡比较(x-±s)
2.3 脑梗死体积 sham组未见明显的梗死灶,MCAO组可见比较恒定的白色梗死区,梗死部位主要集中在额顶区皮质、尾壳核背外侧。DMSO组与同时间点的MCAO组相比梗死体积差异无统计学意义,各再灌注时间点calpeptin处理组与同时间点MCAO组及DMSO组相比,梗死体积显著减小。见表3。
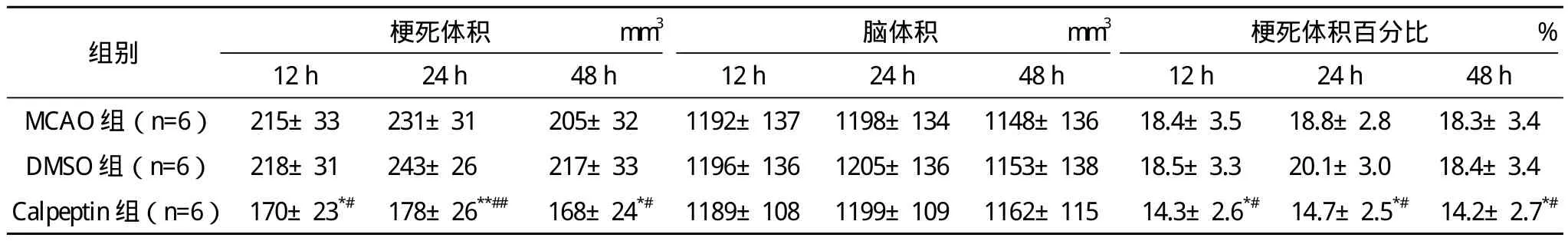
表3 各组大鼠不同时间点脑梗死体积比较(x-±s)
3 讨论
缺血性脑血管病是严重危害人类健康的疾病之一,其病理生理过程涉及多种毒性级联过程[5]。calpain在缺血性脑损伤中起着重要的作用而备受关注,是近年来研究的热点之一[6]。calpain分为calpainⅠ(又称μ-calpain)和calpainⅡ(又称m-calpain)两种类型,可分别被微摩尔和毫摩尔水平的Ca2+激活[7],在生理状态下,calpain以酶原的形式存在于细胞质中[8],在病理情况下(如脑缺血等),细胞内Ca2+超载,Ca2+与calpain催化区的特异性钙调蛋白样位点结合引起构象改变,从而使其激活,激活后的calpain可水解关键的细胞骨架蛋白而导致细胞死亡[9]。有研究发现猴子短暂性全脑缺血后,海马CA1区神经元内μ-calpain大量激活,激活后的μ-calpain可水解溶酶体膜连接蛋白,导致溶酶体破裂,导致水解酶大量释放,造成神经元坏死[10]。激活后的calpain还可引起线粒体渗透性转变,导致细胞死亡。
以往一直认为calpain主要参与细胞坏死,但越来越多的证据表明它也在凋亡中也起着重要作用。有研究发现钙蛋白酶抑制剂PD1506可显著抑制培养的神经胶质母细胞瘤细胞及海马神经元的凋亡,说明calpain参与了神经元的凋亡的发生[11]。
本研究通过检测脑梗死体积、神经元的凋亡、神经功能评分3项指标,显示侧脑室注射calpeptin可显著减少MCAO术后大鼠脑梗死体积及海马CA1区神经元的凋亡,并可改善大鼠的神经功能。进一步证实calpain抑制剂对大鼠局灶性脑缺血再灌注损伤有显著的脑保护作用,并且calpeptin抑制脑缺血后神经元凋亡可能是其脑保护作用的机制之一。calpain参与脑缺血后神经元凋亡的机制目前尚不很清楚,目前认为其可能的机制有:(1)促进caspase-3激活从而导致细胞凋亡[12];(2)可激活促凋亡蛋白bax促进细胞凋亡[13];(3)引起bax/bcl-2的比率增高[14];(4)calpain还可能参与细胞凋亡过程中的DNA的阶梯性裂解及染色体的聚集[15]。本实验中calpeptin是通过何种途径抑制缺血后海马CA1区的神经元凋亡尚不清楚,有待于进一步的研究。脑缺血损伤机制复杂,在过去的十年,国内外学者在关于calpain在脑缺损伤中的作用机制方面进行了大量的研究,有学者认为,calpain将成为治疗脑损伤的一个重要靶点,研究开发新型的、副作用小、特异性强的calpain抑制剂,并用于人类临床治疗中,将为脑缺血治疗带来新的希望。
[1] Sheldon R A, Sadjadi R, Lam M, et al. Alteration in downstream hypoxia gene signaling in neonatal glutathione peroxidase overexpressing mouse brain after hypoxia-ischemia[J]. Developmental Neuroscience,2015,37(4-5):398-406.
[2] Li H, Zhang N, Sun G, et al. Inhibition of the group Ⅰ mGluRs reduces acute brain damage and improves long-term histological outcomes after photothrombosis-induced ischaemia[J]. ASN Neuro,2013,5(3):195-207.
[3] Belayev L, Alonso O F, Busto R, et al. Middle cerebral artery occlusion in the rat by intraluminal suture: neurological and pathological evaluation of an improved model[J]. Stroke,1996,27(9):1616-1623.
[4] Bederson J B, Pitts L H, Tsuj M, et al. Rat middle cerebral artery occlusion evaluation of the model and development of a neurologic evaluation[J]. Stroke,1986,17(3):472-476.
[5] Suzuki S, Murotomi K, Nakajima Y, et al. Development of an artificial calcium-dependent transcription factor to detect sustained intracellular calcium elevation[J]. ACS Synthetic biology,2014,3(10):717-722.
[6] Ding Z J, Chen X, Tang X X, et al. Calpain inhibitor PD150606 attenuates glutamate induced spiral ganglion neuron apoptosis through apoptosis inducing factor pathway in vitro[J]. PloS One,2015,10(4):e0 123 130.
[7] Sonobe T, Akiyama T, Du C K, et al. Contribution of calpain to myoglobin efflux from cardiomyocytes during ischaemia and after reperfusion in anaesthetized rats[J]. Acta Physiologica,2014,210(4):823-831.
[8] Song Y J, Li D, Pan L P, et al. The suppression of epileptiform discharges in cultured hippocampal neurons is regulated via alterations in full-length tropomyosin-related kinase type B receptors signalling activity[J]. The European Journal of Neuroscience,2014,40(3):2564-2575.
[9] Clinkinbeard T, Ghoshal S, Craddock S, et al. Calpain cleaves methionine aminopeptidase-2 in a rat model of ischemia/reperfusion[J].Brain Research,2013,1499(11):129-135.
[10] Yamashima T, Tonchev A B, Tsukada T, et al. Sustained calpain activation associated with lysosomal rupture executes necrosis of the postischemic CA1 neurons in primates[J]. Hippocampus,2003,13(7):791-800.
[11] Aggeli I K, Zacharias T. Calcium paradox induces apoptosis in the isolated perfused Rana ridibunda heart: involvement of p38-MAPK and calpain[J]. Canadian Journal of Physiology and Pharmacology,2013,91(12):1095-1106.
[12] Sheng P, Kuang Z S, Yan Z, et al. The protective effects and potential mechanism of Calpain inhibitor Calpeptin against focalcerebral ischemia-reperfusion injury in rats[J]. Mol Biol Rep,2011,38(2):905-912.
[13] Song Y J, Li D, Pan L P, et al. The suppression of epileptiform discharges in cultured hippocampal neurons is regulated via alterations in full-length tropomyosin-related kinase type B receptors signalling activity[J]. The European Journal of Neuroscience,2014,40(3):2564-2575.
[14] Kim C, Yun N, Lee Y M, et al. Gel-based protease proteomics for identifying the novel calpain substrates in dopaminergic neuronal cell[J]. J Biol Chem,2013,288(51):36 717-36 732.
[15] Samantaray S, Patel K S, Knaryan V H, et al. Calpain inhibition prevents ethanol-induced alterations in spinal motoneurons[J].Neurochem Res,2013,38(8):1734-1741.

