醋酸与环己烯酯化合成醋酸环己酯宏观动力学
陈幸福,陈 献,汤吉海,费兆阳,2,崔咪芬,乔 旭,2
(1. 南京工业大学 化学化工学院,江苏 南京 210009;2. 南京工业大学 材料化学工程国家重点实验室,江苏 南京 210009)
醋酸与环己烯酯化合成醋酸环己酯宏观动力学
陈幸福1,陈 献1,汤吉海1,费兆阳1,2,崔咪芬1,乔 旭1,2
(1. 南京工业大学 化学化工学院,江苏 南京 210009;2. 南京工业大学 材料化学工程国家重点实验室,江苏 南京 210009)
以磺酸型苯乙烯阳离子交换树脂(D006型)为催化剂,醋酸与环己烯直接加成酯化制备醋酸环己酯。考察了环己烯-醋酸、醋酸环己酯-醋酸2个二组分物系的吸附平衡常数之间的关系。在消除外扩散影响的条件下,研究醋酸与环己烯加成酯化反应的宏观反应动力学,在搅拌转速600 r/min、反应温度343.15~363.15 K、催化剂用量(w)5%~15%的范围内测定了宏观反应动力学数据。采用LHHW动力学模型进行数据回归,得到醋酸与环己烯加成酯化反应的指数前因子和活化能分别为5.33×109L2/(mol·g·min)和93.06 kJ/mol,该酯化反应为放热反应,标准反应焓为-40.51 kJ/mol。该模型通过了统计检验,表明模型可靠。
醋酸环己酯;环己烯;醋酸;加成酯化;宏观动力学;树脂催化剂
环己醇是优良的中高沸点有机化工产品,是生产尼龙的重要中间体[1]。传统的环己醇制备方法主要有环己烷氧化法和苯酚加氢法,目前工业中大多使用环己烷氧化法[2]。日本旭化成公司开发了苯部分加氢生产环己烯、再由环己烯水合生产环己醇的新工艺。该工艺的反应物全部转化为产物,节能减排,反应过程安全[3]。但环己烯与水不互溶,需加入1,4-二氧六环等作为助溶剂增加环己烯在水中的溶解度[1,4],即使如此,受反应平衡的限制,仍存在环己烯转化率低、反应温度高、反应后产物环己醇与助溶剂不易分离等缺点[5-6]。
Steyer等[7-8]提出了由环己烯生产环己醇的间接法工艺,即以甲酸为夹带剂、磺酸树脂为催化剂,通过酯化、水解两步反应制备环己醇的反应精馏工艺。湖南长岭石化科技开发有限公司[9]开发了由C1~4羧酸与环己烯先酯化、再经酯交换反应生产环己醇及相应的羧酸酯的反应精馏工艺。Animesh等[10]研究了Amberlyst-15催化剂催化醋酸与环己烯酯化、Filtrol-24催化剂催化醋酸环己酯与正丁醇酯交换反应的动力学。汤吉海等[11-13]研究了树脂、SO3H-SBA-15催化剂催化(甲基)丙烯酸等不饱和羧酸与环己烯的酯化反应工艺。上述研究结果表明,饱和与不饱和的短链羧酸均能与环己烯酯化生成羧酸环己酯。
醋酸是一种价廉易得的羧酸,相比于甲酸不易分解,也比(甲基)丙烯酸等不饱和羧酸稳定,是一种用于环己烯间接法生产环己醇的优异的反应夹带剂。阳离子交换树脂在酯化反应中表现出良好的活性和选择性,同时化学稳定性较高,具有不腐蚀设备、无污染、易分离和可再生重复利用等优点,在工业上得到了较为广泛的应用[14]。
本工作以磺酸型苯乙烯阳离子交换树脂为催化剂,在消除外扩散影响的情况下,测定了醋酸与环己烯直接加成酯化合成醋酸环己酯的宏观反应动力学数据,建立了LHHW模型,拟合得到动力学参数,为醋酸与环己烯酯化生产醋酸环己酯的反应器设计和反应精馏集成工艺的开发提供参考。
1 实验部分
1.1 催化剂及原料
醋酸:化学纯,上海凌峰化学试剂有限公司;环己烯:化学纯,国药集团化学试剂有限公司;磺酸型苯乙烯阳离子交换树脂: D006型,河北凯瑞化工有限责任公司。
1.2 分析方法
采用浙江福立化工仪器有限公司FULI-9750型气相色谱仪分析反应产物,FID检测,XE-60毛细管色谱柱(30 m×0.32 mm×0.25 μm)。分析条件:载气为N2,柱前压0.1 MPa,汽化室温度200 ℃,检测器温度200 ℃,柱温60 ℃。程序升温参数设置:初温60 ℃,保留3 min;以40 ℃/min的升温速率升至120 ℃,保留1 min;再以40 ℃/min的升温速率升至终温150 ℃,保留1 min。以甲苯为内标进行定量分析。
1.3 实验方法
称取适量的树脂催化剂置于真空干燥箱中,在温度60 ℃、真空度-0.095 MPa下干燥24 h,备用。酯化反应器采用500 mL四口烧瓶,向其中一次性加入干燥好的树脂催化剂、原料醋酸和环己烯。加热至设定温度后搅拌并开始计时,反应过程中间隔一定时间取样分析。
2 动力学模型
2.1 动力学模型
以醋酸与环己烯为原料合成醋酸环己酯的反应方程式见式(1)。
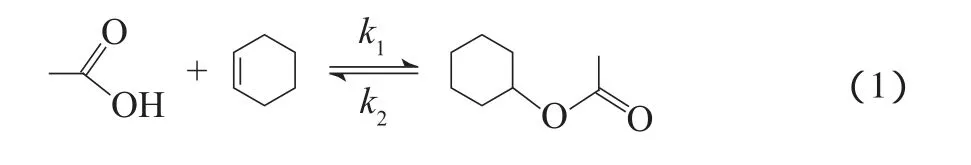
采用LHHW模型研究酯化反应动力学行为,LHHW模型考虑环己烯与醋酸同时吸附在催化剂表面,反应发生在吸附在催化剂表面的两组分之间,模型方程式见式(2):

式中,与温度相关的反应速率常数可由Arrhenius方程式(3)表示。

将式(3)代入式(2)可得基于催化剂质量的醋酸环己酯生成速率表达式(4)。

2.2 反应平衡常数
化学反应平衡常数由标准反应吉布斯自由能及反应温度决定[15-16],见式(5)[17]。

将醋酸与环己烯摩尔比(简称酸烯摩尔比)为3∶1时的反应平衡常数(见表1)对式(3)进行拟合,可得温度与反应平衡常数的关系式为:Keq=exp(4 873/T-13.813)。因此标准反应焓和熵分别为-40.51 kJ/mol和-114.84 J/(mol·K)。标准反应焓为负值表明该反应为放热反应,与文献报道的标准反应焓-37.56 kJ/mol[8,18-19]相近。

表1 反应平衡常数Table 1 Thermodynamic equilibrium constants
2.3 吸附平衡常数
对于二组分混合物,总物料平衡提供了如式(6)所示的复合等温线方程[20]。

式中,n0,Δx,m,x1,x2均可由实验测定,但和无法测量。为得到与的关系,假设液相是非理想的,固相是理想的,设K12为2个组分独立吸附过程吸附平衡常数的比值,可得式(7)[21]:

根据两组分的吸附实验数据对式(7)进行拟合得到ns和K12(见表2),拟合曲线见图1。由表2可看出,醋酸环己酯和环己烯与醋酸的吸附平衡常数之比分别为2.512 3和5.211 2,即KB= 5.211 2KA,KC= 2.269 5KA。
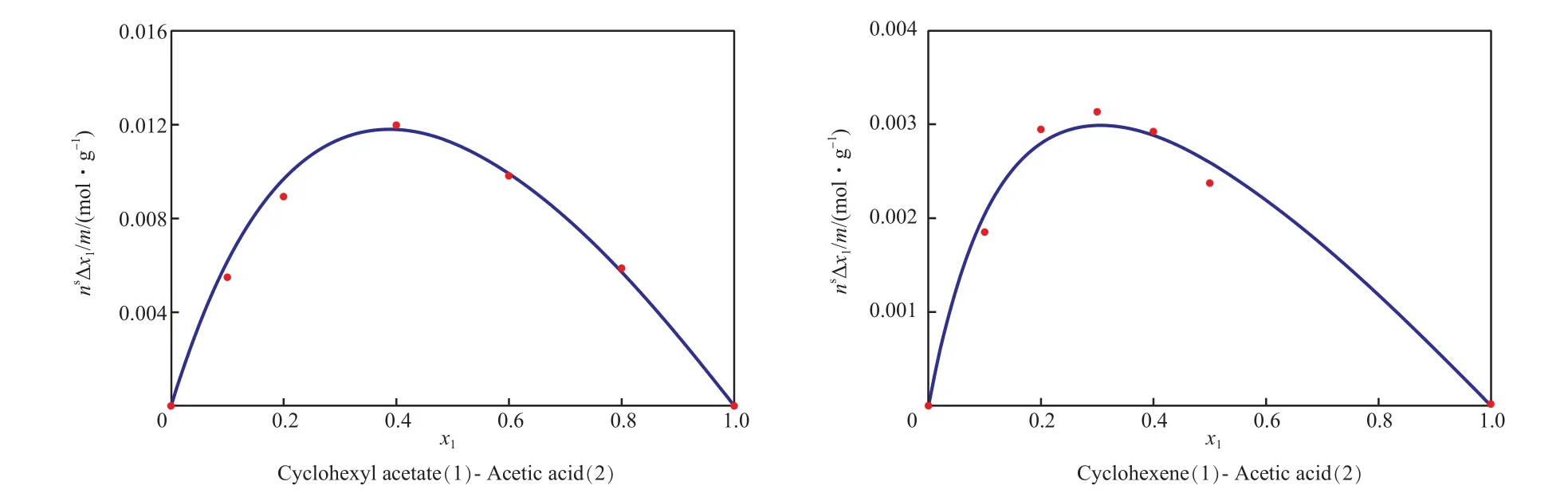
图1 二组分物系吸附实验拟合曲线Fig.1 Fitting curves of adsorption experiments for the binary systems.

表2 吸附实验数据关联结果Table 2 Correlated results of the adsorption data
3 结果与讨论
3.1 外扩散影响的消除
为消除外扩散的影响,将反应限制在动力学控制区域内。在釜式反应器中,线速度由搅拌转速决定,因此采用不同转速进行实验,实验结果见图2。由图2可看出,当搅拌转速从200 r/min增至400 r/min时,环己烯转化率随搅拌转速的增大而显著增大;而当搅拌转速在400 r/min以上时,环己烯转化率几乎不变。因此可认为,搅拌转速在400 r/min时已消除外扩散影响;且醋酸环己酯的选择性大于97.8%,可忽略环己烯二聚副反应。故下述动力学实验选择在搅拌转速600 r/min下进行。

图2 搅拌转速对环己烯转化率和醋酸环己酯选择性的影响Fig.2 Effects of stirring speed on the conversion of cyclohexene(XB)and the selectivity to cyclohexyl acetate(SC).
3.2 动力学模型参数估算
结合吸附平衡常数、反应平衡常数及式(4)可得到微分方程(8):
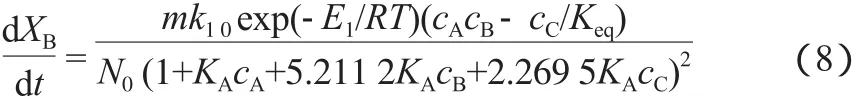
采用Runge-Kutta法对式(8)进行求解,再用各物质浓度的计算值与实验值之差的平方和作为目标函数,并采用非线性最小二乘法使目标函数平方和最小进行拟合得到模型参数。LHHW模型拟合结果见表3。

表3 动力学模型参数估算结果Table 3 Calculated values of kinetics parameters
3.3 拟合结果
模型拟合值与实验值的对比见图3~5。从图3~5可看出,实验值均匀地分布在拟合曲线的两侧,表明LHHW模型的适应性良好。
反应温度是动力学实验的重要影响因素,升高反应温度对加快反应速率有利。由图3(a)可看出,在363.15 K下反应300 min后达到平衡,而在358.15 K下反应540 min后才接近平衡。从图3(a)还可看出,随反应温度的降低,环己烯的平衡转化率提高,说明该反应为可逆放热反应。从图4可看出,催化剂用量对反应的影响显著,在其余条件相同的情况下,催化剂用量由10%(w)增至15%(w)时,反应速率明显加快。从图5可看出,反应物初始摩尔比同样是动力学实验的重要影响因素,反应速率随酸烯摩尔比的增大而加快,酸过量时再继续增加酸烯摩尔比对反应速率的影响程度逐渐减小。

图3 反应温度对环己烯转化率的影响Fig.3 Effects of reaction temperature on the cyclohexene conversion.
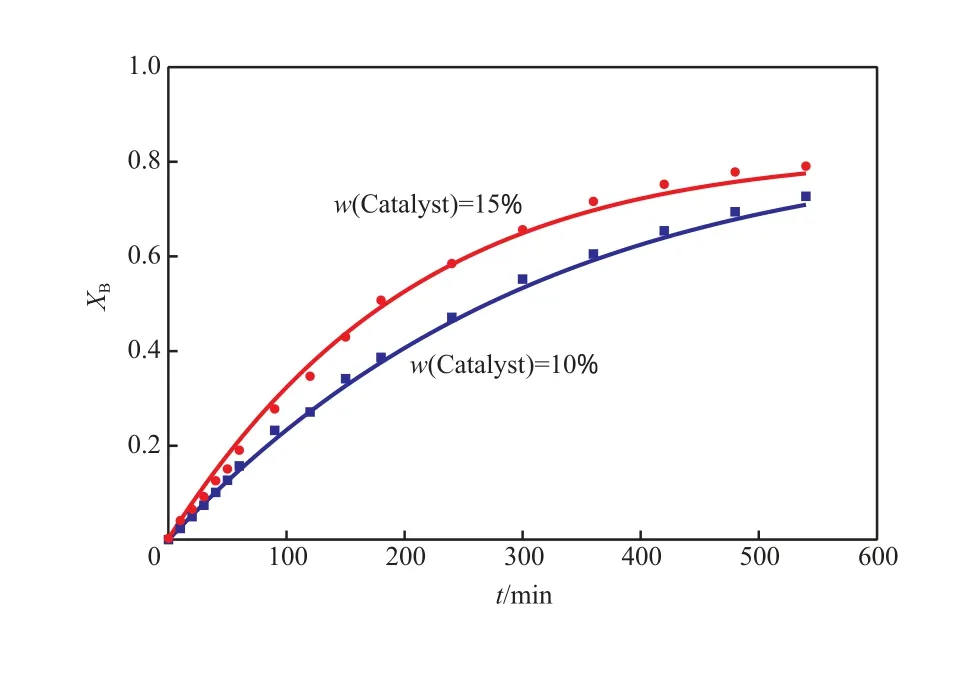
图4 催化剂用量对环己烯转化率的影响Fig.4 Effects of catalyst dosage on the cyclohexene conversion.

图5 酸烯摩尔比对环己烯转化率的影响Fig.5 Effects of the initial mole ratio of acetic acid to cyclohexene on the cyclohexene conversion.
3.4 模型检验
为检验动力学方程的适用性,采用F统计检验进行分析。F0.05为相应自由度下显著水平为5%的F值,是回归均方和与模型计算误差均方和之比,可判别是否存在对回归均值的偏差。当F>10F0.05时,模型对实验结果的预测性较好。ρ2为决定性指标,可判断测试结果对回归均值总偏离的大小,ρ2越接近1越好。模型统计检验结果见表4。由表4可看出,该模型的ρ2=0.999>0.9,F=309 58>>10F0.05,说明LHHW模型的统计检验结果是显著的,该模型可靠。
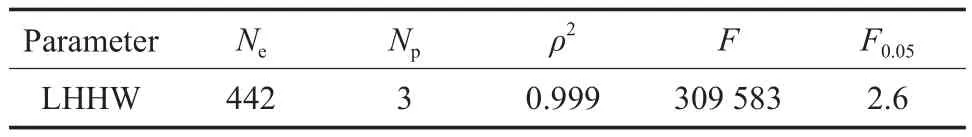
表 4 统计检验结果Table 4 Results of statistic test
4 结论
1)使用磺酸型苯乙烯阳离子交换树脂(D006型)催化醋酸与环己烯直接加成酯化。在温度363.15,358.15,353.15 K时反应达到平衡,根据反应平衡常数得到反应平衡方程:Keq=exp(4 873/ T-13.813),并得到标准反应焓和熵分别为-40.51 kJ/mol和-114.84 J/(mol·K)。各组分吸附平衡常数为:KA= 0.043 7,KB= 5.211 2KA,KC= 2.269 5KA。
2)在消除外扩散影响的情况下,通过测定醋酸、环己烯及醋酸环己酯浓度随时间的变化,采用 LHHW 模型进行数据回归,得到酯化反应的指数前因子和活化能分别为5.33×109L2/(mol·g·min)和93.06 kJ/mol。
符 号 说 明
cA醋酸的浓度,mol/L
cB环己烯的浓度,mol/L
cC醋酸环己酯的浓度,mol/L
E1活化能,J/mol
F 回归均方和与模型计算误差均方和之比
F0.05相应自由度下显著水平为5%的F值
ΔG■标准吉布斯自由能,J/mol
ΔH■标准反应焓,J/mol
KA醋酸的吸附平衡常数
KB环己烯的吸附平衡常数
KC醋酸环己酯的吸附平衡常数
Keq热力学反应平衡常数
K12组分1,2的吸附平衡常数的比值
k1正反应速率常数,L2/(g ·min·mol)
k10正反应的指数前因子,L2/(g ·min·mol)
m 催化剂的质量,g
N0环己烯的初始物质的量,mol
Ne实验数据组数
NP待估模型参数个数
n0溶液中组分的原始物质的量,mol
R 理想气体常数,J/(mol·K)
r 醋酸与环己烯的摩尔比
rC醋酸环己酯的生成速率,mol/(g·min)
SC醋酸环己酯选择性,%
ΔS■标准反应熵,J/(mol·K)
T 温度,K
t 时间,min
XB环己烯的转化率,%
xi溶液中组分i的摩尔分数
Δx 溶液中组分摩尔分数的变化量
ρ2决定性指标
[1] Qiu Ting,Kuang Chenhui,Li Chenggang,et al. Study on Feasibility of Reactive Distillation Process for the Direct Hydration of Cyclohexene to Cyclohexanol Using a Cosolvent[J]. Ind Eng Chem Res,2013,52(24):8139 - 8148.
[2] 靳敬敬,李芳,杨丽红,等.HZSM-5催化乙酸环己酯水解反应[J].石油学报,2014,30(1):169 - 174.
[3] Malone M F,Doherty M F. Reactive Distillation[J]. Ind Eng Chem Res,2000,39(11):3953 - 3957.
[4] Qiu Ting,Wang Xiaoda,Tian Hui,et al. Liquid-Liquid Equilibrium for the System Water+1,4-Dioxane+Cyclohexanol over the Temperature Range of 313.2-343.2 K[J]. Fluid Phase Equilib,2012,32(4):28 - 32.
[5] Ye Jianchu,Li Jun,Sha Yong,et al. Evaluation of Reactive Distillation and Side Reactor Confguration for Direct Hydration of Cyclohexene to Cyclohexanol[J]. Ind Eng Chem Res,2014,53(4):1461 - 1469.
[6] 石宇飞,刘杨青,魏会娟,等.焙烧温度对HZSM-5催化剂催化环己烯水合反应性能的影响[J].石油化工,2013,42(12):1373 - 1377.
[7] Steyer F,Freund H,Sundmacher K. A Novel Reactive Distillation Process for the Indirect Hydration of Cyclohexene to Cyclohexanol Using a Reactive Entrainer[J]. Ind Eng Chem Res,2008,47(23):9581-9587.
[8] Steyer F,Sundmacher K. Cyclohexanol Production via Esterif -cation of Cyclohexene with Formic Acid and Subsequent Hydration of the Esters Reaction Kinetics[J]. Ind Eng Chem Res,2007,46(4):1099 - 1104.
[9] 湖南长岭石化科技开发有限公司.一种由环己烯制备环己醇的方法:中国,103232325 A[P]. 2013 - 04 - 18.
[10] Animesh C,Man M S. Cyclohexanol from Cyclohexene via Cyclohexyl Acetate: Catalysis by Ion-Exchange Resin and Acid-Treated Clay[J]. React Polym,1992,18(2):107 -115.
[11] 汤吉海,许燕,周峰,等. 阳离子交换树脂催化合成丙烯酸环己酯[J]. 现代化工,2011,31(8):57 - 59,61.
[12] Zhou Feng,Tang Jihai,Fei Zhaoyang,et al. Eff cient Cyclohexyl Acrylate Production by Direct Addition of Acrylic Acid and Cyclohexene over SBA-15-SO3H[J]. J Porous Mater,2014,21(2):149 - 155.
[13] 许燕,汤吉海,周峰,等. 树脂催化甲基丙烯酸与环己烯反应合成甲基丙烯酸环己酯[J].石油化工,2011,40(10):1042 - 1045.
[14] 刘勇,杨浩,陈蔚萍,等.强酸性阳离子交换树脂催化合成乙酸异辛酯动力学[J].石油化工,2013,42(6):620 - 624.
[15] Shan Xianglei,Cheng Zhenmin,Yuan Peiqing. Reaction Kinetics and Mechanism for Hydration of Cyclohexene over Ion-Exchange Resin and H-ZSM-5[J]. Chem Eng J,2011,175:423 - 432.
[16] Ostaniewicz-Cydzik A M,Pereira C S M,Molga E,et al. Reaction Kinetics and Thermodynamic Equilibrium for Butyl Acrylate Synthesis from n-Butanol and Acrylic Acid[J]. Ind Eng Chem Res,2014,53(16):6647 - 6654.
[17] Mao Wei,Wang Xiaolei,Wang Hua,et al. Thermodynamic and Kinetic Study of tert-Amyl Methyl Ether(TAME) Synthesis[J]. Chem Eng Process,2008,47(5):761 - 769.
[18] Steel W V,Chirico R D,Cowell A B,et al. Thermodynamic Properties and Ideal-Gas Enthalpies of Formation for 2-Aminoisobutyric Acid(2-Methylalanine),Acetic Acid,(4-Methyl-3-Penten-2-one),4-Methylpent-1-ene,2,2′-Bis(Phenylthio)Propane,and Glycidyl Phenyl Ether(1,2-Epoxy-3-Phenoxypropane)[J]. J Chem Eng Data,1997,42(6):1052 - 1066.
[19] Simirskii V V,Kozyro A A,Kabo G Y,et al. Thermodynamic Properties and Saponification Kinetics of Cyclohexyl Acetate[J]. J Appl Chem USSR,1992,65(72):1348 -1353.
[20] Lee M,Chou P,Lin H. Kinetics of Synthesis and Hydrolysis of Ethyl Benzoate over Amberlyst 39[J]. Ind Eng Chem Res,2005,44(4):725 - 732.
[21] Song W,Venimadhavan G,Manning J M,et al. Measurement of Residue Curve Maps and Heterogeneous Kinetics in Methyl Acetate Synthesis[J]. Ind Eng Chem Res,1998,37(5):1917 - 1928.
(编辑 安 静)
Macrokinetics for Synthesis of Cyclohexyl Acetate by Esterification of Cyclohexene and Acetic Acid
Chen Xingfu1,Chen Xian1,Tang Jihai1,Fei Zhaoyang1,2,Cui Mifen1,Qiao Xu1,2
(1. College of Chemistry and Chemical Engineering,Nanjing Technology University,Nanjing Jiangsu 210009,China;2. State Key Laboratory of Materials-Oriented Chemical Engineering,Nanjing Technology University,Nanjing Jiangsu 210009,China)
Cyclohexyl acetate was synthesized by the addition esterification of cyclohexene and acetic acid using sulfonic acid type styrene cation exchange resin(D006) catalyst. The adsorption equilibriums of two binary systems,namely cyclohexene-acetic acid and cyclohexyl acetate-acetic acid were investigated,and the macrokinetics of the esterif cation reaction were studied,in which the influence of the external diffusion was eliminated. The experimental data for the esterification macrokinetics were determined under the conditions of stirring speed of 600 r/min,temperature of 343.15-363.15 K and catalyst dosage of 5%-15%(w). A LHHW macrokinetics model was established and the model parameters were regressed with the experimental data. The results showed that the pre-exponential factor and the activation energy of the esterification reaction were 5.33×109L2/(mol·g·min) and 93.06 kJ/mol,respectively. The esterif cation reaction is exothermal reaction and the standard reaction enthalpy is -40.51 kJ/mol. Furthermore,the statistical test indicated that the macrokinetics model was reliable.
cyclohexyl acetate;cyclohexene;acetic acid;addition esterif cation;macrokinetics;resin catalyst
1000 - 8144(2015)07 - 0833 - 06
TQ 013.2
A
2015 - 01 - 05;[修改稿日期] 2015 - 04 - 06。
陈幸福(1988—),男,江苏省连云港市人,硕士生。联系人,汤吉海,电话 025 - 83587166,电邮 jhtang@njtech.edu.cn。
国家自然科学基金项目(21276126,61203020)。

