二甲苯诱导大鼠肾损伤模型的建立
徐忠秀 曹香华 王生余 曾彩虹 朱小东 刘志红 秦卫松
二甲苯诱导大鼠肾损伤模型的建立
徐忠秀 曹香华 王生余 曾彩虹 朱小东 刘志红 秦卫松
目的:建立二甲苯诱导肾损伤的大鼠模型,观察吸入二甲苯对大鼠肾脏损伤的病理特点。方法:选择雄性SD大鼠,吸入二甲苯2次/d,3h/次。分别收集吸入二甲苯4、6、8、10、12周各个时间点大鼠的尿液、血清和肾组织,检测24h尿蛋白、生化指标和尿N-乙酰-β-D-氨基葡萄糖苷酶(NAG)/肌酐;行肾组织光镜和电镜观察肾小管和肾小球病变,免疫荧光染色观察足细胞裂孔膜蛋白podocin和骨架蛋白synaptopodin表达和分布变化。结果:(1)大鼠吸入二甲苯3周开始出现蛋白尿,8~9周尿中蛋白量达到最高(34.78±2.91 mg/24h),此后蛋白尿维持在一个相对恒定的水平;(2)实验大鼠尿NAG酶在吸入二甲苯2周后开始升高,第4周增高最为显著,并且达最高水平[25.03±4.88 U/(g·cr)]。(3)吸入二甲苯的大鼠总蛋白、白蛋白、肌酐和谷丙转氨酶与正常对照组相比没有显著差异,大鼠谷草转氨酶较正常对照组明显升高;吸入二甲苯12周,血清尿素氮与正常对照组相比增高。(4)光镜下观察可见肾小管上皮细胞空泡变性,肾小管细胞刷状缘脱落、扁平,部分小管上皮细胞崩解,脱落至管腔中。肾小球未见明显异常。超微结构观察可见多处肾小管上皮细胞刷状缘脱落,上皮细胞崩解,线粒体肿胀,基质电子密度降低,嵴移向周围,变短及数量减少。肾小球足细胞节段足突融合。(5)大鼠吸入二甲苯肾组织免疫荧光染色,可见肾小球足细胞裂孔膜蛋白podocin和骨架蛋白synaptopodin荧光强度减弱,表达呈现不连续颗粒样分布。
结论:成功建立了大鼠吸入二甲苯的肾损害模型,初步证实吸入二甲苯能够导致肾脏损伤,大鼠出现蛋白尿,肾小管上皮细胞损伤明显,肾小球足细胞节段损伤,肾小管损伤程度明显重于肾小球。
二甲苯大鼠蛋白尿肾小管肾小球Corresponding author:QINWeisong(E-mail:qinweisong@163.com)
近年来,由于接触有机溶剂导致的肾病发病率逐年增加,这些患者均以水肿、大量蛋白尿起病,对常规的免疫抑制剂无效,部分患者在脱离接触后,经积极的治疗后症状很快缓解,但也有很多患者很快进入终末期肾病(ESRD)[1]。到目前为止,对于有机溶剂引起肾脏损害的机制还不十分清楚。
有机溶剂是多种化学物质的组成成分,具有溶解油类、脂肪类、树脂类和纤维素的能力,广泛用于生产和生活中。有机溶剂的挥发性和亲脂性使其易对生物体产生毒性作用。有机溶剂进入人体主要是通过呼吸和皮肤接触,可引起机体多种器官和组织损害,例如造血系统、神经系统、肝脏、肾脏和脂肪含量丰富的组织[2-5]。
在实际生产和生活中使用的有机溶剂大多为混合液,其中各种物质所占的比例并不完全相同,因此有接触史的肾脏疾病患者虽然临床表现多以肾病综合征为主[1],但病理表现多种多样,可见系膜增生性病变、膜增殖性肾炎、膜性肾病及抗肾小球基膜肾炎等[6],也可见到肾小管损害[7]。我们既往研究证实,大鼠吸入混合有机溶剂可出现明显的肾脏损害,如可出现蛋白尿,病理观察可见到肾小管及肾小球足细胞出现不同程度损伤[8]。为了进一步研究有机溶剂导致肾脏损害的机制,需要建立单一一种有机溶剂肾损害的模型。
在本研究中,我们选择二甲苯开展进一步研究。二甲苯无色透明,具有芬芳气味,略带甜味、易挥发,油漆、喷漆、橡胶、皮革等工业广泛用作溶剂或稀释剂。由于国家对油漆等材料中苯的含量制定了严格的标准,因此近年来油漆等有机溶剂的污染主要以二甲苯超标为主。有研究发现二甲苯暴露可能会通过氧化应激途径引起肾小管上皮细胞坏死,最终导致肾衰竭[9],但是对二甲苯引起的肾脏损害尚缺乏系统深入的研究。
材料与方法
动物分组和实验设计选用4~6周龄雄性SD大鼠57只(南京军区南京总医院实验动物中心提供),体质量140~160g。大鼠被随机分为对照组(7只)和实验组(50只),实验组又分为5个时间点,分别为吸入二甲苯4、6、8、10、12周,每个时间点10只大鼠。实验期间,房间温度恒定在25℃左右,湿度70%,昼夜交替,大鼠自由进食、饮水,保持垫料干燥。
二甲苯吸入方法实验中我们选用两个特制木箱(80 cm×80 cm×50 cm),每箱放入2笼大鼠,每笼5只,笼内放2个平皿,平皿中加入一定量的二甲苯,使其完全挥发,计算后笼内有机溶剂二甲苯的总浓度为15 000 PPM。实验大鼠每日吸入两次,上下午各3h。
标本留取每周留取大鼠24h尿和随机尿,随机尿用于尿蛋白定量和N-乙酰-β-D-氨基葡萄糖苷酶(NAG)检测。实验终点,用氯胺酮麻醉大鼠,通过心脏穿刺,采血并置非肝素化采血管。用生理盐水经心脏灌洗,迅速分离出肾脏,分别留取肾组织用于光镜、电镜、免疫荧光观察。分离出血清,用于生化分析。
尿液检测
尿蛋白定量尿蛋白检测采用双缩脲法。具体步骤如下:(1)标准曲线的测定:取12支试管分两组,分别加入0,0.2,0.4,0.6,0.8,1.0 ml的标准蛋白质溶液(1mg/ml,BSA),用水补足到1毫升,然后加入4 ml双缩脲试剂。充分摇匀后,在室温(20~25℃)下放置30min,于540 nm处进行比色测定。用未加蛋白质溶液的第一支试管作为空白对照液。取两组测定的平均值,以蛋白质的含量为横坐标,光吸收值为纵坐标绘制标准曲线。(2)样品的测定:取2~3个试管,用上述同样的方法,测定未知样品的蛋白质浓度。随机尿NAG酶检测采用对硝基苯酚比色法检测大鼠尿样中NAG酶的活性。NAG的活力以国际单位表示,即1L样品中的NAG在37℃水解底物,每分钟生成1μmol/L的对硝基苯酚相当1μ/L。
血清生化分析采用HITACHI 7080自动生化分析仪,检测血清总蛋白(TP)、白蛋白(Alb)、肌酐(Scr)、尿素氮(BUN)、谷草转氨酶(AST)和谷丙转氨酶(ALT)。
肾组织病理
光镜检查处死大鼠,取其肾脏经肾门冠状面切取组织,厚约2 mm,固定,石蜡包埋,切片厚度2 μm,行HE染色。光镜下观察肾组织的病理改变。
电镜检查将肾组织标本切成1 mm3的组织块,用3.75%戊二醛于4℃固定4h以上。用0.1M PBS漂洗5~6次,2%锇酸4℃固定2h,蒸馏水漂洗3~4h,丙酮脱水、浸透,然后用包埋试剂盒(SPI公司)包埋、切片。将厚80~90 nm的切片置于铜网上,醋酸铀染液室温染10~20 min,双蒸水洗净,滤纸吸干,Hitachi 7500透射电镜观察。
免疫荧光染色观察足细胞裂孔膜蛋白podocin和骨架蛋白synaptopodin的表达,将2μm厚度的石蜡切片常规脱蜡,分别与兔抗鼠podocin(1∶200;p0372,sigma)和synaptopodin(1∶200;R34229,sigma)孵育,4℃过夜,PBS缓冲液冲洗三次,然后用FITC标记的羊抗兔二抗(1∶50;F0205,KADO)室温反应45 min,PBS洗涤后甘油封片观察。
统计学处理计量资料以均数±标准差表示,两组间比较采用t检验,P<0.05为差异有统计学意义。
结果
实验大鼠24h尿蛋白的变化大鼠吸入二甲苯3周后开始出现蛋白尿,之后缓慢增加,第7周增幅最大,8~9周尿蛋白量达到最高,尿蛋白含量为(34.78±2.91)mg/24h,此后维持在一个相对恒定的水平(图1)。
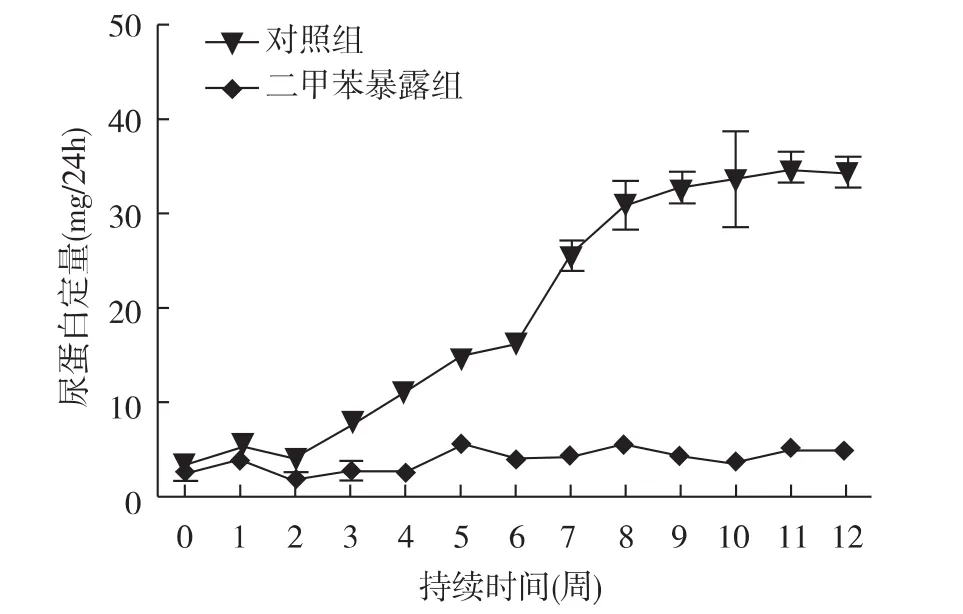
图1 实验大鼠24h尿蛋白定量
尿NAG酶的变化大鼠吸入二甲苯2周后尿NAG酶即开始升高,2~4周增加最为显著,之后便维持在一个相对恒定的水平,随观察时间延长,尿NAG酶并未出现明显变化,12周时尿NAG为(25.03±4.88)U/(g·cr)(图2)。

图2 实验大鼠随机尿NAG酶检测
实验大鼠生化指标的变化二甲苯吸入组大鼠血清总蛋白、白蛋白、肌酐和谷丙转氨酶与正常对照组大鼠相比没有显著统计学差异(表1)。大鼠吸入二甲苯12周,血清尿素氮水平较正常对照组增高(P=0.028 9)。在吸入二甲苯6周、8周、10周、12周后,大鼠血清中谷草转氨酶明显升高。
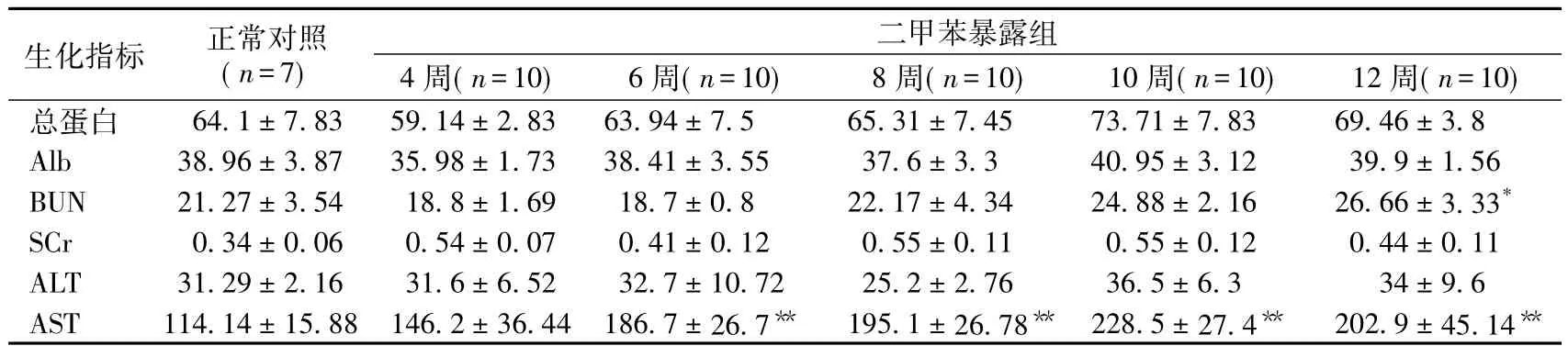
表1 实验大鼠血清生化指标
实验大鼠肾组织病理变化实验终点留取吸入二甲苯的大鼠肾组织,光镜下可见广泛肾小管上皮细胞空泡变性(图3A),近端肾小管上皮细胞刷状缘脱落、扁平,部分肾小管上皮细胞崩解,脱落至管腔中(图3B)。光镜观察肾小球未见明显异常。
超微结构观察可见多处肾小管上皮细胞刷状缘脱落(图4A),上皮细胞崩解(图4B),线粒体肿胀,基质电子密度降低,嵴移向周围,变短及数量减少,线粒体体积增大(图4C),足细胞节段足突融合(图4D)。
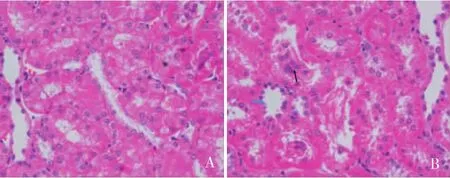
图3 大鼠吸入二甲苯引起的肾脏损害(HE,×400)
吸入二甲苯对大鼠肾小球裂孔膜蛋白和骨架蛋白的影响正常大鼠肾小球足细胞裂孔膜蛋白podocin(图5A)和骨架蛋白synaptopodin(图6A)的表达沿血管袢呈连续线样分布。二甲苯暴露6周、8周、10周和12周的大鼠可观察到部分肾小球podocin和synaptopodin荧光强度减弱,表达呈不连续颗粒样分布(图5、6)。

图4 二甲苯暴露大鼠肾脏超微结构观察(EM)
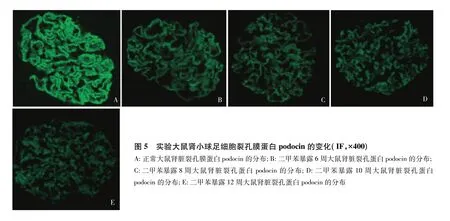
图5 实验大鼠肾小球足细胞裂孔膜蛋白podocin的变化(IF,×400)A:正常大鼠肾脏裂孔膜蛋白podocin的分布;B:二甲苯暴露6周大鼠肾脏裂孔蛋白podocin的分布; C:二甲苯暴露8周大鼠肾脏裂孔蛋白podocin的分布;D:二甲苯暴露10周大鼠肾脏裂孔蛋白podocin的分布;E:二甲苯暴露12周大鼠肾脏裂孔蛋白podocin的分布
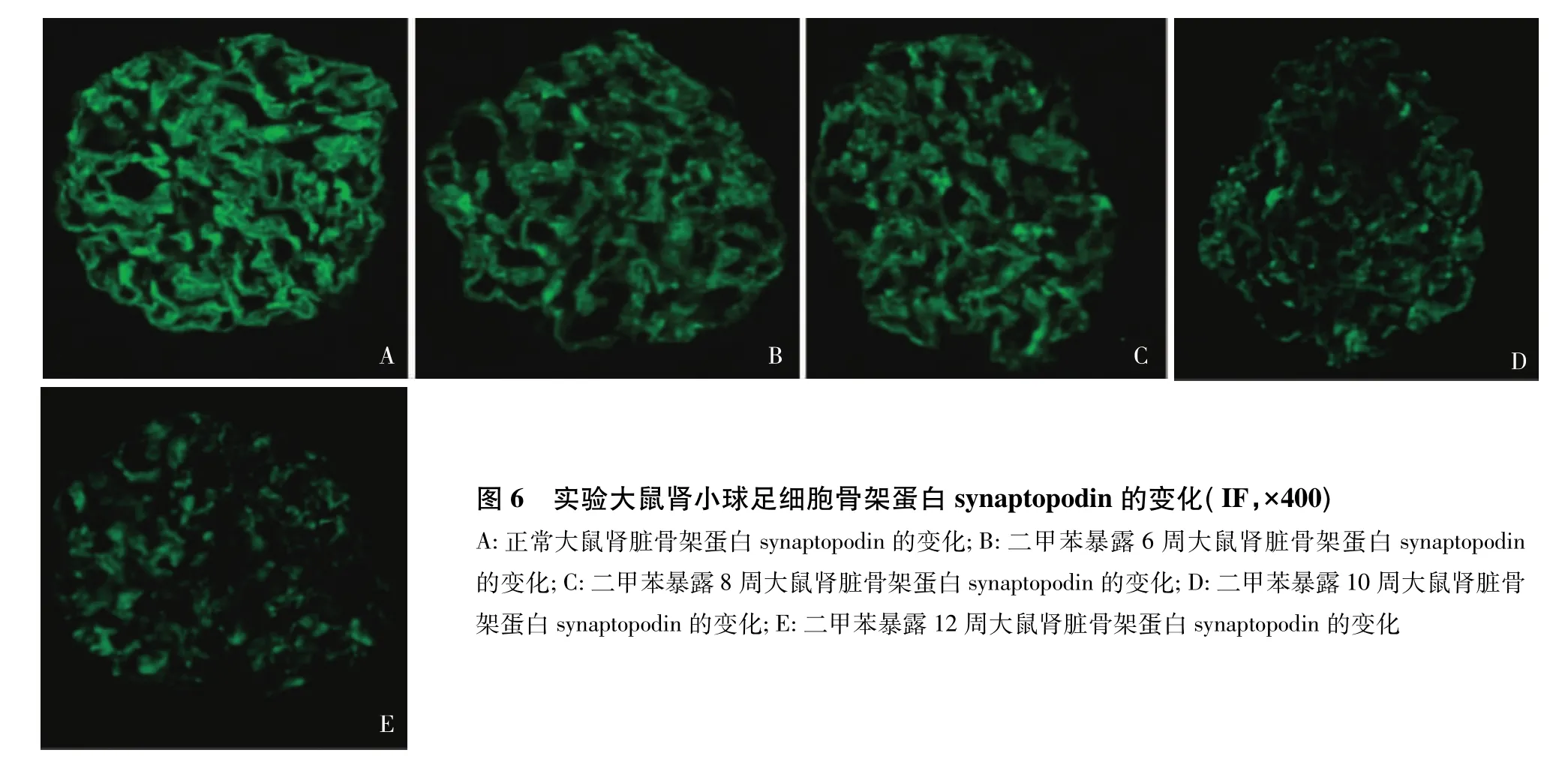
图6 实验大鼠肾小球足细胞骨架蛋白synaptopodin的变化(IF,×400)A:正常大鼠肾脏骨架蛋白synaptopodin的变化;B:二甲苯暴露6周大鼠肾脏骨架蛋白synaptopodin的变化;C:二甲苯暴露8周大鼠肾脏骨架蛋白synaptopodin的变化;D:二甲苯暴露10周大鼠肾脏骨架蛋白synaptopodin的变化;E:二甲苯暴露12周大鼠肾脏骨架蛋白synaptopodin的变化
讨论
本研究建立的大鼠吸入二甲苯的肾损伤模型,其肾组织病理表现为肾小球和肾小管损伤。二甲苯是多种工业原料的添加剂,广泛存在于日常生活中。已有研究初步证实二甲苯可以引起蛋白尿,但并没有进行更深入的研究。我们的研究发现大鼠吸入3周后开始出现蛋白尿,8~9周达最高水平;吸入二甲苯2周后尿液NAG酶开始升高,4周时最高,之后维持稳定。吸入二甲苯12周后大鼠肾小管病理可见肾小管上皮细胞刷状缘脱落、细胞崩解,脱落至管腔中,电镜下可见线粒体肿胀。
肾脏血液供应非常丰富,静息状态约占每搏量的20%,因此进入机体内的二甲苯若不能完全经肝脏解毒,会随血液流经肾脏,由于肾脏的“逆流倍增”效应,很容易造成肾小管上皮细胞损伤[8]。肾小球滤过液会通过受损的小管上皮细胞外渗,导致肾皮质受压血供减少;与此同时,脱落至管腔的细胞残骸以及球旁细胞分泌的血管紧张素使得管腔狭窄,从而进一步加重了肾皮质缺血[10]。也有研究证实甲苯和二甲苯能够影响氧化呼吸链的第四阶段,使得线粒体解偶联导致ATP耗竭,导致线粒体膜蛋白消散、钙离子释放[11]。本研究观察到肾小管上皮细胞线粒体肿胀,可能与此机制有关。
在本研究中我们发现,大鼠肾小管对于二甲苯的损伤比较敏感,在早期就开始出现肾小管的损伤,NAG酶在吸入二甲苯2周后开始升高,第4周为(25.03±4.88)U/(g·cr)。光镜下可观察到肾小管上皮细胞空泡变性,肾小管细胞刷状缘脱落、扁平,部分小管上皮细胞崩解,脱落至管腔中,间质中未见有浸润细胞的存在。超微结构观察可见多处肾小管上皮细胞刷状缘脱落,上皮细胞崩解,线粒体肿胀,基质电子密度降低,嵴移向周围,变短及数量减少。在晚期的病理切片中我们还观察到足细胞节段足突融合。大鼠吸入二甲苯后肾组织免疫荧光染色,可见肾小球足细胞裂孔膜蛋白podocin和骨架蛋白synaptopodin荧光强度减弱,表达呈现不连续颗粒样分布。这些结果表明,有机溶剂对肾小管上皮细胞的损伤明显早于肾小球足细胞,对肾小管上皮细胞损伤的程序明显比足细胞严重。吸入的有机溶剂在肾小管经浓缩后损伤肾小管,导致肾小管返流,使肾小球包囊内有机溶剂的浓度增加,从而导致肾小球壁层和脏层上皮细胞的损伤[12,13],详细机制需要进一步的深入研究。
在吸入二甲苯的大鼠模型中,血清总蛋白、白蛋白、肌酐、谷丙转氨酶与对照组相比并无明显改变,仅在吸入二甲苯12周的大鼠中观察到血清尿素氮较正常对照组出现升高。目前已有一些关于二甲苯对实验动物毒性的报道[14-18],如Kum等[19]观察了二甲苯暴露对于大鼠肾脏氧化应激及血清生化指标的影响,发现短期低剂量吸入二甲苯,大鼠血清尿素氮水平明显增高,肾组织谷胱甘肽和丙二醛活性升高。另外,也有研究发现二甲苯能引起大鼠肝细胞线粒体解偶联[20]。
小结:我们成功建立了大鼠吸入二甲苯的肾损伤模型,大鼠在吸入二甲苯后出现蛋白尿,病理改变可见肾小管上皮细胞的明显损伤,肾小球足细胞发生节段损伤,肾小管的损伤明显重于肾小球。二甲苯引起肾脏损伤的具体机制还有待更深入的研究阐明。
1吴燕,鲍浩,张苏华,等.有机溶剂相关性肾病综合征(一种新发现的中毒性肾病?).肾脏病与透析肾移植杂志,2008,17(4): 305-310.
2 vanValen E,Wekking E,van der Laan G,et al.The course of chronic solvent induced encephalopathy:a systematic review.Neurotoxicology,2009,30(6):1172-1186.
3 Sarma SN,Kim YJ,Song M,et al.Induction of apoptosis in human leukemia cells through the production of reactive oxygen species and activation of HMOX1 and Noxa by benzene,toluene,and o-xylene.Toxicology,2011,280(3):109-117.
4 Kum C,Kiral F,Sekkin S,et al.Effects of xylene and formaldehyde inhalations on oxidative stress in adult and developing rats livers.Exp Anim,2007,56(1):35-42.
5 Cristofori P,Zanetti E,Fregona D,et al.Renal Proximal Tubule Segment-Specific Nephrotoxicity:An Overview on Biomarkers and Histopathology.Toxicol Pathol,2007,35(2):270-275.
6 Nelson NA,Robins TG,Port FK.Solventnephrotoxicity in humansand experimental animals.Am JNephrol,1990,10(1):10-20.
7 Langman JM.Xylene:its toxicity,measurement of exposure levels,absorption,metabolism and clearance.Pathology,1994,26(3): 301-309.
8 Qin W,Xu Z,Lu Y,et al.Mixed organic solvents induce renal injury in rats.PLoSOne,2012,7(9):e45873.
9 Al-Ghamdi SS,Raftery MJ,Yaqoob MM.Acute solvent exposure induced activation of cytochrome P4502E1 causes proximal tubular cell necrosis by oxidative stress.Toxicol In Vitro,2003,17(3): 335-341.
10 Lauwerys R,Bernard A,Viau C,et al.Kidney disorders and hematotoxicity from organic solvent exposure.Scand JWork Environ Health,1985,11(Suppl 1):83-90.
11 Rydzynski K,Korsak Z,Jedlinska U,et al.The toxic effects of combined exposure to toluene and m-xylene in animals.IV.Liver ultrastructure after subchronic inhalatory exposure.Pol JOccup Med Environ Health,1992,5(1):35-42.
12 Gibson JE,Bus JS.Current perspectives on gasoline(light hydrocarbon)-induced male rat nephropathy.Ann N Y Acad Sci,1988,534:481-485.
13 Gradden CW,Pai P,Hindell P,et al.Membranous nephropathy,hydrocarbon exposure and genetic variants of hydrocarbon detoxification.QJM,2001,94(2):79-87.
14 Morel G,Bonnet P,Cossec B,et al.The role of glutathione and cysteine conjugates in the nephrotoxicity of o-xylene in rats.Arch Toxicol,1998,72(9):553-558.
15 Singh MP,Ram KR,Mishra M,et al.Effects of co-exposure of benzene,toluene and xylene to Drosophila melanogaster:alteration in hsp70,hsp60,hsp83,hsp26,ROS generation and oxidative stress markers.Chemosphere,2010,79(5):577-587.
16 Singh MP,Mishra M,Sharma A,et al.Genotoxicity and apoptosis in Drosophila melanogaster exposed to benzene,toluene and xylene: attenuation by quercetin and curcumin.Toxicol Appl Pharmacol,2011,253(1):14-30.
17 Gagnaire F,Marignac B,Blachère V,etal.The role of toxicokinetics in xylene-induced ototoxicity in the ratand guinea pig.Toxicology,2007,231(2-3):147-158.
18 Zielińska-Psuja B,Orlowski J,Plewka A,et al.Metabolic Interactions between Acetylsalicylic Acid,Xylene and Trichloroethylene in Rats.Polish Journal of Environmental Studies,2001,10(1):43-49.
19 Kum C,Sekkin S,Kiral F,et al.Effects of xylene and formaldehyde inhalations on renal oxidative stress and some serum biochemical parameters in rats.Toxicol Ind Health,2007,23(2):115-120.
20 Revilla AS,Pestana CR,Pardo-Andreu GL,et al.Potential toxicity of toluene and xylene evoked by mitochondrial uncoupling.Toxicol In Vitro,2007,21(5):782-788.
Themodel of renal injury by inhaling xylene in rats
XU Zhongxiu,CAO Xianghua,WANGShengyu,ZENGCaihong,ZHU Xiaodong,LIU Zhihong,QINWeisong
National Clinical Research Center of Kidney Disease,Jinling Hospital,Nanjing University School ofMedicine,Nanjing 210016,China
Objective:To build amodel to observe the characteristics of renal injury in rats by exposure to xylene.
Methodology:Male Sprague-Dawley rats(n=57),weighing 140-160g,4-6 week old,were used in this study.They were randomly divided into two groups:control group(n=7)and xylene exposure group(n=50),who were exposed to xylene six hours per day for twelve weeks.The 24h urinary protein excretion and urinary NAG levels were measured.In addition,serum total protein(TP),albumin(Alb),urea(BUN),creatinine(SCr),aspartate amino transferase(AST) and alanine amino transferase(ALT)levelswere examined.The tubular and glomerularmorphology were observed by light microscopy and transmission electronmicroscopy.The podocin and synaptopodin expression and distribution change were determined by indirect immunofluorescence staining.Results:Compared with the control rats,the proteinuria was observed in rats after xylene exposure of 3 weeks,and the amount of urinary protein excretion was increased to(34.78± 2.91)mg/24h at 8 weeks.The level of urinary NAG was increased obviously after the xylene exposure of 4weeks.After xylene exposure of12 weeks,the urinary NAG in experiment and control ratswas(25.03±4.88)U/(g·cr)and(14.36± 2.05)U/(g·cr),respectively.No significant differenceswere found in the levels of TP,Alb,Scr and ALT.The levels ofserum urea was increased in xylene exposed rats at 12 weeks(P<0.05)and AST was increased significantly.The histological examination bymicroscopy showed that there were remarkable injuries in proximal renal tubule,including loss of brush border and vacuolar degeneration of the epithelial cells.Ultra structural study demonstrated that brush border and cytoplasm of tubular epithelial cell were dropped and some epithelial cells were disintegrated.The mitochondria of tubular epithelial cells was swollen and the electron density was decreased in matrix.The results by immunofluorescence staining showed that distribution of podocin and synaptopodin along GBM was discontinuous and granular after xylene exposure of12 weeks.Conclusion:The present study indicates the renal injury by exposure to xylene.The severity of tubular epithelial cell damage was significantly heavier than that of podocytes.
xylene rats proteinuria tubule glomerulus
2013-11-06
(本文编辑 加则)
国家重点基础研究发展计划(973计划)[2012CB517600(2012CB517605)];国家自然科学基金(81270811);江苏省临床医学科技专项(BL2012007)
南京大学医学院附属金陵医院(南京军区南京总医院)肾脏科硕士研究生(徐忠秀),南京军区南京总医院国家肾脏疾病临床医学研究中心全军肾脏病研究所(南京,210016)[通信作者]秦卫松(E-mail:qinweisong@163.com)
2015年版权归《肾脏病与透析肾移植杂志》编辑部所有

