危重症患者肾脏替代治疗中应用抗菌药剂量的调控策略
何 旭 综述 季大玺 审校
·血液净化·
危重症患者肾脏替代治疗中应用抗菌药剂量的调控策略
何 旭 综述 季大玺 审校
危重症患者抗菌药的代谢动力学发生改变,肾脏替代治疗也影响药物清除率。应根据药代动力学参数、残余肾清除率、肾脏替代治疗的清除率、药动学目标制定危重症患者个体化的抗菌药剂量。
危重症肾脏替代治疗抗菌药药代动力学
终末期肾病(ESRD)患者病情已处于相对稳定状态,同时肾脏替代治疗(RRT)的模式、剂量相对固定,因此这些患者RRT治疗时的药物剂量调整已有公认的指导依据。但对于危重症患者而言,接受RRT治疗时如何调整药物剂量由于影响因素众多,很难达成共识。这些影响因素包括RRT模式、剂量及时间的差异,特别是危重症患者药代动力学的显著改变[1]。因此,如何调整抗菌药剂量一直是困扰临床医师的难题。了解危重症RRT治疗时药代动力学变化及药物调整基本原则对指导临床用药有重要意义,本文拟对上述问题作一简述。
药代动力学
给药后初始药物浓度取决于药物的分布,即分布容积(Vd),而此后药物浓度则主要与清除率有关。因此Vd决定药物负荷剂量,而总药物清除率决定追加量。根据药效学与药动学的关系,抗菌药分为三种类型:时间依赖型、浓度依赖型及时间-浓度依赖型。时间依赖型药物的疗效取决于给药期间的血药浓度超过最低抑菌浓度(MIC)的时间(T>MIC)占给药间期百分比。浓度依赖型药物的疗效取决于药物血浆峰浓度(Cmax)和MIC的比值(Cmax:MIC)。时间-浓度依赖型药物疗效主要取决于血药浓度-时间曲线下面积(AUC)与MIC的比值(AUC:MIC)。不同药代动力学目标决定了抗菌药物调整的方式不同:时间依赖型药物主要以调整给药间隔时间为主,单次给药剂量可保持不变;浓度依赖型药物以调整单次药剂量为主,给药间隔时间则可保持不变;时间-浓度依赖型药物则可能两种都需调整。常用抗菌药的代谢动力学目标见表1。

表1 常用抗菌药的药代动力学目标
RRT对抗菌药清除的影响
RRT主要影响经肾脏排泄的抗菌药,清除取决于药物本身的理化性质和RRT特性两个方面。
药物的理化性质,如分子量大小、Vd、蛋白结合率(PB)、药物的电荷等,是影响RRT对其清除的主要因素。分子量小、分布容积小、蛋白结合率低的亲水性抗菌药容易被RRT清除。对于抗菌药而言,大多数药物的分子量在500 D左右,少数如万古霉素、利奈唑胺等虽可达1 400 D,但由于现在RRT多使用高通量滤器,其分子截留量(20~30 kD)远大于药物分子量,因此分子大小不是影响RRT对其清除的主要因素。某些情况下药物所带电荷会通过Gibbs-Donnan效应及吸附效应影响其通过滤器的能力,如阳离子药物由于血液中阴离子蛋白吸引而难以通过滤过膜[7](如氨基糖苷类、左氧氟沙星等),而阴离子药物(如头孢他啶等)则更易通过滤过膜。此外滤器还可能通过吸附方式清除部分药物,如阿卡米星与磺化的聚丙烯晴膜不可逆地相结合[8],但其临床意义可能并不大。Vd是影响药物清除的另一重要因素,而Vd取决于药物的水溶性和脂溶性。亲水性药物如(β内酰胺类、糖肽类及氨基糖苷类)主要分布于细胞外液,其Vd常较小,以原型从肾脏排出,易被RRT清除;亲脂性药物(大环内酯类、氯霉素类、利福平、四环素类、氟喹诺酮类及新一类唑烷酮)[9]能够自由通过细胞膜进入细胞内液,细胞外液特别是血管内分布较少,浓度低,因此Vd较大,以非肾脏途径清除为主,RRT对于清除影响不大。一般认为Vd较高(>1 L/kg)和PB较高(>80%)的药物不易通过RRT清除[10]。
RRT清除率取决于溶质清除的机制(弥散、对流、吸附)、滤过膜的性质(膜材料、通透性、表面积)、液体流量(血流量、超滤率、透析液流量)、滤器使用时间。常用CRRT清除率的计算方法见表2。
筛选系数(Sc)和饱和系数(Sd)分别表示超滤液和透析液中药物浓度与血浆药物浓度的比值。在CRRT模式下,由于透析液/置换液流量相对血流量小得多,且目前所用滤过膜孔径明显大于多数抗菌药的分子直径,游离的药物浓度能在两者之间达到平衡。因此抗菌药通过滤器膜的能力与药物分子量无关而与其PB相关,一般可通过公式Sc或Sd= 1-PB来计算。影响PB的因素也可能影响药物的RRT清除[11],如危重症患者体内游离的头孢曲松增多,与健康志愿者相比,CRRT药物清除率明显增加。目前PB数据常参考慢性肾脏病(CKD)或健康人群,但危重症患者PB有着显著改变,从而使得估算的Sc或Sd值与实测值之间存在差异。Bouman等[12]通过比较抗菌药(阿莫西林、头孢他啶、环丙沙星、甲硝唑、万古霉素)实际CRRT清除率和估算清除率发现,头孢他啶和万古霉素的实际和估算清除率存在较大差异。这对于主要依靠肾脏清除和治疗窗较窄的抗菌药(如万古霉素)而言意义重大,提示最好进行监测药物浓度以决定药物剂量。

表2 CRRT清除率的计算公式
在间歇性RRT模式如血液透析(HD)和各种杂合式RRT(HRRT)模式下,由于透析液流量较大,透析液通过透析器后血液中游离药物浓度与透析液之间远未达到平衡,此时的Sd除受PB影响外,还受透析液流量的影响,因此其清除率难以估算,只能实际测量。
危重症患者抗菌药代谢动力学变化及RRT的影响
危重症患者体内药物的吸收、分布、代谢与排泄过程均有显著的改变。主要的药代动力学变化包括Vd增加[13]、药物PB改变[14]及药物清除率改变。而RRT主要影响药物清除率,还可能影响药物Vd。
危重症患者常因细胞外液增加而导致药物Vd增大。如系统性炎症反应综合征伴随的毛细血管渗漏综合征及低白蛋白血症,导致血管内液体向组织间隙转移及液体潴留[15],合并急性肾损伤(AKI)时更易出现容量负荷增加及Vd增大。Vd增大对亲水性抗菌药(β内酰胺类、氨基糖苷类)影响更明显,通常需增加药物剂量以达有效血药浓度[16]。文献报道AKI时头孢三嗪、头孢他啶、替奈米星Vd增加[17],但脓毒症患者美罗培南的Vd无明显增加[18]。这些患者接受RRT后,随着过多液体被清除,Vd逐步恢复正常,药物剂量需随之减少。
危重症患者的液体潴留还可能影响药物在不同分布容室之间的转移速度,如细胞内外的转移、血管内外的转移、不同器官之间的转移。当RRT通过外在的清除降低血液药物浓度时,不同容室转移速度可能也会成为影响RRT清除率的重要因素,但目前关于这方面的数据还缺乏。
危重症患者的药物PB受到血浆蛋白浓度、酸碱平衡状态、合并用药及其他竞争性结合物质的影响,可能出现较大波动。如各种原因导致的低白蛋白血症会明显降低药物PB,增加游离分数(FF);而一些合并用药(如肝素、水杨酸盐、磺胺类药)则可与抗菌药竞争白蛋白结合位点[7],同样增加FF。FF的增加导致在同样血药浓度情况下游离药物浓度明显升高,有时高达数倍,游离药物浓度是影响药物疗效及毒副作用的主要决定因素,而FF增加也导致CRRT清除增加。
清除率下降是危重症患者最常见、最重要的药代动力学改变。除肝、肾本身损伤影响药物清除外,血流动力学因素(如全身血流再分布、氧供等)同样会影响药物代谢。对于肾脏而言,决定药物清除的主要因素为肾小球滤过率(GFR)及肾小管功能。肾脏主要有三种溶质清除形式:肾小球滤过、肾小球滤过后肾小管部分重吸收、肾小球滤过和肾小管分泌。只有第一种情况下可能通过测定或评估GFR来判定肾脏药物清除率,而其他两种情况则相对复杂,不能简单以GFR来判定肾脏清除率。此外机体器官功能的相互影响及代偿性改变,也会影响其代谢,如AKI时GFR的下降可导致肾小管分泌增加、重吸收减少而代偿性排泄药物[13],AKI时还可能通过增加肝脏清除率来代偿[19]。患者接受RRT时,只能模拟肾小球滤过清除,无法替代肾小管分泌及重吸收作用。CRRT所能达到的游离小分子溶质清除率通常在20~30 ml/min,高容量情况下可达50~60 ml/min,而间歇性治疗模式在治疗期间清除率一般可达100~200 ml/min。了解这些有助于临床更合理地调整药物剂量。
危重症患者行RRT治疗时如何调整抗菌药剂量
影响危重症患者药物疗效的最重要因素是危重状态导致的复杂的药代动力学变化,RRT只是其中众多因素之一。CRRT是危重症患者最常用的治疗方式,一般情况下CRRT提供20~40ml/min的清除率,而且不是所有抗菌药都能清除:以肝脏清除为主的药物,肾脏不清除,CRRT亦不清除;以肾脏清除为主的药物,如PB较高(>60%~80%),主要通过肾小管分泌清除,CRRT对其影响可忽略不计;只有游离度高且以肾脏清除为主的药物,需考虑CRRT清除的影响,此时计算总清除率时需将残余肾功能清除率与CRRT清除率相加,以估算相当GFR情况下的药物剂量。
鉴于危重症病情的复杂性及个体差异,试图根据已有的健康人群或ESRD患者的药代动力学数据来决定危重症患者的药物剂量毫无疑问是不准确的。已有不少研究证实了这一点。Udy等[20]报道81例接受CRRT的危重症患者采用万古霉素治疗,结果显示,总清除率及Vd的个体变异率分别达34.7%及49.8%,总清除率与CRRT相关参数(如血流量、超滤液速度、透析液/总废液速度)无明显相关性,Vd亦与体重相关性差,根据一般药代动力学参数预测的血药浓度与测定浓度亦无明显相关性,只有根据个体药代动力学数据预测的浓度与测定浓度之间才具有良好相关性。
目前很难推出公认的指南用于指导危重症患者CRRT时的抗菌药调整。行CRRT治疗的危重症患者应制定合理的个体化抗菌药剂量。需要的关键数据包括:(1)危重症患者的药代动力学数据(Vd、PB、非CRRT清除率),以上数据主要通过参考既往文献获得;(2)患者残余肾清除率;(3)药物是否能通过CRRT清除,计算CRRT清除率。参考既往文献获得Sc和Sd,根据公式计算CRRT清除率。特别注意的是相同膜材料,相似膜面积、血液/透析液/滤过液流量的研究结果才有借鉴价值,如有条件进行药物浓度检测,最好实际测定特定滤器对于药物的Sc和Sd;(4)药动学目标和ICU中菌群的MIC。在得到相关数据后再依据图1进行药物剂量的计算。
值得注意的是,根据上述方法计算的药物剂量仅能作为评估药量的参考,合理的药量还需根据所实际测定的血药浓度进一步调整。尤其对于毒副作用较大的药物(如万古霉素和氨基糖苷类)或毒副作用随剂量增加而增大的药物(β内酰胺类),治疗药物监测是最有效的剂量优化策略。
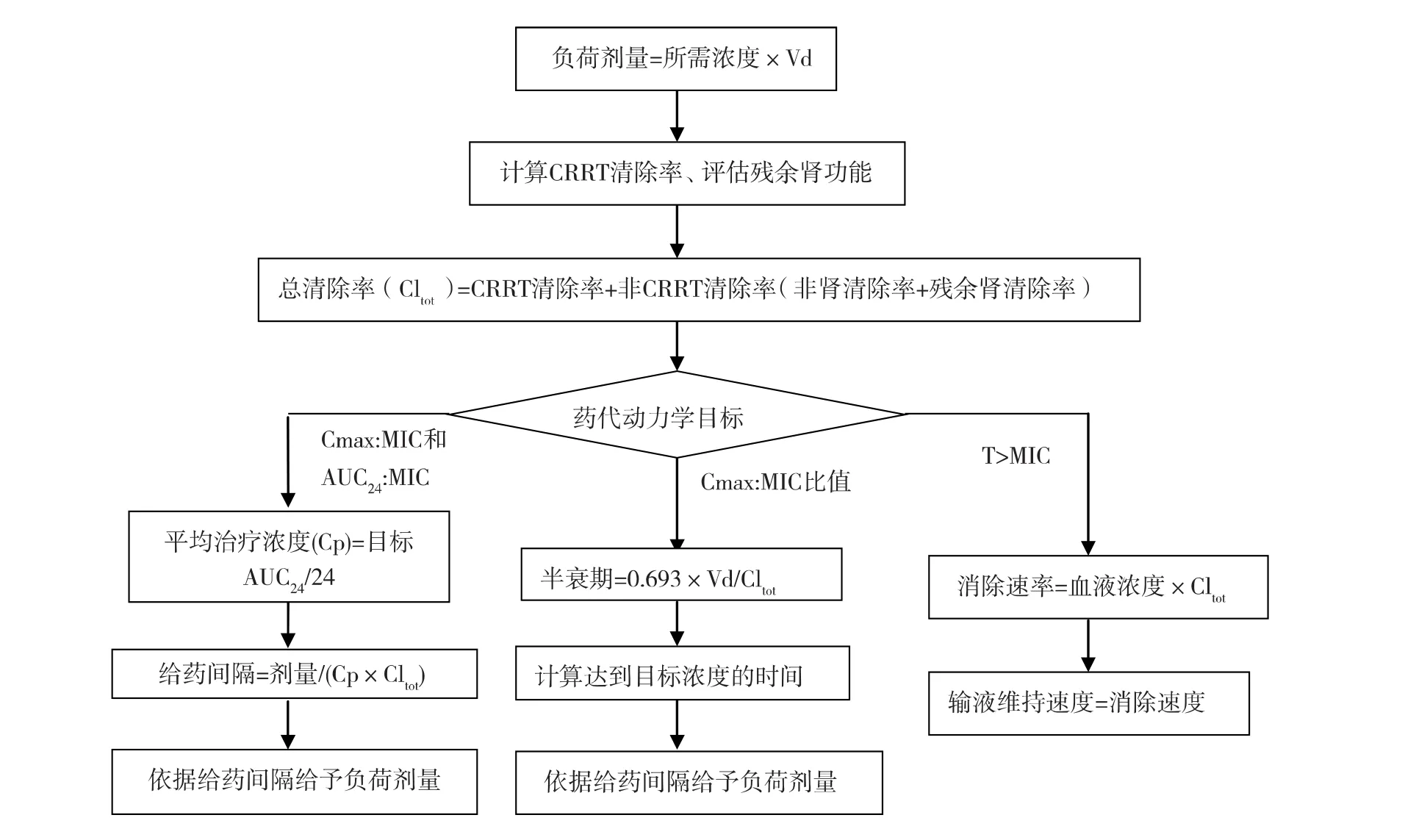
图1 抗菌药物剂量计算步骤[21]
小结:危重症患者药代动力学的显著改变和RRT治疗,给抗菌药物的使用带来巨大挑战。合理的抗菌治疗有助于提高危重症患者的存活率,根据完整的药代动力学参数计算的个体化的药物剂量,有望达到最大药效和最小的毒副作用,对改善危重症行RRT治疗患者的预后有深远意义。
1 Schetz M.Drug dosing in continuous renal replacement therapy: general rules.Curr Opin Crit Care,2007,13(6):645-651.
2 Burgess DS.Pharmacodynamic principles of antimicrobial therapy in the prevention of resistance.Chest,1999,115(3 Suppl):19s-23s.
3 Moore RD,Lietman PS,Smith CR.Clinical response to aminoglycoside therapy:importance of the ratio of peak concentration tominimal inhibitory concentration.J Infect Dis,1987,155(1): 93-99.
4 Ambrose PG,Grasela DM,Grasela TH,et al.Pharmacodynamics of fluoroquinolones against Streptococcus pneumoniae in patients with community-acquired respiratory tract infections.Antimicrob Agents Chemother,2001,45(10):2793-2797.
5 Rybak MJ,Lomaestro BM,Rotschafer JC,et al.Vancomycin therapeutic guidelines:a summary of consensus recommendations from the infectious diseases Society of America,the American Society of Health-System Pharmacists,and the Society of Infectious Diseases Pharmacists.Clin Infect Dis,2009,49(3):325-327.
6 Andes D,van Ogtrop ML,Peng J,et al.In Vivo Pharmacodynamics of a New Oxazolidinone(Linezolid).Antimicrob Agents Chemother,2002,46(11):3484-3489.
7 Bugge JF.Pharmacokinetics and drug dosing adjustments during continuous venovenous hemofiltration or hemodiafiltration in critically ill patients.Acta Anaesthesiol Scand,2001,45(8):929-934.
8 Tian Q,Gomersall CD,Ip M,et al.Adsorption of amikacin,a significant mechanism of elimination by hemofiltration.Antimicrob Agents Chemother,2008,52(3):1009-1013.
9 Guenter SG,Iven H,Boos C,et al.Pharmacokinetics of levofloxacin during continuous venovenous hemodiafiltration and continuous venovenous hemofiltration in critically ill patients.Pharmacotherapy,2002,22(2):175-183.
10 de Pont AC.Extracorporeal treatment of intoxications.Curr Opin Crit Care,2007,13(6):668-673.
11 Joynt GM,Lipman J,Gomersall CD,et al.The pharmacokinetics of once-daily dosing of ceftriaxone in critically ill patients.JAntimicrob Chemother,2001,47(4):421-429.
12 Bouman CS,van Kan HJ,Koopmans RP,et al.Discrepancies between observed and predicted continuous venovenous hemofiltration removal of antimicrobial agents in critically ill patients and the effects on dosing.Intensive Care Med,2006,32(12):2013-2019.
13 Roberts JA,Lipman J.Antibacterial dosing in intensive care: pharmacokinetics,degree of disease and pharmacodynamics of sepsis.Clin Pharmacokinet,2006,45(8):755-773.
14 Golper TA.Update on drug sieving coefficients and dosing adjustments during continuous renal replacement therapies.Contrib Nephrol,2001 (132):349-353.
15 Nduka OO,Parrillo JE.The pathophysiology of septic shock.Crit Care Clin,2009,25(4):677-702,vii.
16 Fertmann J,Wolf H,Kuchenhoff H,et al.Prognostic factors in critically ill surgical patients requiring continuous renal replacement therapy.JNephrol,2008,21(6):909-918.
17 Bagshaw SM,Uchino S,Bellomo R,et al.Timing of renal replacement therapy and clinicaloutcomes in critically ill patientswith severe acute kidney injury.JCrit Care,2009,24(1):129-140.
18 Kielstein JT,Czock D,Schpke T,et al.Pharmacokinetics and total elimination of meropenem and vancomycin in intensive care unit patients undergoing extended daily dialysis.Crit Care Med,2006,34 (1):51-56.
19 Wallis SC,Mullany DV,Lipman J,et al.Pharmacokinetics of ciprofloxacin in icu patients on continuous veno-venous haemodiafiltration.Intensive Care Med,2001,27(4):665-672.
20 Udy AA,Covajes C,Taccone FS,et al.Can population pharmacokinetic modelling guide vancomycin dosing during continuous renal replacement therapy in critically ill patients?Int J Antimicrob Agents,2013,41(6):564-568.
21 Choi G,Gomersall CD,Tian Q,et al.Principles of antibacterial dosing in continuous renal replacement therapy.Blood Purif,2010,30 (3):195-212.
Antibacterial dosing in critically ill patients receiving renal replacement therapy
HE Xu,JIDaxi
National Clinical Research Center of Kidney Diseases,Jinling Hospital,Nanjing University School of Medicine,Nanjing 210016,China
The Pharmacokinetics of Critically ill patientswould change greatly,renal replacement therapy aswell as increase the drugs clearance.To optimize antibiotic therapy,individualization of antibiotic dosing is important.So the Pharmacokinetics,residual renal function,CRRT clearance,Pharmacokinetics target should all be considered.
critically ill renal replacement therapy antibacterial agents pharmacokinetics
2014-12-10
(本文编辑 心平)
南京军区南京总医院肾脏科国家肾脏疾病临床医学研究中心全军肾脏病研究所(南京,210016)

