狼疮性肾炎足细胞病患者的临床病理特征及预后
王少凡 陈 浩 陈樱花 刘正钊 徐 峰 刘志红 胡伟新
·论 著·
狼疮性肾炎足细胞病患者的临床病理特征及预后
王少凡*陈 浩*陈樱花 刘正钊 徐 峰 刘志红 胡伟新
目的:回顾性分析狼疮性肾炎足细胞病(狼疮足细胞病)患者的临床、病理特征及远期预后。 方法:系统性红斑狼疮(SLE)伴肾损害,经肾活检组织学和电镜检查符合狼疮足细胞病的患者53例(女48例,男5例,中位年龄31岁,中位病程1.5月)。回顾性分析其临床、病理特征及远期预后。 结果:53例狼疮足细胞病占同期狼疮性肾炎的1.41%,其中50例临床表现肾病综合征,17例(32.1%)伴急性肾损伤(AKI),合并镜下血尿和高血压各9例(17.0%)。根据肾活检光镜改变分为系膜增生性病变(MP,n=31)、轻微病变(MCD,n=13)和局灶节段性肾小球硬化(FSGS,n=9)三组。电镜观察中位足细胞足突融合比例85%,三组间无明显差异。FSGS组AKI发生率(77.8%)显著高于MP组(22.6%)和MCD组(23.1%)(P<0.01),肾小管间质急性病变程度也明显高于其他两组(P<0.05)。与MCD组(23.1%)相比,MP组(83.9%)和FSGS组(88.9%)低C3血症的比例显著升高(P<0.01)。经激素或激素联合免疫抑制剂诱导治疗后,69.8%获得完全缓解,FSGS组完全缓解率(22.2%)显著低于MCD组(92.3%)和MP组(74.2%)(P<0.01)。中位随访时间60月,29例(54.7%)肾病复发,13例复发后行重复肾活检,其中6例发生病理转型,无终末期肾病或死亡病例。 结论:狼疮足细胞病以肾病综合征或伴AKI为主要特征,组织学改变可为MCD、MP或FSGS,激素或激素联合免疫抑制剂治疗敏感,FSGS者AKI发生率高、肾小管损伤重且治疗缓解率低。该病复发率高,部分重复肾活检可见病理转型,长期随访预后良好。
狼疮性肾炎 足细胞病 病理分型 预后
狼疮性肾炎(LN)的临床表现和病理改变存在一定联系,临床表现为肾病综合征(NS)的LN患者肾活检病理通常见免疫复合物沉积于肾小球毛细血管袢[1-2]。但近年研究发现,少数临床表现为NS的LN患者肾活检病理仅见免疫复合物沉积于肾小球系膜区,电镜下见肾小球足细胞足突广泛融合,与微小病变(MCD)类似,也有个案报道病理改变可呈系膜增生或局灶节段肾小球硬化(FSGS)[3-5],早年将其称为系统性红斑狼疮(SLE)合并特发性MCD或归入Ⅱ型LN,但近年研究认为这种肾脏病变与SLE本身有关,其临床、病理表现与典型Ⅱ型LN有显著区别,也不同于其他增殖性LN所伴发的足细胞病变[3]。有学者称之为狼疮足细胞病[6],认为是LN的特殊病理类型。因其发生率相对较低[7-10],既往文献多为个案报道或小样本观察,目前对狼疮足细胞病的临床、病理特征及其相互联系尚缺乏研究。我们在3 750例LN中发现狼疮足细胞病53例,本文分析其临床、免疫学特征、病理特点、治疗反应及预后,并比较不同病理改变之间的差异。
对象和方法
研究对象 2000年1月至2013年12月间在南京军区南京总医院肾脏科住院行肾活检的LN病例,所有病例符合以下条件:(1)符合1997年美国风湿病协会SLE的诊断标准;(2)肾活检病理改变符合狼疮足细胞病;(3)有完整的临床、病理及实验室检查记录;(4) 无非甾体类抗炎药或其他可能导致足细胞损害的药物使用史;(5)无肥胖、糖尿病或HIV等造成继发性FSGS的疾病。
临床指标 包括一般情况(年龄、性别),SLE病程、LN病程、SLE活动指数(SLE-DAI)、首发症状、高血压、急性肾损伤(AKI),肾外脏器损害。
实验室检查 包括24h尿蛋白定量、尿沉渣红细胞计数、血清白蛋白(Alb)、血清肌酐(SCr)、抗核抗体(ANA)、抗双链DNA抗体(A-dsDNA)、A-Sm、抗核糖蛋白(A-RNP)、抗干燥综合征A抗原(SSA)、SSB、抗心磷脂抗体(ACL)、补体C3和C4。
肾脏病理 肾组织标本经石蜡包埋,切片厚度1.5~2 μm,HE、PAS、PASM-Masson、Masson三色染色行光镜检查。采用冰冻切片行免疫荧光(IF)检查,观察肾组织免疫球蛋白(Ig)和补体沉积部位及强度。肾组织电镜标本以3.75%冷戊二醛固定,1%四氧化锇固定,超薄切片厚50 nm,醋酸钠、柠檬酸铅双染色,透射电镜观察肾小球病变及电子致密物沉积情况。
指标定义 AKI指SCr在48h内上升≥26.52 μmol/L或超过基础值的50%。完全缓解(CR)指尿蛋白≤0.4 g/24h、Alb≥35 g/L且SCr正常。部分缓解(PR)指尿蛋白下降超过基础值的50%且低于3.5 g/24h、SCr正常或上升不超过基线值的15%。未缓解(NR)指治疗未达CR或PR。获得缓解时间指从诱导治疗开始至达到缓解的时间。肾病复发指CR患者尿蛋白≥1.0 g/24h、PR患者尿蛋白上升≥2.0 g/24h,或尿蛋白倍增,伴或不伴血尿增加。病理转型指重复肾活检患者,依据2003年ISN/RPS病理分型标准,转为其他病理类型。随访时间指肾活检至最后一次随访日期(截止至2014-06-30),复发后病理转型者随访终点为重复肾活检日期。终末期肾病(ESRD) 指eGFR<15 ml/(min·1.73m2)或肾脏替代治疗持续≥3个月。
狼疮足细胞病定义为电镜观察见肾小球足细胞足突广泛融合(指足突融合范围超过肾小球毛细血管袢面积的50%),无明显基膜上皮侧或内皮下电子致密物沉积,可见系膜区电子致密物沉积,光镜下肾小球无毛细血管袢内或毛细血管外增生性病变。
肾小管间质急性病变分为:轻度(指肾小管上皮刷状缘脱落范围<25%,间质水肿和炎细胞浸润面积<25%),中度(指肾小管上皮刷状缘脱落范围25%~49%,间质炎细胞浸润面积<50%),重度(指肾小管上皮刷状缘脱落比例≥50%,或肾小管上皮细胞坏死)。肾小管间质慢性病变分为:轻度(指肾小管萎缩/间质纤维化比例<25%),中度(指肾小管萎缩/间质纤维化比例25%~49%),重度(指肾小管萎缩和间质纤维化比例≥50%)。
统计学方法 采用SPSS 16.0软件进行统计分析。计量资料以中位数(四分位数间距)表示,两组间比较采用Mann-Whitney检验,三组间比较采用Kruskal Wallis检验;计数资料以百分率表示,组间比较采用卡方检验或Fisher’s确切概率法,P<0.05为差异具有统计意义,P<0.01为统计学差异显著。
结 果
临床资料 2000年1月至2013年12月间共 3 750 例LN首次行肾活检,除外增殖型和Ⅴ/Ⅵ型LN,对肾小球病理改变为轻微病变、系膜增生或节段硬化的LN重新阅片并电镜检查,共发现53例患者符合狼疮足细胞病(图1)。其中女性48例,男性5例,中位年龄31岁(20~40岁),中位肾脏病程1.5月(0.6~8.5月),中位SLE-DAI 10分(6.5~13分)。
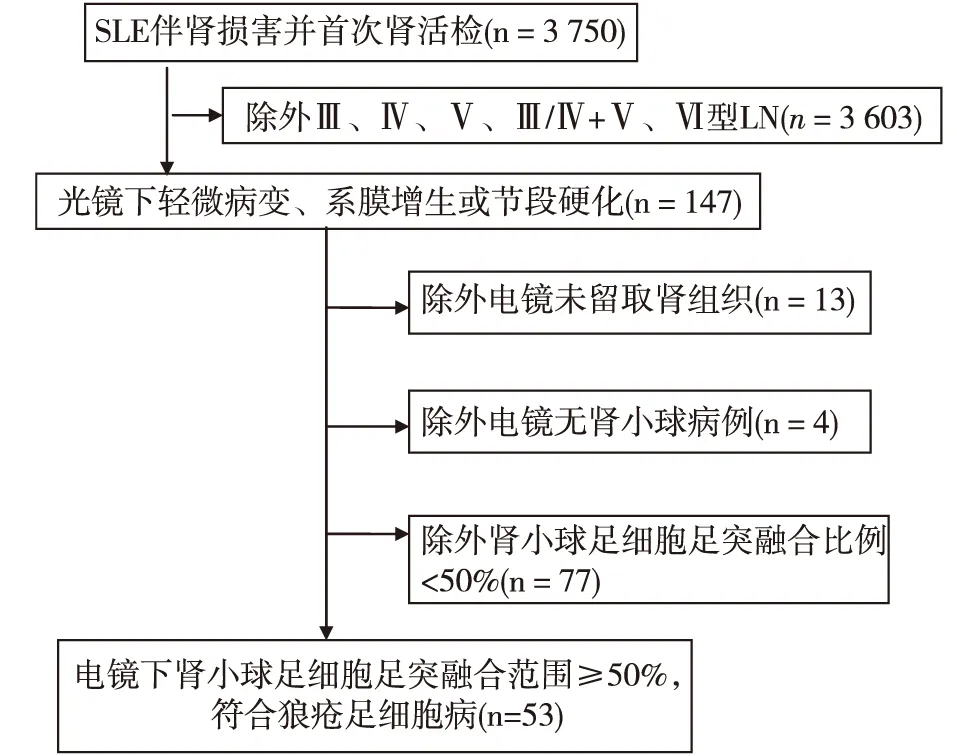
图1 狼疮足细胞病的筛查流程SLE:系统性红斑狼疮;LN:狼疮性肾炎
肾外表现 肾外受累率最高的是血液系统(54.7%),其次是面部红斑(49.1%)和关节炎(35.8%)(表1)。6例患者早期无明显肾外表现,在随访中逐渐出现多系统受累。
免疫学指标 患者血清ANA均阳性,A-dsDNA、ACL阳性率均为26.4%,69.8%存在低C3血症,30.2%患者C4水平低下(表2)。
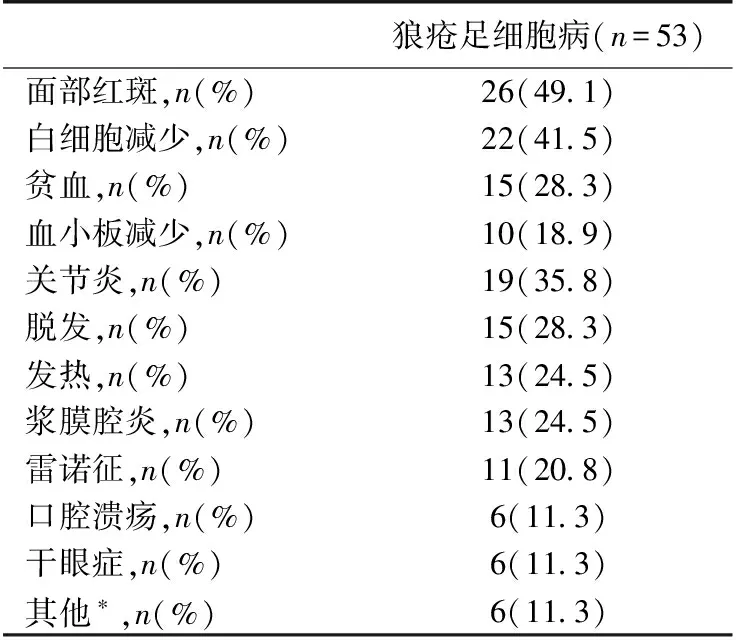
表1 肾外脏器损害
*包括甲状腺和中枢神经系统损害各2例,光敏感 和抗磷脂抗体综合征各1例ANA:抗核杭体;A-dsDNA:抗双链DNA抗体;A-Sm:抗Sm抗体;A-RNP:抗核糖蛋白;SSA:抗干燥综合征A抗原;SSB:抗干燥综合征B抗原;ACL:抗心磷脂抗体
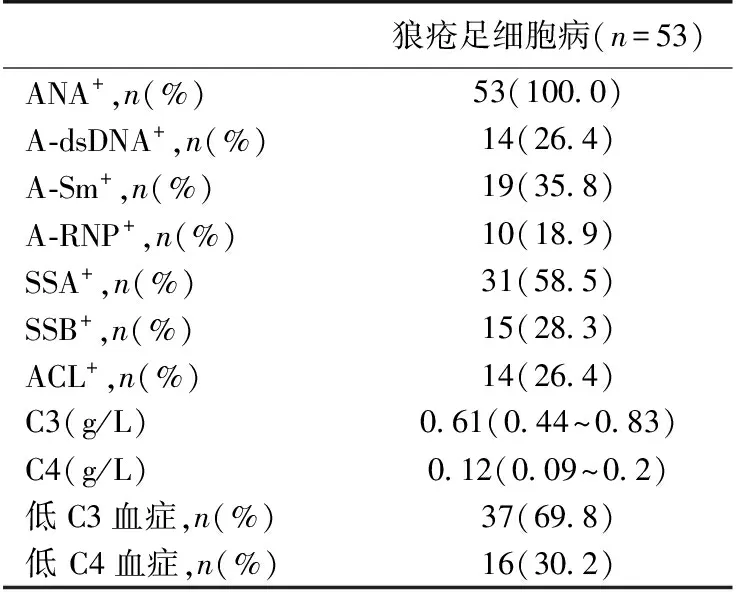
表2 免疫学指标
肾脏表现 50例表现为肾病综合征,其中17例(34%)合并AKI,6例入院时需肾脏替代治疗。3例表现为非肾病性蛋白尿,无一例发生AKI。合并高血压或镜下血尿各9例(表3)。
肾脏病理 光镜下肾小球呈现三种病变类型:轻微病变(MCD,n=13);系膜增生性病变(MP,n=31),指肾小球系膜细胞≥3个/系膜区或系膜基质增生;局灶节段性肾小球硬化(FSGS,n=9),其中5例为顶部型,2例为经典型,1例为门周型,1例为塌陷型(图2)。28例见肾小管间质急性病变。
免疫荧光检查43例见肾小球Ig(s)伴补体沉积,6例仅见Ig(s)沉积于系膜区,4例Ig(s)及补体阴性,18例(34.0%)见IgG和(或)IgA或补体沉积于肾小管上皮细胞胞质或小管基膜(图2)。临床合并AKI的患者肾小管免疫复合物沉积比例高于无AKI者(52.9%vs25.0%,P<0.05)。
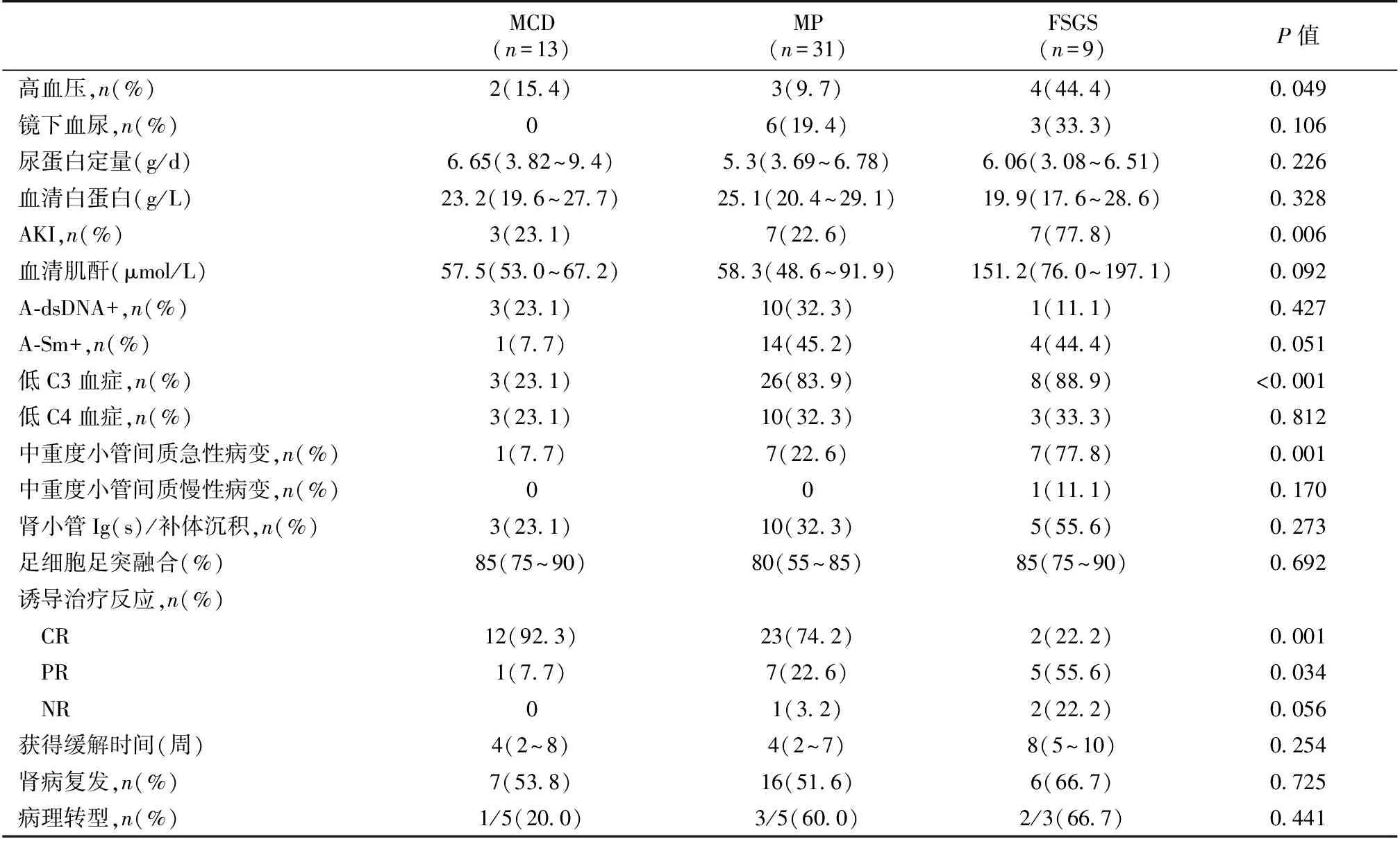
表3 不同病理类型间临床、免疫、病理特征及治疗、预后的比较
MCD:微小病变;MP:系膜增生性病变;FSGS:局灶节段性肾小球硬化;AKI:急性肾损伤;A-dsDNA:抗双链DNA抗体;A-Sm:抗Sm抗体;Ig:免疫球蛋白;CR:完全缓解;PR:部分缓解;NR:未缓解电镜下肾小球足细胞中位足突融合比例85%(65~87.5%)(图2)。7例同时见足细胞脱落或基膜裸露。49 例系膜区电子致密物沉积,4例免疫荧光染色阴性患者肾小球未见电子致密物沉积。
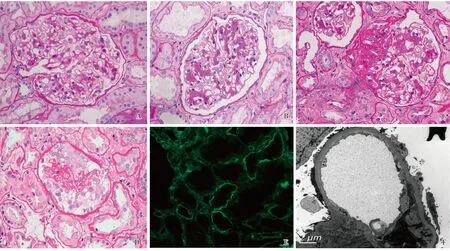
图2 狼疮足细胞病患者病理改变A:肾小球轻微病变(PAS,×400);B:肾小球系膜增生性病变(PAS,×400);C:局灶节段性肾小球硬化(PAS,×400);D:塌陷型局灶节段性肾小球硬化(PAS,×400);E:IgG在肾小管基膜沉积(IF,×400);F:肾小球足细胞足突广泛融合伴系膜区电子致密物沉积(EM)
肾脏病理与临床的联系 比较三种不同病理类型患者的临床特征发现,三组尿蛋白和血浆白蛋白水平及自身抗体阳性率无差异,但FSGS组AKI发生率明显高于MCD和MP组(P<0.01),FSGS组和MP组补体C3下降率显著高于MCD组(P<0.01)。三组间肾小球足细胞足突融合范围无明显差异,FSGS组肾小管间质中重度急性病变比例显著高于MCD和MP组(P<0.05),肾小管Ig(s)/补体沉积比例也较高,但无统计学差异(表3)。
治疗反应和预后 初次诱导治疗采用激素(n=33)或激素联合免疫抑制剂(n=20),疗效判断时间为12周,总体缓解率94.3%,其中CR 37例(69.8%),PR 13例(24.5%),3例NR。6例需肾脏替代治疗者经激素治疗3天~2周后肾功能恢复正常。FSGS组CR率显著低于MCD和MP组(P<0.01)(表3)。
中位随访时间60月(36~82月),29例(54.7%)肾病复发,三组复发率无明显差异。13例在复发后行重复肾活检,各有3例转为Ⅳ型和Ⅴ型(表3)。随访末所有病例SCr均正常,无一例发生ESRD或死亡。
讨 论
狼疮足细胞病是近年来才逐渐被认识的一种特殊类型的LN,国外报道其发生率为 0.5%~1.6%[9-10]。本研究共收集53例狼疮足细胞病,占同期LN的1.41%。
本组患者临床多为肾病综合征,少数可表现为非肾病性蛋白尿,高血压和血尿的发生率低,这一临床特点与足细胞病相符。肾病综合征病例中34%合并AKI,与既往文献报道狼疮足细胞病的AKI发生率高相一致[4-5]。与增殖性LN不同,合并AKI的狼疮足细胞病并不存在肾小球新月体形成、袢内增生或血管病变等可能导致AKI的因素,而是突出表现为肾小管损伤。以往研究认为,肾病综合征并发AKI与有效循环容量不足相关[11],本组并发AKI的17例患者中仅1例有明确循环容量不足的表现,而近半数有免疫球蛋白和(或)补体沉积于肾小管上皮细胞或基膜,比例明显高于无AKI者,因此免疫复合物在肾小管的沉积导致的间质炎症反应有可能参与了肾小管损伤和AKI的发生[12]。另外,FSGS组AKI发生率明显高于MCD和MP组,这表明AKI与肾小球足细胞损伤的严重程度相关,这也从另一方面解释了免疫抑制剂治疗后所有AKI患者的肾功能迅速恢复正常。
本研究证实狼疮足细胞病组织形态学改变以MP最为多见(以往诊断为Ⅱ型LN),其次为MCD,FSGS最少,而Hertig等[3]报道的11例狼疮足细胞病中7例为FSGS。本研究发现,MCD组AKI发生率最低,而FSGS组合并AKI、高血压和血尿的比例最高,同时FSGS组低补体血症发生率最高,肾小管间质急性病变最重,肾小管Ig(s)/补体沉积比例高。不同的病理形态是狼疮足细胞病发展的不同阶段,还是其发病机制存在差异尚有待进一步研究。
狼疮足细胞病对激素或激素联合免疫抑制剂治疗总缓解率达94.3%,其中大部分达CR。本研究发现不同病理类型患者对免疫抑制治疗的反应不同,MCD和MP组的CR率最高,FSGS组缓解率最低,但复发率均较高,表明需要更好的维持期治疗方案。在复发后行重复肾活检发现部分发生病理转型,且多发生于反复复发后,尤其MP和FSGS组的转型率高于MCD组,因此,对于多次复发,尤其病理改变为MP或FSGS者,需行重复肾活检明确是否转型。
值得注意的是,本文6例患者在起病初除ANA阳性外并无其他肾外器官受累,因不满足SLE的诊断标准曾被误诊为足细胞病、IgA肾病等疾病,但在随访过程中出现其他系统受累而确诊为狼疮足细胞病。因此对于血清ANA阳性、肾活检免疫荧光及电镜下见系膜区免疫复合物沉积的足细胞病,要考虑SLE及狼疮足细胞病的可能,需长期激素或联合免疫抑制剂治疗,随访中应密切监测免疫学指标及其他系统受累的情况。
文献报道和本研究均发现少数狼疮足细胞病患者肾小球无免疫沉积物,这部分患者的足细胞病是SLE所致还是SLE合并原发MCD尚存在争议。目前认为肾小球系膜区电子致密物沉积与足细胞病变和蛋白尿程度无直接关系[5,13],足细胞损伤也非免疫复合物介导,而可能与T细胞功能异常有关[14-15],本文肾小球无电子致密物沉积的病例在肾病复发时都伴随肾外复发或免疫学指标活动,因此仍考虑其足细胞病变与SLE相关。
小结:狼疮足细胞病临床以肾病综合征为主要表现,AKI发生率高,部分病例早期SLE表现不典型。肾小球病变不均一,不同病理形态间临床表现、免疫学指标、肾小管损伤及激素治疗反应存在差异,表现为FSGS者肾脏损害更为严重,治疗反应更差,提示可能存在不同的损伤机制。
1 Pollack VE,Pirani CL,Schwartz FD.The natural history of the renal manifestations of systemic lupus erythematosus.J Lab Clin Med,1964,63:537-550.
2 Baldwin DS,Gluck MC,Lowenstein J,et al.Lupus nephritis:Clinical course as related to morphologic forms and their transitions.Am J Med,1977,62(1):12-30.
3 Hertig A,Droz D,Lesavre P,et al.SLE and idiopathic nephrotic syndrome:Coincidence or not? Am J Kidney Dis,2002,40(6):1179-1184.
4 Stankeviciute N,Jao W,Bakir A,et al.Mesangial lupus nephritis with associated nephrotic syndrome.J Am Soc Nephrol,1997,8(7):1199-1204.
5 Kraft SW,Schwartz MM,Korbet SM,et al.Glomerular podocytopathy in patients with systemic lupus erythematosus.J Am Soc Nephrol,2005,16(1):175-179.
6 Shea-Simonds P,Cairns TD,Roufosse C,et al.Lupus podocytopathy.Rheumatology (Oxford),2009,48(12):1616-1618.
7 Abdulmassih Z,Makdassi R,Bove N,et al.Epidemiology of primary glomerulonephritis in Picardie.Ann Med Interne (Paris),1990,141(2):129-133.
8 Simon P,Ramee MP,Ang KS,et al.Epidemiology of glomerular diseases in a region in France.Changes as a function of periods and the age of patients.Presse Med,1988,17(41):2175-2178.
9 Descombes E,Droz D,Drouet L,et al.Renal vascular lesions in lupus nephritis.Medicine (Baltimore),1997,76(5):355-368.
10 Huong DL,Papo T,Beaufils H,et al.Renal involvement in systemic lupus erythematosus.A study of 180 patients from a single center.Medicine (Baltimore),1999,78(3):148-166.
11 Seo DB,Lee SW,Song JH,et al.Acute renal failure associated with a minimal change nephrotic syndrome in a systemic lupus erythematosus patient.Yonsei Med J,2002,43(1):114-118.
12 Cameron JS.Lupus nephritis.J Am Soc Nephrol,1999,10(2):413-424.
13 Han TS,Schwartz MM,Lewis EJ.Association of glomemlar podocytopathy and nephrotic proteinuria in mesangial lupus nephritis.Lupus,2006,15(2):71-75.
14 Cunard R,Kelly CJ.T cells and minimal change disease.J Am Soc Nephrol,2002,13(5):1409-1411.
15 Koyama A,Fujisaki M,Kobayashi M,et al.A glomerular permeability factor produced by human T cell hybridomas.Kidney Int,1991,40(3):453-460.
(本文编辑 心 平 莫 非)
Clinic-pathological characteristics and outcomes of patients with lupus podocytopathies
WANGShaofan*,CHENHao*,CHENYinghua,LIUZhengzhao,XUFeng,LIUZhihong,HUWeixin
NationalClinicalResearchCenterofKidneyDisease,JinlingHospital,NanjingUniversitySchoolofMedicine,Nanjing210016,China*WANGShaofanandCHENHaoareconsidertobefirstauthorCorrespondingauthor:HUWeixin(E-mail:huwx@vip.163.com)
Objective:To investigate the clinical, histological characteristics and outcomes of SLE patients with lupus podocytopathy. Methodology:Fifty three SLE cases with renal involvement and biopsy-proven lupus podocytopathy were collected in this retrospective study. Their clinical,immunological pathological features and prognosis were analyzed. Results:The patients with lupus podocytopathy accounted for 1.41% of lupus nephritis patients in the same period. 50 (94.3%) cases presented as nephrotic syndrome in which 17 (14%)cases were complicated by acute kidney injury (AKI). The pathological manifestations under LM showed mesangial proliferation (MP) in 31 (58.5%) cases, minimal change disease (MCD) in 13 (24.5%)and focal segmental glomerulonephritis (FSGS) in 9 (16.9%) cases. The incidence of AKI was much higher in FSGS group than that in MCD and MP group (P<0.01). Compared with MCD group, the ratio of low serum C3 level was significantly higher in MP and FSGS group (P<0.01). 37 (69.8%) cases
complete remission (CR) undering induction treatment of glucocorticoid or steroids in combination with immune depressant. The CR rate in FSGS group was much lower than that in the other two groups (P<0.01). 29(54.7%) cases relapsed during follow-up. 13 patients had repeat renal biopsy while histological transition was found in 6. No patient progressed to end stage renal failure or death. Conclusion:Lupus podocytopathy was characterised by nephrotic syndrome, often complicated by AKI, and had different histological changes including MCD, MP and FSGS. It had high remission rate and benign prognosis, but easy to relapse. Patients with FSGS showed more serious renal lesion and worse therapeutic response.
lupus nephritis podocytopathy pathological classification prognosis
国家科技支撑计划课题(2011BAI10B04,2013BAI09B04,2015BAI12B05),江苏省自然科学基金(BK20131326)
南京大学医学院附属金陵医院(南京军区南京总医院)肾脏科 硕士研究生(王少凡),国家肾脏疾病临床医学研究中心 全军肾脏病研究所(南京,2100016),*王少凡和陈 浩为共同第一作者
胡伟新(E-mail:huwx@vip.163.com)
2014-12-05
ⓒ 2015年版权归《肾脏病与透析肾移植杂志》编辑部所有

