信号响应性基因载体及其应用研究
王 晶 刘 健 许海燕
(中国医学科学院基础医学研究所,北京协和医学院基础学院,北京 100005)
引言
基因治疗(gene therapy)是近年来被广泛关注的一种全新的治疗手段。广义的基因治疗,包括了所有在核酸水平上进行的治疗手段,包括增强或抑制特定基因的表达,以及导入功能性和外源性基因等。基因治疗与常规治疗方法的最重要的区别在于:一般意义上的疾病治疗,是针对基因异常所导致的各种症状进行对症治疗,而基因治疗则针对的是疾病的根源——异常的基因本身。目前,许多难以通过常规手段治疗的疾病,如遗传病(血友病、囊性纤维病、家庭性高胆固醇血症等)、恶性肿瘤、心血管疾病、感染性疾病(艾滋病、类风湿)等,均有望利用基因技术进行有效的治疗。因此,基因治疗技术将为克服这些对人类健康造成严重威胁的疾病提供有力的武器。
与常规药物治疗同样,基因治疗也需要将适量的核酸药物递送到目标部位,并使其在恰当的时间范围内发挥作用,这就离不开药物递送技术的帮助。而且由于核酸药物的特殊性,使其对药物递送系统有一些特殊的要求。例如,核酸药物通常需要到达细胞内的特定部位才能发挥作用,对于siRNA和shRNA等RNA药物来说,一般只要能进入细胞质即可,而对于质粒等需要通过翻译表达才能发挥作用的核酸药物,还必须进入细胞核内部。此外,由于核酸药物在化学结构上含有大量的磷酸基团,在生理环境下会带负电荷,因此裸的核酸药物分子会由于分子内的静电斥力呈伸展状态,分子尺寸较大;而且负电性的核酸药物也会与同样呈现电负性的细胞膜相互排斥[1],这些因素导致了核酸药物自身很难接近并进入细胞。基于这些原因,设计和构建能够搭载核酸药物进入细胞,并使其能在细胞内可控释放的载体,是实现基因治疗的关键。
核酸载体通常可分为病毒载体及非病毒载体两大类。病毒载体虽然具有很高的转染效率,但是由于其表面抗原容易引起人体免疫反应,且病毒的自我复制能力及潜在的突然变异风险,使病毒载体的安全性受到质疑[2]。对于非病毒载体,低水平的转染效率及特异靶向性的缺乏,是其应用于临床基因治疗的主要障碍。非病毒核酸递送系统要发挥作用,需要经历逃避免疫系统的清除、通过细胞膜屏障、从内体中逃逸、进入细胞核、与核酸药物分离等诸多必要的阶段[3]。这种复杂性是导致非病毒载体效率低下的主要原因,也使得单一功能的载体很难实现理想的效果。理想的非病毒性载体应具有以下特性:1)在血液中稳定存在,保护核酸分子不被细胞外核酸降解酶破坏,并能抵达目标细胞;2)能够准确靶向目标组织或细胞;3)能促进核酸分子进入细胞内部;4)使核酸分子高效地从内体中释放,进入细胞质;5)促进核酸分子进入细胞核并被表达(对于siRNA不需要);6)具有开关作用,保证核酸药物作用时间的可控性;7)具备可视化特性,能提供无损评估核酸递送效果的手段。很显然,传统载体难以同时满足上述要求,而且针对不同阶段的提高转染效率的策略,有时甚至是相互矛盾的。例如,虽然PEG修饰能延长载体在血液中的滞留时间并减少被网状内皮系统吞噬,但也导致了新的困境,即不利于载体被细胞识别并进入细胞;而另一方面,阳离子载体虽然能促进载体进入细胞并加速核酸复合体从内体中的释放,但非特异性的静电吸附,会使其在体内环境中难以达到目标部位。因此,需要开发一些具有一定“智能”的新型载体,使其能够根据环境或人工调控信号做出响应,适时地发挥某些特定的作用。这一类新型的信号应答型载体,是未来基因递送的主要发展方向之一。
从信号响应性基因载体这一概念的提出,到现在只有短短十几年的时间,但是对其进行的研究已经有了飞速的发展。温度和pH是生物体内两项重要的指标,所以最初的研究主要集中在温度和pH调控的信号应答性载体[4-5]。随着载体制备技术的成熟,以及对细胞内载体作用机制研究的深入,人们又陆续设计开发了能够应答其他信号的载体,包括超声、磁场、光照、电场、氧化/还原环境、酶等。尽管不同信号应答型载体的作用机理不同,但其目的都是为了帮助核酸药物突破各类生理屏障,提高其靶向性,并使核酸药物在特定时间及部位释放出来,从而实现高效、可控的治疗效果。
本文对信号应答的目的及机理进行了归纳,并根据所应答的信号性质,将载体分为外部物理信号响应载体及内部化学生理信号响应载体两大类,着重介绍了各种信号应答型载体的分子结构、应答机制及最新应用。同时,对近年来出现的能同步实现定位、诊断、治疗目的的多功能信号应答型载体,也做了详细的介绍。
1 单一信号响应性基因载体
1.1 外部物理信号刺激响应
1.1.1 温度敏感性基因载体
温度是一项重要的生理指标,并且易于进行人工干预,因此能够比较方便地通过温度变化调控载体的功能,这一类载体通常被称为温敏性基因载体。温度敏感性基因载体一般由两部分组成:DNA结合基团和温度敏感基团。其中DNA结合基团通常在结构组成上含有大量胺基,在生理条件下带正电,能通过静电吸引使DNA吸附在载体上;而温度敏感基团则会对温度的变化做出响应,从而使载体的性状发生改变。聚异丙基丙烯酰胺(PNIPAm)是最常用的温度敏感基团,它的低临界溶解温度(LCST)在32℃左右[6],接近正常生理温度。当温度高于LCST时,酰胺基和水之间的氢键被破坏,酰胺基之间形成分子内氢键,链段中疏水的异丙基开始起主导作用,此时PNIPAm的疏水性较强,高分子链段发生皱缩并紧密包裹DNA,利于其进入细胞内;而当温度下降到低于LCST时,酰胺键与水分子之间会形成氢键,使水合作用加强,此时PNIPAm亲水性增加,链段舒展并与DNA分离,从而达到DNA释放的目的(见图 1)。Kurisawa等[7]制备了 P(NIPAm-8DMAEMA-11BMA),其中包含了8 mol%DMAEMA和11 mol%BMA,LCST是21℃。实验证明该载体能够成功地将pCMV-lacZ质粒转染到COS-1细胞中,其在37℃下能够对DNA分子进行包覆;而温度降到20℃后,DNA分子绝大部分会与载体分离。Li等制备了一系列基于低聚乙二醇(OEG)的树枝状大分子,并研究不同支化程度、不同侧链取代基对其LCST的影响[8]。经过改造后,树枝状大分子的LCST可以从100℃ ~176℃调节至 27℃ ~65℃,从而满足在生物体的应用。Oupicky'等制备了小分子量的聚赖氨酸(PLL)与PNIPAm的接枝共聚物,并研究了其在38℃和20℃下对DNA分子包覆和释放情况[9]。他们发现当温度高于转变温度时,载体与DNA分子所形成的聚电解质复合物的密度会有一个明显的增加,增加的程度随PNIPAm在载体中所占比例的增大而增加,与PNIPAm的分子量无关,而且随着PNIPAm链段的收缩,复合物表面的电荷量也会增加。除此之外,也有将聚氧乙烯(PEO)、聚乙烯基吡咯烷酮(PVP)等具有温度敏感型的高分子用于载体的制备,但是其应用的广泛程度远不及PNIPAm。温度敏感型基因载体可以说是响应性载体的构建基础,对它的研究一直没有停止过,且综述也很多,此处不再展开。

图1 温度敏感性基因载体的响应机制[6]。载体与DNA的复合物在临界温度以上时会紧密结合,低于临界温度时会变得松散,从而控制DNA释放Fig.1 The concept of temperature-responsive gene carriers[6].A complex between the carrier polymer and the DNA is tightly formed above the transition temperature and loose under the transition temperature,then to control DNA release
1.1.2 超声响应性基因载体
超声微泡在造影剂方面一直有广泛的应用。将其用于基因转染是信号响应性载体的又一发展方向。具有超声波响应性的微囊,通常由外壳和内充气体两部分构成,在超声波的作用下,空化效应及声孔效应使内部气体产生“震荡”或“内爆”活性。伴随发生的微束、冲击波、射流等激烈过程,导致周围组织的细胞壁和质膜被击穿,产生可逆或不可逆的小孔,从而引起细胞膜通透性改变。在基因转染过程中,微泡急剧萎陷产生的强大射流,犹如成千上万的微型注射器,将基因注入细胞内(见图2)。
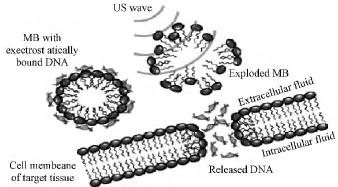
图2 声孔效应在基因递送中的应用[10]。当包含pDNA的微囊通过血管接近肿瘤细胞,在US作用下微囊破裂释放pDNA。释放的pDNA利用声孔效应造成的小孔进入细胞Fig.2 Sonoporation for gene delivery[10]. When plasmid-DNA-(pDNA-)containing MBs are passed through blood vessels adjacent to tumor cells,US waves rupture MB and release pDNA.Released pDNA penetrates into cells through their membranes by sonoporation
Chumakova等制备了PLGA/PEI/质粒复合物纳米粒子[11]。PEI的表面带负电用于搭载 DNA,PLGA微球内部充满空气用于超声响应。在超声波的作用下,微球破碎使DNA释放进入细胞内。研究表明,超声辐照组载体的转染效率比未辐照组提高了8倍。Vandenbroucke等将siRNA进行PEG化以防止其在体内被降解,并将PEG化的siRNA络合物(PEG-siPlexes)搭载于 C4F10的纳米微球上[12]。在超声作用下氟化物会气化爆破,促进PEG-siPlexes进入细胞内。与不进行超声作用的载体相比较,转染效率显著提高(见图3)。Sirsi等在脂膜微囊(lipid-coated microbubbles)上修饰了PEG,PEI分子合成一种新型的超声响应型微囊,在体内试验中取得了很好的效果[13]。Nomikou等则研究了中性微囊、阳离子化微囊及生物素修饰阳离子化微囊,在超声作用下的体内体外基因递送效率[14]。结果显示的递送效果为:生物素修饰阳离子化微囊>阳离子化微囊>中性微囊。由于超声波使用方便,在安全性、穿透性等方面具有很强的优势,因此,未来超声响应性基因载体将会有很大的发展空间。
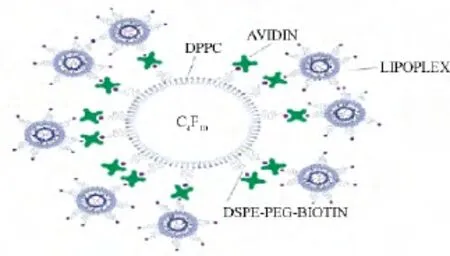
图3 PEG-siPlexes搭载于微囊表面[12]Fig.3 Schematicoverview ofa PEG-siPlex loaded microbubble[12]
1.1.3 磁场控制基因载体
利用磁场对磁性颗粒的作用力,人们开发了磁性转染(magnetofection)技术。该技术将磁性颗粒通过静电相互作用或者抗原-抗体结合等方式,连接于病毒载体或非病毒载体上,通过磁场的诱导使载体接近细胞膜,在初期转染时可以有效提高转染效率[15]。磁场的另一个重要应用是用来实现靶向递送的作用。Liu等制备了核壳结构的Fe3O4聚多巴胺纳米粒子(Fe3O4@PDA NPs),用于搭载基因和药物,Fe3O4核被厚度约为20 nm的PDA外壳包裹,可在磁场的作用下达到靶位置并释放DNA或药物[16]。由于PDA同时具有还原剂和偶联剂的作用,在其表面还可以沉积Au纳米粒子,可以作为一种新型的催化剂载体。此外,通过磁场达到控制释放的目的近年来也有研究。Giri等设计了一种中空的二氧化硅管,在其内部可以包封药物或DNA,两端用磁性纳米颗粒 Fe3O4进行封堵[17]。当载体进入细胞后,细胞内的还原性条件使酰胺键断裂,在磁场作用下Fe3O4脱落,内部搭载的DNA或药物释放(见图4)。由于磁性颗粒生物相容性较好,而且超顺磁性氧化铁颗粒可以作为临床核磁成像中的造影剂,磁场响应性氧化铁纳米颗粒受到了越来越多的关注,并有望实现诊疗一体化载体的开发。比如Filippousi等利用纳米沉淀法制备了以超顺磁Fe3O4为核心、mPEG-PPSu-mPEG为壳结构的磁场响应性载体,不仅可用于诊断,还可搭载药物或基因[18]。
1.1.4 光敏感性基因载体
很多化学反应可以被光照引发或加速,自然界中最重要的光化学反应是植物的光合作用。在半导体技术中广泛使用的光刻蚀技术,也是利用光的能量使特定分子分解。光化学反应还可以用来生成一些新的活性物质,其在医学方面最典型的应用就是光动力治疗(PDT)。光动力学治疗首先使光敏剂(具有光敏活性的分子)定位于靶细胞或目标组织中,随后利用可以激活光敏剂的特定波长的光对目标部位进行照射。此时光敏剂分子能将光子能量传递给周围的氧分子,进而产生各种活性氧(ROS)成分,如单线态氧、超氧自由基等,这些活性氧成分可以用来杀死肿瘤细胞[19-20]。

图4 基于二氧化硅包裹超顺磁氧化铁纳米粒子的磁响应性递送体系[17]Fig.4 Schematic of the magnetic-responsive delivery system based on mesoporous silica nanorods capped with superpara magneticiron oxide nanoparticles[17]
光化学反应的机理也可以用来设计合成光刺激响应性基因载体。比如利用光照诱发特定化学键断裂,或利用光照产生的活性氧破坏内体膜,从而促进核酸药物在细胞内的释放等。Monroe等研究了质粒与光敏感基团复合后的表达状况[21]。将带有荧光素酶的质粒包裹在重氮乙烷(DMNPE)中,用基因枪法注射到小鼠皮下直径约1 cm的位置进行转染,在355 nm的光照条件下,可以有效提高转染效率。这是对设计光刺激响应性载体的早期探索。Handwerger等合成了生物素化光敏性聚乙烯亚胺(B-PC-PEI)用于DNA的递送,其中的邻硝基苄醇基团在20 cm(9 mW/cm2)光照强度下以365 nm波长照射5 min后可以发生裂解,从而实现释放siRNA 的目的[22]。Deng等在 Poly(b-amino ester)s(PBAEs)的基础上加入光敏基团,在UV的照射下能够显著提高载体的降解速度(见图 5)[23]。PBAEs是一种常用的阳离子载体,但是其分子量很大且在细胞内降解慢,因而具有很大的细胞毒性。加入光刺激响应的基团后,光照条件下载体能迅速降解,有效降低了载体毒性,提高转染效率。该载体在多种哺乳动物细胞中均取得很好效果。随后,Yin等也制备了一种结构为PDMNBLG-r-PVBLG-8的载体,用于搭载 DNA[24]。当载体从内涵体中逃逸后,通过光照控制DNA的释放,提高干扰效率。Li等更是在光响应的基础上,结合了荧光分子或其他生物制剂,通过交互作用制备了可同时实现示踪、控释、治疗目的的基因载体[25]。迄今,利用光照条件递送药物的载体比较多见,将其用于基因递送的研究还相对较少。
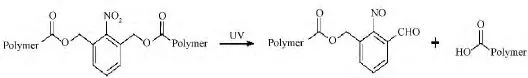
图5 PBAEs在光照条件下的降解过程[23]Fig.5 Proposed degradation mechanisms of PBAEs in response to UV irradiation[23]
1.2 内部生化学信号刺激响应
外部物理信号虽然能很容易的实现人工干预,并能很好地实现针对特定部位的靶向控释。但在实际应用中需要有明确的病灶部位,这对于实体肿瘤等特定情况下是有效的,但对于白血病、遗传性疾病等系统性疾病,则会面临无从下手的窘境。而且,受限于物理信号的空间分辨率,针对特定细胞或特定组织的精确定位,在目前的技术水平下也难以实现。因此,利用病变组织、细胞内的特定化学环境及特定细胞因子、代谢产物、信号通路中间产物等信号分子的差异性,开发对生物体内部的生化学信号做出响应的智能载体,就成为一个重要的策略。
1.2.1 pH敏感性基因载体
特定的pH环境是生物体维系正常生理功能的必要条件。人体内不同组织、器官的pH环境存在巨大差异,如胃中的pH在1~2左右,而肠道则在8左右。对于肿瘤组织来说,由于肿瘤细胞生长速度快,肿瘤组织内部血供不足,导致其内部的pH值由正常组织的7.4降至5~6左右。此外,细胞内部不同细胞器内的pH环境也大不相同,如内体中的pH在5.5~6.0,溶酶体中更是接近4.5,其酸性远远高于细胞外部[26-27]。这些环境酸性的差异,使pH响应性药物载体的开发成为可能。
目前,对pH敏感性基因载体的研究已经相当成熟,pH敏感的脂质、纳米微囊、树枝状大分子等都是研究的对象。Yatvin等首先设计制备了第一类由卵磷脂和N-棕榈酰同型半胱氨酸(PHC)组成的pH敏感性脂质[28]。自此,带有如乙烯醚、腙、缩醛和原酸酯官能团的脂质[29-30],都引起了研究者的广泛关注。与一般药物载体不同,基因载体的作用场所大多是细胞内部,由于载体复合物大多是以胞吞方式进入细胞,并与溶酶体融合,因此pH敏感性基因载体,会更多的利用到细胞中酸性溶酶体或内体与细胞外部存在的pH差异。Tseng等利用pH响应的机理,在载体与DNA复合物的外部螯合Zn2+:ntaPEG,从而提高载体的稳定性[31]。当载体进入溶酶体中(pH=4)后,螯合的PEG降解并释放DNA。pH敏感性的聚合物,通常是利用pH调节聚合物的亲、疏水性质,从而达到阳离子遮蔽的目的,在低pH值下,载体电荷发生变化,“质子海绵效应”可以使溶酶体溶胀破裂,促使DNA释放到细胞质中。如何提高载体的敏感度,使DNA更快的从溶酶体中逃逸出来,成为pH响应性基因载体主要的研究方向。而质子海绵效应理论仍存在诸多矛盾,需要进一步的证实[32]。
除此之外,利用pH敏感的特点调控载体表面电荷,从而降低载体对血清等成分的吸附,实现载体在体内长循环也是一个热点研究方向。Murthy等设计了一系列以疏水的P(BMA-DMAEMA-styrene)三元共聚物为骨架,表面覆盖可酸降解的苯甲醛缩乙二醇键连接的PEG链的“加密”高分子,用来搭载寡核苷酸[33]。在pH=7.4的生理环境中,PEG化的载体可以有效减少血清中蛋白的吸附及免疫系统对载体的识别;当进入肿瘤细胞内的溶酶体后,醇键断裂,卸掉PEG外壳的载体利用质子海绵作用逃离溶酶体。Du等更是综合利用了肿瘤组织及细胞内两种pH梯度,将阳离子载体用于细胞内阿霉素的递送[34]。当载体进入肿瘤微环境时,pH降低到6.8左右,带负电荷的载体外部电荷反为正电荷,有利于细胞的摄取。进入溶酶体后,pH降低至5.0左右,载体崩解并释放药物。将该载体用于搭载基因也是一个不错的选择。
1.2.2 氧化还原敏感性基因载体
氧化还原刺激响应性载体的实现,主要依赖于细胞内部存在大量的谷胱甘肽。细胞内谷胱甘肽的浓度是细胞外的200倍以上,从而在细胞内外形成了氧化还原电位差。氧化还原敏感性基因载体,通常在化学结构上含有对谷胱甘肽(GSH)还原酶或二硫苏糖醇(DTT)敏感的二硫键(-S-S-),在还原剂存在下能被还原成巯基,使分子链断裂。由于细胞外的谷胱甘肽不足以还原二硫键,所以只有当载体进入细胞内部时“敏感开关”才会启动,从而起到在胞内定点释放核酸药物的作用[35]。Chen等设计了一种具有还原响应性的聚酰胺-胺型(RHB)超支化大分子,由DMDPTA、HMBA、CBA通过迈克尔加成共聚得到,其中的二硫键在还原条件下会被破坏[36]。实验证明,具有氧化还原敏感性的载体有效地提高了基因的转染效率。与此类似,Manickam等也通过制备含有二硫键的大分子聚合物或者脂质体,来实现对细胞内谷胱甘肽的氧化还原响应,从而提高基因载体的转染效率[37]。Yuan等设计制备了一种能够靶向成纤维细胞生长因子受体的氧化还原型基因载体[38]。其通过MPC与Ad-SS-PEG自组装形成以PEG为包覆层的基因载体。载体进入细胞后接触氧化还原的环境二硫键被还原,PEG脱离,载体降解从而释放DNA(见图6)。
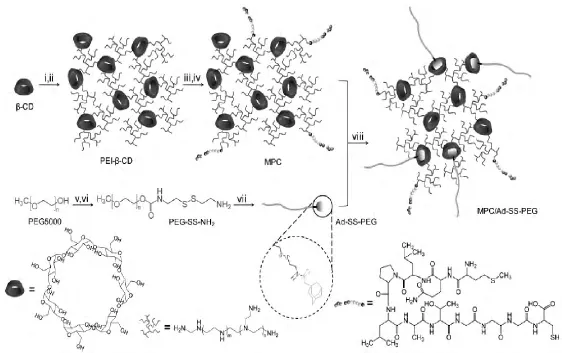
图6 MPC/Ad-SS-PEG载体的合成路线[38]Fig.6 Synthesis route of MPC/Ad-SS-PEG[38]
1.2.3 其它细胞内特定分子敏感性基因载体
除了以上几种大多数细胞中都存在的响应机制外,近年来,对于针对细胞内其它特定分子如酶、葡萄糖等设计的敏感性基因载体也有一些研究。酶敏感的载体,一般通过利用肿瘤细胞中某些过表达的酶所需要的酯类衍生物及短肽序列来达到靶向肿瘤细胞的目的[39-40]。利用这个原理,通过氨基甲酸酯将一些小分子胺类(亚精胺、精胺等)连接在超支化的聚甘油上,从而制备了酶敏感的基因载体[41]。该载体能够将siRNA压缩后在细胞内部释放,其基因沉默效率十分理想。将酶敏感性用于载体脱去PEG也是一个新颖的尝试,在肿瘤细胞上存在高表达的基质金属蛋白酶(MMP)[42],Hatakeyama等利用这一特点设计了PEG-peptide-DOPE(PPD)载体,在体内可实现长循环[43]。当达到肿瘤部位时,其中的缩氨酸结构被MMP酶解后脱去PEG,在体外的转染实验中效果也十分理想。
2 多重刺激响应敏感性载体
随着对刺激响应性载体研究的深入,单一的刺激响应功能已经不能满足需求。在同一载体上实现多种功能,例如同时起到靶向定位及诊断治疗的目的,是当前载体研究的另一大方向。以下介绍几种可同时实现多种功能的复合型刺激响应性载体,其中有些转染效率已被初步研究,但大多数还处于材料制备合成阶段;少数几种搭载了药物或基因,其设计理念新颖多样,应用前景广泛。
邢等采用声振空化法制备基于表面活性剂的微泡超声造影剂(ST68),结合了超声和磁感应两种物理响应机制[44]。用多元醇法制备表面带负电荷的磁性Fe3O4纳米粒子。以微泡为模板,通过静电吸引层层自组装的方法,使聚乙烯亚胺和磁性Fe3O4纳米粒子在微泡表面交替沉积,制备磁性微泡。该载体只研究了其在靶向和超声造影方面的应用,若能使微泡囊搭载DNA,通过磁靶向使载体接近细胞,在超声的作用下释放DNA,也将是一个很好的设想。
利用磁场进行靶向,再结合温度、pH、氧化还原等条件控制DNA释放,是多功能刺激响应性载体典型的设计理念。Wang等利用ATRP法成功在磁性纳米颗粒表面接枝了温度敏感基团,使载体同时具有磁控及温敏特性[45]。研究表明,尺寸控制在100~120 nm的载体,通过外加磁场和温度控制在COS-7和HepG-2细胞中可以有效提高转染效率。Hao等制备了一种以Fe3O4磁性纳米粒子为中心的壳球形基因载体[46]。利用了磁场进行靶向定位进入细胞,利用氧化还原响应控制DNA释放。其制备方法是通过胆固醇化的聚甲基丙烯酸N,N-二甲基氨基乙酯(Chol-PDMAEMA30),把Fe3O4连接在一起并通过静电吸附DNA,在其表面用聚甲基丙烯酸单甲氧基聚乙二醇酯 -b-聚甲基丙烯酸(PPEGMA-b-PMAASH)形成球壳,通过二硫键进行交联固定形状从而增强DNA包封率。在磁场的作用下载体进入细胞内部,二硫键氧化还原,使球壳破裂释放DNA(见图7)。

图7 磁场-氧化还原复合型基因载体[46]Fig.7 Schematic diagram of the magnetic/redox-responsive gene carries[46]
pH与温敏相结合也是一个研究的热点。Guo等[47]制备的温度-pH敏感性两亲性水凝胶应用于药物载体方面获得了很好的效果。Alexander等更是对pH-温敏性载体在基因递送方面的应用进行了综述[48]。除此之外,还有 pH-光响应[49]、pH-氧化还原敏感[50-51]、pH-温度-氧化还原三重响应[52]等结合各种响应机制的载体设计,有的已经应用于基因递送并取得了很好的效果,有的还仅限于材料制备阶段。
由于磁转染、pH、温度敏感性载体是刺激响应性载体中研究时间较长、制备技术相对成熟的几种载体,所以开发复合型载体大多是建立在这三者的基础上。随着对其他响应性机制研究的深入,多功能刺激响应性载体的种类会更加丰富。
3 结语
综上所述,刺激响应性基因载体在体外的实验结果令人欣喜,预期的作用机制可基本实现,是提高基因治疗的效率、增强基因药物特异性及靶向性的有效手段。但目前大多数研究仍停留在细胞水平,在体内实验中依然鲜有成效,其主要原因是体内环境比体外培养体系要复杂得多。提高信号响应的专一性及灵敏度,同时维持适当的响应阈值,以及寻找靶标细胞和组织所特有的内源性信号,将是信号响应性载体走向临床应用所必须面对的主要挑战。多信号协同调控以及联合分子影像学技术的诊疗一体化技术应该是未来研究的趋势。当然,由于主要的刺激响应性载体多为通过各种化学手段制备而来的高分子聚合物,设计的响应机制越多,制备过程越复杂,其实用性及安全性也就需要进行更多的验证。
[1]Nishikawa M,Huang L.Nonviral vectors in the new millennium:delivery barriers in gene transfer[J].Hum Gene Ther,2001,12(8):861-870.
[2]Leong KW,Mao HQ,Truong-Le VL,et al.DNA-polycation nanospheres as non-viral gene delivery vehicles[J].J Control Release,1998,53(1-3):183-193.
[3]Jeong JH,Kim SW,Park TG.Molecular design of functional polymers for gene therapy[J].Prog Polym Sci,2007,32(11):1239-1274.
[4]Torchilin VP.Targeted pharmaceutical nanocarriers for cancer therapy and imaging[J].AAPS J,2007,9:128 -147.
[5]Shenoy D,Little S,Langer R,et al.Poly(ethylene oxide)-modified poly(β-amino ester)nanoparticles as a pH-sensitive system for tumor-targeted delivery of hydrophobic drugs:part 2.In vivo distribution and tumor localization studies[J].Pharm Res,2005,22(12):2107 -2114.
[6]Heskins M,GuilletJE.Solution propertiesofpoly(N-isopropylacrylamide)[J].Sci Chem,A2:1441-1455.
[7]Kurisawa M,Yokoyama M,Okano T.Gene expression control by temperature with thermo-responsive polymeric gene carriers[J].J Control Release,2000,69(1):127 -137.
[8]Li Wen, ZhangAfang, Chen Yong, etal. Low toxic,thermoresponsive dendrimers based on oligoethylene glycols with sharp and fully reversible phase transitions[J].Chem Commun(Camb),2008,45:5948-5950.
[9]Oupický D,Reschel T,Konák C,et al.Temperature-controlled behaviorofself-assembly gene delivery vectorsbased on complexes ofDNA with poly (l-lysine)-graft-poly (N-isopropylacrylamide)[J].Macromolecules,2003,36:6863 -6872.
[10]Figueiredo M,Esenaliev R.PLGA nanoparticles for ultrasoundmediated gene delivery to solid tumors[J].J Drug Deliv,2012,2012:1-20.
[11]Chumakova OV,Liopo AV,Andreev VG,et al.Composition of PLGA and PEI/DNA nanoparticles improves ultrasound-mediated gene delivery in solid tumors in vivo [J].Cancer Lett,2008,261(2):215-225.
[12]Vandenbroucke RE,Lentacker I,Demeester J,et al.Ultrasound assisted siRNA delivery using PEG-siPlex loaded microbubbles[J].J Control Release,2008,126(3):265 -273.
[13]Sirsi SR, HernandezSL, ZielinskiL, etal. Polyplexmicrobubble hybrids for ultrasound-guided plasmid DNA delivery to solid tumors[J].J Control Release,2012,157(2):224 -234.
[14]Nomikou N,Tiwari P,Trehan T,et al.Studies on neutral,cationic and biotinylated cationic microbubbles in enhancing ultrasound-mediated gene delivery in vitro and in vivo[J].Acta Biomater,2012,8(3):1273 -1280.
[15]Scherer F,Anton M,Schillinger U,et al.Magnetofection:enhancing and targeting gene delivery by magnetic force in vitro and in vivo[J].Gene Ther,2002,9(2):102 -109.
[16]Liu Rui,Guo Yunlong,Odusoten G,et al.Core-shell Fe3O4polydopamine nanoparticles serve multipurpose as drug carrier,catalyst support and carbon adsorbent[J].ACS Appl Mater Interfaces,2013,5(18):9167-9171.
[17]Giri S,Trewyn BG,Stellmaker MP,et al.Stimuli-responsive controlled-release delivery system based on mesoporous silica nanorods capped with magnetic nanoparticles[J].Angew Chem Int Ed Engl,2005,44(32):5038 -5044.
[18]Filippousi M,Papadimitriou SA,Bikiaris DN,et al.Novel coreshell magnetic nanoparticles for Taxol encapsulation in biodegradable and biocompatible block copolymers:preparation,characterization and release properties[J].Int J Pharm,2013,448(1):221-230.
[19]Dolmans DE,Fukumura D,Jain RK.Photodynamic therapy for cancer[J].Nat Rev Cancer,2003(3):380 -387.
[20]Delaney TF,Glatstein E.Photodynamic therapy of cancer[J].Comprehensive Therapy,1988,14(5):43-55.
[21]Monroe WT, McQuain MM, Chang MS, et al. Targeting expression with light using caged DNA[J].J Biol Chem,1999,274(30):20895-20900.
[22]Handwerger RG,Diamond SL.Capture and triggered release of nucleic acids from solid supports[J].Bioconjug Chem,2007,18(3):717-723.
[23]Deng Xiaojian, Zheng Nan, Song Ziyuan, et al. Triggerresponsive,fast-degradable poly(β-amino ester)s for enhanced DNA unpackaging and reduced toxicity [J]. Biomaterials,2014,35(18):5006-5015.
[24]Yin Lichen,Tang Haoyu,Kim KH,et al.Light-responsive helical polypeptides capable of reducing toxicity and unpacking DNA:toward nonviral gene delivery[J].Angew Chem Int Ed Engl,2013,52(35):9182 -9186.
[25]Li Wenyu,Du Jianwei,Zheng Kun,et al. Multifunctional nanoparticles via host-guest interactions:a universal platform for targeted imaging and light-regulated gene delivery[J].Chem Commun(Camb),2014,50(13):1579-1581.
[26]Engin K,Leeper DB, Cater JR, et al. Extracellular pH distribution in human tumours[J].Int J Hyperthermia,1995,11(2):211-216.
[27]Mellman I,Fuchs R,Helenius A.Acidification of the endocytic and exocytic pathways[J].Annu Rev Biochem,1986,55:663-700.
[28]Yatvin MB, Kreutz W, Horwitz BA, et al. pH-sensitive liposomes:possible clinical implications[J].Science,1980,210(4475):1253-1255.
[29]Cordes EH,Bull HG.Mechanism and catalysis for hydrolysis of acetals,ketals,and ortho esters [J].Chem Rev,1974,74(5):581-603.
[30]Tseng SJ,Zeng YiFang,Deng YuFan,et al.Switchable delivery of smallinterferingRNA usinganegativelycharged pH-responsive polyethylenimine-based polyelectrolyte complex [J].Chem Commun(Camb),2013,49(26):2670-2672.
[31]Tseng Wenchi, Su Lingyu, Fang Tsueiyun. pH responsive PEGylation through metal affinity for gene delivery mediated by histidine-grafted polyethylenimine[J].J Biomed Mater Res B Appl Biomater,2013,(2):375 -386.
[32]Kobayashi K,Agari T,Oka M,et al.Detection of seizureassociated high-frequency oscillations above 500 Hz [J].Epilepsy Res,2010,88(2-3):139-144.
[33]Murthy N,Campbell J,Fausto N,et al.Design and synthesis of pH-responsive polymeric carriers that target uptake and enhance the intracellular delivery of oligonucleotides[J].J Control Release,2003,89(3):365-374.
[34]Du Jinzhi,Du Xiaojiao,Mao Chengqiong,et al.Tailor-made dual pH-sensitive polymer-doxorubicin nanoparticles for efficient anticancer drug delivery[J].J Am Chem Soc,2011,133(44):17560-17563.
[35]Raina S,Missiakas D.Making and breaking disulfide bonds[J].Annu Rev Microbiol,1997,51:179 -202.
[36]Chen Jun,Wu Chao,Oupický D.Bioreducible hyperbranched poly (amido amine)s for gene delivery [J].Biomacromolecules,2009,10(10):2921 -2927.
[37]Manickam DS,Li Jing,Putt DA,et al. Effect of innate glutathione levels on activity of redox-responsive gene delivery vectors[J].J Controll Release,2010,141:77 -84.
[38]Ping Yuan,Hu Qida,Tang Guping,et al.FGFR-targeted gene delivery mediated by supramolecularassembly between βcyclodextrin-crosslinked PEI and redox-sensitive PEG [J].Biomaterials,2013,34(27):6482 -6494.
[39]Azagarsamy MA,Sokkalingam P,Thayumanavan S.Enzymetriggered disassembly of dendrimer-based amphiphilic nanocontainers[J].J Am Chem Soc,2009,131(40):14184 -14185.
[40]Duncan R. Designing polymer conjugates as lysosomotropic nanomedicines[J].Biochem Soc Trans,2007,35(Pt 1):56 -60.
[41]Rainer H,Wiebke F,Abdul QM,et al.Compounds suited as nanocarriers for active agents and their use[P].European Patent Application:12/994165,2011-04-07.
[42]Coussens LM, Fingleton B, Matrisian LM. Matrix metalloproteinase inhibitors and cancer—trials and tribulations[J].Science,2002,295(5564):2387 -2392.
[43]Hatakeyama H,Akita H,Kogure K,et al.Development of a novel systemic gene delivery system for cancer therapy with a tumor-specific cleavable PEG-lipid [J].Gene Ther,2007,14(1):68-77.
[44]邢占文,柯亨特,王金锐,等.基于聚合物微泡的超声/荧光双模态造影剂的制备及成像研究[J].中华核医学与分子影像杂志,2013,2(33):14-18.
[45]Wang Hongbo,Yang Jianhai,Li Yongmao,et al.Combining magnetic field/temperature dual stimuli to significantly enhance gene transfection of nonviral vectors[J].J Mater Chem B,2013,1:43-51.
[46]Hao Ying,Zhang Mingzu,He Jinlin,et al.Magnetic DNA vector constructed from PDMAEMA polycation and PEGylated brush-type polyanion with cross-linkable shell[J].Langmuir,2012,28(15):6448-6460.
[47]Guo Baolin,Gao Qingyu.Preparation and properties of a pH/temperature-responsive carboxymethyl chitosan/ poly (N-isopropylacrylamide)semi-IPN hydrogel for oral delivery of drugs[J].Carbohydr Res,2007,342(16):2416 -2422.
[48]Schmaljohann D.Thermo-and pH-responsive polymers in drug delivery[J].Adv Drug Deliv Rev,2006,58(15):1655 -1670.
[49]Dirksen A,Zuidema E,Williams RM,et al.Photoactivity and pH sensitivity of methyl orange functionalized poly(propyleneamine)dendrimers[J].Macromolecules,2002,35(7):2743-2747.
[50]Bulmus V,Woodward M,Lin L,et al.A new pH-responsive and glutathione-reactive,membrane-disruptive polymeric carrier for intracellular delivery of biomolecular drugs[J].J Control Release,2003,93(2):105-120.
[51]Chen Wei,Zhong Ping,Meng Fenghua,et al.Redox and pH-responsive degradable micelles for dually activated intracellular anticancer drug release[J].J Control Release,2013,169(3):171-179.
[52]Klaikherd A,Nagamani C,Thayumanavan S.Multi-stimuli sensitive amphiphilic block copolymer assemblies[J].J Am Chem Soc,2009,131:4830-4838.

