电沉积纳米金修饰的16通道电流型PSA免疫传感器的制备
王泽华 曾冬冬 张 欢 宓现强*
1(上海理工大学医疗器械与食品学院,上海 200093)
2(中国科学院上海高等研究院,上海 201210)
引言
前列腺特异性抗原(prostate specific antigen,PSA)是由前列腺上皮细胞分泌产生的一种丝氨酸蛋白酶,1971年首次发现于精液中,而且这种蛋白只在前列腺组织中存在。1979年,Wang等从前列腺组织中提取并纯化了这种蛋白质[1]。正常情况下,PSA直接分泌到前列腺导管系统内,正常的前列腺导管系统周围存在着一种由内皮层、基底细胞层和基底膜构成的屏障,可避免前列腺上皮产生的PSA直接进入血液之中,从而维持了血液中PSA的低浓度。当前列腺发生癌变时该屏障被破坏,致使PSA直接进入血内,癌的恶性程度越高,对正常前列腺组织的破坏就越大,血清中PSA浓度也相应增高。一般认为,血清PSA小于4.0 ng/mL为正常,PSA大于10 ng/mL则患前列腺癌的危险性增加[2]。因此,检测 PSA已成为诊断前列腺癌的重要手段[3]。
目前,临床用于PSA检测的方法主要有酶联免疫吸 附 测 定 法 (ELISA)[4-5]、化 学 发 光 免 疫 法(CLIA)[6-7]和荧光免疫分析法(FIA)[8-9]等。这些方法虽各具优点,但在快速、灵敏、特异等方面还不理想,探求更好的简便、高效检测方法仍是目前的研究热点和发展趋势。电化学免疫检测技术可以将目标识别元件中抗原和抗体结合产生的化学量转化成与分析物浓度有关的电信号,并通过电子系统进行处理和显示。电化学免疫传感器(electrochemical immunosensor,ECIS)由一个目标识别元件和一个信号换能器组成,具有灵敏、快速、简便、高效等特点,基于电化学免疫传感技术制备的检测设备相对来说成本低、能耗少且易于微型化和集成化[10],被认为是很有希望实现简便、高效检测PSA的器件。
基于裸碳电极的电化学免疫传感方法检测时间短、样品消耗少,但存在阴阳性电流响应曲线的离散度差、灵敏度低等不足[11],从而制约了此免疫传感器的实际应用。针对这些缺陷,研究人员将纳米技术与电化学免疫分析技术相结合,相继开发了用于PSA检测的碳纳米管修饰的电化学免疫传感器、基于三维纳米线阵列的无标记电化学免疫传感器、基于纳米金修饰的聚酰胺胺(Au-PAMAM)复合材料的电化学免疫传感器等[12-14],但普遍存在制备过程较复杂、操作繁琐、纳米粒子材料易流失等不足。本研究在裸碳电极基础上通过将纳米金电沉积在16通道丝网印刷碳电极(16-SPCE)表面,制备了一种PSA电流型免疫传感器。与传统电化学免疫传感器相比,该免疫传感器的制备时间明显缩短,特异性和灵敏度明显提高,且可降低成本,为临床免疫分析及检测提供了一种快速、新颖和简便的方法。
1 材料和方法
1.1 仪器与试剂
CHI660电化学工作站购于上海辰华仪器公司。16通道丝网印刷碳电极由中国科学院上海应用物理研究所提供。
3,3',5,5'-四甲基联苯胺(K-blue 低活性底物,已配有双氧水)水溶液购于 Neogen公司(Lexington,KY)。牛血清蛋白(BSA)购于Sigma公司。HAuCl4·3H2O(Au% >48%)购于国药集团上海试剂有限公司。PSA酶联免疫试剂盒(包括一系列0~500 ng/mL不同浓度的PSA抗原标准溶液和HRP标记PSA抗体储备液)购于Diagnostic Products公司(DPC,美国)。30份前列腺癌患者血清标本和3份正常人体血清均由上海市肿瘤医院检验科提供。其他试剂均为未经纯化直接使用的分析纯。实验中所用水均为Milli-Q水。
1.2 16-SPCE PSA免疫电极的制备
实验采用双抗体夹心法,其检测原理如图1所示。将16-SPCE电极条置于优选出的0.05 mg/mL HAuC14溶液中,以碳电极作为对电极,AgCl电极作为参比电极,于-200 mV下电沉积,优化的沉积时间为150 s。取出电极条,用Milli-Q水彻底冲洗电极表面后,以氮气(N2)吹干残留的水珠,得到纳米金修饰的16通道丝网印刷电极。将PSA抗体(5.35 mg/mL)用0.01 M磷酸盐缓冲溶液(PBS)稀释100倍,然后取10 μL滴涂于每个修饰后的工作电极表面,置4℃冰箱中孵育16 h后取出,用0.01 M PBS溶液冲洗干净,并用N2吹干,获得免疫电极,置4℃冰箱中保存备用。
进行免疫反应时,首先取出孵育好的免疫电极,用0.01 M PBS溶液冲洗干净,并用N2吹干,取50 μL 1%酪蛋白溶液滴涂于每个电极表面,置37℃冰箱中孵育2 h后取出,洗净,滴加不同浓度PSA抗原,37℃冰箱中孵育 1 h后,取 5 μL HRP标记的PSA二抗(1:200倍稀释的HRP-anti-PSA)滴涂于修饰后的工作电极表面,37℃冰箱中孵育1 h。最后,将制备好的电极用0.01 M PBS进行彻底冲洗用于电化学测试。
HAuCl4浓度和电沉积时间会对纳米金修饰电极的性能产生重要影响,因此对制备电极所用的氯金酸浓度和沉积时间进行实验,以得到电极制备的最优条件。

图1 电沉积纳米金修饰16-SPCE电化学免疫传感器检测PSA示意Fig.1 Schematic diagrams of electrodeposited goldnanoparticles modified 16-SPCE electrochemical immunosensor arrays for PSA.
1.4 检测方法
采用三电极体系:以免疫电极为工作电极,碳电极为对电极,AgCl电极为参比电极。
以循环伏安法(CV)和稳态时间电流曲线法(amperometric I-T)进行电化学表征,以检测所制作电极的灵敏度。时间电流曲线法测量的电位为100 mV,检测时间为100 s,测试温度为室温,此时氧化还原反应电流信号已经趋于稳定。电化学检测使用辣根过氧化物酶(HRP)的催化底物 3,3',5,5'-四甲基联苯胺水溶液(K-Blue低活性底物TMB,已含有双氧水)。将该免疫传感器对 PSA、甲胎蛋白(alpha fetoprotein, AFP)和 癌 胚 抗 原(carcinoembryonic antigen,CEA)同时进行检测,以测试所制作电极的特异性。
选取30个前列腺癌病人血清标本,利用纳米金修饰后的16-SPCE的电化学免疫传感器进行检测,并和标准的ELISA方法进行了对照。此外进行正常人血清中PSA含量的检测,分别取3份正常人血清样品,每份样品各设有20个复孔,然后进行检测。
2 结果
2.1 纳米金修饰的16-SPCE PSA免疫传感器的最优制备条件
采用电沉积的方法制备纳米金修饰的电极。首先考察氯金酸溶液浓度对电极制备的影响。将16-SPCE 分别置于 0.02、0.05、0.1 mg/mL HAuCl4溶液中,得到的纳米金修饰电极置于0.5 M H2SO4溶液中进行CV扫描,通过比较纳米金修饰前后还原峰电流增大的程度判断修饰电极的性能。从图2可以看到随着HAuCl4溶液溶度的不断增大,还原峰电流先增大后减小,在HAuCl4浓度为0.05 mg/mL时达到饱和,峰电流不再增大。因此,可认为HAuCl4溶液溶度为0.05 mg/mL为电极制备的最优条件。

图2 HAuCl4浓度的影响Fig.2 The influence of HAuCl4concentration
其次,考察电沉积时间对电极制备的影响,将16-SPCE 分别电沉积 30、100、150、200 s,得到的纳米金修饰电极置于0.5 M H2SO4溶液中进行CV扫描,通过纳米金修饰前后还原峰电流增大的比例来判断修饰电极的性能,随着沉积时间的增加,还原峰电流也逐渐增大,150 s时峰电流达到最大值,之后开始降低,结果如图3所示。故选择电沉积时间150 s为电极制备的最优条件。
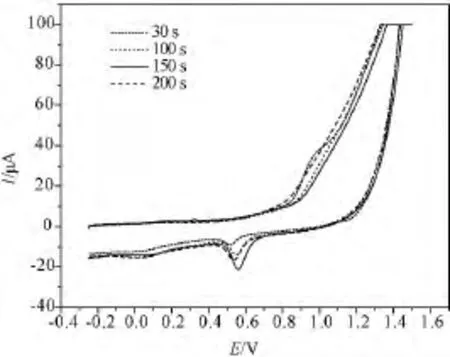
图3 电沉积时间的影响Fig.3 The influence of electrodeposition time
然后,将纳米金修饰电极与裸碳电极检测PSA进行了电流信号的对比研究,通过滴加浓度为10 ng/mL HRP-anti-PSA于不同修饰电极表面,在3,3',5,5'-四甲基联苯胺水溶液中,于 -0.4 ~0.6 V电位范围内,以0.05 V/s的扫描速度进行电极修饰后的电化学性质表征,得到循环伏安图(见图4)考察不同修饰电极的电流信号变化。发现电沉积纳米金后的循环伏安图中电流明显增大,较裸碳电极相比,信号明显增大。

图4 不同电极在测试底液中的循环伏安曲线Fig.4 CV curves for different modified electrodes in the test liquid
最后,探究两种修饰16-SPCE电化学免疫传感器检测信号强度的差异,将基于电沉积纳米金和裸碳电极修饰16-SPCE电化学免疫传感器制备的免疫电极分别对一系列HRP-anti-PSA的浓度(4~50 ng/mL)进行了检测。发现基于电沉积纳米金修饰16-SPCE电化学免疫传感器检测到低至10 ng/mL的HRP-anti-PSA时电化学信号仍然要比背景信号高很多(>3 SD),说明这种免疫传感器的检测限可以低至10 ng/mL。而裸碳电极的信噪比要远远低于纳米金修饰电极。当HRP-anti-PSA的浓度低于10 ng/mL时,信号就很难与背景区分(<3 SD)(见图5)。

图5 不同电极修饰16-SPCE电化学免疫传感器的性能差异Fig.5 Different electrodes modified 16-SPCE ECISA performance difference
2.2 纳米金修饰的16-SPCE免疫传感器对PSA的检测性能
2.2.1 检测PSA的灵敏度
对于基于纳米金修饰后16-SPCE的ECIS检测PSA的灵敏度,采用以下方案进行考察:滴加不同浓度 HRP-anti-PSA 的免疫电极在 3,3',5,5'-四甲基联苯胺水溶液中,于-0.4~0.6 V电位范围内,以0.05 V/s的扫描速度进行测定,得到循环伏安图(见图6),发现在200 mV左右的还原峰电流明显增加,形成了一对非对称的氧化还原峰。为了获得更直观的免疫电极还原峰电流的大小,进行I-T检测,获得的时间-电流曲线图(见图7),图7(a)中从上至下依次是浓度为 0、1、2、4、10、50、100 ng/mL PSA抗原的电流响应曲线,图7(b)中从上至下依次是0.1、0.2、0.5 ng/mL低浓度PSA抗原的电流响应曲线,发现稳态电流信号随着浓度的增加呈现单调增加趋势。将得到的免疫电极还原峰电流的大小与待测PSA的浓度拟合成标准曲线(见图8),结果显示还原峰电流的增大与PSA抗原溶液浓度在0.2~100 ng/mL范围内呈较好的线形关系,所以该方法检测的线性范围达0.2~100 ng/mL,其线性回归方程为 Y=134.558X+72.705,(R=1,P <0.000 1),回归曲线见图8中的插入图。通过分别计算空白样本的3倍标准差和10倍标准差得到该方法测量的检测限为0.14 ng/mL。
2.2.2 检测PSA的特异性

图6 不同HRP-anti-PSA浓度下的循环伏安曲线Fig.6 CV curvesfordifferentHRP-anti-PSA concen-trations

图7 不同浓度PSA的时间-电流曲线。(a)PSA浓度为0、1、2、4、10、50、100 ng/mL 的时间 - 电流曲线;(b)PSA 浓度为0.1、0.2、0.5 ng/mL 的时间 -电流曲线Fig.7 I-T curves for different PSA concentrations.(a)IT curves response of PSA concentration,from top to bottom:0,1,2,4,10,50,100 ng/mL;(b)I-T curves response of PSA concentration,from top to bottom:0.1、0.2、0.5 ng/mL
对于基于纳米金修饰后16-SPCE的ECIS检测PSA的特异性,采用以下方案进行考察:将PSA、AFP和CEA都配制成50 ng/mL,分别加入不同的电极孔位进行检测,其结果如图9所示。结果表明由PSA引起的电流相应远远大于AFP和CEA。
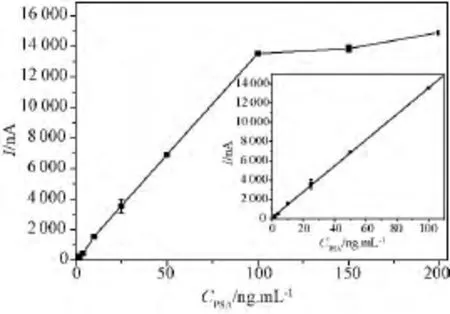
图8 免疫电极电流响应与PSA浓度的关系Fig.8 Immune current response of the electrode's relationship with PSA concentration

图9 电沉积纳米金修饰16-SPCE电化学免疫传感器检测 PSA、AFP、CEAFig.9 Electrodeposited goldnanoparticles modified 16-SPCE ECISA detection of PSA、AFP、CEA
2.3 纳米金修饰的16-SPCE免疫传感器对实际血清样品的检测
图10为30个前列腺癌患者利用所制作的电极进行检测的结果与标准的ELISA方法进行相关分析的结果。回归方程为Y=0.930X+0.773(R=0.944,P <0.001,n=30),表明两种方法吻合性很好。
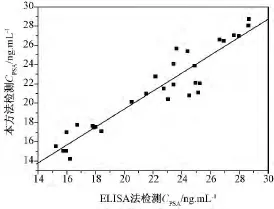
图10 本方法和ELISA法测值之间的相关性Fig.10 The correlation between our method and ELISA
3份正常人血清样品的检测结果结果分别为0.42、0.49、0.51 ng/mL,符合正常人血清中 PSA 的含量[15]。
3 讨论
PSA是目前临床上用来诊断前列腺癌重要的肿瘤标志物,很多大型医疗机构多采用化学发光免疫法对PSA进行检测,但该方法需要特殊检验设备,试剂多为进口,费用昂贵,在中小型医疗机构中很难广泛应用。而简便的常规检测方法,如酶联免疫吸附测定法和荧光免疫分析法都存在操作步骤繁琐、准确性差,成本高等缺陷。本研究基于16通道丝网印刷碳电极技术,充分利用纳米金的优势,开发了一种成本低、制作简便、灵敏度高、检测时间短的电化学免疫传感器。
在电化学免疫传感器的制备过程中,如何在电极表面实现抗体固定是一个非常关键的步骤[16-17],这是因为抗体的固定方式、活性及数量等直接影响传感器的稳定性、灵敏度和响应时间等性能。目前使抗体固定在电极表面最常见的方法是通过物理吸附作用,这种方法操作简单,且不会破坏抗体活性,但同时也存在抗体组装效率不高,容易脱落等缺陷。纳米材料具有表面效应、量子效应等特点,可以有效地扩增电极比表面积。在裸碳电极表面修饰纳米材料可以提高电极吸附抗原抗体能力,从而有望解决电极表面的抗体组装问题。通过电沉积法在16通道的丝网印刷碳电极表面修饰一层纳米金制备了一种电化学免疫传感器。
电极制备时HAuCl4浓度和电沉积时间会对纳米金修饰电极的性能产生重要影响。具体来说,HAuCl4浓度和沉积时间会影响电极表面的纳米金的还原速率及纳米金的尺寸,随着HAuCl4浓度的增加和电沉积时间的延长,在电极表面沉积的纳米金越来越多最终达到一定的饱和密度。由于纳米金的电催化性能,其提高了电极表面的导电性能,因此在硫酸中扫描时,会观察到还原峰电流随HAuCl4浓度增加而提高,直至达到饱和。而HAuCl4浓度过多和沉积时间过长则会影响纳米金在电极表面的沉积效率、密度及纳米金的平整度,从而影响其催化性能,导致硫酸中扫描的还原峰减小。基于以上原因,对制备电极所用的HAuCl4浓度和沉积时间进行了考察,从而得到HAuCl4浓度为0.05 mg/mL和电沉积时间为150 s时是电极制备的最优条件。
用最优条件下制备的16-SPCE电化学免疫传感器对PSA进行了检测,同时与裸碳修饰16-SPCE电化学免疫传感器检测PSA进行了对比,证明纳米金修饰的16-SPCE电化学免疫传感器检测PSA的电流信号明显高于裸碳电极,这是因为纳米金具有表面效应、小尺寸效应等纳米材料独有的优势,与裸碳电极相比,纳米金修饰电极提高了抗PSA抗体在电极阵列上的组装效率,最终产生的信噪远远高于裸碳电极。通过对不同浓度HRP-anti-PSA的检测发现,纳米金修饰的16-SPCE电化学免疫传感器可以实现低浓度的检测,而裸碳电极则无法区分,证明沉积在电极表面的纳米金能有效地促进电子传递,起到明显放大电化学信号的作用。
为了进行纳米金修饰的16-SPCE免疫传感器检测PSA灵敏度的研究,采用循环伏安法对免疫电极进行表征,从而获得免疫电极表面发生的氧化还原反应信息。结果发现在200 mV左右的还原峰电流明显增加,形成了一对非对称的氧化还原峰,这是因为免疫电极上发生了氧化还原反应,氧化还原反应来自辣根过氧化氢酶(HRP)催化过氧化氢,3,3',5,5'-四甲基联苯胺水像电子穿梭机一样进出HRP酶的氧化还原活性中心,HRP酶不断催化过氧化氢,使得催化电流迅速增加形成一个明显增大的电催化峰。这一现象证明了PSA抗原和HRP标记的PSA抗体在免疫电极表面发生了特异性结合。为了反映HRP酶催化电化学反应所产生的电流和时间的关系,采用稳态时间电流法进行表征,由于充电电流的影响,开始电流值较大,但是电流很快就达到平衡状态,在100 s左右已经达到稳态电流。将得到的稳态电流信号进行拟合分析,发现稳态电流信号随着浓度的增加呈现单调增加趋势,该方法的检测限根据大于3倍标准偏差计算为0.14 ng/mL,满足临床定量检测PSA灵敏度的要求。
特异性是衡量电化学免疫传感器实用性能的重要指标之一,本研究将该免疫传感器对PSA、AFP和CEA同时进行检测,发现AFP和CEA检测信号值极低,和空白样本相当,说明固定在免疫电极表面的酶标抗体未能将AFP和CEA捕获,因此并未引起较大的电流变化,而PSA检测的信号值却很高,与AFP、CEA和空白样本能进行明显区别,说明固定在免疫电极表面的酶标抗体成功捕获PSA。由此证明该电化学免疫传感器具有较好的选择性,可以实现PSA的特异性检测。通常前列腺癌患者PSA在4~10 ng/mL被认定为诊断灰区[18],所提出的检测方法灵敏度高、特异性强,可以弥补灰区可能带来的误诊。
对前列腺癌病人血清样本进行检测结果发现利用纳米金修饰后的16-SPCE的电化学免疫检测方法与ELISA法定量结果相关性好 (R=0.944,P<0.001),说明所开发的ECISA可以对PSA定量检测。进一步采用ECISA对正常人血清样本中PSA含量进行检测,发现其含量符合正常人血清中PSA的含量范围。与ELISA相比,ECISA具有操作简单、制备成本低、反应时间短等显著优点。
综上所述,基于电沉积纳米金修饰的16-SPCE电化学免疫传感器具有较好的灵敏度,同时,该电化学免疫传感器既可以对单一样品同时进行大批量的重复测试,或同时平行测定混合组分,也可以同时进行多组不同样品的测量,加之具有成本低的优势,非常适合我国广大欠发达地区及中小型医疗机构的需求。
[1]Wang MC,Valenzuela LA,Murphy GP,et al.Purification of a human prostate specific antigen[J].Investigative Urology,1979,17(2):159-163.
[2]Catalona WJ,Richie JP,Ahmann FR,et al.Comparison of digital rectal examination and serum prostate specific antigen in the early detection of prostate cancer:results of a multicenter clinical trial of 6,630 men[J].The Journal of Urology,1994,151(5):1283-1290.
[3]Becker C,Lilja H.Individal prostate-specific antigen(PSA)forms as prostate tumor markers[J].Clinica Chimica Acta,1997,257:117-132.
[4]MacKness BC,Chourb S,Farris LR,et al.Polymer-proteinenhanced fluoroimmunoassay for prostate-specific antigen[J].Analytical and Bioanalytical Chemistry,2010,396(2):681 -686.
[5]胡萍,司同国,于海鹏,等.联合检测血清HMGB1 PSA在局限性前列腺癌冷冻术后复发中的应用价值[J].中国肿瘤临床.2013,40(8):462-465.
[6]Seto Y,Iba T,Abe K.Development of ultra-high sensitivity bioluminescent enzyme immunoassay for prostate-specific antigen(PSA)using firefly luciferase[J].Luminescence,2001,16(4):285-290.
[7]Xu Shoujiang, Liu Yang, Wang Taihong, et al. Positive potential operation of a cathodic electrogenerated chemiluminescence immunosensor based on luminol and graphene for cancer biomarker detection[J].Analytical Chemistry,2011,83(10):3817-3823.
[8]朱岚,黄飚,张祥瑞.双标记前列腺特异性抗原时间分辨荧光免疫分析试剂盒研究[J].中华检验医学杂志,2006,29(11):1001-1004.
[9]Kokko T,Liljenback T,Peltola MT,et al.Homogeneous dualparameter assay for prostate-specific antigen based on fluorescence resonance energy transfer[J].Analytical Chemistry,2008,80(24):9763-9768.
[10]Ling Huiling,Lv Jingzhang,Zhu Zhihao,et al.New progress in detection of foodborne pathogenic Escherichia coli O157:H7 based on biosensors[J].Journal of Food Safety and Quality,2013,4(6):1828-1834.
[11]Dou Wenchao, TangWeilu, ZhaoGuangying, etal. A disposable electrochemical immunosensor arrays using 4-channel screen-printed carbon electrode for simultaneous detection of Escherichia coli O157:H7 and Enterobacter sakazakii[J].Electrochimica Acta,2013,97:79 -85.
[12]Liu Fang,Deng Wenping,Zhang Yan,et al.Application of ZnO quantum dots dotted carbon nanotube for sensitive electrochemiluminescence immunoassay based on simply electrochemical reduced Pt/Au alloy and a disposable device[J].Analytica Chimica Acta,2014,818:46 -53.
[13]Moon JM, Hui KY,Cho Y. A nanowire-based label-free immunosensor:Directincorporation ofaPSA antibodyin electropolymerized polypyrrole [J]. Biosensors and Bioelectronics,2014,57:157-161.
[14]Kavosi B,Hallaj R,Teymourian H,et al.Au nanoparticles/PAMAM dendrimerfunctionalized wired ethyleneamine–viologen ashighly efficientinterface forultra-sensitive αfetoprotein electrochemical immunosensor[J].Biosensors and Bioelectronics,2014,59:389 -396.
[15]许海楠,高鹏,王军,等.PSA及其相关指标与前列腺癌的诊断[J].医学综述,2010,16(12):1823 -1825.
[16]Wong LS,Khan F,Micklefield J.Selective covalent protein immobilization:strategiesand applications[J]. Chemical Reviews,2009,109:4025-4053.
[17]Redeker ES,Ta DT,Cortens D,et al.Protein engineering for directed immobilization[J].Bioconjugate Chemistry,2013,24:1761-1777.
[18]Shao Weixie,Hong Lili,Jing Du,et al.Influence of serum prostate-specific antigen(psa)level,prostate volume,and psa density on prostate cancer detection with contrast-enhanced sonography using contrast-tuned imaging technology[J].J Ultrasound Med,2013,32:741-748.

