高效液相色谱法测定小鼠血清中磺胺间甲氧嘧啶及其N4-乙酰化代谢物含量
张强,张丹,刘业好,盛杰,陈文军,王国秀,刘开永
(安徽医科大学公共卫生学院,合肥230601)
高效液相色谱法测定小鼠血清中磺胺间甲氧嘧啶及其N4-乙酰化代谢物含量
张强,张丹,刘业好,盛杰,陈文军,王国秀,刘开永∗
(安徽医科大学公共卫生学院,合肥230601)
磺胺间甲氧嘧啶(SMM)于ICR小鼠哺乳期暴露后,测定其血清中SMM和N4-乙酰化磺胺间甲氧嘧啶(ACSMM)含量。小鼠哺乳期以0、10、50、200 mg/(kg·d)灌胃给药直至21 d,于第22天麻醉,摘眼球取血。血清样品经乙腈沉淀蛋白,超声辅助提取,采用反相C18(250 mm× 4.6 mm,5μm)色谱柱,以乙腈:水(含0.2%冰乙酸)为流动相,流速为1 mL/min,柱温35℃,高效液相色谱耦合二极管阵列检测器对目标物检测,SMM和ACSMM检测波长分别为273 nm和267 nm,外标法峰面积定量。SMM和ACSMM血清加标回收率为85.8%~110.2%,精密度(RSD%)均小于8.3%,在0.05~2.5μg/mL和5~30μg/mL(适用母鼠体内SMM)范围内与峰面积呈良好的线性关系,r2>0.990;最低检出限分别为0.023和0.042μg/mL。本法灵敏、快速、准确,可用于血清中SMM和ACSMM的测定。
磺胺间甲氧嘧啶;N4-乙酰化磺胺间甲氧嘧啶;高效液相色谱;二极管阵列检测器
磺胺间甲氧嘧啶(sulfamonomethoxine,SMM)是长效磺胺类兽药(Sulfonamides,SAs)中的一员,研究表明SAs(包含SMM)在地表水、蔬菜、鱼肉制品和牛奶等中均有检出,甚至部分食品存在超标[1-4]。磺胺药能通过乳汁分泌,药物在葡萄糖-6-磷酸脱氢酶缺乏的新生儿中导致溶血性贫血发生,还可导致胆红素脑病和新生儿溶血[5]。磺胺类药物及其乙酰化代谢物在酸、中性环境中易在泌尿系统形成结晶,引起尿痛、血尿、尿闭等[6]。研究证明磺胺类抗菌药物是一种甲状腺素干扰物,可损伤甲状腺滤泡细胞的粗面内质网,从而影响甲状腺球蛋白的合成与分泌[7-9]。目前关于SMM代谢产物的液相色谱检测报道较少[10],国内目前所报道的也仅限于SMM原形药的残留检测且具有不确定性[11]和代谢动力学探讨[12]。本研究拟建立方便快捷的色谱学方法,测定SMM哺乳期长期暴露后母体及子代血清SMM及ACSMM含量,为其在特殊人群体内暴露的风险评估提供数据。
1 材料与方法
1.1 材料 SPF级ICR小鼠(8周龄;雄性体重28~30 g,雌性体重24~26 g)购于北京维通利华实验动物技术有限公司(许可证号:SCXK(京)2012-0001)。
1.2 仪器与试剂 岛津LC-20A高效液相色谱仪,光电二极管阵列检测器(PDA-5500);高速离心机(5417R),德国Eppendorf公司;纯水仪(DZG-303A),安徽皖仪科技股份有限公司。磺胺间甲氧嘧啶标准品(CAS:1220-83-3,批号:00817),含量>98.5%,德国Dr.Ehrenstorfer GmbH公司;N4-乙酰化磺胺间甲氧嘧啶标准品(CAS:4049-01-8,批号:003-096),含量>98.9%,上海Carlow化学试剂有限公司;乙腈,色谱纯,美国Tedia公司;冰乙酸,分析纯,国药集团化学试剂有限公司。
1.3 动物处理 实验前适应性喂养1周,饮食自由,昼夜均衡,温度23~25℃,湿度45%~55%。24只雌鼠按雌雄比2∶1交配受孕,孕鼠正常喂养至自然分娩,将母鼠分为对照组、低、中、高剂量暴露组,分娩后第1天母鼠灌胃给予0、10、50和200 mg/kg SMM(溶于生理盐水),正常饲喂21 d,第22天麻醉母鼠和子鼠后,摘除眼球取血,3500 r/min离心10 min,吸上清,保存于-20℃冰箱,待测。
1.4 方法
1.4.1 色谱条件 Luna C18色谱柱(250mm×4.6mm,5μm,Phenomenex Inc,USA);乙腈:水(含0.2%冰乙酸)=25∶75为流动相:检测波长:267 nm(ACSMM)和273 nm(SMM);流速1 mL/min;柱温35℃;进样量20μL。
1.4.2 标准溶液的配制 混合标准溶液:分别准确称取磺胺间甲氧嘧啶和N4-乙酰化磺胺间甲氧嘧啶0.0100 g,甲醇溶解,转移至10 mL容量瓶,定容至刻度,摇匀,配成各组分质量浓度为1mg/mL的混合标准溶液。以流动相稀释母液配制系列浓度为0.05、0.5、0.625、1.25和2.5μg/mL的标准工作液。由于母鼠体内SMM浓度较高,单独配制5、10、15、20和30μg/mL的标准系列浓度。
1.4.3 样品前处理 吸取0.2 mL血清于2 mL离心管中,加入0.6 mL乙腈,涡旋振荡1 min,超声辅助提取10min,再涡旋振荡1min,15000 r/min离心10 min,取上清液经0.22μm有机滤膜过滤,收集滤液待测。
1.5 方法学考察
1.5.1 标准曲线 取空白血清加入适量SMM和ACSMM标准溶液,得混合液系列浓度:0.05、0.5、0.625、1.25和2.5μg/m L,进行HPLC分析后,以峰面积为纵坐标,系列标准浓度为横坐标,进行线性回归分析。仅作母鼠体内SMM含量测定的单个标准品添加浓度系列为5、10、15、20和30μg/m L。
1.5.2 精密度与回收率 空白血清添加SMM和ACSMM标准品,使混合物终浓度为0.5、1.0和2.5μg/mL,每个浓度重复3个样品,然后以1.4.3项样品处理方法进行前处理及测定,依据标准曲线,计算实测浓度、回收率和精密度。
1.5.3 灵敏度 通过加标试验,以0.5μg/mL的添加浓度进样3次,以信噪比RSN等于10来计算最低定量限(LOQ),以RSN等于3计算最低检测限(LOD)。
2 结果
2.1 方法学验证
2.1.1 检测波长的选择 用200~400 nm检测波长对2.5μg/mL的混合标准液进行了扫描。结果发现2个化合物最大吸收波长并不一致,为了提高方法的灵敏度,保证目标化合物都能在各自最大吸收波长下检测,因此实验采用多波长检测,由图1可以看出,SMM最大吸收波长是273 nm,ACSMM最大吸收波长是267 nm。

图1 SMM(左)和ACSMM(右)的最大吸收波长光谱图
2.1.2 色谱条件的选择 在1.4.1项条件下,SMM和ACSMM标准品和血清添加均得到了很好的分离,前者保留时间为9.105 min,后者为7.834 min(图2)。

图2 SMM和ACSMM标准品色谱图(浓度2.5μg/m L)

图3 空白小鼠血清色谱图

图4 小鼠血清添加SMM和ACSMM混合标准品(0.5μg/m L)色谱图
2.1.3 样品提取 经过反复试验,用0.6 mL乙腈一次提取,可将目标分析物提取出来,且小鼠空白血清和标准品添加色谱图比较,分离度较好,目标色谱峰处无干扰(图3~图5)。
2.1.4 标准曲线 线性回归方程分别为:SMM:y=87230x-4292.3,r2=0.9993;y=35624x+27528(r2=0.9989,仅用于母鼠体内SMM计算);ACSMM:y=82870x-724.33,r2=0.9974。在实验初期,用一条混合标准添加浓度做标准曲线时,由于SMM及代谢物在母鼠和仔鼠浓度范围跨度较大,为兼顾代谢物计算的误差产生,通过绘制双标准曲线来计算目标物浓度。从上述数据可看出本方法在各自浓度范围内线性关系良好。
2.1.5 精密度和回收率 经过3次添加回收率测定,方法的回收率SMM:85.8%~110.2%,ACSMM:88.2%~106.3%,精密度(RSD%)均小于8.3%,可以用于检测血清中的SMM和ACSMM。
2.1.6 方法灵敏度 经信噪比测试,灵敏度值如下:SMM,LOD=0.012μg/mL,LOQ=0.023μg/mL;ACSMM,LOD=0.018μg/mL,LOQ=0.042μg/mL。表明该测定方法的灵敏度较好。
2.2 样品测定 利用本法,对1.3项的血清样品进行测定,SMM及ACSMM浓度见表1。
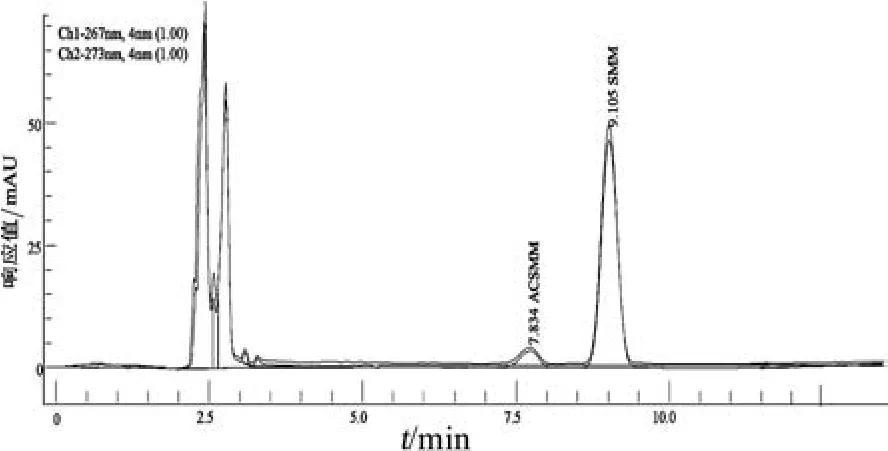
图5 小鼠实际样品血清色谱图
表1 母鼠和子鼠血清SMM和ACSMM浓度(s,n=6)
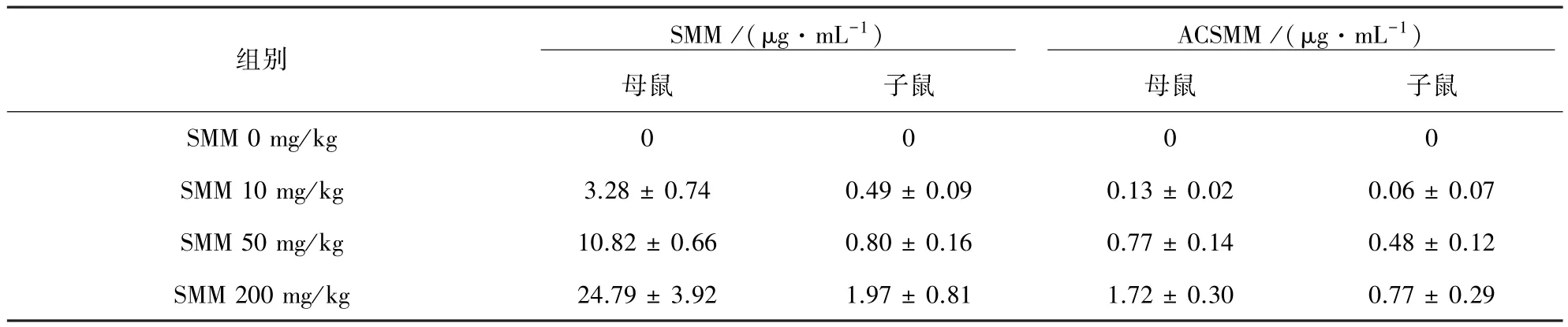
表1 母鼠和子鼠血清SMM和ACSMM浓度(s,n=6)
组别 SMM/(μg·mL-1)ACSMM/(μg·mL-1)母鼠子鼠母鼠子鼠SMM 0 mg/kg 0 0 0 0 SMM 10 mg/kg 3.28±0.74 0.49±0.09 0.13±0.02 0.06±0.07 SMM 50 mg/kg 10.82±0.66 0.80±0.16 0.77±0.14 0.48±0.12 SMM 200 mg/kg 24.79±3.92 1.97±0.81 1.72±0.30 0.77±0.29
由表1可知,对照组未检出SMM及ACSMM,当母鼠SMM灌胃剂量以倍数增加时,母鼠和子鼠血清的SMM和ACSMM并不以倍数关系增加。
3 讨论与小结
本文建立了长效兽药磺胺间甲氧嘧啶及其乙酰化代谢物的高效液相色谱耦合二极管阵列检测器的快速检测方法。本法采用乙腈直接沉淀蛋白,超声辅助提取,既加快了预处理的速度,又缩短了SMM及ACSMM提取的时间,且杂质干扰较小。本方法的优势在于所用仪器、试剂、前处理方法均较简单、常见。试验中曾用二氯甲烷提取时,血清中脂肪漂浮在提取溶剂表面,倾倒困难;使用偏磷酸-甲醇作提取溶剂,由于含有大量的水分,造成减压蒸馏耗时费力;使用乙酸乙酯提取效率最高,但提取的组织内源性物质也最多,净化较困难;本实验也尝试用waters HLB固相萃取小柱净化,尽管样品基质的去除较为满意,但是ACSMM的回收率偏低。最后采用乙腈作提取溶剂,提取效率较高,再辅助超声提取,可获得满意的回收率,另外用乙腈提取时共提的杂质也较少。
方法的精密度和准确度均能够满足SMM及其代谢物ACSMM的限量检测要求,且具有较高的实用性,有利于推广普及,为后续研究食品中磺胺类兽药残留的检测提供了基础。Furusawa报道了SMM及代谢物在鸡血浆中的测定,其血清标准添加的高浓度回收率均小于90%,而精密度与本实验基本相同。就ACSMM测定的灵敏度而言,本实验最低定量限低于报道的色谱学方法(0.09μg/mL)[13]。
SMM在人体内为长效类药物,口服半衰期超过24 h,而SMM有效血药浓度维持时间在动物体内差异很大,多数消除半衰期维持在2~7 h[14]。从本实验的浓度数据可以看出,尽管母鼠暴露高剂量的SMM,但是ACSMM在母子鼠体内浓度较低,而且原形药浓度也较低。本实验中ICR小鼠长期暴露SMM后测得的母鼠和子鼠血清中的SMM及ACSMM含量,提示SMM在人和动物体内代谢的差异很大,在磺胺类兽药进行安全风险评估时要考虑种属间的差异。
参考文献:
[1] Nebot C,Regal P,Miranda J,et al.Simultaneous determination of sulfonamides,penicillins and coccidiostats in pork by high-per⁃formance liquid chromatography-tandem mass spectrometry[J].Journal of chromatographic science,2012,50(5):414-425.
[2] Na G,Fang X,Cai Y,et al.Occurrence,distribution,and bioaccumulation of antibiotics in coastal environment of Dalian,China[J].Marine pollution bulletin,2013,69(1):233-237.
[3] 李晓晶,黄聪,于鸿,等.土壤中11种磺胺类兽用抗生素的超高效液相色谱-串联质谱测定法[J].环境与健康杂志,2013,30(5):437-439.
[4] 王丹,隋倩,赵文涛,等.中国地表水环境中药物和个人护理品的研究进展[J].科学通报,2014,59(9):743-751.
[5] 陈瑞玲.磺胺类药与甲氧苄啶的合理应用[J].中国临床医生,2008,36(7):18-20.
[6] 董琳.肾脏的药品不良反应与药物警戒[J].药物流行病学杂志,2011,20(1):46-49.
[7] Takayama S,Aihara K,Onodera T,et al.Antithyroid effects of propylthiouracil and sulfamonomethoxine in rats and monkeys[J].Toxicology and applied pharmacology,1986,82(2):191-199.
[8] 王津涛,孙丁,潘红梅,等.磺胺二甲嘧啶对FRTL-5细胞合成、分泌甲状腺球蛋白的影响[J].环境与职业医学,2004,21(3):182-185.
[9] 王津涛,孙丁,潘红梅,等.磺胺二甲嘧啶对FRTL-5细胞基因表达谱的影响[J].卫生研究,2005,34(1):19-21.
[10]Kishida K,Furusawa N.Application of shielded column liquid chromatography for determination of sulfamonomethoxine,sulfadimethoxine,and their N4-acetyl metabolites in milk[J].Journal of Chromatography A,2004,1028(1):175-177.
[11]陆连寿,张秀英.高效液相色谱法测定磺胺间甲氧嘧啶含量的不确定度评定[J].中国兽药杂志,2008,42(11):30-33.
[12]杨晓松,余辉菊,邱莎,等.基质固相分散萃取-高效液相色谱-荧光检测法测定动物性食品中磺胺类药物残留[J].中国卫生检验杂志,2013,23(5):1109-1112.
[13]Furusawa N.Determining sulfamonomethoxine and its acetyl/hydroxylmetabolites in chicken plasma under organic solvent-free conditions[J].Analytical and bioanalytical chemistry,2006,385(8):1570-1574.
[14]吴俊伟,饶勇,姜波.磺胺间甲氧嘧啶混悬注射液在猪体内的药动学研究[J].畜牧兽医学报,2007,38(7):718-722.
(编辑:侯向辉)
Determ ination of Sulfamonomethoxine and Its N4-acetyl M etabolite in M ice Serum by HPLC
ZHANG Qiang,ZHAGN Dan,LIU Ye-hao,SHENG Jie,CHENWen-jun,WANG Guo-xiu,LIU Kai-yong∗
(School of Public Health,AnhuiMedical University,Hefei 230601,China)
Determination of sulfamonomethoxine(SMM)and N4-acetyl metabolite(ACSMM)in ICR mice exposed to SMM during lactation.The lactational mice were orally administered with SMM(0,10,50,200 mg/(kg·d)for 21 d,the mice were anesthetized and then taken blood by removalling eyeball.Following serum protein precipitation with acetonitrile,the ultrasonic-assisted extraction of the targets,separation of them were carried out on a reversed-phase C18(250 mm×4.6mm,5μm)column,themobile phase was involved in acetonitrile and 0.2%acetic acid in water,the flow rate was 1 mL/min and the column temperature was 35℃,the high performance liquid chromatographywas coupled with a diode array detector,detection wavelength of SMMand ACSMM were 273 and 267 nm respectively,and quantified with external standard method.The recoveries of SMM and ACSMM spiked in serum were 85.8%~110.2%,RSD s less than 8.3%were obtained,the linear range was 0.05~2.5μg/mL,but 5~30μg/mL suitable for SMM in the dams,and showed a good linear relationship(r2>0.990).The limit of quantitation(LOQ)was 0.023 and 0.042μg/mL respectively.This method was sensitive,rapid,accurate,can be used for the determination of SMM and ACSMM in serum.
sulfamonomethoxine;N4-acetyl sulfamonomethoxine;high performance liquid chromatography;diode array detector
2014-12-01
A
1002-1280(2015)02-0027-05
S859.83
国家自然科学基金项目(81202209);安徽省高等学校优秀青年人才基金(2012SQRL075ZD);安徽医科大学中青年学术骨干资助基金(2012051)
张强,硕士在读,从事食品卫生学研究。
刘开永。E-mail:liukaiyong163@163.com

