Salinomycin对乳腺癌阿霉素耐药细胞株MCF-7/DOX的增殖抑制作用及机制
刘 浩,卢敏莹,贺智敏
(广州医科大学附属肿瘤医院肿瘤研究所,广东 广州 510095)
Salinomycin对乳腺癌阿霉素耐药细胞株MCF-7/DOX的增殖抑制作用及机制
刘 浩,卢敏莹,贺智敏
(广州医科大学附属肿瘤医院肿瘤研究所,广东 广州 510095)
目的 本研究旨在探讨Salinomycin对乳腺癌阿霉素耐药细胞株MCF-7/DOX增殖和凋亡的影响及可能作用机制。方法 MTS实验检测Salinomycin对MCF-7/DOX细胞增殖的影响;Annexin V-FITC/PI染色检测Salinomycin对MCF-7/DOX耐药细胞凋亡的影响;DCFH-DA染色检测Salinomycin对MCF-7/DOX耐药细胞活性氧(reactive oxygen species, ROS)产生的影响;JC-1法测定细胞线粒体膜电位;Western blot法检测细胞凋亡相关蛋白BAX、BCL-2、caspase-3和caspase-9的表达变化。结果 Salinomycin能明显抑制MCF-7/DOX耐药细胞增殖,且具有浓度依赖性;流式分析发现Salinomycin能够诱导MCF-7/DOX细胞凋亡,增加细胞内ROS水平,降低细胞线粒体膜电位;与对照组相比较,Salinomycin处理明显抑制BCL-2的表达,上调BAX、cleaved caspase-3和cleaved caspase-9的蛋白表达;抗氧化剂N-acetylcysteine(NAC)则逆转上述作用。结论 Salinomycin能够诱导MCF-7/DOX细胞凋亡,其机制可能与Salinomycin诱导ROS的产生,激活线粒体凋亡途径有关。
乳腺癌;Salinomycin;阿霉素耐药;细胞凋亡;活性氧;线粒体膜电位
乳腺癌是女性最常见的恶性肿瘤之一。近年来,我国女性乳腺癌发病率逐年升高,并有逐步年轻化的趋势[1]。目前化疗仍是乳腺癌临床治疗的主要方法之一。阿霉素(doxorubicin,DOX)是一种周期非特异性广谱抗癌药,对各期细胞均有作用,具有很强的抗癌活性,广泛应用于包括乳腺癌在内的临床各类肿瘤化疗中。然而,研究表明乳腺癌细胞易对阿霉素产生耐药,导致化疗失败,从而使阿霉素在乳腺癌治疗的应用中受到很大限制[2]。
Salinomycin是由白色链球菌(streptomyces albus)经发酵培养产生的一种一元羧酸聚醚类离子载体型抗生素类,具有杀菌、抑菌的作用[3]。自2009年,Gupta等[4]发现Salinomycin能选择性抑制乳腺癌干细胞以来,Salinomycin的抗肿瘤作用越来越受到关注。随后多项研究表明, Salinomycin能够诱导结直肠癌[5]、肺癌[6]、前列腺癌[7]等多种肿瘤细胞的凋亡。此外,研究发现Salinomycin能够逆转人白血病KG-1a细胞的耐药性[8],然而相关机制还有待进一步明确。
本实验旨在研究Salinomycin对体外培养的乳腺癌阿霉素耐药细胞MCF-7/DOX的增殖抑制作用,并对其作用机制进行初步探讨。
1 材料与方法
1.1 材料人乳腺癌MCF-7/DOX耐药细胞购自中科院上海细胞库。DMEM培养基、胎牛血清、胰蛋白酶购自Gibco公司;Salinomycin购自Selleck公司;P-gp、BCL-2、BAX、caspase-3、caspase-9抗体购自CST公司;P-gp,β-actin抗体购自Santa Cruz公司;预染蛋白质Marker购自Fermentas公司;HRP标记山羊抗鼠IgG、山羊抗兔IgG购自北京鼎国生物技术有限公司;NAC、cyclosporine A、Doxorubicin、DCFH-DA、JC-1购自Sigma公司;MTS购自Promega公司;Annexin V-FITC/PI细胞凋亡检测试剂盒购自碧云天生物技术研究所。ECL化学发光底物试剂盒购自Pierce公司;Quick Start Bradford蛋白定量试剂购自Bio-Rad公司;其余试剂均为国产分析纯。
1.2 细胞培养人乳腺癌MCF-7/DOX耐药细胞用含10%胎牛血清的DMEM培养液,于37℃、5% CO2的培养箱内饱和湿度培养。将MCF-7/DOX细胞暴露于低剂量[1/10的半数抑制浓度(50% concentration of inhibition, IC50)]的阿霉素中维持细胞耐药性。
1.3 MTS法检测Salinomycin对MCF-7/DOX耐药细胞增殖的影响接种5×103个细胞每孔至96孔板,培养过夜使细胞贴壁。向对应试验孔加入不同浓度的Salinomycin,继续培养24、48、72 h,吸去培养基,加入100 μL含0.5 g·L-1MTS的RPMI 1640,继续培养4 h。最后用酶标仪测定490 nm波长下的光密度(optical density, OD)值,并计算药物对细胞的抑制率。抑制率/%=(1-实验组OD值/对照组OD值)×100%。以Salinomycin浓度为横坐标,抑制率为纵坐标作图并拟合抑制曲线,并计算IC50值。
1.4 流式细胞术检测Salinomycin对MCF-7/DOX耐药细胞凋亡的影响接种3×105个细胞每孔到6孔板中,Salinomycin处理24、48、72 h。分别收集细胞,按照Annexin V/PI凋亡检测试剂盒的说明书要求,先后加入Annexin V和PI,避光、室温孵育10 min后,流式细胞仪检测细胞凋亡。
1.5 蛋白提取和Western blot分析收集细胞,经PBS洗涤后用三去污裂解液[50 mmol·L-1Tris-Cl (pH 8.0),150 mmol·L-1NaCl,0.2 g·L-1叠氮钠,100 mg·L-1Aprotin,100 mg·L-1PMSF,1 g·L-1SDS,10 g·L-1NP-40,5 g·L-1去氧胆酸钠]裂解,离心后收集上清,用Bradford法测定蛋白浓度;等量蛋白样品经10%的SDS-PAGE电泳分离后,转印至PVDF膜上,5%脱脂奶粉室温封闭2 h,P-gp、BAX、BCL-2、caspase-3、caspase-9、α-actin一抗均以1 ∶1 000比例稀释,4℃孵育过夜。经PBST洗涤后,加入HRP标记的特异性二抗以1 ∶5 000比例稀释,室温下孵育2 h,最后用ECL化学发光试剂对X光片显影,扫描图片。
1.6 DCFH-DA染色检测Salinomycin对MCF-7/DOX耐药细胞内ROS的影响DCFH-DA可以自由透过细胞膜,被细胞内部的酯酶水解后得到DCFH,不能自由通过细胞膜,从而被装载到细胞内部。DCFH与活性氧反应后,被氧化生成荧光物质DCF,在485 nm处被激发,发射波长为525 nm,产生的荧光信号通过流式细胞仪检测。接种3×105个细胞每孔到6孔板中,加入不同浓度Salinomycin处理细胞,12 h后加DCFH-DA探针,37℃下孵育20分钟,收集细胞,PBS洗涤2 次,重悬浮于400 μL PBS,迅速进行流式细胞仪检测,实验重复3次。
1.7 JC-1染色检测Salinomycin对MCF-7/DOX耐药细胞线粒体膜电位的影响接种3×105个细胞每孔到6孔板中,加入不同浓度Salinomycin处理细胞24 h,PBS 洗涤2次,按试剂盒说明加入1 mL细胞培养液和1 mL JC-1染色工作液混匀, 37℃孵育20 min, JC-1染色缓冲液洗涤2次,加入培养液,迅速进行流式细胞仪检测,JC-1单体的最大激发波长为514 nm,最大发射波长为529 nm;JC-1 聚合物的最大激发波长为585 nm,最大发射波长为590 nm,实验重复3次。
1.8 统计学方法采用SPSS 15.0软件One-way analysis of variance方式进行方差分析,两两比较采用Student′t检验。
2 结果
2.1 Salinomycin抑制乳腺癌MCF-7/DOX耐药细胞的增殖采用8个不同浓度的Salinomycin在3 个不同时间点对MCF-7/DOX细胞进行处理,MTS试验检测Salinomycin对细胞增殖抑制的量效和时效关系,结果表明,0、1、2、4、8、16、32、64 μmol·L-1Salinomycin作用随着其浓度的增加和作用时间的延长,细胞存活率逐渐降低(Fig 1)。作用24、48、72 h后的IC50分别为(13.27±0.27)、(8.83±0.33)、(3.72±0.15) μmol·L-1。结果说明Salinomycin明显抑制MCF-7/DOX耐药细胞增殖,且具有浓度和时间依耐性。
2.2 Salinomycin对乳腺癌MCF-7/DOX耐药细胞多药耐药蛋白P-糖蛋白(P-gp)表达和功能的影响采用不同浓度Salinomycin (0、4、8 μmol·L-1)分别处理MCF-7/DOX细胞48 h,Western blot 检测Salinomycin对P-gp蛋白表达的影响,结果发现,Salinomycin处理对P-gp蛋白的表达没有明显影响(Fig 2A)。采用流式细胞仪分析发现,Salinomycin处理并不影响细胞内药物的浓度(Fig 2B)。进一步采用Salinomycin与P-gp蛋白抑制剂cyclosporine A共处理MCF-7/DOX细胞,以阿霉素作为对照,MTT实验结果显示,cyclosporine A能增强阿霉素对MCF-7/DOX耐药细胞的增值抑制作用,而对Salinomycin的增值抑制效果没有明显的影响(Fig 2C)。结果说明Salinomycin对MCF-7/DOX耐药细胞的增值抑制作用可能与P-gp蛋白无关。
2.3 Salinomycin诱导乳腺癌MCF-7/DOX耐药细胞凋亡采用Salinomycin (8 μmol·L-1)分别处理MCF-7/DOX细胞24、48、72 h,Annexin V-FITC/PI染色,流式细胞术检测Salinomycin对MCF-7/DOX耐药细胞凋亡的影响。结果显示,随着时间的增加,MCF-7/DOX细胞的凋亡比率明显增加,24、48、72 h凋亡比率分别为7.5%、28.2%、46.3% (Fig 3)。

Fig 1 Effects of Salinomycin on cell viability of MCF-7/DOX cells
MCF-7/DOX cells were treated with salinomycin (0, 1, 2, 4, 8, 16, 32, 64 μmol·L-1) for 24, 48, 72 h; cell viability was determined by MTS assay. The results shown representative of five independent experiments.*P<0.05vscompared to control group.
2.4 Salinomycin对凋亡相关蛋白BAX,Bcl-2,caspase-3和caspase-9表达的影响采用不同浓度Salinomycin(0, 4, 8 μmol·L-1)分别处理MCF-7/DOX细胞48 h,Western blot检测Salinomycin对凋亡相关蛋白BAX、Bcl-2、caspase-3和caspase-9表达的影响,结果发现Salinomycin能明显抑制Bcl-2的表达,而促进BAX、cleaved caspase-3、cleaved caspase-9的表达(Fig 4)。
2.5 Salinomycin对乳腺癌MCF-7/DOX耐药细胞ROS、线粒体膜电位的影响为了进一步探究Salinomycin诱导MCF-7/DOX细胞凋亡的机制,采用DCFH-DA荧光探针标记流式细胞仪检测Salinomycin对细胞内ROS产生的影响。结果显示,Salinomycin处理明显增加细胞内DCFH荧光,并呈现浓度依赖性特点(Fig 5A)。线粒体膜电位的下降是细胞凋亡早期的一个标志性事件,通过JC-1从红色荧光到绿色荧光的转变可以检测到细胞膜电位的下降。我们发现Salinomycin处理MCF-7/DOX细胞24 h 后,线粒体膜电位明显下降( Fig 5B) 。为进一步证实Salinomycin诱导肿瘤细胞凋亡中是否与ROS的产生有关,我们在Salinomycin处理细胞时加入抗氧化剂5 mmol·L-1NAC共处理。结果显示NAC明显抑制ROS的产生(Fig 5A),增加线粒体膜电位(Fig 5B)。NAC处理增加Bcl-2蛋白的表达,抑制BAX、cleaved caspase-3蛋白的表达( Fig 5C)。结果说明ROS的积累在Salinomycin诱导肿瘤细胞凋亡中起着关键的作用。

Fig 2 Effects of salinomycin on protein expression and function of P-gp in MCF-7/DOX cells
A: MCF-7/DOX cells were treated with salinomycin (0, 4, 8 μmol·L-1) for 48 h; the protein expression level of P-gp was determined by Western blot assay. B: MCF-7/DOX cells were co-treated with salinomycin (8 μmol·L-1) and doxorubicin (10 μmol·L-1) for 48 h, and cellular doxorubicin concentration was determined by flow cytometry. C: MCF-7/DOX cells were co-treated with salinomycin (8 μmol·L-1) and cyclosporine A (5 μmol·L-1) or doxorubicin (10 μmol·L-1) and cyclosporine A (5 μmol·L-1) for 48 h, The cell viability was determined by MTS assay. The results shown representative of three independent experiments.*P<0.05vscompared to control group.

Fig 3 Effects of salinomycin on cell apoptosis of MCF-7/DOX cells
MCF-7/DOX cells were treated with salinomycin (8 μmol·L-1) for 24 h, 48 h, 72 h. The cell apoptosis was determined by Annexin V/PI staining. The dual parameter dot plots combining Annexin V-fluorescein isothiocyanate (FITC) and PI fluorescence showed the viable cell population in the lower left quadrant (Annexin V-/PI-), apoptotic cells in the lower right quadrant (Annexin V+/PI+) and the upper right quadrant (Annexin V+/PI+), and necrotic cells in the upper left quadrant (Annexin V-/PI+). The results shown representative of three independent experiments.
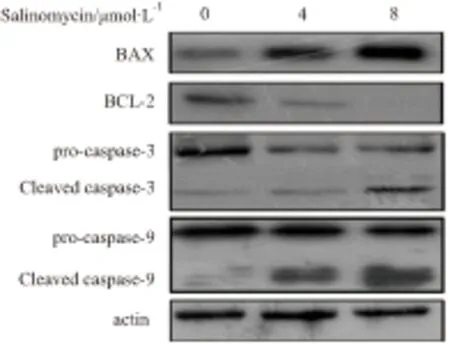
Fig 4 Effects of salinomycin on protein expression of BAX, BCL-2, caspase-3 and caspase-9 of MCF-7/DOX cells
MCF-7/DOX cells were treated with salinomycin (0, 4, 8 μmol·L-1) for 48 h; the protein expression levels of BAX, BCL-2, caspase-3, and caspase-9 were determined by Western blot assay. The results shown representative of three independent experiments.
3 讨论
肿瘤耐药的发生是多因素、多途径共同作用的结果[9]。最新研究表明肿瘤细胞对凋亡的敏感性是影响化疗效果的重要因素之一[10]。细胞凋亡过程受到抑制时可导致肿瘤细胞耐药的发生,寻找高效低毒的凋亡诱导剂,或者选择无交叉耐药的联合化疗方案是逆转肿瘤耐药性的重要策略。近年来,Salinomycin的药理作用越来越受到关注。由于Salinomycin被发现能够选择性抑制乳腺癌干细胞,且其效率比临床常用化疗药物紫杉醇高出100多倍[4]。一项最新临床研究发现,每2 d静脉给药200~250 μg·kg-1Salinomycin能有效抑制乳腺癌、头颈癌转移,且无明显的毒副作用[11]。因此Salinomycin被认为是一类潜在的抗癌药物[12]。
本实验首次观察了Salinomycin对乳腺癌MCF-7/DOX耐药细胞增殖的影响,结果发现,Salinomycin能有效抑制乳腺癌耐药细胞的增殖。肿瘤细胞增加药物的外排,减少药物的吸收是其耐受化疗药物的一种主要手段。已知乳腺癌MCF-7/DOX耐药细胞高表达多药耐药蛋白P-gp,抑制P-gp蛋白的表达能够增加MCF-7/DOX耐药细胞的化疗敏感性[13]。Fuchs 等[8]研究发现,Salinomycin可以抑制P-gp蛋白高表达的白血病细胞增殖。我们发现虽然Salinomycin同样抑制MCF-7/DOX的增殖,却对P-gp蛋白的表达没有影响,提示Salinomycin可以克服P-gp蛋白引起的促增殖作用,其机制与P-gp蛋白表达无关。
肿瘤细胞凋亡抵抗是肿瘤化疗耐药的另一重要原因[14],研究发现Salinomycin可以克服多种凋亡抵抗促进多种肿瘤细胞凋亡[15]。我们发现Salinomycin同样能够有效诱导乳腺癌MCF-7/DOX耐药细胞凋亡,且具有时间依赖性。文献报道[16],
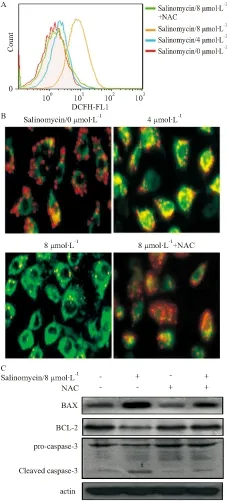
Fig 5 Effects of salinomycin on ROS production and mitochondrial membrane potential in MCF-7/DOX cells
A: MCF-7/DOX cells were treated with salinomycin (0, 4, 8 μmol·L-1) for 12 h, cellular ROS level was determined by DCFH-DA staining; B: MCF-7/DOX cells were treated with salinomycin (0, 4, 8 μmol·L-1) for 24 h, mitochondrial membrane potential assay kit with JC-1 was used to determine the effects of salinomycin on the change of mitochondrial membrane potential. C: MCF-7/DOX cells were co-treated with salinomycin (8 μmol·L-1) and NAC (5 mmol·L-1) for 48 h, The protein expression levels of BAX, BCL-2, and caspase-3 were determined by Western blot assay. The results shown representative of three independent experiments.
Salinomycin可以通过诱导氧化应激反应来抑制前列腺癌肿瘤细胞增殖而且不影响正常前列腺上皮细胞。Kim等同样发现Salinomycin能够引起肿瘤细胞氧化应激反应以及线粒体膜去极化导致细胞凋亡[7]。证据表明氧化应激适应与肿瘤细胞耐药性具有相似的机制[17],一些抗氧化蛋白(如PrxII、CAT等)的表达与乳腺癌、胶质瘤、头颈癌等肿瘤细胞耐药性成正相关[18]。Diehn等[19]发现乳腺癌干细胞含有较低的ROS水平,而增加细胞内ROS水平能增加乳腺癌干细胞对放、化疗的敏感性[20]。我们发现Salinomycin处理:(1)明显增加乳腺癌MCF-7/DOX耐药细胞内ROS的水平;(2)降低细胞线粒体膜电位;(3)下调凋亡抑制蛋白BCL-2的表达,上调促凋亡蛋白BAX的表达;(4)激活caspase-9、caspase-3蛋白。相反,抗氧化剂预处理则能够逆转Salinomycin的作用。结果说明Salinomycin可通过促进ROS产生,激活线粒体凋亡途径而诱导乳腺癌MCF-7/DOX耐药细胞的凋亡。
总之,本实验首次发现Salinomycin对乳腺癌MCF-7/DOX耐药细胞具有很好的增殖抑制效果,其作用机制可能与诱导ROS产生导致的细胞凋亡有关。那么Salinomycin诱导ROS产生的机制,以及Salinomycin是否在体内同样具有逆转乳腺癌耐药的作用,还需要进一步通过实验深入研究,以期为临床联合应用化疗药物逆转乳腺癌耐药提供实验基础和联合用药策略。
[1] 郑 莹, 吴春晓, 张敏璐. 乳腺癌在中国的流行状况和疾病特征 [J]. 中国癌症杂志, 2013, 23(8):561-9.
[1] Zheng Y, Wu C X, Zhang M L. The epidemic and characteristics of female breast cancer in china [J].ChinOncol, 2013, 23(8):561-9.
[2] Tacar O, Dass C R. Doxorubicin-induced death in tumour cells and cardiomyocytes: is autophagy the key to improving future clinical outcomes [J]?JPharmPharmacol, 2013, 65(11):1577-89.
[3] Miyazaki Y, Shibuya M, Sugawara H, et al. Salinomycin, a new polyether antibiotic [J].JAntibiot, 1974, 27(11):814-21.
[4] Gupta P B, Onder T T, Jiang G, et al. Identification of selective inhibitors of cancer stem cells by high-throughput screening [J].Cell, 2009, 138(4):645-59.
[5] Dong T T, Zhou H M, Wang L L, et al. Salinomycin selectively targets CD133+ cell subpopulations and decreases malignant traits in colorectal cancer lines [J].AnnalsSurgOncol, 2011, 18(6):1797-804.
[6] Wang Y. Effects of salinomycin on cancer stem cell in human lung adenocarcinoma A549 cells [J].MedChem, 2011, 7(2):106-11.
[7] Kim K Y, Yu S N, Lee S Y, et al. Salinomycin-induced apoptosis of human prostate cancer cells due to accumulated reactive oxygen species and mitochondrial membrane depolarization [J].BiochimBiophysResCommun, 2011, 413(1): 80-6.
[8] Fuchs D, Daniel V, Sadeghi M, et al. Salinomycin overcomes ABC transporter-mediated multidrug and apoptosis resistance in human leukemia stem cell-like KG-1a cells [J].BiochimBiophysResCommun, 2010, 394(4):1098-104.
[9] Lu H P, Chao C C. Cancer cells acquire resistance to anticancer drugs: an update [J].BiomedJ, 2012, 35(6):464-72.
[10] Sui X, Kong N, Ye L, et al. p38 and JNK MAPK pathways control the balance of apoptosis and autophagy in response to chemotherapeutic agents [J].CancerLett, 2014, 344(2):174-9.
[11] Naujokat C, Steinhart R. Salinomycin as a drug for targeting human cancer stem cells [J].JBiomedBiotechnol, 2012, 2012:950658.
[12] Zhou S, Wang F, Wong E T, et al. Salinomycin: a novel anti-cancer agent with known anti-coccidial activities [J].CurrMedChem, 2013, 20(33):4095-101.
[13] Wind N S, Holen I. Multidrug resistance in breast cancer: from in vitro models to clinical studies [J].IntJBreastCancer, 2011, 2011:967419.
[14] 李 玄,贺晓丽,毕明刚. 内质网应激凋亡通路中的耐药节点[J]. 中国药理学通报,2013,29(9):1192-6.
[14] Li X,He X L,Bi M G. Medicine resistance motecules in the endoplasmic reticulum stress mediated apoptosis pathway[J].ChinPharmBull,2013,29(9):1192-6.
[15] Fuchs D, Heinold A, Opelz G, et al. Salinomycin induces apoptosis and overcomes apoptosis resistance in human cancer cells [J].BiochemBiophysResCommun, 2009, 390(3):743-9.
[16] Ketola K, Hilvo M, Hyötyläinen T, et al. Salinomycin inhibits prostate cancer growth and migration via induction of oxidative stress [J].BrJCancer, 2012, 106(1):99-106.
[17] Pennington J D, Wang T J, Nguyen P, et al. Redox-sensitive signaling factors as a novel molecular targets for cancer therapy [J].DrugResistUpdate, 2005, 8(5): 322-30.
[18] Wang T, Diaz A J, Yen Y. The role of peroxiredoxin II in chemoresistance of breast cancer cells [J].BreastCancer(DoveMedPress), 2014, 6:73-80.
[19] Diehn M, Cho R W, Lobo N A, et al. Association of reactive oxygen species levels and radioresistance in cancer stem cells [J].Nature, 2009, 458(7239):780-3.
[20] Nagano O, Okazaki S,Saya H. Redox regulation in stem-like cancer cells by CD44 variant isoforms [J].Oncogene, 2013, 32(44): 5191-8.
Anti-proliferative effect of salinomycin on doxorubicin- resistant human breast cancer MCF-7/DOX cells
LIU Hao, LU Min-ying, HE Zhi-min
(CancerResearchInstituteandCancerHospital,GuangzhouMedicalUniversity,Guangzhou510095,China)
Aim To investigate the anti-proliferative effect of salinomycin on doxorubicin-resistant human breast cancer MCF-7/DOX cells. Methods MCF-7 and MCF-7/DOX cells were treated or untreated with salinomycin. Cell viability was detected by MTS assay. Cell apoptosis was detected by Annexin V-FITC/PI assay. Reactive oxygen species (ROS) was measured by DCFH-DA staining. Mitochondrial membrane potential was measured by JC-1 assay. The expression of apoptosis related proteins BAX, BCL-2, caspase-3, and caspase-9 were evaluated by Western blot analysis. Results The cell viability was significantly reduced by salinomycin treatment in a dose-dependent manner. The flow cytometry results showed that salinomycin induced MCF-7/DOX cell apoptosis, increased ROS production, and decreased mitochondrial membrane potential. Furthermore, salinomycin decreased the expression of BCL-2, and increased the expression of BAX, cleaved caspase-3, and cleaved caspase-9. Moreover, the antioxidant N-acetylcysteine (NAC) markedly blocked the above effects. Conclusions Our results suggest that salinomycin-induced apoptosis in MCF-7/DOX is associated with induction of ROS production, and activation of mitochondria apoptosis pathway, which may become a potential chemotherapeutic agent for the therapy of doxorubicin resistant breast cancer.
breast cancer; salinomycin; doxorubicin resistance; cell apoptosis; ROS; mitochondrial membrane potential
时间:2015-3-16 15:41 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20150316.1541.003.html
2014-10-31,
2015-01-04
国家自然科学基金资助项目(No 81402497)
刘 浩(1981-),男,博士,助理研究员,研究方向:肿瘤转移、耐药的分子机制,Tel:020-66673666,E-mail:haoliu2020@ 163.com; 贺智敏(1957-),男,博士,教授,博士生导师,研究方向:恶性肿瘤发病和治疗耐受的分子机制,通讯作者,Tel: 020-66673666,E-mail:hezhimin2005@yahoo.com
10.3969/j.issn.1001-1978.2015.04.022
A
1001-1978(2015)04-0549-06
R329.24;R329.25;R737.902.2;R979.1;R979.14

