二烯丙基二硫下调DJ-1抑制人白血病HL-60细胞增殖及诱导分化
王 娟,杨叶宁,秦 晶,唐玉娴,李清叶,苏 琦,谭 晖
(1.南华大学肿瘤研究所,湖南 衡阳 421001,2. 解放军总医院呼吸科,北京 100853)
二烯丙基二硫下调DJ-1抑制人白血病HL-60细胞增殖及诱导分化
王 娟1,2,杨叶宁1,秦 晶1,唐玉娴1,李清叶1,苏 琦1,谭 晖1
(1.南华大学肿瘤研究所,湖南 衡阳 421001,2. 解放军总医院呼吸科,北京 100853)
目的 研究二烯丙基二硫(DADS)通过下调DJ-1对人白血病细胞系HL-60增殖抑制及诱导分化的影响。 方法 通过细胞形态法观察细胞分化;Western blot及免疫细胞化学检测DADS对HL-60细胞DJ-1表达的影响;针对DJ-1 mRNA序列设计合成siRNA转染人白血病细胞HL-60,Western blot检测基因干扰效果;利用MTT法及间接免疫荧光检测DADS及DJ-1沉默对HL-60细胞的生长及细胞分化的影响。结果 DADS可以诱导HL-60细胞向成熟粒细胞系样分化。DADS呈时间依赖性抑制DJ-1的表达(P<0.05),DJ-1干扰组细胞生长减慢(P<0.05),与DADS 共同作用后可诱导HL-60细胞分化。 检测细胞生长情况发现干扰组细胞生长减慢(P<0.05)。结论 DADS通过下调DJ-1抑制细胞增殖并诱导HL-60细胞分化;干扰DJ-1基因可以增强DADS对HL-60细胞的增殖抑制诱导分化作用。
白血病;DJ-1;DADS;诱导分化;基因沉默;增殖
白血病是常见恶性肿瘤之一,且各种治疗效果差。随着诱导分化和诱导凋亡药物出现,白血病的治疗发生了突破性的进展。因此,开发高效、低毒治疗白血病的药物,寻找有效靶点进行靶向干预治疗,提高5年生存率,对白血病治疗具有重要的意义。
大蒜及其烯丙基硫化物在肿瘤防治方面的作用研究受到国内外学者的广泛关注。二烯丙基二硫(diallyl disulfide, DADS)对胃癌、食管癌、乳腺癌、肺癌、前列腺癌、结肠癌、等肿瘤均有明显的抑制作用[1-5]。
近年来研究发现,DJ-1 高表达于肺癌、食道癌、胰腺癌、肝癌、乳腺癌、喉癌、黑色素瘤等恶性肿瘤中[6-8],DJ-1表达与肿瘤的T分期、临床分期、淋巴结转移、肿瘤分化、肿瘤的复发呈相关性。另外,上调DJ-1基因的表达可促进细胞的癌变,降低化疗药物对癌细胞的增殖抑制作用,与化疗抵抗有关[9-10]。这些研究表明,DJ-1 促癌基因可用于诊断和预测恶性肿瘤病人的预后,具有潜在的临床应用价值。因此,DJ-1蛋白可作为候选的肿瘤标志蛋白,也可作为抗肿瘤药物作用的重要靶点。
本研究通过荧光标记siRNA沉默HL-60细胞内DJ-1基因表达,观察沉默DJ-1以及DADS作用下对HL-60细胞生物学影响,证实DJ-1可能是DADS抑制HL-60细胞增殖及诱导分化的靶点,拟阐明DADS抗白血病的分子机制,从而为开发高效、低毒的抗白血病药物与基因干预治疗提供理论基础和实践依据。
1 材料与方法
1.1 材料人早幼粒白血病HL-60细胞系,中南大学细胞中心馈赠;DADS为Fluka公司产品;小牛血清,杭州四季青生物工程公司产品;MTT:Amreco公司产品;DJ-鼠抗人单克隆抗体,购自Milipore公司;β-actin,鼠抗人单克隆抗体,联科生物公司;CD11b兔多克隆抗体,购自Epitomics公司,Cy3标记的山羊抗兔二抗购自康为世纪生物科技有限公司;Western blot灌胶试剂盒均购自北京康为世纪生物公司;siRNA片段,购自广州锐博生物技术公司。
1.2 方法
1.2.1 体外细胞培养及细胞形态学观察 HL-60细胞悬浮培养于含体积分数为0.12的热灭活小牛血清的RPMI 1640培养基中,在37℃、含体积分数为0.05的CO2培养箱内培养。将对照组和经1.25 mg·L-1DADS处理后4 d的HL-60细胞, Giemsa染色,显微镜镜下观察细胞形态变化,拍照。
1.2.2 Western blot验证DJ-1蛋白的表达 离心收集细胞;提取细胞总蛋白,BCA蛋白定量。蛋白变性后根据蛋白浓度加入适量蛋白,再进行SDS-PAGE凝胶电泳;用蛋白湿转移装置将蛋白转移到PVDF膜上;5%脱脂牛奶封闭液;加入稀释的Ⅰ抗;再加入稀释的Ⅱ抗室温孵育1 h;显影。
1.2.3 细胞免疫化学法观察DADS对HL-60细胞DJ-1的影响 离心收集细胞,涂片;体积分数为0.95的乙醇固定10 min,每张切片滴加50 μL即用型血清封闭液,室温孵育10 min后甩干;滴加一抗工作液50 μL,4 ℃孵育过夜;每张切片加50 μL生物素标记的二抗,室温孵育30 min;每张切片加50 μL链霉素抗生物素蛋白-过氧化酶溶液,室温孵育30 min;每张切片加100 μL新鲜配制的DAB溶液,显色3~5 min;苏木精复染,酒精脱水,中性树胶封片。
1.2.4 细胞瞬时转染及筛选有效的DJ-1 siRNA序列 取对数生长期HL-60细胞接种至24孔板,每孔加入不含抗生素的培养基进行转染。用不含血清的DMEM分别稀释Lipo2000和siRNA,室温孵育5 min;最后形成siRNA-Lipo2000混和物室温孵育20 min。将siRNA-Lipo2000混和液加入每个含有细胞及培养液的孔中。将培养板放入培养箱中孵育4~6 h后,荧光显微镜下观察拍照,继续培养。转染48和72 h后,提取总蛋白,进行Western blot检测。DJ-1 siRNA序列取序列a、b、c中抑制率最高组。
1.2.5 MTT法检测细胞生长 离心收集对数生长期HL-60细胞,制备细胞悬液接种至96孔板,边缘孔用无菌PBS填充,每板设对照组,加培养基100 μL,每组设定6个复孔;置入培养箱孵育48 h;每孔加入10 μL MTT溶液,继续孵育4 h;取出培养板后离心,每孔加入100 μL二甲基亚砜,置摇床上低速震荡20 min,使结晶物充分溶解后,酶联免疫检测仪测量各孔吸光度值。
1.2.6 间接免疫荧光细胞化学实验 离心收取对数生长的细胞,PBS洗涤细胞,取10 μL细胞悬液滴置载玻片,室温自然干燥,滴加50 μL丙酮固定约5min,羊血清37℃孵育30min,滴加稀释后的CD11b抗体,37℃孵育1 h,孵育二抗:滴加稀释后的荧光标记二抗,室温、避光孵育40 min,荧光显微镜下观察涂片,拍照。
2 结果
2.1 DADS处理HL-60细胞前后形态学变化姬姆萨染色结果显示,DADS处理HL-60细胞96 h后,细胞形态发生改变,主要表现在胞核的分化,呈现U型或肾型改变,核质比例减少,核仁减少或消失等。对照组则细胞体积较大,胞核大且圆,见Fig 1。表明DADS有诱导HL-60细胞分化的作用。

Fig 1 Detection of cell differentiation by Giemsa stain(×400)
A:HL- 60 cells B:HL- 60 cells treated by DADS for 96h
2.2 DADS抑制HL-60细胞DJ-1蛋白的表达Western blot结果显示,与对照组比较,DADS作用HL-60细胞24、48、72及96 h后,DJ-1蛋白表达呈时间依赖性明显下降(Fig 2)。这提示DADS可以抑制DJ-1蛋白的表达。
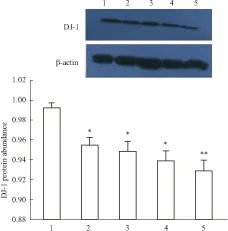
Fig 2 The effect of DADS on the expression of DJ-1 in HL-60 cells detected by Western blots
1:Control group;2: Treated by DADS for 24h;3: Treated by DADS for 48h;4: Treated by DADS for 72h;5: Treated by DADS for 96 h.*P<0.05,**P<0.01vscontrol
2.3 免疫细胞化学观察DADS对HL-60细胞DJ-1蛋白表达的影响DJ-1在HL-60细胞中呈强阳性表达,而 DADS处理72 h 后, DJ-1表达明显下降,见Fig 3,这进一步表明DADS可以抑制DJ-1蛋白的表达。

Fig 3 The effect of DADS on the expression of DJ-1 in HL-60 cells detected by immunocytochemistry
A: HL-60 cells; B: HL-60 cells treated by DADS for 72h
2.4 Western blot检测转染前后DJ-1蛋白表达以及DADS对其作用的效果将Cy3荧光标记的DJ-1-siRNA瞬时转染HL-60细胞后,6 h后荧光显微镜下观察细胞内见红色荧光标记物表达,转染效率达95%以上,提示转染成功。干扰组DJ-1蛋白表达较对照组、脂质体组及阴性对照组明显下调(P<0.05),见Fig 4;DADS分别处理对照组、干扰组、脂质体组及阴性对照组后,DJ-1蛋白表达较未处理前下调,且DADS处理干扰组前后DJ-1蛋白表达差异有显著性(P<0.05),见Fig 5。

Fig 4 The effect on the expression of DJ-1 in HL-60 cells treated by siRNA as detected by Western blots
1:Control group;2:Negative control group;3:Liposome group;4:DJ-1 siRNA group.*P<0.05vscontrol
2.5 MTT检测转染前后细胞增殖的影响MTT法证实,干扰组细胞生长较对照组、脂质体组及阴性对照组减慢,差异有显著性意义(P<0.05),见Fig 6。这表明干扰DJ-1可以抑制HL-60细胞的增殖能力。
2.6 间接免疫荧光检测DJ-1干扰及DADS对HL-60细胞分化的影响CD11b是成熟髓细胞表面分化抗原,DADS作用前,对照组细胞及脂质体组几乎不表达标记红色荧光的CD11b、DJ-1干扰组CD11b表达增高,DADS作用后,3组细胞CD11b的表达明显提高,提示DADS具有诱导HL-60细胞分化的作用,DJ-1干扰可以促进DADS诱导的HL-60细胞分化,见Fig 7。

Fig 5 The expression of DJ-1 in HL-60 cells treated by DADS before and after transfection
1:Control group treated by DADS;2:Negative control group treated by DADS;3:DJ-1 siRNA group treated by DADS;4:Liposome treated by DADS.*P<0.05vscontrol

Fig 6 The effect of DJ-1 on the proliferation of HL-60 cells detected by MTT
*P<0.05vscontrol
3 讨论

Fig 7 The effect on the expression of CD11b in HL-60 cells detected by indirect immunofluorescence assay
A:HL-60 cells;B:Liposome group;C:DJ-1 siRNA group;1:DADS(-)2:treated by DADS for 72h
DJ-1编码蛋白属于ThiJ/PfpI/DJ-1超家族,是具有多种功能的蛋白质。DJ-1在多种恶性肿瘤中特异性表达, 而未见于正常组织。有研究发现, RNAi沉默DJ-1在白血病细胞系K562以及HL-60的表达,抑制了细胞增殖且增加了白血病细胞对化疗药物依托泊苷的敏感性。用特异性DJ-1-siRNA干扰神经母细胞瘤细胞株SH-SY5Y细胞后暴露于百草枯,能增强SH-SY5Y细胞对百草枯引起凋亡的敏感性。因此可以认为,DJ-1可作为多种恶性肿瘤治疗的一个潜在靶点。有人采用蛋白质组学研究发现,DJ-1蛋白高表达与维甲酸、顺铂等药物耐药有关[11-12]。
先前已证实小剂量DADS主要使HL-60细胞阻滞于G1期,S期细胞减少,DNA合成受阻, 细胞不能进入分裂周期而转入静息状态,在药物的刺激下诱导其向正常细胞分化[13]。运用蛋白质组学初步鉴定DADS诱导人白血病HL-60细胞的差异蛋白质18 种,其中DJ-1表达下调[14-15],利用Western blot进行验证,表明DADS可以通过降低DJ-1的表达诱导HL-60细胞分化,DJ-1siRNA转染人白血病HL-60细胞后,可抑制细胞增殖,并且随着DADS作用时间的延长,对细胞增殖的抑制作用愈明显。
DJ-1促进癌细胞分裂增殖和迁移侵袭,很可能涉及到几个相互协调的细胞内分子途径。研究证实,DJ-1蛋白是PTEN 抑癌基因的主要负性调控蛋白之一, PTEN拮抗着调节细胞生长和生存的PI3激酶和PKB/Akt信号通路,在癌症患者血浆中发现DJ-1的含量和表达量增加,刺激PI3K/Akt通路促进肿瘤细胞的增殖与生长[16-17]。同时DJ-1作为一种抑制PTEN的蛋白,影响细胞的黏附、运动与迁移。FAK信号通路与恶性肿瘤细胞的侵袭和转移有着密切的关系,有实验证实干扰PTEN后,可以激活Fak通路,参与肝癌、胃癌、白血病细胞迁移及侵袭[18-19]。因此考虑DJ-1对部分信号通路的过度激活起着举足轻重的作用。
综上所述,DJ-1可能通过调控细胞分裂、增殖、迁移、分化以及凋亡,参与白血病的发生、发展以及预后,可能是白血病一个潜在的治疗靶点,亦或是白血病的一个潜在生物标志物,同时预示着DADS可能成为临床白血病治疗的有效药物。
[1] Ling H, Lu L F, He J, et al. Diallyl disulfide selectively causes checkpoint kinase-1 mediated G2/M arrest in human MGC803 gastric cancer cell line[J].OncolRep, 2014,32(5):2274-82.
[2] Yin X, Zhang J, Li X, et al. DADS suppresses human esophageal xenograft tumors through RAF/MEK/ERK and mitochondria-dependent pathways[J].IntJMolSci, 2014, 15(7): 12422-41.
[3] Bauer D, Mazzio E, Soliman K F, et al. Diallyl disulfide inhibits TNFalpha-induced CCL2 release by MDA-MB-231 cells[J].AnticancerRes, 2014, 34(6): 2763-70.
[4] Hahm E R, Singh S V. Diallyl trisulfide inhibits estrogen receptor-alpha activity in human breast cancer cells[J].BreastCancerResTreat, 2014, 144(1): 47-57.
[5] Yun H M, Ban J O, Park K R, et al. Potential therapeutic effects of functionally active compounds isolated from garlic[J].PharmacolTher, 2014, 142(2): 183-95.
[6] Zhu X L, Wen W P, Lei W B, et al. DJ-1 expression in laryngeal squamous cell carcinoma and its relationship with tumor recurrence and metastasis[J].ZhonghuaErBiYanHouTouJingWaiKeZaZhi, 2010, 45(6): 497-501.
[7] Wei W, Tang C, Zhan X, et al.Effect of DJ-1 siRNA on biological behavior of human lung squamous carcinoma SK-MES-1 cells[J].ZhongNanDaXueXueBaoYiXueBan, 2013, 38(1): 7-13.
[8] Wu F, Liang Y Q, Huang ZM. The expression of DJ-1 gene in human hepatocellular carcinoma and its relationship with tumor invasion and metastasis[J].ZhonghuaGanZangBingZaZhi, 2009, 17(3): 203-6.
[9] Chen L L, Tian J J, Su L, et al. DJ-1: a promising marker in metastatic uveal melanoma[J].JCancerResClinOncol, 2014.
[10]Ismail I A, Kang H S, Lee H J, et al. DJ-1 upregulates breast cancer cell invasion by repressing KLF17 expression[J].BrJCancer, 2014, 110(5): 1298-306.
[11]Qin H, Liu T, Yang J L, et al. Screening proteins related to retinoic acid resistance by proteomic analysis[J].ZhonghuaYiXueZaZhi, 2007, 87(8): 520-5.
[12]Liu H, Wang M, Li M, et al. Expression and role of DJ-1 in leukemia[J].BiochemBiophysResCommun, 2008, 375(3): 477-83.
[13]武明花,黄卫国,谭 晖,等. DADS抑制JAK1/STAT3信号通路诱导人白血病HL-60细胞分化[J]. 中国药理学通报, 2005, 21(05): 580-3.
[13]Wu M H, Huang W G, Tan H, et al. Su Q. Induction of differentiation by diallyl disulfide through inhibition of JAK1/STAT3 in human leukem ia HL-60 cells[J].ChinPharmacolBull,2005, 21(05):580-3.
[14]Zhao J, Huang W G, He J, et al. Diallyl disulfide suppresses growth of HL-60 cell through increasing histone acetylation and p21WAF1 expressioninvivoandinvitro[J].ActaPharmacolSin, 2006, 27(11): 1459-66.
[15]何 洁,万 炜,黄卫国,等. 双向电泳分析二烯丙基二硫诱导HL60细胞分化的蛋白表达差异[J]. 南华大学学报(医学版), 2004, 32(02):0143-04.
[15]He J, Wan W, Huang W G. Analysis of protein expression in diallyldisulfide treated HL60Cell with two dimensional electrophoresis[J].JNanhuaUniv(MedEdit), 2004, 32(02):143-4.
[16]Yin X, Zhang R, Feng C, et al. Diallyl disulfide induces G2/M arrest and promotes apoptosis through the p53/p21 and MEK-ERK pathways in human esophageal squamous cell carcinoma[J].OncolRep, 2014, 32(4): 1748-56.
[17]Kim Y C, Kitaura H, Taira T, et al. Oxidation of DJ-1-dependent cell transformation through direct binding of DJ-1 to PTEN[J].IntJOncol, 2009, 35(6): 1331-41.
[18]Gupta A, Dey C S. PTEN, a widely known negative regulator of insulin/PI3K signaling, positively regulates neuronal insulin resistance[J].MolBiolCell, 2012, 23(19): 3882-98.
[19]Sun B, Meng J, Xiang T, et al. Jianpijiedu fang improves survival of hepatocarcinoma mice by affecting phosphatase and tensin homolog, phosphoinositide 3-kinase, and focal adhesion kinase[J].JTraditChinMed, 2013, 33(4): 479-85.
Diallyl Disulfide down regulated DJ-1 inhibiting ability of proliferation and inducing human leukemic cell differentiation
WANG Juan1,2,YANG Ye-ning1,QIN Jing1,TANG Yu-xian1,LI Qing-ye1,SU Qi,TAN Hui1
(1.CancerResearchInstitute,NanhuaUniversity,HengyangHunan421001,China;2.RespiratoryofChinesePLAGeneralHospital,Beijing100853,China)
Aim To observe the effect of DADS on the poliferation and differentiation of human leukemic cells by down-regulating DJ-1.Methods Cell differentiation were detected by morphologic observation.The effects of DADS on DJ-1 expression in HL-60 cells were detected by immunocytochemistry and Western blot. DJ-1-specific siRNA was designed and synthesized. Small interfering RNA was transfected into HL-60 cells to knock down the DJ-1 expression.Western blot was used to detect the siRNA interference efficiency.The effects of DADS and DJ-1 silence on cell growth and differentiation in HL-60 cells were detected by MTT method and indirect immunofluorescence detection.Results HL-60 cells were induced differentiation toward neutrophilic by DADS.The expression of DJ-1 was inhibited in HL-60 cells after treated with DADS in a time dependent manner(P<0.05).DJ-1 protein was overexpressed in HL-60 cell lines, which could be reversed after treated with DADS.Fluorescently labeled DJ-1-siRNA transfected HL-60 cells. All these detections showed that the growth rate of DJ-1-siRNA group was lower(P<0.05).Conclusion DADS inhibits cell proliferation and induces cell differentiation by down-regulating DJ-1 in HL-60 cell lines.Silencing DJ-1gene enhances the rate of inhibition of proliferation and induction differentiation of HL-60 cell lines after treated with DADS.
leukemia;DJ-1;DADS; inducing differentiation;gene silence;proliferation
时间:2015-3-3 11:08 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20150303.1108.024.html
2014-11-22,
2014-12-26
国家自然科学基金资助项目(No 81100375);湖南省高校创新平台开放基金(No 11K057);南华大学博士科研启动基金 (No 2010XQD40)
王 娟(1983-),女,硕士生,研究方向:白血病防治的分子机制,E-mail:630811881@qq.com; 杨叶宁(1988-)女,硕士生,研究方向:白血病防治的分子机制,共同第一作者,E-mail:27199139@qq.com; 谭 晖(1973-),女,博士,硕士生导师,研究方向:白血病防治的分子机制,通讯作者,Fax:0734-8281547,E-mail:1047550723@qq.com
10.3969/j.issn.1001-1978.2015.03.024
A
1001-1978(2015)03-0416-05
R329.24;R394.2;R733.702.2;R916.4