丹参药材指纹图谱建立方法研究
崔同欣 刘 将 纪亚楠
丹参药材指纹图谱建立方法研究
崔同欣 刘 将 纪亚楠
(上海华源安徽锦辉制药有限公司,安徽阜阳236018)
在目前已知的丹参及其制剂成分检测方法的基础上,主要对丹参水溶性成分的指纹图谱建立方法进行了初步探究,通过试验建立了丹参药材水溶性成分指纹图谱检测的试验条件和方法。
丹参药材;指纹图谱;方法;建立
0 引言
丹参,为唇形科植物丹参Salvia miltiorrhiza Bge.的干燥根及根茎。秋季9—10月份采挖,除去泥沙,干燥。
丹参药材中有效成分主要分为两类:一类为水溶性的酚酸类成分(丹参素、原儿茶醛和丹酚酸A、B、C等),另一类为脂溶性的二萜类成分(丹参酮I、丹参酮II和隐丹参酮等)。定性鉴别上述两类成分或定量测定其某种或多种有效成分含量,已成为评价丹参及其制剂质量的重要方法[1]。据统计,丹参制剂达100多种,而丹参制剂中主要有效成分为水溶性的酚酸类成分,考虑到原药材的质量控制与制剂质量之间的相关性,我们主要对丹参药材水溶性酚酸类成分进行了指纹图谱的研究,该类成分对紫外线具有较强的吸收值,可采用HPLC-UV法建立制剂指纹图谱。
1 丹参指纹图谱研究情况
1.1 脂溶性成分的指纹图谱
丹参脂溶性成分的指纹图谱,一般将药材经处理提取后,以甲醇-水溶剂系统进行梯度洗脱。由于丹参药材、对照品以及使用仪器等条件的不同,洗脱系统存在差异。徐德然[2]等以丹参酮ⅡA、隐丹参酮为对照进行指纹图谱研究。
目前获取指纹图谱的主要方法有色谱法、光谱法、X射线衍射法和分子生物技术等。其中,色谱技术是近年来分析化学领域中发展快、应用广的方法之一。常用的色谱技术包括薄层色谱、液相色谱、气相色谱和毛细管电泳等[3]。其中,高效液相色谱是液相品,5%甲醇与0.1%乙酸-甲醇梯度洗脱,在254 nm波长处检测,用于不同产地丹参脂溶性成分指纹图谱的比较研究。
1.2 水溶性成分的指纹图谱
近10年来,采用HPLC法分析技术对水溶性酚酸类化合物进行指纹图谱研究有显著的优势。研究中一般采用C18柱,甲醇或乙腈同时加入酸抑制剂进行线性梯度洗脱,分离效果较佳。周欣[4]等以丹参素钠、原儿茶醛为对照品,乙腈-0.4%冰醋酸水溶液进行梯度洗脱,检测波长254 nm,建立了贵州铜仁地区丹参药材的HPLC水溶性共有指纹图谱;宋敏[5]采用甲醇-1.0%冰醋酸溶液梯度程序洗脱,以丹参对照药材制备指纹对照品进行了色谱系统适用性试验,并考察了梯度洗脱程序、流动相酸度以及色谱柱填充剂对指纹图谱重现性的影响。
1.3 有效成分的指纹图谱研究
随着丹参指纹图谱研究的深入,丹参有效成分(脂溶性和水溶性)指纹图谱的研究也日益成熟。鉴于药材的有效成分理化性质差异较大,实际操作中,多采用水提、不同浓度甲醇提取等方法,以含酸抑制剂的乙腈或甲醇为流动相,建立丹参有效部位指纹图谱定性研究的分析方法。
刘艳华[6]等采用水提法,以原儿茶醛为外标,1%冰醋酸和1%冰醋酸甲醇溶液梯度洗脱,检测波长270 nm,建立了河南灵宝地区丹参药材的指纹图谱;郑晓珂[7]等以甲醇-0.5%冰醋酸梯度洗脱,流速0.8 mL/min,检测波长281 nm,柱温35 ℃,建立了丹参药材的指纹图谱;黎琼红[8]等采用甲醇为溶剂进行索提后,以丹参酮ⅡA、原儿茶醛、丹参素钠为对照品,0.02%磷酸乙腈-0.02%磷酸梯度洗脱,40 ℃柱温,检测波长280 nm,建立了丹参药材的高效液相指纹图谱;刘洋[9]等采用水回流提取后甲醇超声的方法,以丹参素、原儿茶醛、丹酚酸B、隐丹参酮、丹参酮I、丹参酮ⅡA为对照品,用0.1%三氟乙酸水溶液-乙腈为流动相梯度洗脱,检测波长270 nm,柱温30 ℃,在同一图谱中同时建立起水溶性成分和脂溶性成分的指纹图谱。
1.4 其他方法
近些年来,随着毛细管电泳(HPCE)、高速逆流色谱(HSCCC)及HPLC-MS联用技术的发展,这些技术已经被用于丹参指纹图谱的研究。
季一兵[10]等用毛细管电泳技术,采用50 μm× 50 cm未涂渍毛细管柱,20 mmol/L硼砂溶液作缓冲液,运行电压为15 kV,检测波长210 nm,建立了丹参中药材的HPCE指纹图谱;顾铭[11]等采用HSCCC法,以正己烷-乙醇-水体系采用分步洗脱,建立了丹参药材中脂溶性成分的HSCCC指纹图谱;陈勇[12]等应用电喷雾-质谱(ESI-MS)技术研究了原儿茶醛和丹参素的ESI-MS规律,并对丹参药材中已知的18种水溶性成分中的5种进行了质谱检测和电喷雾行为探讨,初步制定了丹参药材的水溶性成分的特征图谱。此外,汪红[13]等以丹酚酸B为指标,以0.5%甲酸-乙腈为流动相,检测波长287 nm,得到其LC-MS(n)特征图谱,同时对图谱中7种主要化合物进行了精确归属,初步探讨丹酚酸成分的ESI-MS(n)规律。
徐曼[14]等还应用对照品对照和高效液相色谱-质谱联用技术对丹参注射液中的主要成分进行了定性分析,测定了18个不同厂家生产的丹参注射液的HPLC-UV指纹图谱以及代表性厂家注射液的HPLC-DAD-MS图谱,指认了其中的15个酚酸类成分,研究结果显示,18个不同厂家生产的丹参注射液在所含化学成分的数目和含量上差异显著。该方法可用于测定不同来源的丹参注射液的色谱指纹图谱,并为丹参注射液的全面质量评价和生产工艺监控提供了可行的方法。
2 丹参水溶性成分指纹图谱建立方法试验
2.1 供试品溶液的制备
原药材质量标准研究主要是为了更好地控制制剂的质量,因而在药材指纹图谱的研究中,应充分考虑药材指纹图谱控制与制剂质量之间的相关性,故在供试品溶液的制备时,我们参考了制剂的制备工艺,即以一定浓度的碱水进行提取。
2.1.1 丹参药材的粉碎
丹参药材需粉碎成细粉后进行提取,粉碎前如药材含水量较高,则应将药材低温干燥,根据《中国药典》2010版丹参含量测定项下规定,药材粉碎成过三号筛的药材细粉即可,但我们在粉碎时发现有少量药材纤维难以粉碎过三号筛,该部分应尽量粉碎后加入药材细粉混匀,再称取样品,以保证取样的均匀。
2.1.2 提取方式及溶剂的选择
考虑到丹参注射剂制剂的制备工艺采用水提醇沉和碱水解的工艺,本药材提取方法拟采用碱水提取。首先对提取方式及提取溶剂进行了优选:称取药材粉末1.0 g,共6份,按表1进行提取,提取时间为1 h,各提取液滤过,取续滤液5 mL,加入等体积甲醇,摇匀,滤过,取续滤液,HPLC分析。
2.1.3 提取时间的选择
考察了不同的提取时间对图谱的影响:称取药材粉末1.0 g,共3份,精密加入25 mL 0.08%Na2CO3溶液回流提取,提取时间按表3进行,提取结束,取续滤液5 mL,加甲醇5 mL,混匀,滤过,取续滤液,

表1 提取方法优选
结果显示,以0.1%Na2CO3水溶液回流提取,效果较好,与中间体及制剂的色谱图相对吻合,提示该提取溶剂较为适合。
为了更进一步地优选适宜的提取溶剂,以0.1% Na2CO3为参考,考察了多个不同浓度的Na2CO3水溶液:称取药材粉末1.0 g,共8份,按表2进行回流提取,提取时间为1 h,各提取液滤过,取续滤液5 mL,加入等体积甲醇,摇匀,滤过,取续滤液,HPLC分析。
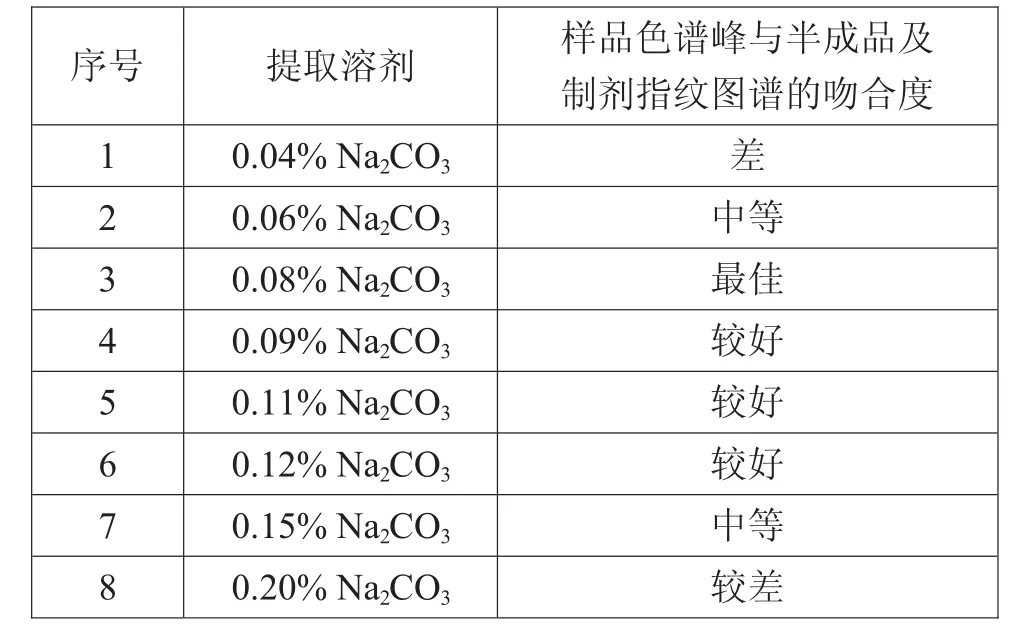
表2 提取方法优选
结果显示,以0.08%Na2CO3水溶液回流提取,样品色谱峰与半成品及制剂的指纹图谱吻合度相对较好,因此,最终选择提取方式为0.08%Na2CO3水溶液回流提取。HPLC分析。

表3 提取时间选择
药材回流提取1 h及2 h,色谱峰差异较小,指纹图谱的吻合度较好,考虑到节约时间,选择提取回流时间为1 h。
药材供试品溶液的制备确定为:称取丹参药材粉末(过三号筛)1.0 g,置具塞圆底烧瓶中,加0.08% Na2CO325 mL,称定重量,加热回流1 h,放冷,加0.08%Na2CO3补足失重,滤过,精密量取续滤液5 mL置10 mL量瓶中,甲醇定容,摇匀,滤过,取续滤液,即得。
2.2 检测方法选择
考虑到药材提取液中主要含水溶性的酚酸类成分,并参考了丹参注射剂等制剂有效成分的检测条件,选用HPLC-UV法进行分析,具体的测试条件、方法考察如下:
2.2.1 仪器和试剂
HPLC仪器:Agilent 1100 G1311A QuartPump,VWD紫外-可见检测器,全自动进样器,AgilentLC色谱工作站。
溶剂:甲醇为色谱纯(汉邦科技有限公司),乙腈为色谱纯(Tedia company),三氟乙酸、冰醋酸均为色谱纯,水为亚沸蒸馏水,其余试剂均为分析纯。
2.2.2 流动相选择
(1)甲醇:酸水系统;(2)乙腈:酸水溶液系统。
试验优选了两种系统的流动相条件(甲醇为流动相A,乙腈为流动相B,酸水溶液为流动相C),试验结果如表4~表8所示。
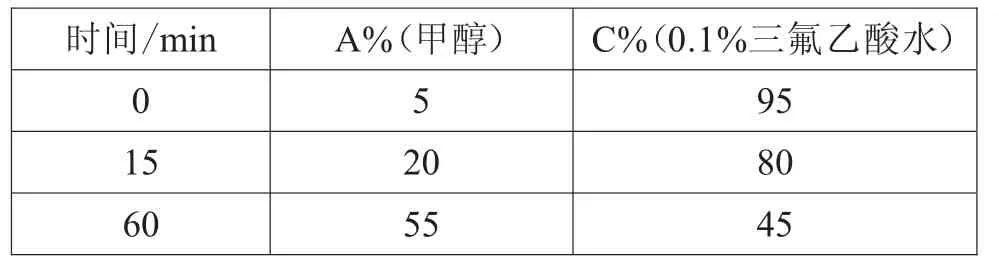
表4 梯度(1)

表5 梯度(2)

表6 梯度(3)
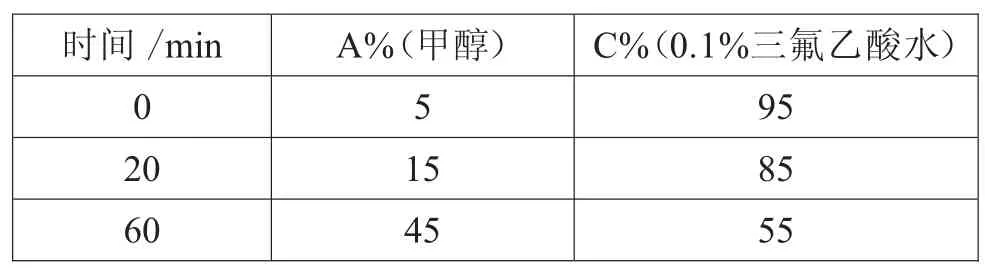
表7 梯度(4)

表8 梯度(5)
试验结果表明,在乙腈-酸水溶液系统下该制剂中整体色谱峰能呈现良好的分离,0.1%三氟乙酸水与0.5%冰醋酸水效果相当,考虑到大部分丹参制剂含量测定中使用的酸水为0.5%冰醋酸水,因此指纹图谱流动相条件最终确定为梯度(5)的方法。
2.2.3 测定波长选择
对丹参样品进行了全波长(190~400 nm)HPLC测试,结果显示,在281 nm测定波长下整体色谱峰较好,有效成分能够充分体现,因此选择测定波长为281 nm。
2.3 色谱柱选择
(1)C18柱:Hedera C18(250 mm×4.6 mm,5 μm),江苏汉邦科技有限公司;(2)C18柱:Kromasil C18(250 mm×4.6 mm,5 μm),大连依利特公司;(3)C18柱:Phenomenex C18(250 mm×4.6 mm,5 μm),菲罗门公司。
在上述条件下,3支以上规格C18色谱柱样品的HPLC色谱图均能达到分离要求,考虑简便、经济的因素,我们选择江苏汉邦科技公司的Hedera C18色谱柱。
2.4 延时测试
丹参药材供试液指纹图谱延时测试,延长测试时间1倍至2 h,药材色谱图中未见明显的成分滞后峰,如图1所示。
2.5 精密度试验
同一批丹参药材供试液,连续进样6次进行精密度测定,测定结果如表9、表10所示。结果表明,供试液中各共有峰的相对保留时间及主要峰的峰面积比值基本一致(RSD%≤5%),符合指纹图谱的技术要求。
2.6 稳定性试验
同一批丹参药材同法制备供试液6份,依法测定,结果分别如表11、表12所示。结果表明,供试液中各共有峰的相对保留时间及主要峰的峰面积比值基本一致(RSD%≤5%),符合指纹图谱的技术要求。

图1 丹参药材供试液指纹图谱延时测试

表9 丹参药材样品液的精密度考察结果(共有峰的相对保留时间)

表10 丹参药材样品液的精密度考察结果(主要峰的峰面积比值)

表11 丹参药材样品液的稳定性考察结果(共有峰的相对保留时间)

表12 丹参药材样品液稳定性考察结果(主要峰的峰面积比值)
2.7 重复性试验
同一批丹参药材同法制备供试品液6份,依法测定,结果分别如表13、表14所示。结果表明,供试品液中各共有峰的相对保留时间及主要峰的峰面积比值基本一致(RSD%≤5%),符合指纹图谱的技术要求。
图谱采用《中药色谱指纹图谱相似度评价系统2004A版》软件对多批制剂指纹图谱进行处理:从中选择1张图谱为对照图谱,对色谱峰进行自动匹配后生成“对照图谱”,将该图谱作为本丹参药材的标准指纹图谱,如图2所示。
2.8.2 丹参药材指纹图谱测定

表13 丹参药材样品液的重复性考察结果(共有峰的相对保留时间)

表14 丹参药材样品液重复性考察结果(主要峰的峰面积比值)
2.8 丹参药材指纹图谱测定
2.8.1 标准指纹图谱制备
取19批丹参药材,依法制备,分别精密吸取供试品溶液各10 μL,注入液相色谱仪,测定19批丹参药材60 min指纹图谱,发现石家沟的丹参药材图谱有较大差异,所以将其舍去,考察剩余18批丹参药材的相似度。
对以上各批丹参药材以标准指纹图谱为对照进行相似度评价,采用《中药色谱指纹图谱相似度评价系统2004B版》软件进行处理:以标准指纹图谱为对照图谱,自动匹配后,进行相似度评价,结果如表15所示。
结果显示,以标准指纹图谱为对照,18批药材与之相似度均大于0.960,符合指纹图谱要求。

图2 丹参药材标准指纹图谱
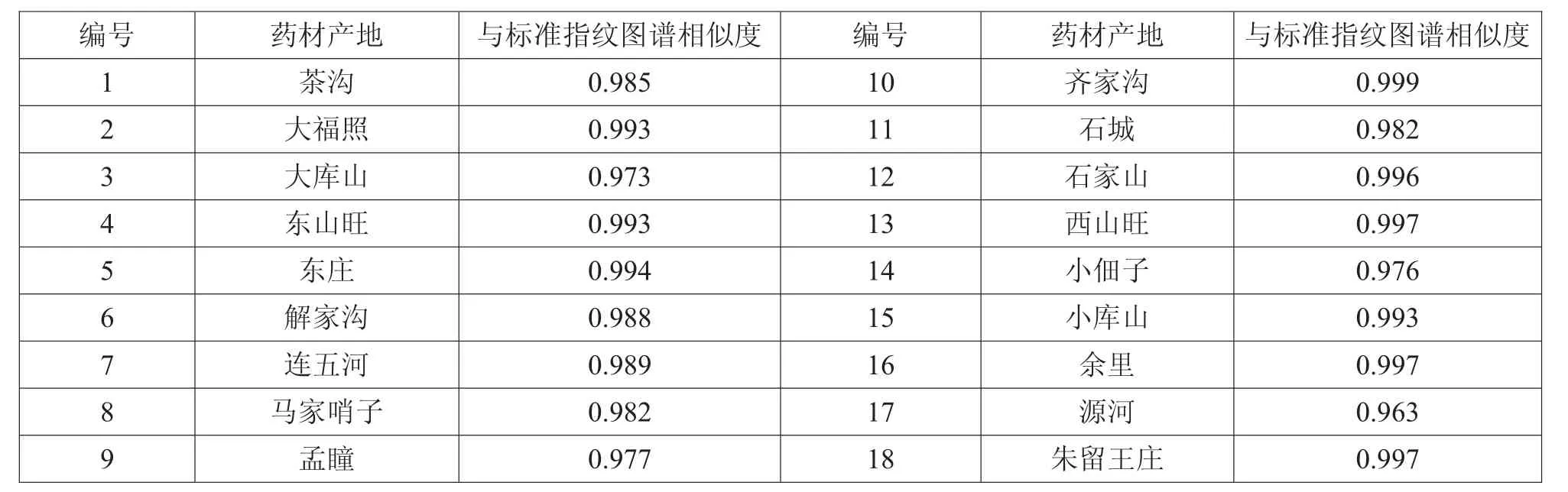
表15 18批丹参药材相似度评价结果
3 结语
综上所述,丹参药材及相关制剂的质量控制研究已较为深入,但仍有不足,特别是对于质量控制要求较高的注射用制剂,其质量标准应在现有基础上进一步提高,主要包括对制剂中化学成分进行深入研究,建立合理的含量测定指标,完善指纹图谱等,从而为药品的质量控制、新产品的生产和开发、市场监督检验、临床合理用药等方面提供有效的科学检测方法和依据。本文主要对丹参水溶性成分的指纹图谱建立方法进行了初步探究,随着检测手段的不断进步,必将有更先进的检测技术和方法建立起来,以保障中药及其制剂的质量和使用安全。
[1] 曹冬,黄喜茹,王建华.丹参的化学成分及其制剂的指纹图谱与质量标准研究进展[J].中国药房,2005,16(17):1339-1341.
[2] 徐德然,王康才,丁静,等.不同产地丹参脂溶性成分指纹图谱的比较[J].中国野生植物资源,2006(12):40-43.
[3] 谢培山.中药色谱指纹图谱[M].北京:人民卫生出版社,2005:18.
[4] 周欣,王道平,梁光义,等.丹参药材水溶性成分的高效液相色谱指纹图谱研究[J].色谱,2005,23(3):292-295.
[5] 宋敏,杭太俊,张正行.丹参水溶性成分标准对照品对照法研究[J].中草药,2005,36(3):360-364.
[6] 刘艳华.丹参HPLC指纹图谱的研究[J].中国药科大学学报,2002,33(2):127-130.
[7] 郑晓珂,董三丽,冯卫生,等.河南产丹参高效液相色谱指纹图谱的研究[J].中国现代应用药学杂志,2006,23(1):57-60.
[8] 黎琼红,张国刚,徐世义,等.丹参药材脂溶性成分的HPLC指纹图谱[J].沈阳药科大学学报,2006,23(1):25.
[9] 刘洋,石任兵,刘斌,等.丹参药材化学成分HPLC指纹图谱研究[J].北京中医药大学学报,2006,29(3):188-192.
[10] 季一兵,郑朝华,陈玉英.丹参的毛细管电泳指纹图谱研究[J].中成药,2003,25(12):953-955.
[11] 顾铭,张贵峰,苏志国,等.高速逆流色谱技术在丹参指纹图谱中的应用[J].中国药品标准,2005(6):7-12.
[12] 陈勇,张玲,王世敏,等.丹参水溶性成分的电喷雾质谱行为及其特征图谱的初步研究[J].分析化学研究简报,2004,32(11):1485-1488.
[13] 汪红,王强.丹参中丹酚酸成分的ESI-MS(n)行为及LC-MS(n)特征图谱研究[J].中华中医药学刊,2007,25(7):1387-1389.
[14] 徐曼,刘爱华,张金兰,等.不同厂家生产的丹参注射液色谱指纹图谱的比对研究[J].世界科学技术:中医药现代化,2007,9(2):65-72.
2015-05-04
崔同欣(1963—),男,安徽太和人,工程师,从事药品生产管理、药品研发及GMP验证工作。
刘将(1979—),男,安徽颍上人,药师,从事药品生产管理、药品研发及GMP验证工作。
纪亚楠(1984—),女,安徽阜阳人,助理工程师,从事药品生产管理、药品研发及GMP验证工作。

