新型含色酮异噁唑类去甲斑蝥素衍生物的合成
黄文盈邓莉平∗王 玮
(1.绍兴文理学院 化学化工学院,浙江 绍兴312000;2.浙江苏泊尔制药有限公司,浙江 绍兴312000)
新型含色酮异噁唑类去甲斑蝥素衍生物的合成
黄文盈1邓莉平1∗王 玮2
(1.绍兴文理学院 化学化工学院,浙江 绍兴312000;2.浙江苏泊尔制药有限公司,浙江 绍兴312000)
主要介绍一种新型含色酮结构异噁唑类去甲斑蝥素衍生物的制备方法,该制备方法用1,3-偶极环加成方法在去甲斑蝥素结构中的C5和C6位引入异噁唑环,与色酮衍生物反应导入色酮结构,从而合成一系列的共5个新型的含有色酮结构的异噁唑类去甲斑蝥素衍生物.
去甲斑蝥素;色酮结构;异噁唑类
斑蝥素,化学名:外,外-2,3-二甲基-7-氧代双环[2,2,1]-庚烷-2,3-二羧酸酐,属于外式构型(exo configuration),化学结构式如下图(Scheme 1).
去甲斑蝥素,化学名:7-氧杂二环[2.2.1]-庚烷-2,3-二羧酸酐,化学结构式如下图(Scheme 2).

斑蝥素是研究恶性肿瘤药物的有效成分.国内外对此进行了多方面的研究,证实斑蝥素作用于多种肿瘤细胞,能抑制蛋白磷酸酯酶的活性,通过对细胞周期产生影响来控制肿瘤细胞的增加.研究证明其对原发性肝癌有一定疗效,能升高白细胞数量,且不影响免疫系统,有很高的药用研究价值.但斑蝥素的毒性较大[1-3],合成很复杂,近年来的研究表明,斑蝥素中少了2,3位的两个甲基,能保持较强的抗肿瘤活性和独特的升高白细胞作用,而且毒性大大降低,基本上消除了斑蝥素对泌尿系统毒刺激副作用.去甲斑蝥素(NCTD)可作用于细胞周期的不同环节,干扰细胞增殖,诱导细胞死亡.NCTD本身无致变性,器官毒性作用也较小,临床治疗剂量下对肝肾功能未见明显损害,亦未出现明显的泌尿系统刺激作用.临床研究也证实其对肝癌、白血病细胞均有杀伤作用,并且抗黏附转移.因此,与斑蝥素骨架修饰[4]有关的一项具有重大意义的合成工作是去掉2,3位甲基取代.这一结构改变简化了合成步骤并且不会影响斑蝥素抗癌活性[5],同时毒性有所降低.
这次我们在C5或C6上引入异噁唑的基础上还导入了色酮的结构,产生出了一系列新型的含色酮结构异噁唑类去甲斑蝥素衍生物.经实验研究发现,去甲斑蝥素五元环中的氧可以用氮或硫代替,一些取代基可以取代在氮和硫上.同时在C5和C6上取代还可以改变结构活性.为此我们经过研究得出以下的实验数据:

表1 取代基的活性测试数据表
核磁共振实验数据如下:
4,8-环氧-5,7-(1H,6H)-二酮-6-(4-苯基)-3a,4,4a,7a,8,8a-六氢-3-(6-溴-4H-色酮-4-酮)-[3,4-f]-1,2-苯丙异噁唑(4a)
m.p.182.4-183.3℃
1H NMR(DMSO)δ:5.255(s,1H,O-CH=),8.172~7.167(m,8H,Ar-H),3.098(s,2H,1 -H,4-H),3.504(s,1H,5-H),2.377(s,1H,6-H),2.538,2.516(d,J=8.8Hz,2H,2-H,3 -H).
4,8-环氧-5,7-(1H,6H)-二酮-6-(4-羟苯基)-3a,4,4a,7a,8,8a-六氢-3-(6-溴-4H -色酮-4-酮)-[3,4-f]-1,2-苯丙异噁唑(4b)
m.p.210.8-211.8℃
1H NMR(DMSO)δ:5.255(s,1H,O-CH=),8.178~7.184(m,7H,Ar-H),3.098(s,2H,1 -H,4-H),3.504(s,1H,5-H),2.295(s,1H,6-H),2.519,2.511(d,J=3.2Hz,2H,2-H,3 -H),8.697(s,1H,OH).
4,8-环氧-5,7-(1H,6H)-二酮-6-(4-p-甲苯基)-3a,4,4a,7a,8,8a-六氢-3-(6-溴-4H-色酮-4-酮)-[3,4-f]-1,2-苯丙异噁唑(4c)
m.p.167.9-171.0℃
1H NMR(DMSO)δ:5.243(s,1H,O-CH=),8.173~7.066(m,7H,Ar-H),3.073(s,2H,1 -H,4-H),3.528(s,1H,5-H),2.376(s,1H,6-H),2.534,2.513(d,J=8.4Hz,2H,2-H,3 -H),2.345(s,3H,-CH3).
4,8-环氧-5,7-(1H,6H)-二酮-6-(4-氯苯基)-3a,4,4a,7a,8,8a-六氢-3-(6-溴-4H -色酮-4-酮)-[3,4-f]-1,2-苯丙异噁唑(4d)
m.p.173.4-174.4℃
1H NMR(DMSO)δ:5.254(s,1H,O-CH=),8.080~7.245(m,7H,Ar-H),3.098(s,2H,1 -H,4-H),3.506(s,1H,5-H),2.380(s,1H,6-H),2.539,2.517(d,J=8.8Hz,2H,2-H,3 -H)
4,8-环氧-5,7-(1H,6H)-二酮-6-(4-溴苯肼)-3a,4,4a,7a,8,8a-六氢-3-(6-溴-4H -色酮-4-酮)-[3,4-f]-1,2-苯丙异噁唑(4e)
m.p.202.7-203.7℃
1H NMR(DMSO)δ:5.258(s,1H,O-CH=),8.079~7.182(m,7H,Ar-H),3.102(s,2H,1-H,4-H),3.564(s,1H,5-H),2.378(s,1H,6-H),2.525,2.517(d,J=3.2Hz,2H,2-H,3-H).
基于以上实验数据,我们使用色酮在异噁唑的结构上进行改造,对去甲斑蝥素进行结构改造,提高去甲斑蝥素的活性.该新型的含色酮结构异噁唑类去甲斑蝥素衍生物的制备步骤如下:
(1)去甲去氢斑蝥素的合成:取一定量的顺丁烯二酸酐于研钵中研细,倒入锥形瓶中并加入乙醚,室温条件下搅拌至溶解,滴入呋喃,室温下搅拌24~48h,呋喃与顺丁烯二酸酐发生Diels-Alder反应,制得去甲去氢斑蝥素;
(2)N-取代去甲去氢斑蝥酰亚胺的合成:将适量的去甲去氢斑蝥素溶于丙酮溶剂中,在搅拌下缓慢滴加苯胺的丙酮溶液,反应10h后加入醋酸锰、三乙胺和醋酐,在室温条件下反应8h;将干燥后的沉淀溶于二甲基甲酰胺中,冰水浴中与二环己基碳二亚胺搅拌反应10h,将滤液置于冰水中得到结晶,再重结晶得到产物;
(3)导入色酮结构:将N-取代去甲去氢斑蝥酰亚胺和色酮衍生物混合于酒精中,加入氯胺T,回流12h,进行1,3-偶极环加成反应,导入色酮结构,用甲醇再结晶,真空干燥得到化合物;
(4)去甲斑蝥素衍生物的制备方法:将步骤(1)中反应得到的沉淀减压过滤;
(5)去甲斑蝥素衍生物的制备方法:将步骤(2)中反应得到的沉淀真空干燥,冰水浴应将温度降至0℃,重结晶应用甲醇.
本实验涉及的反应如下:
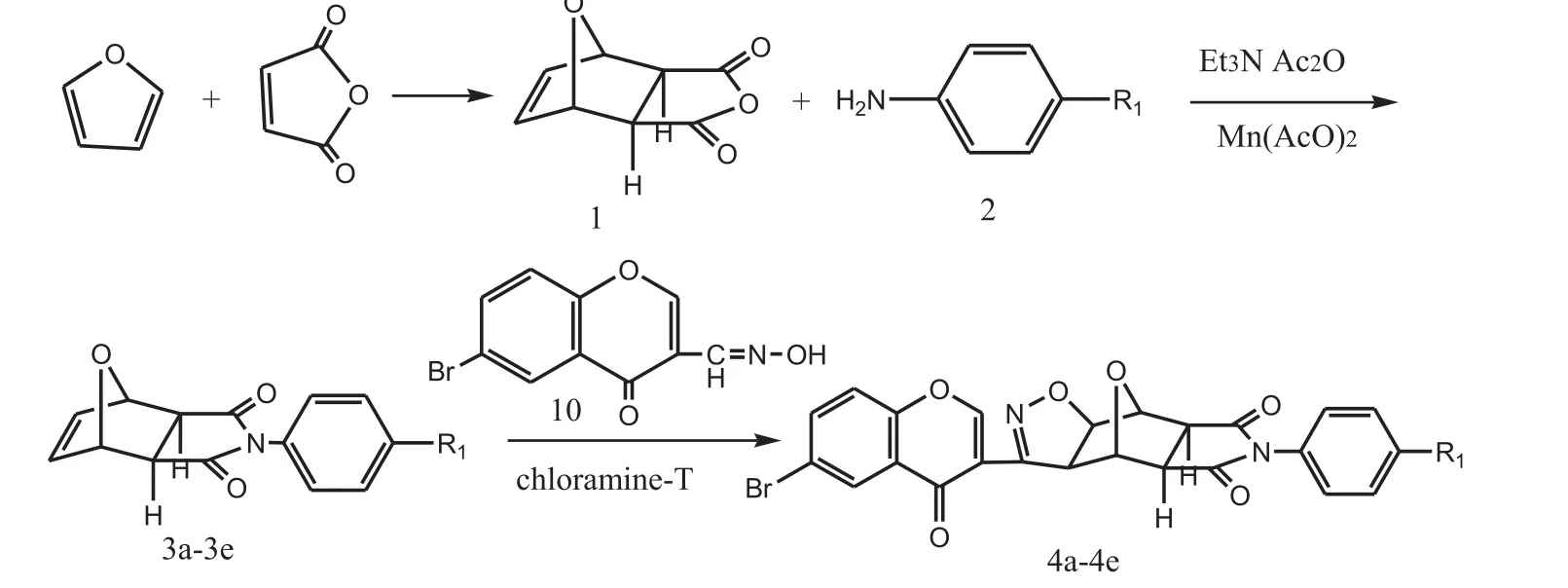
R1是氢,羟基,甲基,氯或溴;4a R1是氢;4b R1是羟基;4c R1是甲基;4d R1是氯;4e R1是溴.
通过下面具体实验案例进一步验证本实验.具体步骤如下:
实施例1:
去甲斑蝥素的合成:在100mL锥形瓶中依次加入15mL乙酯和4.00g粉末状顺丁烯二酸酐.等顺丁烯二酸酐完全溶解后,搅拌下加入2.76g呋喃.然后在室温下放置24~48h,将反应完全后得到的产物进行减压过滤得到去甲斑蝥素粗品结晶.
N-取代去甲去氢斑蝥酰亚胺的合成:取3.32g去甲斑蝥素溶解于30mL丙酮中,将丙酮溶液和化合物加入到反应锥形瓶中,逐渐有大量的沉淀生成.在室温条件下反应8h后,将减压过滤得到的沉淀真空干燥,再与20mL二甲基甲酰胺混合溶解,置于冰水浴中冷却至0℃,再加入3.09g二环己基碳二亚胺,搅拌反应10h.然后冷却,过滤,将滤液倒在50mL冰水中,析出固体.将其减压过滤,洗涤,最后用甲醇重结晶得到产物3a-3f.
导入色酮结构:将1mmol N-取代去甲斑蝥酰亚胺和1.1mmol色酮衍生物置于20mL酒精中,再加入1.2mL氯胺,回流12h.将沉淀过滤,清洗,用甲醇再结晶,真空干燥后得到4a、4b、4c、4d、4e这5个产物.
实施例2:
将化合物用DMSO溶解,稀释,肿瘤细胞Bel-7402(人肝癌细胞)、KB(口腔癌细胞)、SGC7901(胃癌细胞)[6]、HL-60(白血病细胞)在96孔板上种入4 000个孔,每孔加入化合物2μL,使其终浓度为12.0μM,6.0μM,3.0μM,1.5μM,共同置于37℃、含5%CO2细胞培养箱中培养72h,以二甲基亚砜(1%)为空白对照.72h后,加入终浓度为0.25mg/mL的3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐,置于相同条件的细胞培养箱中4 h后吸干溶剂,每孔加入100μl二甲基亚砜,用酶联免疫仪于570nm处测定吸光度(OD值),根据所得的吸光度值计算药物对细胞增殖的抑制率:
抑制率=[1-(测试样品OD值-空白OD值)/(阴性对照OD值-空白OD值)]×100.
按如下公式计算被测样品的IC50值(寇式法):
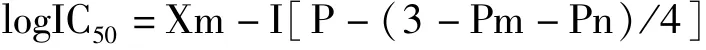
其中Xm:设计的最大浓度的对数值;I:最大剂量比相临剂量的对数值;P:阳性反应率之和;Pm:最大阳性反应率;Pn最小阳性反应率.
所得数据用于计算IC50值(4b,4c,4d的抑制率过低舍去).

表2 IC50值有效数据表
由以上结果可得,这一种新型含色酮结构异噁唑类去甲斑蝥素衍生物的制备方法简化了合成步骤并且不会影响斑蝥素抗癌活性,同时毒性有所降低[7],具有可实用性.
[1]Deng Li-Ping,Hu Yongzhou.Synthesis of novel pyrazole-linked norcantharidin derivatives of substituted aromatic amineswith efficient1,3-dipolar cycloaddition[J].JHeterocyclic Chem,2006,43:1715.
[2]Deng Li-Ping,Hu Yongzhou.1,3-dipolar cycloaddition reaction:Synthesis and configuration of norcantharidin derivatives of substituted aromatic amine[J].JHeterocyclic Chem,2007,44:597.
[3]Li-Ping Deng,Yongzhou Hu.Synthesis of Novel Norcantharidin Derivatives of Substituted Aromatic Amines with Improved 1,3‐Dipolar Cycloaddition[J].Synth Commun,2007,37(1):157.
[4]董环文,刘超美,何秋琴,等.斑蝥素及其衍生物的合成及结构修饰的研究进展[J].药学实践杂志, 2008,26(2):99-102.
[5]曾文南,卢懿.斑蝥素及其衍生物的合成与活性研究进展[J].有机化学,2006,26(5):579-591.
[6]张恒,李晓飞,陈祥盛.斑蝥素、斑蝥素酸钾及斑蝥素酸钠作用胃癌细胞的研究[J].山地农业生物学报,2011,30(1):52-55.
[7]Bertini I,Calderone V,FragaiM,etal.Structural basis of serine/threonine phosphatase inhibition by the archetypal smallmolecules cantharidin and norcantharidin[J].JMed Chem,2009,52(15):4838-4843.
Synthesis of Novel Chromone-containing Isoxazoles Norcantharidin Derivatives
Huang Wenying1Deng Liping1Wang Wei2
(1.Shaoxing University,Shaoxing,Zhejiang 312000;2.Zhejiang Supor Pharmaceutical Co.Ltd.,Shaoxing,Zhejiang 312000)
The papermainly introduces a method for preparing novel chromone-containing isoxazoles norcantharidin derivatives.By the preparation of 1,3-dipolar cycloaddition,the isoxazole ring was introduced in the C5 and C6 of norcantharidin structure,and the reaction with chromone derivatives resulted in the chromone structure,hence the final synthesis of a series of 5 chromone-containing structure model of isoxazoles norcantharidin derivatives.
norcantharidin;chromone structure;isoxazole
R 914
A
1008-293X(2015)07-0010-04
(责任编辑 鲁越青)
10.16169/j.issn.1008-293x.k.2015.07.03
2015-02-02
黄文盈(1992-),女,浙江苍南人,研究方向:医药学.
邓莉平(1978-),女,博士,副教授,研究方向:药物设计与合成,E-mail:1178947348@qq.com.

