补益中药对运动性肾缺血再灌注损伤大鼠肾脏炎症因子及ECM表达的影响
郑孟君,曹建民,郭 娴,周海涛
(1.江南大学体育学院,江苏无锡214000;2.北京体育大学运动人体科学学院,北京100084;3.北京联合大学生物化学工程学院,北京100023)
补益中药对运动性肾缺血再灌注损伤大鼠肾脏炎症因子及ECM表达的影响
郑孟君1,曹建民2,郭 娴2,周海涛3
(1.江南大学体育学院,江苏无锡214000;2.北京体育大学运动人体科学学院,北京100084;3.北京联合大学生物化学工程学院,北京100023)
观察补益中药对运动性肾缺血再灌注损伤大鼠肾脏炎症因子及ECM表达的影响。方法:75只7周龄雄性Wistar大鼠随机分为4组:安静对照组(C组,12只)、一般训练组(M组,12只)、过度训练组(OM组,24只)和补益中药+过度训练组(TM组,24只),M、OM、TM组进行8周56天的游泳训练。采用专业灌胃器每天灌胃1次,TM组灌胃采用黄芪、红景天、丹参、苦参等组成的复合中药制剂,剂量为1 g·kg-1,体积为5 mL·kg-1,其他各组灌胃等量生理盐水。末次训练后24 h,采用PAS染色观察肾小球ECM沉积情况,免疫组织化学法检测肾组织TNF-α、IL-1β、IL-6、IL-18蛋白表达,RT-PCR法检测肾组织TNF-αmRNA、IL-1βmRNA、IL-6 mRNA、IL-18 mRNA、TGF-β1 mRNA表达。结果:1)8周实验后,肾小球ECM沉积,C、M组间无显著差异(P>0.05);OM组较C、M组显著增加(P<0.01);TM组显著低于OM组(P<0.05)。2)血尿素氮和血清肌酐水平,OM组和TM组显著高于C组(P<0.01),TM组显著低于OM组(P<0.05);肾组织TNF-α、IL-1β、IL-6和IL-18蛋白表达,OM组和TM组显著高于C组(P<0.01),TM组显著低于OM组(P<0.05);肾组织TNF-αmRNA、IL-1βm RNA、IL-6 m RNA和IL-18 m RNA表达,OM、TM组显著高于C组(P<0.01),TM组显著低于OM组(P<0.05);肾组织TGF-β1mRNA表达,TM组(P<0.05)和OM组(P<0.01)显著高于C组,TM组显著低于OM组(P<0.05)。结论:8周过度训练致大鼠发生运动性肾缺血再灌注,同时ECM沉积加强。补充补益中药可通过抑制肾脏组织TNF-α、IL-1β、IL-6、IL-18的表达进而减轻了过度训练诱导肾脏缺血再灌注发生时肾脏组织TGF-β1的表达,抑制ECM的合成和(或)促进ECM的降解及组织病理学改变,延缓或避免过度训练导致的运动性缺血再灌注对肾脏的损害。
补益中药;运动性肾缺血再灌注损伤;炎症因子;细胞外基质
肾脏对缺血及缺血再灌注损伤异常敏感,运动及其恢复期肾血流量的两个时相的改变导致了运动性肾缺血再灌注损伤(exercise-related renal ischemia-reperfusion injury,ERRIRI)的整个过程[1]。近年的研究表明:在急性肾缺血再灌注损伤中TNF-α、IL-1、IL-6、IL-18这组功能密切相关的炎症细胞因子发挥着重要作用[2]。肾缺血再灌注损伤所导致的炎症因子的表达可以引起肾脏固有细胞的增殖,刺激其表达粘附分子并生成过多的细胞外基质(extracellular matrix,ECM),进而影响肾脏细胞外基质代谢平衡,并直接影响到组织细胞结构和功能的变化[3]。中医理论认为,肾藏精,精生髓,髓养骨而通于脑。肾中精气所化生之元气,具有推动人体生长发育,温煦和激发人体各脏腑、经络等组织器官活动的作用,为人体诸气的根本[4]。长期过度训练导致的运动性疲劳,先耗伤脾阳,久则及肾;脾肾同为精血生化之源,阳气之根本,脾肾耗伤,阳气受损,精血生化不足,则导致运动的原动力不足,产生诸多疲劳综合症[5]。具有多靶点、多途径作用且几乎不含违禁成分优势的中药,对过度训练导致的ERRIRI的保护作用,已为运动医学界所重视。但目前有关中药对运动训练与炎症细胞因子及肾组织细胞外基质代谢间的相互作用关系的调节功能的研究尚未见报道。故本实验选用黄芪、红景天、丹参、苦参等中药材,结合前期研究适当增减组方制成复合中药制剂,观察其对炎性细胞因子TNF-α、IL-1β、IL-6、IL-18蛋白及基因表达的影响及对肾脏ECM代谢、ECM沉积的调节作用,进而研究补益中药对过度训练导致的运动性肾缺血再灌注损伤的保护作用和机制。
1 材料与方法
1.1 动物和分组[6]
清洁级75只雄性Wistar大鼠,49 d龄,体重(196.95±11.36)g,由北京大学医学部实验动物科学部提供,动物生产合格证编号SCXK(京)2006- 0008。整个实验中,实验室温度保持在(22±2)℃,相对湿度55%~75%,光照时间随自然变化。大鼠以基础饲料(北京大学医学部实验动物科学部提供)和蒸馏水常规饲养,自由饮食。实验时间为63d,正式训练56d。动物实验于北京体育大学运动营养实验室完成。
大鼠适应性饲养4 d后,以20 min·d-1的运动量对其进行为期3d的筛选,淘汰个别不适应的游泳者,剔除不符合实验要求的大鼠,剩余大鼠以数字随机分组法分为4组:对照组(C组,12只)、一般训练组(M组,12只)、过度训练组(OM组,24只)和中药+过度训练组(TM组,24只)。采用专业灌胃器每天灌胃一次,TM组剂量为1 g·kg-1,灌胃体积为5 m L·kg-1,其他各组灌胃等量生理盐水。
1.2 实验用药
复合补益中药制剂主要成分为黄芪、红景天、丹参、苦参等,购自北京同仁堂,批号:120324154,并经天津中瑞药业有限公司高级工程师高占友鉴定。按比例称取药品50 g加水500 m L,浸泡30 min后煎30 min,过滤所得水煎液,再将过滤后的水煎液加水500 m L煎30 min,过滤所得水煎液。将两次过滤的水煎液混合,浓缩至浓度1 g(生药)·m L-1,4℃存放备用[6]。
1.3 训练及测试方案
C组常规饲养,不运动,无任何干预。M组进行正式中等强度游泳训练8周(无负重),每周6 d,每天1次,第1次下水游20 min,此后逐渐增加,至第1周末每天游60 min,第2周末加至每天游90 min,第3周末加至每天游120 min,此后5周均保持此运动量。TM组和OM组前3周训练时间安排同M组,第4周起开始安排高强度训练。第1~3周负0.5%体重,第4周负1%体重,第5周负2%体重,每天训练1次。第6周负2%体重,每天上、下午各训练1次,第7~8周,每天上午、下午、夜间各训练1次,均负5%体重[6]。大鼠进行负重游泳,每次训练至力竭。力竭标准以大鼠下沉后10 s不露出水面为准。
C、M组大鼠均正常生长,无意外死亡。TM组和OM组大鼠因尾部负重,疲劳、力竭不能恢复及训练意外死亡等原因,死亡率较高。至第8周末时,TM组24只仅剩14只,OM组24只仅剩11只。
1.4 指标测定
末次游泳训练24 h后,各组大鼠乙醚适度麻醉,颈总动脉取血,加入柠檬酸钠溶液抗凝,37℃水浴30 min后,4℃、3 000 r/min离心10 min,分离制备血清,置-20℃冰箱中保存待查。迅速取双肾,剔除筋膜,置于预冷的生理盐水中洗净血污,观察肾脏大小、色泽、质地,切取肾组织,分别用消毒铝箔包好,迅速投入液氮暂存,随后保存于-70℃冰箱冻存待测[6]。
取部分肾组织,10%甲醛固定,石蜡包埋,制成4 μm厚切片,PAS染色并进行组织病理学分析。采用Jaffe苦味酸法测定血清肌酐,采用二乙酰-肟法测定血清尿素氮,采用免疫组织化学法测定检测肾组织TNF-α、IL-1β、IL-6、IL-18蛋白表达,采用RTPCR法测定肾组织TNF-α、IL-1β、IL-6、IL-18、TGF-β1基因表达。以上试剂盒均由上海恒远生物科技有限公司提供。
1.5 PAS染色切片图像分析
PAS染色切片,在400×物镜下采用北航图像采集模块软件采集视野中同时切到尿极和血管极的肾小球(每张切片约有8~10个),随后运用北航医学病理图像分析软件描绘肾小球毛细血管拌轮廓,区分基质和细胞成分,并测量单个肾小球平均面积及其基质面积[18]。
1.6 统计学分析
采用SPSS 12.0软件对所有数据进行分析、处理,数据用平均数±标准差()表示,组间差异采用方差分析,等级计数资料采用秩和检验分析,相关关系采用Pearson相关分析。显著性水平为P<0.05,非常显著性水平为P<0.01。
2 结果
2.1 肾组织PAS染色检查结果
应用肾脏组织PAS染色切片分析肾小球ECM沉积情况。C、M组大鼠间肾小球ECM沉积无显著差异(P>0.05);OM组大鼠肾小球ECM的沉积较C、M组显著增加(P<0.01);TM组大鼠肾小球ECM的沉积显著低于过度训练组大鼠(P<0.05)(表1和图1)。

表1 各组大鼠肾小球ECM沉积比较

图1 4组肾小球ECM沉积情况(PAS,×400)
2.2 血清尿素氮和肌酐
表2显示:血清尿素氮和肌酐水平,C、M组比较无显著性差异(P>0.05)。TM、OM组显著高于C组(P<0.01);TM组显著低于OM组(P<0.05)。

表2 各组大鼠血清尿素氮和肌酐水平比较
2.3 肾组织IL-1β、IL-6、TNF-α、IL-18蛋白水平
2.3.1 IL-1β蛋白水平 表3显示:C、M组大鼠肾脏组织IL-1β水平仅轻度表达,组间无显著性差异(P>0.05)。TM、OM组与C组比较有显著性差异(P<0.01)。OM组阳性表达较强,TM组较OM组表达减轻(P<0.05)。

表3 各组肾组织IL-1β蛋白水平比较
2.3.2 IL-6蛋白水平 表4显示:C、M组大鼠肾脏组织IL-6蛋白水平仅轻度表达且无显著性差异(P>0.05)。TM、OM组和C组比较存在显著性差异(分别为P<0.01,P<0.05)。OM组阳性表达较强,TM组较之表达减轻(P<0.05)。

表4 各组肾组织IL-6蛋白水平比较
2.3.3 TNF-α蛋白水平 表5显示:C、M组大鼠肾脏组织TNF-α蛋白水平仅轻度表达且无显著性差异(P>0.05)。TM、OM组和C组比较存在显著性差异(P<0.05)。OM组阳性表达较强,TM组较之表达减轻(P<0.05)。
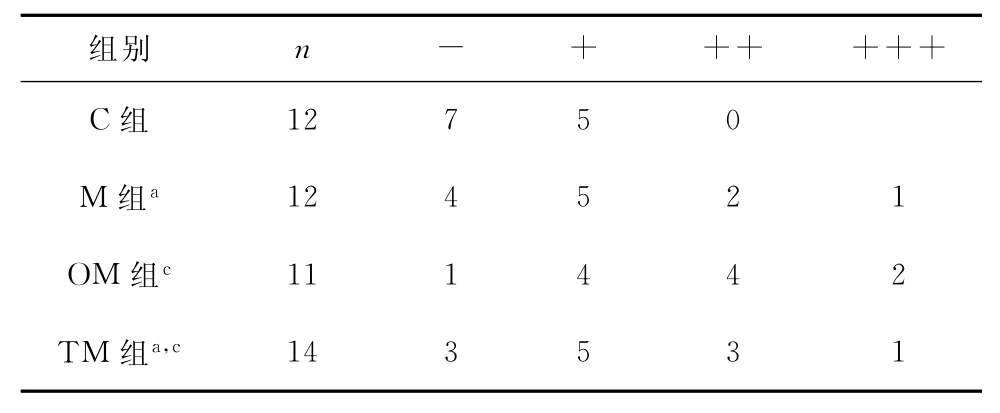
表5 各组肾组织TNF-α蛋白水平比较
2.3.4 IL-18蛋白水平 表6显示:C、M组大鼠肾脏组织IL-18蛋白水平仅轻度表达且无显著性差异(P>0.05)。TM、OM组和C组比较存在显著性差异(P<0.05)。OM组阳性表达较强,TM组较之表达减轻(P<0.05)。

表6 各组肾组织IL-18蛋白水平比较
2.4 肾组织IL-1βm RNA、IL-6 m RNA、TNF-α m RNA、IL-18 m RNA相对表达量
表7显示:C、M组间肾脏组织IL-1βm RNA、L-6 m RNA、TNF-αm RNA、IL-18 m RNA表达水平均无显著性差异(P>0.05),TM、OM组显著高于C组(P<0.01),TM组显著低于OM组(P<0.05)。
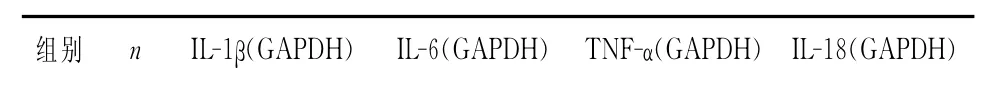
表7 各组肾脏组织IL-1βmRNA、IL-6 mRNA、TNF-αmRNA、IL-18 mRNA相对表达量比较

2.5 肾组织TGF-β1mRNA相对表达量
表8显示:C、M组间肾脏组织TGF-β1mRNA表达水平无显著性差异(P>0.05),TM、OM组显著高于C组(分别为P<0.05,P<0.01),TM组显著低于OM组(P<0.05)。
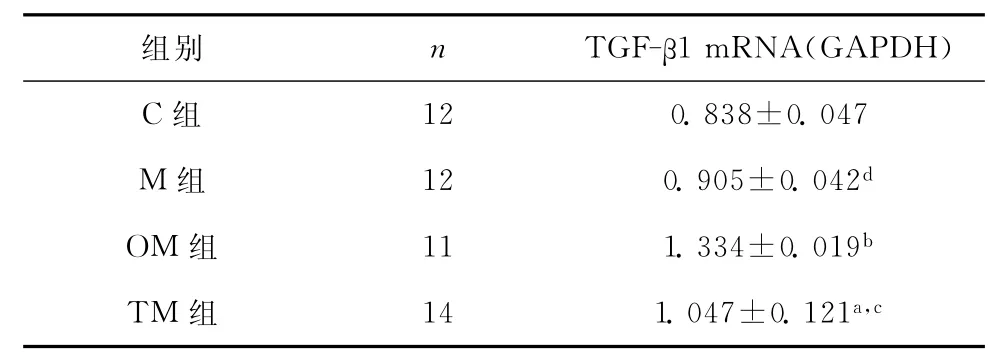
表8 各组肾脏组织TGF-β1mRNA相对表达量比较
3 讨论
ECM是广泛存在于细胞之间的一个动态网状结构,主要由胶原蛋白、弹性蛋白、蛋白多糖和糖蛋白构成。ECM除对细胞发挥支持与连接作用外,在增殖、分化等多种生理过程中也发挥着重要作用。肾脏ECM产生增多或(和)ECM降解减少,均可导致肾组织内ECM堆积[7]。ECM在肾间质的过度堆积是导致肾小管间质纤维化的直接原因[8]。ECM作为肾小球基底膜的构成成分,在保证肾小球滤过屏障完整性中发挥重要作用。同时在保护肾小管上皮细胞结构、功能及肾小管间质纤维化发展过程中也发挥着重要作用。常态下ECM的生成与降解处于动态平衡。但在某些病理状态下,ECM的质变和量变导致了细胞周围微环境的改变,可直接影响细胞的功能和器官的形态[9]。研究表明:浸润的炎症细胞可以产生大量促炎症介质和促增殖因子,如TGF-β1、PDGF、IL-1、bFGF。这些可溶性介质通过自分泌、旁分泌等多种形式介导与扩大间质的炎症反应,一方面加重上皮细胞的损伤,另一方面直接促进间质纤维细胞增殖活化,促使ECM合成增多或/和抑制ECM的降解[10]。TGF-β1主要分布在肾小管间质,是作用最强的促肾脏纤维化生长因子,可以通过诱导肾小管上皮细胞向肌成纤维细胞转分化,进而促进ECM的积聚诱导肾小管间质纤维化[11]。TGF-β1不仅可以促进ECM的合成及抑制ECM的降解,同时它还可以以自分泌及旁分泌的方式参与肾小管间质纤维化的发生与发展,是细胞肥大及ECM合成的重要介质[12],已成为目前公认的肾小管间质损害过程中的关键因子。TGF-β1可通过以下环节引起ECM的过度积聚[13-14]。1)通过明显增加ECM组成成分如Col-I、Col-III、Col-IV及FN的表达使胶原组织合成增加;2)通过刺激ECM受体的合成,使整合素的合成增加进而影响ECM的表达;3)通过减少基质金属蛋白酶(Matrix metalloproteinases,MMP)的表达以及促进纤溶酶原激活剂抑制物和影响金属蛋白酶组织抑制剂的合成来减少ECM的降解;4)通过刺激参与ECM降解的蛋白酶的抑制因子的产生,包括PAI-1及组织型金属蛋白酶抑制剂,减少ECM的降解。
已有研究表明,大负荷训练会致使大鼠发生免疫反应,激活肾脏炎症效应细胞。激活的效应细胞增殖、释放炎症介质及细胞外基质会对肾脏造成损害。炎症介质、细胞外基质又反作用于效应细胞。炎症细胞、炎症介质及细胞外基质间的“交互应答”作用,导致并加重了缺血再灌注肾脏损害的发生和不断进展,从而导致肾脏组织微细结构发生变化[15-16]。同时过度训练造成大鼠肾缺血再灌注损伤时,肾脏组织TNF-α、IL-1β、IL-6、IL-18含量与肌酐和尿素氮成正相关,可以反映运动性肾缺血再灌注损伤的严重程度[6,17-18]。本研究结果显示:8周的过度训练导致大鼠血清肌酐和尿素氮水平升高;肾脏组织的相关炎症因子的基因表达水平显著提高,继而引发蛋白表达上调。这些改变加剧了肾缺血再灌注损伤中肾脏组织的炎性反应,并使得促肾脏纤维化生长因子TGF-β1基因表达水平显著提高,ECM生成增多或降解减少,进而造成ECM代谢失衡,肾组织发生明显的病理学改变,大鼠肾脏功能受到严重损伤。而M组大鼠肾组织相关指标及ECM沉积变化不大,说明中等强度的训练方式未造成血液促炎因子的变化及病理学改变,肾脏功能良好。TM组大鼠肾组织相关炎症因子表达(P<0.05)及TGF-β1表达(P<0.05)显著低于OM组大鼠;血尿素氮和肌酐水平也较OM组显著降低(P<0.05);肾小球ECM的沉积显著低于OM组大鼠(P<0.05)。由此可认为本实验中通过补充补益中药抑制了过度训练诱导的肾脏缺血再灌注发生时肾组织相关炎症因子的过表达,进而下调肾脏组织TGF-β1表达,抑制ECM的合成和(或)促进ECM的降解及组织病理学改变,延缓了肾功能障碍的发生。其机制可能为:1)本实验选用的补益中药一方面具有良好的抗氧化性,另一方面可以通过提高组织内抗氧化酶活性,降低氧自由基水平,抑制脂质过氧化反应,改善机体氧化/抗氧化系统平衡调节能力,进而抑制由过度训练引起的氧化应激增加所引发的肾脏组织细胞大量分泌炎性细胞因子[19-24]。2)黄芪可抑制TGF-β1诱导的HK-2细胞ECM的分泌,同时通过PAI-1途径增加ECM的降解,使FN减少[25-27]。此外,黄芪还可降低ECM的主要成分Col-I、Col-III、Col-IV及FN的表达的合成,防止ECM的积聚[26,28-29]。3)红景天中的主要物质红景天苷可以抑制ECM合成。主要通过以下途径:①红景天苷可以通过下调HIF-1a及TGF-β1的表达、改善细胞缺氧状态进而抑制ECM成分的合成[30-31]。②红景天苷可以下调节大鼠肾组织PAI-1,上调MMP-2,MMP-9水平,减少ECM成分的积聚。③红景天苷可以通过抑制FN、LN的表达,抑制ECM的合成,减少EMC在肾小球中的积聚,促进肾脏病理损害的修复[32]。4)丹参通过抑制血管紧张素Ⅱ诱导的系膜细胞PAI-1表达,和通过调控因血管紧张素Ⅱ的刺激诱导的系膜细胞分泌增加的TGF-β1与增高的细胞内ROS水平而实现抑制ECM的合成,减少EMC在肾小球中的积聚,促进肾脏病理损害的修复[33]。
4 结论
补充补益中药可通过抑制肾脏组织中炎症因子的表达,进而减轻了过度训练诱导的肾脏缺血再灌注发生时肾脏组织TGF-β1的表达,抑制ECM的合成和(或)促进ECM的降解及组织病理学改变,延缓或避免过度训练导致的运动性缺血再灌注对肾脏的损害。
[1]Bergamaschi C T,Boim M A,Moura LA.Effects of long-term training on the progression of chronic renal faiture in rats[J].Med Sci Sports Exerc,1997,29(2):169-174.
[2]Vlassara H,Torreggiani M,Post J B,et al.Role of oxidants/inflammation in declining renal function in chronic kidney disease and normal aging[J].Kidney Int Suppl,2009,114:S3-11.
[3]Klahr S,Morrissey J.Progression of chronic renal disease[J].Am J Kidney Dis,2003,41(3):S3-7.
[4]程少丹,梁倩倩,施杞.中医”治未病”思想在脊柱退变性疾病防治中的应用[J].中国中医骨伤科杂志,2012,20(6):71-74.
[5]喻治达,沈丹丹.应用络病学理论抗运动性疲劳[J].辽宁中医杂志,2014,41(2):351-352.
[6]周海涛,曹建民.补益中药对运动性肾缺血再灌注损伤大鼠的保护作用[J].中国运动医学杂志,2013,32(6):518-524.
[7]Berthier C,Marti HP.Metzincins,including matrix metalloproteinases and meprin,in kidney transplantation[J].Swiss Med Wkly,2006,136(49-50):789-794.
[8]袁亮,吴永贵,郝丽,等.白芍总苷(TGP)对糖尿病大鼠肾脏保护作用及部分机制[J].中国药理学通报,2007,6(23):821-826.
[9]Orlando G,Booth C,Wang Z,et al.Discarded human kidneys as a source of ECM scaffold for kidney regeneration technologies[J].Biomaterials,2013,34(24):5915-5925.
[10]陈香美.肾小球疾病中肾小管间质损害的研究进展[J].中华肾脏病杂志,2002,18(2):146-147.
[11]Tian Y C,Phillips A O.Interaction between the transforming growth factor-Btypeòreceptor/Smad pathway and B-catenin during transforming growth factor-β1-mediated adherens junction disassembly[J].Am J Pathol,2002,160(5):1619-1628.
[12]Yokoi H,Mukoyama M,Sugawara A,et al.Role of connective tissue growth factor in fibronectin expression and tubulointerstitial fibrosis[J].Am J Physiol Renal Physiol,2002,282(5):F933-942.
[13]Nakamura J,FukuiM,Ebibara I,et al.mRNA expression of growth factors in glomeruli from diabetic rats[J].Diabetes,1993,42(3):450-456.
[14]Yokoyama H,Deckert T.Central role of TGF-beta in the pathogenesis of diabetic nephropathy and macrovascular complications:A hypothesis[J].Diabet Med,1996,13(4):313-320.
[15]佟强,曹建民,吴翱,等.过度运动对肾脏细胞外基质、金属蛋白酶及其抑制因子影响的实验研究[J].北京体育大学学报,2006,29(7):931-933.
[16]郭林.大负荷训练导致大鼠肾组织微细结构变化和分子调控机理的探讨[D].北京:北京体育大学,2005.
[17]郭爱民,曹建民,周海涛.红景天对大鼠运动性肾缺血再灌注血清和肾组织中IL-1β、TNF-α、IL-6和IL-18水平的影响[J].沈阳体育学院学报,2013,32(5):74-79.
[18]邱振宇,周盾,冯欣,等.红参附子提取物保护下肾缺血再灌注损伤大鼠细胞间粘附分子1的表达[J].中国临床康复,2006,10(39):126-127.
[19]陈雯微.黄芪在肾缺血再灌注损伤过程中保护作用观察[J].中国实用儿科杂志,2008,23(6):463-464.
[20]蔡虹静,苏庆国,徐芳,等.黄芪注射液和维生素E联合使用对大鼠肾缺血再灌注损伤的影响[J].中医杂志,2011,52(17):1496-1499.
[21]张生明.碱提红景天中的多糖及抗氧化性研究[J].安徽农业科学,2008,36(18):7741-7742.
[22]刘建和,李群,何少平,等.柴胡三参胶囊对大鼠心肌缺血再灌注损伤的影响[J].中国中医药信息杂志,2010,17(11):29-31.
[23]刁波,唐瑛,王晓昆,等.刺五加多糖对海马神经元抗氧化酶系统的影响[J].医学导报,2009,28(1):21-24.
[24]贾昌盛,孙建军,李美德,等.苦参素降低大鼠肾脏缺血-再灌注损伤[J].基础医学与临床,2012,32(8):943-947.
[25]魏佳莉,王畅,彭佑铭,等.黄芪对人肾小管上皮细胞细胞外基质分泌的影响及其机制探讨[J].中国中西医结合肾病杂志,2009,10(8):664-667.
[26]Steinberg MS,Mc Nutt PM.Cadherin and their connections:adhesion junctions havebroader functions[J].Curr Opin Cell Bio1,1999,11(5):554-560.
[27]吴朝妍,张莹雯.黄芪多糖对肾阳虚型糖尿病大鼠肾组织NF-κB、TGF-β1的影响[J].武汉大学学报(医学版),2006,27(3):381-385.
[28]Yang J,Liu Y.Dissection of key events in tubular epithelial to myofibroblast transition and its implications in renal interstitial fibrosis[J].Am J Patho1,2001,159(4):1465-1475.
[29]Zeisberg M,Hanai J,Sugimoto H,et al.BMP-7 counteracts TGF-beta1-induced epithelial-to-mesenchymal transition and reverses chronic renal injury[J].Nat Med,2003,9(7):964-968.
[30]张蕾,谢席胜,李飞燕,等.红景天苷对低氧诱导肾小管上皮细胞转分化的作用机制[J].四川大学学报,2010,41(1):43-48.
[31]苗里宁.高山红景天甙对阿霉素肾病大鼠肾小球硬化防治作用的研究[D].北京:中国人民解放军军医进修学院,2005.
[32]李彩萍,张艳,黄骁燕.圣地红景天对糖尿病大鼠尿微白蛋白排泄率及肾脏TGF-β1表达的影响[J].中国中西医结合肾病杂志,2008,9(10):871-874.
[33]袁军,鲁艳芳,陈陶后,等.丹参对血管紧张素Ⅱ诱导的肾小球系膜细胞表达TGF-β1,ROS和PAI-1的影响[J].中国中药杂志,2007,32(22):2400-2404.
责任编辑:郭长寿
Effect of Tonic Medicine on Kidney Inflammation Factors and ECM Expression in Rats of Exercise-related Renal Ischemia-reperfusion Injuries
ZHENG Mengjun1,CAO Jianmin2,GUO Xian2,ZHOU Haitao3
(1.Sports College,Jiangnan University,Wuxi 214000,Jiangsu,China;2.Sport Science College of Beijing Sport University,Beijing 100084,China;3.Biochemical Engineering College of Beijing Union University,Beijing 100023,China)
Objective:To study the protective effects of tonic medicine on kidney inflammation factors and extracellular matrix(ECM)expression in rats of exercise-related renal ischemia-reperfusion injuries.Methods:75 male Wistar rats at the age of 7 weeks were divided into 4 groups randomly:control group(C group,n=12),general training group(M group,n=12),overtraining group(OM group,n=24),tonic medicine+overtraining group(TM group,n=24),the Rats in M,OM,TM groups were assigned to 8 weeks of swimming training,7 days a week.Professional gavage were given once a day.The Rats of TM group were given with compound Chinese herbal medicine(The primary elements were Chinese drugs for invigoration,such as Astragalus,Rhodiola rosea,Salviae miltiorrhizae,Sophora flavescens),gavages(ig)dose was 1 g·kg-1;ig volume was 5 m L·kg-1,and other groups were given the normal saline.24 hours after the last training,we observed the glomerular ECM deposition by the PAS stain;detected the renal tissue of TNF-α,IL-1β,IL-6,IL-18 protein by immunohistochemistry and detected the expression of TNF-αm RNA,IL-1βm RNA,IL-6 mRNA,IL-18 m RNA,TGF-β1 m RNA gene in renal tissue by RT-PCR method.Results:1)8 weeks after the experiment,the glomerular ECM deposition of Cgroup and Mgroup appeared normal and showed no differences(P>0.05);OM group was significantly higher than that in Cgroup and Mgroup(P<0.01),TM group was significantly lower than that of group OM(P<0.05).2)OM group and TM group blood urea nitrogen and serum creatinine weresignificantly higher than that of Cgroup(P<0.01),TM group was significantly lower than that of group OM(P<0.05);the expression of renal TNF-α,IL-1β,IL-6 and IL-18 protein in OM group and TM group was significantly higher than that in Cgroup(P<0.01),TM group was significantly lower than that of group OM(P<0.05);the expression of renal TNF-αm RNA,IL-1βm RNA,IL-6 and IL-18 m RNA in TM group and OM group was significantly higher than that of Cgroup(P<0.01),TM group was lower than of OM group(P<0.05);the expression of renal TGF-β1m RNA in TM group and OM group was significantly higher than that of Cgroup(TM,P<0.05;OM,P<0.01),TM group was significantly lower than of OM group(P<0.05).Conclusion:8 weeks overtraining caused the movement of rat renal ischemia reperfusion and increased the deposition of ECM.Tonic medicine can restrain the expression of renal tissue TGF-β1 during exercise-related renal ischemia-reperfusion injury induced by overtraining,which may be achieved by inhibiting the expression of IL-1,TNF-α,IL-6,IL-18 in renal tissue.Finally it decreased the synthetic and increased the decomposition of ECM,reduced the damage and the histopathological changes,as a result,Tonic medicine can protect the rats from exercise-related renal ischemia-reperfusion injury.
tonic medicine;exercise-related renal ischemia-reperfusion injury;inflammation factors;extracellular matrix
G804.7
A
1004-0560(2015)03-0068-06
2015-03-04;
2015-03-29
国家体育总局课题(2013A101)。
郑孟君(1980—),女,讲师,硕士,主要研究方向为体育教学与运动训练。
周海涛(1976—),男,副教授,硕士,主要研究方向为运动性疲劳与恢复。
——题《圣山系-金巅》

