长链非编码RNA UCA1对胰腺癌细胞系侵袭转移的影响
张尤历,赵 义,张行行,王国英,龚爱华,倪 鑫,徐 岷*
(1.江苏大学附属医院消化内科;2.江苏大学医学院细胞生物学教研室,江苏镇江 212000)
长链非编码RNA UCA1对胰腺癌细胞系侵袭转移的影响
张尤历1,赵 义1,张行行1,王国英1,龚爱华2,倪 鑫1,徐 岷1*
(1.江苏大学附属医院消化内科;2.江苏大学医学院细胞生物学教研室,江苏镇江 212000)
目的 探讨尿路上皮癌相关1(UCA1)在胰腺癌中的表达及其对胰腺癌细胞侵袭转移的影响。方法 用荧光定量PCR检测11例胰腺癌组织和配对的癌旁组织及5种胰腺癌细胞系中UCA1的表达,通过RNA干扰技术降低胰腺癌细胞系BxPC-3的UCA1水平,用Transwell侵袭实验和划痕实验观察BxPC-3细胞的侵袭和迁移能力,Western blot检测MMP-2和MMP-9的蛋白水平。结果 胰腺癌组织的UCA1水平高于相应的癌旁组织(P<0.05),UCA1差异性表达于5种胰腺癌细胞系;干扰UCA1后,BxPC-3细胞的MMP-2和MMP-9的蛋白水平均降低(P<0.01),侵袭能力和迁移能力明显减弱(P<0.01)。结论 UCA1在胰腺癌中高表达,下调UCA1通过降低MMP-2和MMP-9的表达减弱胰腺癌细胞系BxPC-3的体外侵袭转移能力。
胰腺肿瘤;肿瘤侵袭;肿瘤转移;长链非编码RNA;尿路上皮癌相关1
胰腺癌是侵袭性极强的肿瘤,预后非常差[1]。长链非编码RNA(long non-coding RNA,lncRNA)是一种长度大于200个核苷酸的RNA分子,由于缺乏开放的阅读框,lncRNA并不编码蛋白质,而是以RNA的形式在表观遗传学、转录水平和转录后3个层面调控基因表达[2]。近年来,研究表明lncRNA在肿瘤的发生发展和转移中发挥重要作用[3]。H19[4]和 MALAT-1[5]可影响胰腺癌细胞的增殖、凋亡、侵袭和迁移等多种生物学过程。
尿路上皮癌相关1(urothelial carcinoma-associated 1,UCA1)是在膀胱癌中筛选并克隆出的一种膀胱癌特异性 lncRNA,全长1 439 bp,位于染色体19p13.12[6]。研究发现 UCA1可促进舌鳞状细胞癌[7]和黑色素瘤[8]的生长和转移。然而,UCA1 在胰腺癌中的表达情况及其作用尚不清楚。本研究探讨UCA1对胰腺癌细胞侵袭转移能力的影响,为临床研发新的诊断胰腺癌的试剂盒和针对胰腺癌的靶向治疗提供理论依据。
1 材料与方法
1.1 材料
1.1.1 组织样本和细胞系:胰腺癌组织和配对的癌旁组织样本由上海长海医院提供;胰腺癌细胞系SW1990、耐吉西他滨 SW1990(SW1990/Gem)、PANC-1、Patu8988和BxPC-3由江苏大学医学院基础医学实验室冻存。用含10%胎牛血清和1%青霉素/链霉素的DMEM培养基于37℃、含5%CO2的恒温培养箱培养细胞。
1.1.2 实验试剂:DMEM高糖培养基、胎牛血清(Hyclone公司);Opti-MEM培养基(Gibco公司);Trizol(Invitrogen公司);反转录试剂盒和荧光定量试剂盒(TaKaRa公司);siRNA(上海吉玛制药技术有限公司);BD BioCoatTMMatrigelTMInvasion Chamber(BD公司);MMP-2、MMP-9和β-actin单克隆抗体(Abcam公司);引物由上海生工生物工程有限公司合成。
1.2 提取总RNA、反转录和real-time PCR
收集对数增殖期的细胞,预冷PBS清洗3次,按照Trizol试剂说明书提取细胞总RNA,紫外分光光度仪检测其纯度及浓度,-80℃保存。按照反转录试剂盒说明书将RNA反转录成cDNA,然后以cDNA为模板扩增U6和UCA1,U6作为内参。Realtime PCR的反应体系为25 μL,反应条件:95℃预变性30 s,95 ℃变性5 s,60 ℃退火30 s,72 ℃延伸30 s,共40个循环。分析熔解曲线以确定扩增产物为单一目的片段,查看基因的扩增情况,并导出相应的域值循环Ct值。采用2-ΔΔCt计算基因的相对表达量(RQ 值),计算公式为 RQ=2-ΔΔCt,ΔCt=Ct目的-Ct内参,ΔΔCt=ΔCt实验- ΔCt对照。
1.3 转染siRNA
转染前1d将BxPC-3接种到6孔板,使细胞在24 h内汇合度达到30% ~50%,按照LipofectamineTM2000的说明书操作,将 siRNA和 LipofectamineTM2000分别加入250 μL Opti-MEM培养基中,室温静置5 min后将两者混合,轻柔混匀,静置20 min后将500 μL siRNA/LipofectamineTM2000复合物逐滴加到6孔板,培养箱中孵育48~72 h后进行转染后的其他实验。siRNA序列为:UCA1-siRNA1正义5'-GAGCCGAUCAGACAAACAATT-3',反 义 5'-UUG UUUGUCUGAUCGGCUCTT-3';UCA1-siRNA2正义5'-GGGCUUGGGACAUUUCACUTT-3',反义 5'-AGU GAAAUGUCCCAAGCCCTT-3';UCA1-siRNA3正义5'-GGGAAUACUAUUCGUAUGATT-3',反义 5'-UCA UACGAAUAGUAUUCCCTT-3';阴性对照正义5'-U UCUCCGAACGUGUCACGUTT-3',反义 5'-ACGUGAC ACGUUCGGAGAATT-3'。
1.4 细胞迁移和侵袭实验
当转染了Ctrl siRNA和UCA1 siRNA的BxPC-3细胞的汇合度达到80% ~90%时,用200 μL枪头划痕,枪头要垂直划过,尽量保证各个划痕宽度一致,用PBS轻轻清洗细胞3次,洗去划痕产生的细胞碎片,用无血清培养基培养细胞,于0、24及36 h在倒置显微镜拍照,观察划痕愈合情况。
转染48 h后,消化并离心收集BxPC-3细胞,用无血清DMEM清洗细胞3次,然后用无血清DMEM重悬细胞,调整细胞浓度为1×106/mL,在小室下层加入含10%胎牛血清的DMEM,上层则加入200 μL细胞悬液,培养箱中孵育48 h后取出小室,用干棉签轻轻擦去小室上层未穿过Matrigel胶的细胞,再用PBS湿润的棉签擦拭2次,小室浸入4%多聚甲醛室温固定30~60 min后,将小室侵入0.1%结晶紫中染色30~60 min,用PBS清洗小室数次,室温中风干。在200倍的显微镜下随机计数5个视野的细胞数,所有实验重复3次。
1.5 Western blot
转染后48~72 h收集细胞,预冷PBS清洗3次,加入适量RIPA/PMSF裂解液,冰上裂解30 min后,4℃、14 000×g离心15 min,吸取上清液,BCA法测蛋白浓度,蛋白样品调至等浓度后经10%聚丙烯酰胺凝胶电泳分离后电转移至PVDF膜上,5%脱脂奶粉室温摇床上封闭2 h,一抗(MMP-2抗体1∶1 000稀释、MMP-9 抗体 1∶1 000 稀释、β-actin 抗体1∶1 000稀释)4℃孵育过夜,TBST洗膜3次,每次10 min;HRP标记的二抗(1∶5 000稀释)37℃温箱中孵育1 h,TBST洗膜3次,每次10 min;ECL化学发光显影,凝胶成像系统分析处理。
1.6 统计学分析
采用SPSS 17.0软件进行统计学分析,实验数据采用均数±标准差(±s)表示。两样本均数比较采用t检验。
2 结果
2.1 UCA1在胰腺癌组织和细胞系中的表达
qRT-PCR结果显示63.6%(7/11)的胰腺癌组织的UCA1水平高于癌旁组织(P<0.05)(图1A);UCA1差异性表达于5种胰腺癌细胞系,其中Patu8988表达相对最低,而BxPC-3中UCA1的表达水平相对最高(图1B)。
2.2 siRNA下调UCA1的表达
3种 siRNA均可下调 UCA1的表达,其中UCA1-siRNA2的作用更明显(P<0.001),故选用UCA1-siRNA2做下游实验(图2)。
2.3 干扰UCA1抑制BxPC-3细胞的迁移
划痕36 h后,对照组siRNA组细胞的划痕已基本消失,而转染UCA1 siRNA的细胞的划痕仍清晰可见(图3)。
2.4 干扰UCA1抑制BxPC-3细胞的侵袭
转染UCA1 siRNA后,BxPC-3细胞穿过Matrigel胶的细胞数(9.80±1.92)显著低于对照组(36.40±7.50)(P<0.001)(图4)。
2.5 干扰UCA1下调BxPC-3细胞MMP-2和MMP-9的蛋白水平
UCA1 siRNA组的MMP-2和MMP-9的蛋白表达量明显低于对照组(P<0.01)(图5)。

图1 UCA1在胰腺癌组织和5种胰腺癌细胞系中的表达Fig 1 The expression level of UCA1 in pancreatic cancer tissues and 5 pancreatic cancer cell lines(±s,n=3)

图2 siRNA干扰UCA1的表达Fig 2 Effect of UCA1-siRNA on the UCA1 level in BxPC-3

图3 下调UCA1对BxPC-3迁移能力的影响Fig 3 Down-regulation of UCA1 influenced the migration of transfected BxPC-3
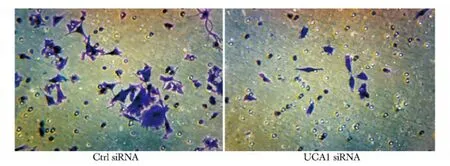
图4 下调UCA1对BxPC-3侵袭活性的影响Fig 4 Down-regulation of UCA1 influenced the invasion of transfected BxPC-3(×200)

图5 Western blot检测转染后BxPC-3的MMP-2和MMP-9的表达Fig 5 The protein levels of MMP-2 and MMP-9 of transfected BxPC-3 was tested by Western blot
3 讨论
胰腺癌是恶性程度最高的肿瘤之一,尽管胰腺癌仅占所有癌症患者的2.8%,但却是第4位最常见的致死性肿瘤,5年生存率<6%[9]。大多数患者诊断时已发生远处转移,而转移是胰腺癌治疗的最大难题。因此,探讨胰腺癌的转移机制成为当前的研究热点。
近年来,非编码RNA在基因调控中的作用引起了研究者的注意,其中microRNA在肿瘤发生发展中的作用已得到广泛的研究并取得一定的成果[10]。lncRNA作为非编码RNA的新角色,可影响胚胎发育、细胞分化和细胞代谢等多种生物学过程。随着基因芯片技术和生物信息学技术的快速发展,逐渐有研究表明一些lncRNA如HOTAIR、MALAT-1和H19等在肿瘤的发生、发展和转移中发挥重要作用。UCA1是近几年新发现的一种膀胱癌特异性lncRNA,在整个胚胎发育阶段,UCA1差异性表达于各种器官,而出生后,除了心脏、脾脏和胎盘组织,大多数正常组织不表达UCA1,但在一些肿瘤尤其是膀胱癌中,UCA1的水平又增高,UCA1的这种时间性和空间性表达提示其可能作为一种癌胚基因在胚胎发育和肿瘤的发生发展中扮演重要角色[11]。已有研究指出UCA1能增加舌鳞状细胞癌[7]和黑色素瘤[8]的转移潜能。然而,UCA1在胰腺癌中的表达情况及其可能的作用尚不清楚。
本研究旨在探索UCA1在胰腺癌中的表达水平及其潜在的作用。通过荧光定量PCR检测胰腺癌组织和胰腺癌细胞系的UCA1水平,结果发现UCA1高表达于胰腺癌组织并差异性表达于胰腺癌细胞系,鉴于UCA1对多种肿瘤的恶性行为的影响,本研究采用siRNA下调BxPC-3细胞的UCA1表达,Transwell侵袭实验和划痕实验结果指出干扰UCA1的表达明显减弱胰腺癌细胞的体外侵袭和迁移能力。基质金属蛋白酶(matrix metalloproteinases,MMPs)通过降解细胞外基质和促进血管形成,在肿瘤的侵袭转移中起重要作用,其中MMP-2和MMP-9可促进胰腺癌转移[12]。因此,本研究想探讨UCA1是否通过调节MMP-2和MMP-9影响胰腺癌的转移过程。Western blot结果显示,干扰UCA1后,BxPC-3细胞的MMP-2和MMP-9的表达量均降低。结果提示胰腺癌中高水平的UCA1可能通过上调MMP-2和MMP-9的表达促进胰腺癌的转移。
本研究仅初步探讨UCA1在胰腺癌转移中的潜在作用,由于肿瘤的转移机制非常复杂,仍需大量的研究来阐明UCA1是如何调控胰腺癌转移相关的基因,这将为胰腺癌的基因治疗提供新的靶点。
[1]孙宇,孙宁,杨绍时,等.肿瘤干细胞作为胰腺癌治疗潜在靶点的研究进展[J].基础医学与临床,2014,34:1006-1009.
[2]Li X,Wu Z,Fu X,et al.lncRNAs:insights into their function and mechanics in underlying disorders[J].Mutat Res Rev Mutat Res,2014,762:1-21.
[3]Tano K,Akimitsu N.Long non-coding RNAs in cancer progression[J].Front Genet,2012,3:219.DOI:10.3389/fgene.2012.00219.
[4]Ma C,Nong K,Zhu H,et al.H19 promotes pancreatic cancer metastasis by derepressing let-7's suppression on its target HMGA2-mediated EMT [J].Tumour Biol,2014,35:9163-9169.
[5]Jiao F,Hu H,Yuan C,et al.Elevated expression level of long noncoding RNA MALAT-1 facilitates cell growth,migration and invasion in pancreatic cancer[J].Oncol Rep,2014,32:2485-2492.
[6]Wang XS,Zhang Z,Wang HC,et al.Rapid identification of UCA1 as a very sensitive and specific unique marker for human bladder carcinoma[J].Clin Cancer Res,2006,12:4851-4858.
[7]Fang Z,Wu L,Wang L,et al.Increased expression of the long non-coding RNA UCA1 in tongue squamous cell carcinomas:a possible correlation with cancer metastasis[J].Oral Surg Oral Med Oral Pathol Oral Radiol,2014,117:89-95.
[8]Tian Y,Zhang X,Hao Y,et al.Potential roles of abnormally expressed long noncoding RNA UCA1 and Malat-1 in metastasis of melanoma[J].Melanoma Res,2014,24:335-341.
[9]Siegel R,Ma J,Zou Z,et al.Cancer statistics,2014[J].CA Cancer J Clin,2014,64:9-29.
[10]周珏宇,石嵘,郑文岭,等.microRNA与肿瘤细胞周期的关系及其研究方法进展[J].基础医学与临床,2013,33:9-14.
[11]Wang F,Li X,Xie X,et al.UCA1,a non-protein-coding RNA up-regulated in bladder carcinoma and embryo,influencing cell growth and promoting invasion[J].FEBS Lett,2008,582:1919-1927.
[12]Verma S,Kesh K,Ganguly N,et al.Matrix metalloproteinases and gastrointestinal cancers:Impacts of dietary antioxidants [J]. WorldJBiolChem,2014,5:355-376.
Effect of long non-coding RNA UCA1 on invasion and metastasis of pancreatic cancer cell lines
ZHANG You-li1,ZHAO Yi1,ZHANG Xing-xing1,WANG Guo-ying1,GONG Ai-hua2,NI Xin1,XU Min1*
(1.Dept.of Gastroenterology,the Affiliated Hospital of Jiangsu University;2.Dept.of Cell Biology Medical College of Jiangsu University,Zhenjiang 212000,China)
ObjectiveTo explore the expression of urothelial carcinoma-associated 1(UCA1)in pancreatic cancer cell lines and its influence on the invasion and metastasis of the pancreatic cancer cells.MethodsThe expression of UCA1 in pancreatic cancer tissues and paired adjacent normal tissues(11 cases)and 5 pancreatic cancer cell lines was analyzed by real-time PCR.The level of UCA1 in BxPC-3 was knocked down by small interfering RNA.The ability of invasion and migrationin vitroof transfected BxPC-3 was detected by Transwell invasion assay and wound healing assay.The protein levels of MMP-2 and MMP-9 were measured by Western blot experiment.ResultsThe expression level of UCA1 in pancreatic cancer tissues was higher than that in paired adjacent normal tissues,and UCA1 differentially expressed in 5 pancreatic cancer cell lines.Down-regulation of UCA1 by siRNA suppressed the expression of MMP-2 and MMP-9 in BxPC3,and dramatically impaired the ability of invasion and migration of BxPC-3.ConclusionsUCA1 is over-expressed in pancreatic cancer,and down-regulation of UCA1 attenuates the capacity of invasion and metastasisin vitroof BxPC-3 by decreasing MMP-2 and MMP-9.
pancreatic neoplasm;neoplasm invasion;neoplasm metastasis;long non-coding RNA;urothelial carcinomaassociated 1
2015-02-03
2015-04-24
江苏省卫生厅科研项目(H201434);镇江市科技支撑计划(SH2014024)*< class="emphasis_bold">通信作者(corresponding author):
(corresponding author):peterxu1974@163.com
R576
A
10.16352/j.issn.1001-6325.2015.09.015
1001-6325(2015)09-1223-05

