赖氨大黄酸减轻百草枯中毒小鼠心脏损伤
李开济,郝晓方,章广玲,魏 洁,林雅军,魏静波,甄永占*
(1.华北理工大学基础医学院河北省慢性疾病重点实验室唐山市慢性病临床基础研究重点实验室,河北唐山 063000;
2.卫生部北京医院/北京老年医学研究所,北京 100730)
赖氨大黄酸减轻百草枯中毒小鼠心脏损伤
李开济1,郝晓方1,章广玲1,魏 洁2,林雅军2,魏静波1,甄永占1*
(1.华北理工大学基础医学院河北省慢性疾病重点实验室唐山市慢性病临床基础研究重点实验室,河北唐山 063000;
2.卫生部北京医院/北京老年医学研究所,北京 100730)
目的 观察赖氨大黄酸(RHL)对百草枯中毒小鼠心脏损伤的保护作用及其机制。方法 小鼠随机分为对照组、百草枯模型组(腹腔注射百草枯建立活性氧自由基引起心脏损伤的小鼠模型)及RHL治疗组(造模前1周给予RHL(50 mg/kg)。用硫代巴比妥酸法检测心脏组织MDA含量,用联苯三酚自氧化法检测SOD活性,用NADPH偶联法检测GSH-Px活性。HE染色及DCFH-DA染色分别观察心脏病理改变及活性氧水平;Western blot检测心肌衰老相关基因的表达。结果 与对照组相比,百草枯模型组小鼠心脏组织SOD和GSH-Px活性下降(P<0.05),MDA水平升高(P<0.05),RHL能减轻百草枯的作用(P<0.05);百草枯引起心肌结构破坏,心肌组织活性氧水平升高,RHL减轻上述变化(P<0.05)。百草枯能够降低SIRT1的表达,增加P53的乙酰化及P53和P66的表达。RHL减轻上述变化(P<0.05)。结论 RHL可以减轻百草枯中毒后所致的小鼠心脏损伤。
赖氨大黄酸;百草枯;心脏损伤;活性氧自由基
*通信作者(corresponding author):yongzhanzhen@126.com
百草枯(paraquat,PQ)是一种世界广泛使用的除草剂,其化学名称1,1'-二甲基-4,4'-联吡啶,属有机杂环类化合物,可经皮肤、呼吸道及消化道吸收进入人体,产生活性氧自由基,导致心脏、肺、肝、肾和神经系统等全身多器官功能衰竭[1-2]。其心脏损伤主要表现为炎性细胞浸润、水肿、细胞核溶解、胞质内空泡形成和心肌细胞坏死等;也观察到线粒体的损害、肌丝的溶解和断裂以及线粒体空泡化等超微结构的改变,但其机制尚不明确[3-4]。目前对于百草枯中毒的治疗主要是支持性的,迄今尚无特异性解毒剂和有效的治疗。
赖氨大黄酸(Rhein lysinate,RHL)是中国医学科学院医药生物技术研究所肿瘤室对大黄酸进行结构改造获得的水溶性好的化合物[5],体外研究表明其低剂量(10 μmol/L)可保护H2O2诱导的脐静脉血管内皮细胞损伤[6]。卫生部北京老年医学研究所曾发现RHL能够延长快速老化小鼠(SAMP10)的寿命,其作用也与清除活性氧自由基有关。但其是否对百草枯中毒引起的心脏损伤具有保护作用尚未见报道[7]。本研究采用百草枯建立活性氧自由基引起心脏损伤模型,观察赖氨大黄酸对心脏的保护作用及其机制。
1 材料与方法
1.1 材料
实验动物、主要试剂:SPF级雄性C57小鼠30只,6~8周龄,体质量24~28 g[中国医学科学院动物所,动物合格证号SCXK(京)2013-0020]。赖氨大黄酸(rhein lysinate,RHL)由本室合成,分子式:C21H22N2O8,相对分子质量:430,纯度98%;百草枯和DCFH-DA活性氧检测试剂盒(Sigma公司);超氧化物歧化酶(SOD)测定试剂盒、谷胱甘肽过氧化物酶(GSH-Px)和丙二醛(MDA)测定试剂盒(南京建成生物工程研究所)和HE(hematoxylin and eosin)染色试剂盒(北京经科宏达生物技术有限公司)。acetyl-P53(lys382)抗体(Upstate公司)SIRT1、P53、P66 和 P21抗体(Cell Signaling公司);化学发光增强剂、GADPH、抗兔二抗和抗小鼠二抗(Santa Cruz公司)。
1.2 方法
1.2.1 动物分组及处理:将小鼠随机分为对照组、百草枯模型组(腹腔注射百草枯10 mg/kg,每周1次)、RHL治疗组,每组10只。RHL治疗组在造模前1周给予RHL(50 mg/kg)灌胃,对照组和百草枯模型组给予等体积蒸馏水灌胃。百草枯模型组和RHL治疗组腹腔注射百草枯(10 mg/kg),每周1次,正常对照组腹腔注射等体积0.9%氯化钠溶液,每周1次,持续2周。标本采集,造模2周后,用10%水合氯醛麻醉小鼠,右心房采血,4℃、3 000 r/min离心15 min,收集血清进行MDA含量、SOD和GSHPx活性检测。收集心脏,将一部分组织制作石蜡切片;剩余心脏组织置于液氮中,冻透后转入-80℃冰箱中备用。通过Western blot检测衰老相关蛋白表达水平变化。
1.2.2 HE染色观察心脏病理变化:心脏在4℃ 预冷的0.9%氯化钠溶液中反复清洗,置于10% 中性甲醛溶液中固定,经石蜡包埋,切片,HE染色后,显微镜下观察并拍照。
1.2.3 心脏组织MDA含量与SOD和GSH-Px活性测定:MDA含量采用硫代巴比妥酸法,SOD活力采用联苯三酚自氧化法,GSH-Px活性采用NADPH偶联法,严格按照试剂盒说明书操作。
1.2.4 心脏组织活性氧水平检测:取心脏在4℃ 预冷的0.9%氯化钠溶液中反复清洗,然后置于OCT中包埋,放入液氮冷却,-80℃冻存,冰机切片后,按照DCFH-DA活性氧检测试剂盒说明书进行染色,在荧光显微镜下观察红色活性氧荧光强度,并照相。
1.2.5 Western blot分析:冻存的心脏组织加入新鲜配制的组织裂解液(mmol/L):137 NaCl,20 Tris,pH 7.4,10 PMSF,1 Na3VO4,10 NaF,2.5 μg/mL抑肽酶,2.5 μg/mL leupetin,1%NP40,20%磷酸酶抑制剂复合物),4℃下匀浆,冰上裂解15 min,4℃、12 000 r/min离心20 min,取上清液,BCA法测蛋白浓度。等量蛋白(40 μg)于10%SDS-PAGE凝胶电泳分离后,电转至聚偏二氟乙烯(PVDF)膜,5%脱脂牛奶37℃封闭1 h,分别加入抗SIRT1、acetyl-P53、P53、P66(1∶1 000)及 GADPH(1∶2 000)抗体,4℃孵育过夜。洗涤10 min×4次,用含辣根过氧化物酶(HRP)标记的相应二抗(1∶5 000)孵育1 h,洗膜15 min×4次,膜上滴加化学发光增强剂,按照试剂说明进行操作,结果在凝胶成像仪上照相并使用Bio-Rad公司Quantity One分析软件测量条带吸光度值,目的条带与GADPH条带吸光度值的比值即为该目的蛋白的相对表达量。
1.3 统计学分析
采用SPSS 13.0软件进行统计学分析,结果以均数±标准差(±s)表示,组间比较采用单因素方差分析。
2 结果
2.1 小鼠一般情况和心脏重量
与对照组比较,百草枯模型组小鼠活动及进食量均减少。RHL治疗组小鼠活动量和进食量较正常对照组虽略有下降,与百草枯模型组相比活动量和进食量均增多,但无差异。对照组、百草枯模型组和RHL治疗组体质量分别为(28.0±1.8)g、(25.0±2.8)g(百草枯模型组与对照组相比P<0.05)和(26.0±2.7)g百草枯模型组。正常对照组、百草枯模型组和RHL治疗组心脏重量分别为(0.21±0.04)g、(0.24±0.05)g和(0.22±0.05)g。
2.2 RHL对百草枯诱导的氧化损伤模型小鼠心脏组织MDA含量与SOD和GSH-Px活性的影响
与正常对照组相比,百草枯诱导的氧化损伤模型小鼠心脏SOD和GSH-Px活性显著降低(P<0.05),MDA含量明显升高(P<0.05)。RHL显著缓解上述变化(表1)。
表1 RHL对百草枯诱导的氧化损伤模型小鼠心脏MDA、SOD和GSH-Px的影响Table 1 The effect of RHL on MDA content,SOD and GSH-Px activities in the cardiac tissue in oxidative damage mice model induced by paraquat(±s,n=10)

表1 RHL对百草枯诱导的氧化损伤模型小鼠心脏MDA、SOD和GSH-Px的影响Table 1 The effect of RHL on MDA content,SOD and GSH-Px activities in the cardiac tissue in oxidative damage mice model induced by paraquat(±s,n=10)
*P<0.05 compared with control group;#P<0.05 compared with model group.
group MDA(nmol/mgprot)SOD(U/mgprot)GSH-Px(U/mL)control 2.1±0.2 246±21 978±62 model 3.0±0.2* 167±17* 494±35*RHL(50 mg/kg) 2.1±0.3# 226±22# 705±41*#
2.3 RHL对百草枯模型小鼠心脏组织病理改变的影响
与对照组相比,百草枯模型小鼠心肌组织可见明显水肿,心肌细胞边界不清,细胞核增大,染色变浅,异染色质沿核膜分布,部分细胞核溶解,细胞质染色变浅,且不均匀。RHL改善心肌组织上述病理变化。各组心肌组织炎性细胞浸润都不明显,组织结构均未见明显破坏(图1)。
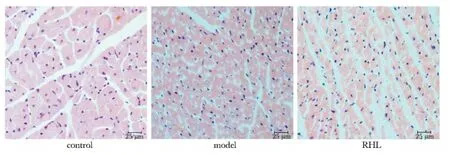
图1 RHL对百草枯氧化损伤模型小鼠心脏组织病理变化的影响Fig 1 The effect of RHL on the change of pathological profile in the cardiac tissue in oxidative damage mice model induced by paraquat(×200)

图2 RHL对百草枯氧化损伤模型小鼠心肌组织活性氧水平的影响Fig 2 The effect of RHL on ROS level in the cardiac tissue in oxidative damage mice model induced by paraquat(×200)
2.4 RHL对百草枯模型小鼠心脏组织活性氧水平的影响
百草枯氧化损伤模型小鼠心肌组织活性氧水平为(2 074±280),显著高于对照组(3.67±3.09)(P<0.05)。RHL显著回调活性氧表达水平至(10.51±2.8)(P<0.05)(图2)。
2.5 RHL对百草枯氧化损伤模型小鼠心脏衰老相关基因表达的影响
与对照组相比,百草枯模型组小鼠心脏组织SIRT1表达水平降低 (P<0.05),P53乙酰化水平升高(P<0.05),P53和P66表达水平升高 (P<0.05)。与模型组相比,RHL使小鼠心脏组织SIRT1表达水平升高 (P<0.05),P53乙酰化水平降低(P<0.05),P53和P66表达水平也降低(P<0.05)(图3,表2)。

图3 RHL对百草枯氧化损伤模型小鼠心肌组织衰老相关基因表达的影响Fig 3 The effect of RHL on the expression of the aging-related gene in the cardiac tissue in oxidative damage mice model induced by paraquat
表2 RHL对百草枯诱导的氧化损伤模型小鼠心脏组织衰老相关基因表达的影响Table 2 The effect of RHL on the expression of the aging-related gene in the cardiac tissue in oxidative damage mice model induced by paraquat(±s,n=10)

表2 RHL对百草枯诱导的氧化损伤模型小鼠心脏组织衰老相关基因表达的影响Table 2 The effect of RHL on the expression of the aging-related gene in the cardiac tissue in oxidative damage mice model induced by paraquat(±s,n=10)
*P<0.05 compared with control group;#P<0.05 compared with model group.
group Sir2 P66 acetyl-P53 P53 control 100±8 100±5 100±11 100±9 model 60±6* 120±7* 116±13* 127±11*RHL 94±12# 88±9*# 94±12# 110±8#
3 讨论
百草枯是一种非选择性除草剂,由于除草效果好和价廉,在农业国家有广大的市场,但由于其代谢产物和氧化还原作用产生的活性氧(ROS)对人和动物的危害极大,目前尚无特效解毒剂,致死率可高达60% ~70%[8],甚至更高。百草枯进入人体后,造成心脏、肺、肝、肾和中枢神经等多器官功能不全,其中心脏毒性是中毒死亡的重要原因之一。百草枯可导致心肌损伤,严重者可出现休克症状,烦渴、多饮,血压下降和脉率加快细弱。高剂量百草枯中毒动物心肌损伤,心肌肌钙蛋白I(cTnI)水平与中毒程度有高度相关性[9]。百草枯中毒患者血清肌酸激酶(CK-MB)水平升高,早期观察能评价中毒程度及指导预后[10]。
前期研究发现低剂量RHL能够清除活性氧自由基,保护脐静脉内皮细胞免受 H2O2的损害[7],RHL能否清除动物体内产生的活性氧尚未见报道。本研究采用百草枯诱导动物体内氧自由基生成模型,发现百草枯降低小鼠体质量及血清 SOD和GSH-Px活性,升高 MDA含量;RHL能升高血清SOD和GSH-Px活性,降低MDA含量。提示RHL能够清除百草枯诱发的体内活性氧自由基生成。百草枯模型组心肌组织活性氧水平显著升高,RHL显著降低活性氧水平。RHL能够逆转百草枯对心肌组织的损伤。
衰老在活性氧自由基诱导心脏损伤中发挥着重要作用,长寿基因SIRT1高表达能够保护百草枯引起的心脏损伤[11]。在高糖诱导的内皮细胞损伤模型中发现SIRT1能够抑制P66c的表达[12]。百草枯模型小鼠SIRT1表达水平降低,P66表达水平显著升高。RHL升高SIRT1表达水平,显著降低P66表达。P53是受SIRT1调控的下游基因[6],它作用于P66启动子上的P53反应元件上调P66的表达水平[13-14]。百草枯模型组小鼠P53乙酰化水平、P53及P66表达水平也显著升高,与百草枯氧化损伤模型组相比,RHL显著下调P53乙酰化水平及P53和P66表达水平。说明SIRT1/P53/P66信号通路在百草枯诱导心脏组织衰老和RHL保护心肌免受氧化损伤中起着重要作用。
总之,RHL能清除活性氧,降低活性氧自由基对心肌组织的损伤。它有望成为治疗百草枯中毒的候选药物。
[1]Cristovao AC,Choi DH,Baltazar G,et al.The role of NADPH oxidase 1-derived reactive oxygen species in paraquat-mediated dopaminergic cell death[J].Antioxid Redox Signal,2009,11:2105-2118.
[2]赵波,菅向东,张忠臣,等.百草枯染毒大鼠组织中毒物含量与脏器损伤的关系[J].中华劳动卫生职业病杂志,2010,28:220-223.
[3]Ge W,Zhang Y,Han X,et al.Cardiac-specific overexpression of catalase attenuates paraquat-induced myocardial geometric and contractile alteration:role of ER stress[J].Free Radic Biol Med,2010,49:2068-2077.
[4]胡业佳,张骞,姜海明.百草枯中毒对大鼠心脏损伤的观察与研究[J].中国病理生理杂志,2012,11:2078.
[5]林雅军,甄永占,魏洁,等.赖氨大黄酸盐的合成工艺及活性研究[J].中国现代应用药学,2010,27:1010-1012.
[6]Lin YJ,Zhen YZ,Wei J,et al.Effects of Rhein lysinate on H2O2-induced cellular senescence of human umbilical vascular endothelial cells[J].Acta Pharmacol Sin,2011,32:1246-1252.
[7]Hu G,Liu J,Zhen YZ,et al.Rhein lysinate increases the median survival time of SAMP10 mice:protective role in the kidney[J].Acta Pharmacol Sin,2013,34:515-521.
[8]Seok SJ,Gil HW,Jeong DS,et al.Paraquat intoxication in subjects who attempt suicide:why they chose paraquat[J].Korean J Intern Med,2009,24:247-251.
[9]张玲,菅向东,金立元,等.百草枯中毒后大鼠血清心肌肌钙蛋白I的检测及分析[J].宁夏医学杂志,2007,29:99-100.
[10]何斌,何庆,胡海.急性百草枯中毒患者血清肌酸激酶MB 与预后的关系[J].西部医学,2007,19:224-225.
[11]Alcendor RR,Gao S,Zhai P,et al.Sirt1 regulates aging and resistance to oxidative stress in the heart[J].Circ Res,2007,100:1512-1521.
[12]Zhou S,Chen HZ,Wan YZ,et al.Repression of P66Shc expression by SIRT1 contributes to the prevention of hyperglycemia-induced endothelial dysfunction [J].Circ Res,2011,109:639-648.
[13]Kim CS,Jung SB,Naqvi A,et al.P53 impairs endothelium-dependent vasomotor function through transcriptional upregulation of P66shc [J].Circ Res,2008,103:1441-1450.
[14]徐蓉,胡刚,林雅军,等.重组人P66Shc/腺病毒表达载体的构建与表达[J].医学分子生物学杂志,2012,9:320-325.
Rhein lysinate attenuated paraquat-induced cardiac injury in mice
LI Kai-ji1,HAO Xiao-fang1,ZHANG Guang-ling1,WEI Jie2,LIN Ya-jun2,WEI Jing-bo1,ZHEN Yong-zhan1*
(1.Hebei Key Laboratory for Chronic Diseases,Tangshan Key Laboratory for Preclinical and Basic Research on Chronic Diseases,School of Basic Medical Sciences,North China University of Science and Technology,Tangshan 063000;
2.Beijing Hospital& Beijing Institute of Geriatrics,Ministry of Health,Beijing 100730,China)
ObjectiveTo investigate the protective effects of rhein lysinate(RHL)on cardiac tissue damage induced by paraquat in experimental mice,and to clarify its mechanism.MethodsIn this study mice were assigned to the following three groups:control,paraquat model,and RHL-treated groups.The model of oxidative damage mice was established by intraperitoneal injection of paraquat.RHL-treated group was given RHL(50 mg/kg)by gavage for one week before performing model.The other two groups were given equal volume of distilled water.For making model,paraquat was intraperitoneally injected in the paraquat model and RHL-treated group.The content of MDA was detected by thiobarbituric acid assay.The activities of SOD and GSH-Px were detected by biphenyl three phenolic autoxidation assay and NADPH coupling method respectivly.The pathological profile of cardiac tissue was observed by hematoxylin and eosin(HE)staining and reactive oxygen species was observed by DCFH-DA staining.The change of proteins related to myocardial damage detected by Western blot.ResultsCompared with control group,the activities of SOD and GSH-Px decreased(P<0.05)and the content of MDA increased(P<0.05)in paraquat model group.However,these changes were attenuated byr RHL treatmen(P<0.05).The pathological examination indicated the structure of cardiac tissue was damaged and reactive oxygen species of cardiac tissue was increased after paraquat was given,however,these changes were attenuated after RHL treatmen.It was shown in western blot analysis that compared with control group,the expression of SIRT1 decreased,the acetylation of P53 and the expression of P53 and P66 increased in paraquat-treated group.These changes were attenuated by RHL treatmen(P<0.05).ConclusionsRHL may attenuate paraquat-induced cardiac injury in mice.
rhein lysinate;paraquat;cardiac injury;reactive oxygen species
R543
A
10.16352/j.issn.1001-6325.2015.09.005
1001-6325(2015)09-1171-05
2015-01-20
2015-04-24
国家自然科学基金(81001439);河北联合大学大学生创新性实验计划(X2014078)

