超低温冻藏牛奶中牛基因组DNA的提取方法
刘永峰,库 婷,高俊岭,杨兴斌
(陕西师范大学食品工程与营养科学学院,陕西西安710119)
超低温冻藏牛奶中牛基因组DNA的提取方法
刘永峰,库 婷,高俊岭,杨兴斌
(陕西师范大学食品工程与营养科学学院,陕西西安710119)
采用不同的解冻方法以及牛奶体细胞分离与SDS苯酚法相结合的手段,分离提取-80℃冻藏牛奶中牛基因组DNA,利用超微量核酸分析仪和琼脂糖凝胶电泳法分别对DNA浓度、纯度及分子量大小进行检测,采用PCR技术扩增牛特异性基因序列片段进行DNA质量鉴定。结果表明,“两步法”解冻提取的牛基因组DNA的质量优于“一步法”和“三步法”,且该方法所提取的DNA浓度为(52.46±2.40)μg/mL,DNA纯度为1.85±0.80,条带较清晰;PCR扩增证实这些DNA可以成功扩增出729bp的牛特异性基因序列片段。本研究成功优化了牛奶中DNA的分离提取方法,筛选出了冻藏牛奶的适宜解冻方法,建立了一种新的超低温冻藏牛奶中牛基因组DNA提取方法。
牛奶;解冻方法;DNA提取;PCR
随着分子生物技术的日益发展,该技术也逐渐被牛奶质量检测及安全的深入研究所采用。Schennink等[1]研究发现荷斯坦奶牛的牛奶中脂肪酸不饱和度指数的变化,可以通过特异基因选择来提高牛奶不饱和脂肪酸的含量。Wang等[2]开展了以色列荷斯坦牛的牛奶品质研究,发现牛奶的乳蛋白率与基因调控有显著关系,研究结果为改善牛奶质量性状提供了参考依据。1999年,Lipkin等[3]首次提出将牛奶作为获取DNA的来源,建立了一种从牛奶中提取DNA的方法。田雨[4]在此基础上优化了从牛奶中分离DNA的方法,将体细胞分离技术与高温裂解技术相结合提取DNA,但是结果与理想状态存在一定差距。本实验室前期也开展了新鲜牛奶中牛基因组DNA提取方面的研究,成功提取了基因组DNA[5]。牛奶中牛基因组DNA的提取可以避免从血液、组织中提取DNA对奶牛正常生理状态造成影响这一问题,也可为从分子水平上研究奶牛生产性能及牛奶品质提供新型、便捷的方法。但是,目前这些研究均以新鲜牛奶作为DNA提取材料,尚无从冻藏牛奶中提取DNA方面的研究。因此,本研究将以冻藏在-80℃的牛奶作为DNA提取材料,筛选合适的解冻方法,优化牛奶中牛基因组DNA的提取方法,为深入研究牛奶品质、判断牛奶是否掺假提供了良好的DNA来源。
1 材料与方法
1.1 试验材料
-80℃超低温冷冻冰箱保存的牛奶样品,保藏2年,采自于西安综合开发总公司畜牧分公司奶牛场的12头奶牛。
1.2 试剂与仪器
1.2.1 主要试剂
(1)磷酸缓冲液(PBS):NaCl 8g,KCl 0.2g,Na2HPO41.44g,KH2PO40.24g,溶于800mL双蒸水中,调pH至7.4,定容至1 000mL,使用时高压灭菌。
(2)OP乳化剂:90%Triton-X100 20mL,95%乙醇125mL,0.9g/L NaCl 855mL。
(3)1mol/L Tris-Cl(pH 8.0):Tris 121.1g,溶于800mL双蒸水中,调pH至8.0,定容至1 000mL。
(4)0.5mol/L EDTA(pH 8.0):EDTA 186.1g,调pH至8.0,定容至1 000mL,高压灭菌。
(5)DNA提取缓冲液:NaCl 2.925g,1mol/L Tris-HCl 25mL,0.5mol/L EDTA 5mL,调pH至7.5~8.0,双蒸水定容至500mL。
(6)20%SDS裂解液:SDS 20g,溶于80mL双蒸水,调pH至7.2,定容至100mL,4℃保存备用。
(7)TE缓冲液:1mol/L Tris-Cl(pH 8.0)4 mL,0.5mol/L EDTA 0.4mL,定容至200mL。
(8)氯仿∶异戊醇=24∶1。
(9)苯酚∶氯仿∶异戊醇=25∶24∶1。
(10)50×TAE贮液:Tris Base 121g,冰乙酸28.55mL,0.5mol/L EDTA(pH 8.0)50mL,pH调至8.0~8.4,定容至500mL,常温储存。电泳时稀释50倍,即工作浓度1×TAE。
1.2.2 主要仪器设备 超高速低温离心机(3k30,美国Sigma公司);低速大容量离心机(DL-4C,上海安亭科学仪器厂);高速离心机(TGL-16G,上海安亭科学仪器厂);精密微量移液枪(德国Eppendorf);电泳仪(DYY-4C,北京市六一仪器厂);全自动凝胶成像分析仪(JS-680B,上海培清科技有限公司);梯度PCR仪(BLO-RAD);超微量核酸分析仪(Na-200,杭州艾普仪器设备有限公司)。
1.3 试验方法
1.3.1 奶样的解冻处理方法 对奶样解冻时间进行预试验,摸索奶样直接解冻和分温度梯度解冻需要的时间。根据解冻指标筛选结果,取出冻藏于-80℃的9个奶样,分成三组,三组用不同的解冻方法进行解冻。第一组(A11、A12和A13)是用常温下自来水冲洗解冻的3个奶样,即一步法;第二组(A21、A22和A23)是将3个奶样于4℃处理290 min后常温自来水冲洗解冻4min,即两步法;第三组(A31、A32和A33)是将3个奶样先在-20℃缓存120min,再于4℃处理190min后,常温自来水冲洗解冻3min,即三步法。
以上三种方法,用常温自来水冲洗解冻终止的标准是固态奶样经轻轻摇动离心管可以变形的状态。
1.3.2 DNA提取方法
(1)牛奶体细胞分离与富集
将解冻的奶样于超高速低温离心机中在7 500 r/min,4℃下离心30min。用小勺刮去离心管上层的乳脂,用吸管将中间层的乳蛋白去掉,留下最底部的一层的沉淀。向离心管底部加入600μL PBS,将底部沉淀捶打悬浮并转移至1.5mL的离心管中,12 000r/min常温离心10min,弃去上层液体,保留底部沉淀。再向底部沉淀加乳化剂60μL、PBS 540 μL,用振荡器振荡至沉淀完全悬浮,40℃恒温水浴处理10min脱去体细胞周围的乳脂,12 000r/min常温离心10min,弃上清,加PBS 500μL悬浮沉淀,于12 000r/min低温离心10min使体细胞沉淀富集,弃上清。
(2)牛奶体细胞消化
向体细胞沉淀中加入350μL的DNA提取缓冲液,50μL的SDS,10μL的蛋白酶K,在56℃下水浴消化过夜。
(3)SDS苯酚法提取DNA
为了准确高效地提取DNA,本研究采用SDS苯酚法提取DNA。
首先,向消化产物中加等体积的Tris饱和酚溶液,来回颠倒10min,12 000r/min低温离心10 min,得到上清液;将上清液转移到另一个1.5mL离心管中,加入等体积的酚、氯仿和异戊醇的混合物,酚、氯仿和异戊醇按体积比为25∶24∶1配制,来回颠倒10min,使沉淀溶解,12 000r/min离心10min,得到上清液;再将上清液转移到另一个1.5 mL离心管中,加入等体积氯仿和异戊醇混合物,氯仿和异戊醇按体积比为24∶1配制,来回颠倒10 min,使沉淀溶解,12 000r/min离心10min,得到上清液。
(4)核酸沉淀
将上清液转移到另一个1.5mL的离心管,加入2倍体积的冰无水乙醇(-20℃)沉淀,轻轻振摇,-20℃,静置30min,12 000r/min离心10 min,弃去上层乙醇。底部沉淀用70%冰乙醇(-20℃)洗涤,12 000r/min,低温离心10min,小心去除上层乙醇,快速挥发乙醇,加入25μL的TE溶解DNA,-4℃保存备用。
1.3.3 琼脂糖凝胶电泳检测方法 基因组DNA采用1%琼脂糖凝胶电泳[6]。取DNA提取液3 μL,6×DNA Loading Buffer溶液1μL,混合后上样。100V稳定电压下电泳30min,凝胶成像系统记录结果。
1.3.4 DNA浓度、纯度的检测方法 利用超微量核酸分析仪测定DNA浓度和纯度(OD260/280)值,取2μL DNA样品直接测得DNA浓度和纯度值。
1.3.5 PCR扩增 根据NCBI中牛B2M(NM_007308)基因序列,经Primer 5软件分析设计了一对扩增编码区的引物,上游引物:5'GGC TTT CCC AGC ATC ACT AAC 3',下游引物:5'TCA CAG CAC CAC CAA ACT TAT CT 3',扩增729bp的片段。
用于扩增编码区片段的10μL PCR反应体系:牛基因组DNA 1μL,2×Taq Master Buffer(5 mmol/L Mg2+)3.3μL,NTP(各2.5mmol/L)1 μL,上游引物(10pmol/μL)0.3μL,下游引物(10 pmol/μL)0.3μL,Taq DNA聚合酶(5U/μL)0.1 μL,ddH2O补至10μL。
PCR循环:94℃5min预变性;(94℃30s,60℃30s,72℃30s)×30cycles;72℃10min。PCR扩增产物经1%琼脂糖凝胶电泳检测。
2 结果与分析
2.1 不同解冻方法奶样中DNA浓度和纯度的检测结果
以不同解冻方法从冻藏牛奶中提取的牛基因组DNA浓度和纯度的检测结果见表1。通过统计学分析得知,不同奶样以同种解冻方法处理得到的DNA浓度和纯度差异均不显著(P>0.05),但是不同解冻方法间DNA浓度和纯度差异显著(P<0.05),说明奶样的解冻方法对DNA浓度和纯度的影响较大。“一步法”解冻处理得到DNA平均浓度为462.50μg/mL,“两步法”为52.46μg/mL,“三步法”为27.67μg/mL;“一步法”解冻处理得到DNA平均纯度为1.32,“两步法”为1.85,“三步法”为1.81。据报道,DNA纯品的纯度高于1.9说明可能含有RNA,而低于1.6说明可能含有蛋白质、酚类等污染[7]。另外,不同方法的解冻过程中,由于肽类分子会有不同程度的降解,蛋白质变性程度也不同,去污剂和有机溶剂酚、氯仿等的作用会使OD260//280比值发生不同程度的改变[8-9]。因此,“一步法”得到的DNA浓度较高,这很大程度上是由于纯度低造成的,“一步法”解冻的奶样在相对较高的温度下放置时间较长,核酸与蛋白质及其他成分结合越紧密。在DNA提取过程中,DNA很难彻底与其分离,进而造成DNA浓度异常偏高[10]。因此,综合DNA的浓度和纯度来看,“两步法”为提取分离牛奶中牛基因组DNA的最优方法。
2.2 不同解冻方法提取DNA的琼脂糖凝胶电泳检测结果
凝胶电泳结果如图1。三种解冻方法提取的DNA分子量均符合真核动物的DNA大小,且条带整齐单一。“一步法”得到的DNA片段较亮,但是降解严重,拖尾现象很明显;“两步法”得到的DNA片段亮,略有拖尾及弥散现象;“三步法”得到的DNA片段较暗,也略有拖尾及弥散现象。综合比较三种方法,两步法提取分离获得的牛DNA质量最好。
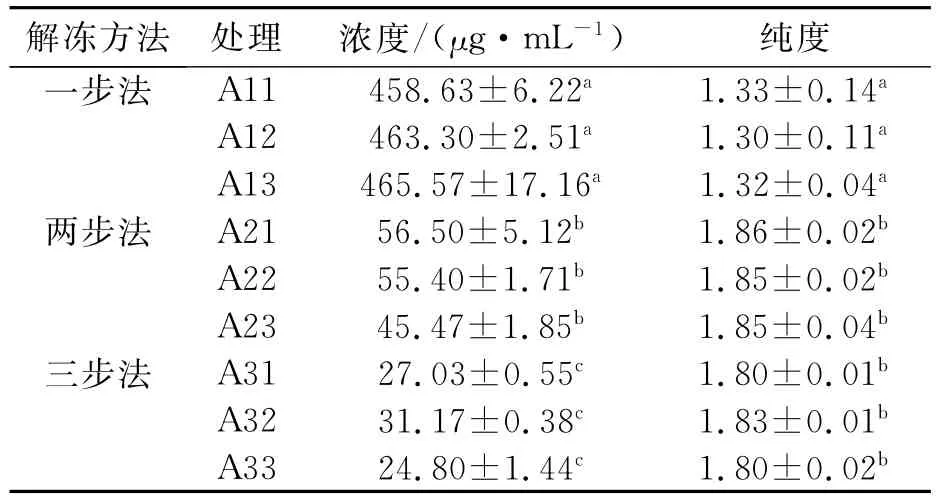
表1 三种解冻方法对不同奶样DNA浓度和纯度的影响结果Tab.1 Effect results of three thawing ways on DNA concentration and purity of milk samples
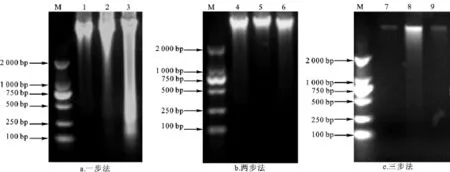
图1 提取的DNA凝胶电泳检测结果Fig.1 The detection results of DNA agarose gel electrophoresis
2.3 不同解冻方法提取DNA的PCR扩增检测结果

图2 DNA的PCR扩增产物电泳检测结果Fig.2 The identified results of PCR amplifying products with DNA gel electrophoresis
为了进一步验证三种解冻方法所提取DNA是否为牛的基因组DNA,本研究参照其他物种的验证方法[11-13],进行了特异性引物的PCR扩增,结果见图2。结果显示等量的DNA模板,不同解冻方法PCR扩增的特异性目的条带均比较单一,且与729bp的特异性引物扩增片段目的大小基本一致。说明本研究从冷藏牛奶中提取的DNA均为牛基因组DNA。从PCR产物条带的亮度来看,三种解冻方法中,以“两步法”所提取的DNA作为模块,扩增得到目的序列条带最亮,效果最好。
3 讨论
在DNA提取过程中,DNA质量会受到诸多因素影响,原料保存时间和温度是常见的两个重要因素[14],一般采用控制温度的办法。解冻是将冻结品融解后而复原其生鲜状态,然而冻结品放置在自然条件下也会复原,所以解冻这道工序往往就被忽视。有研究结果发现,温度剧烈变化可引起细胞化学结构不同程度的改变,能量代谢紊乱,DNA链的完整性遭到破坏等[15]。然而,高质量的DNA有许多要求,如保持DNA分子完整性、高分子量、无明显降解现象、高纯度,以及高获取效率等[16-17]。因此,要获得高质量的DNA,样品从低温保存、解冻到DNA提取的整个过程,都应同等重视。
对于选择-80℃超低温冻藏牛奶提取牛基因组DNA的原因。牛奶中由于乳糖及盐类的含量变化较小,因此冰点也很稳定,平均冰点为-0.54℃[18],这就为牛奶保存温度的控制奠定了基础。吴晓黎[14]等对全血保存条件的研究表明,在-80℃较长时间储存DNA提取材料可以确保能获得高质量的DNA。因此,我们将牛奶在-80℃进行速冻为了能以最快的速度通过牛奶的最大冰晶区,避免出现牛奶细胞内冰晶的形成而破坏细胞的结构,以保证冻藏奶样中较高质量的DNA[18-19]。
对于长时间超低温冻藏的牛奶仍可以保证其DNA的质量良好。可能有以下3个方面的原因:(1)低温能使细胞内核酸酶的活性降低,酶解反应基本被抑制,有利于保持DNA的完整性和得率;(2)牛奶中的水分占到87%~89%,是牛奶的主要组成成分,而水是各种生化反应完成必需的介质,奶样经冷冻结冰后,这种介质消失,也就阻碍了奶样中的各种生化反应,对保持DNA分子的质量也起到了一定的作用;(3)在-80℃超低温条件下,微生物活动受到影响,这在很大程度上抑制了微生物反应,有利于保持DNA质量良好。
综合考虑所获DNA的浓度、纯度、DNA凝胶电泳结果和PCR扩增产物电泳结果,确定“两步法”为最优处理方法。“一步法”解冻的DNA浓度值高于“两步法”和“三步法”所测的值,这可能是因温度骤变,牛奶体细胞结构发生变化,在DNA提取时细胞裂解的更彻底,使各种细胞器游离在裂解液中,特别是含有核酸成分的线粒体,这样,在某种程度上也就增加了DNA浓度偏高的机率。但是,“一步法”得到的DNA纯度是最低的,这可能是由于细胞其他内容物在相对较高温度下与核酸成分作用时间较长,从而增加了除杂的难度,使得DNA纯度偏低。“三步法”得到DNA的纯度虽然很高,但是浓度太低,这可能是因奶样由-80℃放到-20℃,再到4℃,温度反复波动,使牛奶的品质进一步劣变,间接影响了DNA的质量。无论是温度的骤变还是温度的反复波动,都会加速核酸的分解,使DNA提取质量降低。而“两步法”既避免了温度的骤变,又减少了温度波动的频率,所以可以在保证浓度较高的情况下,纯度也可以保持相对较高;同时,PCR扩增结果也证实了“两步法”提取出的DNA扩增效果更好。除解冻温度对DNA质量有影响外,解冻时间也是一个重要的因素,然而解冻时间又受到解冻温度的限制。本研究筛选出的最佳解冻方法是在保证温度较低的基础上,选择较短的解冻时间,结果得到的DNA质量较理想。因此,从超低温冻藏牛奶中提取牛基因组DNA过程中,应该平衡解冻温度与时间之间的相互制约关系,提高DNA质量。
4 结论
从超低温冻藏牛奶中提取牛基因组DNA的前处理过程中,解冻方法会影响牛奶中牛基因组DNA的质量。经过检测DNA浓度、纯度,观察DNA琼脂糖凝胶电泳结果和牛特异性基因PCR结果,筛选出了较为理想的解冻方法,即“两步法”,优化了超低温冻藏牛奶中牛基因组DNA提取方法,为在基因水平解析牛奶质量的研究工作奠定了良好基础。
[1]Schennink A,Heck J M,Bovenhuis H,et al.Milk fatty acid unsaturation:Genetic parameters and effects of stearoyl-CoA desaturase(SCD1)and acyl CoA:Diacylglycerol acyltransferase 1(DGAT1)[J].Journal of Dairy Science,2008,91(5):2135-2143.
[2]Wang X,Peagaricano F,Tal-Stein R,et al.Short communication:Association of an OLR1polymorphism with milk production traits in the Israeli Holstein population[J].Journal of Dairy Science,2012,95(3):1565-1567.
[3]Lipkin E,Shalow A,Khatib H,et al.Milk as a source of deoxyribonucleic-acid and as a substrate for the polymerase chain reaction[J].Journal of Dairy Science,1993,76(7):2025-2032.
[4]田雨.从牛奶中分离DNA方法的建立[J].乳业科学与技术,2006(3):112-113.
[5]Liu Y F,Gao J L,Yang Y F,et al.Novel extraction method of genomic DNA suitable for long-fragment amplification from small amounts of milk[J].Journal of Dairy Science,2014,97(11):6804-6809.
[6]贡成亮,曲春香.生物化学与分子生物学实验指南[M].苏州:苏州大学出版社,2010:12-14.
[7]罗焜,马培,姚辉,等.中药DNA条形码鉴定中的DNA提取方法研究[J].世界科学技术:中医药现代化,2012,14(2):1433-1439.
[8]龚琳,欧徽龙,王德祥,等.海绵动物保存及DNA提取方法的研究[J].海洋科学,2013,37(9):37-42.
[9]Taylor J I,Hurst C D,Davies M J,et al.Application of magnetite and silica-magnetite composites to the isola-tion of genomic DNA[J].Journal of Chromatography A,2000,890:159-166.
[10]祁小廷,柴小清,刘靖,等.改造地高辛标记DNA和检测试剂盒用于凝胶阻滞实验的新方法[J].遗传,2006,28(6):721-725.
[11]刘保忠,宋林生,相建海.海湾扇贝不同保存条件下DNA的提取及RAPD扩增比较[J].海洋科学,2001,25(3):51-53.
[12]张海琪,薛良义,李明云,等.不同保存方法的大黄鱼肌肉样品基因组DNA提取及RAPD分析[J].台湾海峡,2002,21(3):296-300.
[13]方旅平,林元烧,曹文清.不同保存条件下中华水蚤基因组DNA提取的比较[J].海洋科学,2005,29(2):1-4.
[14]吴晓黎,何燕,陈菁,等.存放全血温度及时间对提取DNA质量的影响[J].贵阳医学院学报,2000,25(3):232-234.
[15]宋恩亮,吴乃科,万发春,等.肉牛冷冻精液人工授精技术操作规程[J].山东畜牧兽医,2002(2):14.
[16]Sambrook J,Frietch E F,Maniatis T.Molecular cloning:a laboratory manual[M].2nd ed.New York:Cold Spring Harbor Laboratory Press,1989:463-468.
[17]王敏强,曹俊辉,刘晓玲.3种禽血抗凝剂效果及其对DNA提取质量的影响[J].安徽农业科学,2006,34(23):6124-6125.
[18]汪东风.食品化学[M].北京:化工工业出版社,2007.
[19]张国治,温纪平.速冻食品的品质控制[M].北京:化工工业出版社,2007.
〔责任编辑 宋轶文〕
Study on cattle genomic DNA extraction from milk preserved at ultra-low temperature
LIU Yongfeng,KU Ting,GAO Junling,YANG Xingbin
(School of Food Engineering and Nutritional Science,Shaanxi Normal University,Xi'an 710119,Shaanxi,China)
Three thawing methods,milk somatic cell separation technique and SDS phenol method were used to separate and extract bovine genomic DNA from milk samples preserved at-80℃. The concentration and purity of the extracted DNA were measured by the ultra low volume spectrometer,and molecular weight of DNA was obtained by agarose gel electrophoresis.The DNA quality was further identified by PCR to amplify specific bovine gene fragment.The results showed that DNA obtained from the two-step thawing method was better in quality than that from the one-step thawing method and three-step thawing method.The concentration and purity of the DNA from the two-step method were(52.46±2.40)μg/mL and 1.85±0.80,respectively.The specific bovine gene fragment(729bp)could be successfully amplified,and the strip on gel image was clear.This study established a novel bovine genomic DNA extraction method from milk preserved at ultra-low temperature,by optimizing method for thawing frozen milk.
milk;thawing method;DNA extraction;PCR
Q523
:A
1672-4291(2015)06-0094-06
10.15983/j.cnki.jsnu.2015.06.164
2015-03-19
陕西省青年科技新星项目(2014KJXX-51);陕西省农业科技攻关项目(2014K01-19-02);中央高校基本科研业务费专项资金(GK201502008);中国博士后科学基金(2015M570811)
刘永峰,男,副教授,主要从事畜产品科学与营养研究。E-mail:yongfeng200@126.com

