解纤维素固氮芽孢杆菌与伴生菌的鉴定及其相互关系
熊 平,陶树兴,梁 健,冯晓磊,郭 贤,许真珍,唐 娜
(陕西师范大学生命科学学院,陕西西安710119)
解纤维素固氮芽孢杆菌与伴生菌的鉴定及其相互关系
熊 平,陶树兴*,梁 健,冯晓磊,郭 贤,许真珍,唐 娜
(陕西师范大学生命科学学院,陕西西安710119)
通过提高加热温度和增加稀释度分别获得解纤维素固氮芽孢杆菌与伴生菌的纯培养,依据形态特征、生理生化特性和16SrDNA序列分析对两种菌进行鉴定;将两种菌分别培养及二者按不同比例接种进行混合培养,测定活菌数量、纤维素酶活性和固氮量,探讨两种菌的相互关系。结果表明:解纤维素固氮芽孢杆菌AX32为栗树类芽孢杆菌(Paenibacillus castaneae),伴生菌AX322为根癌土壤农杆菌(Agrobacterium tumefaciens);混合培养与单独培养相比,两种菌活菌数量降低,种间关系为竞争,但混合培养时纤维素酶活性和固氮量提高。
解纤维素固氮芽孢杆菌;伴生菌;菌种鉴定;相互关系
过量使用化肥对土壤环境和农作物品质的负面效应已引起普遍关注;使用有机肥和微生物制剂来提高土壤肥力,实现土壤的可持续利用,已成为人们的共识[1]。目前,中国平原地区谷物收获已广泛采用机械化,在收获的同时将秸秆粉碎还田不仅可以增加土壤有机质含量也可以防止焚烧秸秆对环境的污染。分解纤维素的固氮芽孢杆菌能利用纤维素作为碳源和能源进行固氮和生长,更能适应秸秆还田的土壤环境,与目前生产中使用的圆褐固氮菌(A-zotobacter chroococcum)相比,有芽孢的微生物制剂产品保存期更长[2-4]。本实验室从不同地区不同作物的根际土壤分离到多株能利用纤维素的固氮芽孢杆菌,其中有些菌株在盆栽试验中显示与化肥对照效果相当[4]。在筛选分解纤维素的固氮芽孢杆菌过程中,发现常有伴生菌生长,不容易得到纯培养。王毓庆和罗国威曾对分离圆褐固氮菌出现的伴生菌小菌落进行了研究[5],但解纤维素固氮芽孢杆菌与伴生菌的鉴定和相互关系还未见报道。在排除操作过程中的污染后,经摇瓶培养和菌落计数,发现伴生菌小菌落数量远多于固氮菌数量。经不同温度处理试验,发现解纤维素固氮芽孢杆菌耐热性高于伴生菌。提高加热温度获得了解纤维素固氮芽孢杆菌的纯培养,通过增加稀释度获得了伴生菌的纯培养。本文报道解纤维素固氮芽孢杆菌AX32与伴生菌AX322的鉴定结果及两个物种的相互关系。
1 材料和方法
1.1 培养基
微晶纤维素无氮培养基(g/L):微晶纤维素(经湿磨)10,硫酸镁0.4,磷酸氢二钾0.4,氯化钠0.4,硫酸锰0.02,硫酸钙0.4,硫酸亚铁0.02,碳酸钙5,1%钼酸钠溶液1mL/L,1%硼酸溶液1mL/L,pH值为7.2~7.4,121℃高压蒸汽灭菌30min。固体培养基加琼脂20g/L;纤维素刚果红无氮平板培养基,在纤维素无氮固体培养基中加入刚果红0.2 g/L。
1.2 土壤样品
从陕西长安、三原、户县、铜川、勉县、南郑、洛川、延安,山西晋城、大同、交城,山东烟台,湖北武汉等地,采集小麦、玉米、果树、蔬菜等根际土壤样品24份,用灭菌牛皮纸袋包装,带回后立即进行分离。
1.3 主要试剂和仪器
微晶纤维素购于国药集团化学试剂有限公司,使用前置于有玻璃珠的三角瓶中,加无菌水,于168 r/min振荡48h进行湿磨。刚果红购于上海实验试剂有限公司。
SPX-250B-D型恒温培养箱:上海博迅实业有限公司医疗设备厂;BS-IEA国华振荡培养箱、HH-8B型数显恒温水浴锅:常州国华电器公司;TGL-16G型高速台式离心机:上海安亭科学仪器厂;TU-1810型紫外分光光度计:北京普析通用仪器有限责任公司;FOSS-Kjeltec 2300全自动凯氏定氮仪:瑞典产品(上海瑞玢国际贸易有限公司)。
1.4 解纤维素固氮芽孢杆菌与伴生菌的分离
将土壤悬液于加有玻璃珠的三角瓶中振荡30 min,85℃加热10min,10倍系列稀释后涂布微晶纤维素无氮培养基平板,28℃培养3d,选单菌落再做划线分离于28℃培养3d,移接斜面培养基于28℃培养3d后置4℃保存。
1.5 解纤维素固氮芽孢杆菌与伴生菌的纯化
将分离到的解纤维素固氮芽孢杆菌接入斜面培养基,28℃培养3d,每支斜面用5mL无菌水洗下菌苔装于有玻璃珠的无菌三角瓶中,168r/min振荡20min得菌悬液。纯化解纤维素固氮芽孢杆菌是将菌悬液分装于无菌试管中,分别于80、85、90、95、100℃的水浴中加热处理10min,用0.85%生理盐水系列稀释,取0.1mL菌液涂平板,每个稀释度做3个重复,置于28℃恒温培养,3d后观察菌落生长情况,挑取单菌落移接斜面培养后,再进行液体培养和涂平板确定有无伴生菌存在。伴生菌的纯化是菌悬液不经加热处理,直接用0.85%生理盐水系列稀释至10-9,取0.1mL菌液涂平板,每个稀释度做三个重复,置于28℃恒温培养,3d后观察菌落生长情况,挑取伴生菌小菌落移接斜面培养后,再进行液体培养和涂平板确定有无解纤维素固氮芽孢杆菌存在。
1.6 解纤维素固氮芽孢杆菌AX32及其伴生菌AX322的鉴定
1.6.1 形态学观察和生理生化测定 将已纯化的解纤维素固氮芽孢杆菌AX32斜面接入微晶纤维素无氮液体培养基,28℃培养3d后,用0.85%生理盐水梯度稀释,取0.1mL菌液涂平板,28℃培养3 d后,观察菌落形态。革兰氏染色、荚膜染色、芽孢染色和生理生化特性、耐热性、耐盐性等试验,按参考文献[6]进行。1.6.2 16SrDNA序列和系统学分析 16SrDNA序列提取和测序由上海生工生物工程有限公司完成,基因比对采用NCBI数据库BLAST和Genback在线完成,系统学分析采用MEGA4.1(Beta 3)软件完成。
1.7 解纤维素固氮芽孢杆菌AX32与伴生菌AX322的相互关系
1.7.1 生长量的测定 在经活化的AX32与AX322的斜面中加入无菌水洗下菌体,置于有玻璃珠的三角瓶中于168r/min振荡20min混匀。将AX32与AX322分别接种于50mL微晶纤维素无氮液体培养基中进行纯培养,同时按AX32∶AX322等于1∶1、3∶1、1∶3的比例分别接种于50 mL微晶纤维素无氮液体培养基中进行混合培养,接种量均为8%,接种后于28℃,168r/min振荡培养3d,用平板菌落计数法测定生长情况。
1.7.2 纤维素酶活性测定 将1.7.1的培养物,于6 000r/min,离心15min,取上清液得到粗酶液。
以pH值为6.0磷酸缓冲液配制的1%微晶纤维素(经湿磨)悬液和0.1%纤维二糖溶液为底物,按预试验确定的最佳酶活测定条件(酶液稀释6倍,水浴30℃,预热10min,反应25min)测定AX32与AX322及二者混合培养物所得粗酶液的纤维素酶活力。
1.7.3 固氮量测定 取1.7.1的培养物20mL,在凯氏烧瓶中蒸干,采用全自动凯氏定氮仪测定固氮量。
1.7.4 数据处理 采用SPSS20.0统计分析软件完成。
2 结果分析
2.1 解纤维素固氮芽孢杆菌AX32与其伴生菌AX322的分离纯化
从24份土壤样品中共获得解纤维素固氮芽孢杆菌67株,其中14株固氮量较高。液体培养后活菌计数时发现,这些菌株大多出现了两种菌落,一种为光滑湿润有荚膜直径大于2mm的大菌落,另一种为直径小于1mm的小菌落。对固氮量较高的解纤维素固氮芽孢杆菌AX32重复进行试验,通过试验排除了操作环境、操作过程和摇瓶纱布通气塞造成污染的可能性,菌落数量统计发现小菌落数量大约是大菌落数量的26倍。在后续实验中,热处理时间仍为10min,通过提高热处理温度(表1)淘汰了小菌落获得了纯化的大菌落菌株AX32,不提高热处理温度,通过增加稀释度获得了小菌落伴生菌AX322。

表1 热处理温度对AX32存活率的影响Tab.1 Effect of thermal treatment on survival rate of AX32
2.2 解纤维素固氮芽孢杆菌AX32与其伴生小菌落AX322的鉴定
2.2.1 形态学观察 解纤维素固氮芽孢杆菌AX32在微晶纤维素无氮培养基平板上菌落呈圆形且透明有光泽,菌落直径大于2mm,边缘整齐,黏稠(图1a)。菌体呈杆状,宽0.79~1.3μm,长2.5~5.2μm,革兰氏染色为阳性(图1b);菌体外有荚膜包被(图1c);培养3d后菌体内形成芽孢,芽孢位于菌体中央,椭圆形,直径不大于菌体宽度(图1d)。
伴生菌AX322在微晶纤维素无氮培养基平板上菌落突起,边缘整齐光滑,透明无色,黏度小(图2a)。菌体单杆状,宽0.6~0.9μm,长0.9~2.0 μm,革兰氏染色为阴性(图2b);菌体外有微荚膜包被(图2c);不形成芽孢(图2d)。

图1 菌株AX32的形态学特征Fig.1 Morphological characteristics of strain AX32

图2 AX322的形态特征Fig.2 Morphological characteristics of strain AX322
2.2.2 生理生化特性 解纤维素固氮芽孢杆菌AX32的生理生化实验结果为:接触酶反应阳性,液化明胶,水解淀粉,石蕊牛奶反应阳性,v-p反应阴性,不产生吲哚,甲基红试验阴性,不利用柠檬酸盐,不还原硝酸盐,氧化酶反应阴性;发酵D+葡萄糖、D+蔗糖、D+乳糖、D+半乳糖、D+果糖、甘露醇、D+麦芽糖和D+纤维二糖,不发酵D+核糖、L+阿拉伯糖和木糖。当NaCl浓度<1.50%时,可以生长;pH值为5.7不生长;温度>38℃时生长受到抑制。
伴生小菌落AX322的生理生化实验结果为:接触酶反应阳性,3-酮基乳糖反应为阴性,液化明胶,水解淀粉,石蕊牛奶反应产碱,甲基红试验阴性,v-p反应阴性,不产生吲哚。
2.2.3 16SrDNA序列分析 利用NCBI中的BLAST软件分析菌株AX32 16SrDNA序列长度为1 511bp,伴生菌AX32216SrDNA的序列长度为1 378bp。菌株与Genbank数据库不同菌株16SrDNA序列进行同源性比较,发现菌株AX32与Paenibacillus castaneae(登录号:NR 044403.1)同源性达到99%,GC含量为54.93%。发现菌株AX322与Agrobacterium tumfaciens(登录号:FR828334.1)同源性达到99%,GC含量达54.57%。采用MEGA4.1(Beta 3)软件绘制AX32系统进化树如图3和AX322系统进化树如图4。依据解纤维素固氮芽孢杆菌AX32和伴生菌AX322的形态特征、生理生化特性和参考文献[6-8],解纤维素固氮芽孢杆菌AX32的鉴定结果为栗树类芽孢杆菌Paenibacillus castaneae,伴生菌AX322为根癌土壤农杆菌(Agrobacterium tumefaciens)。
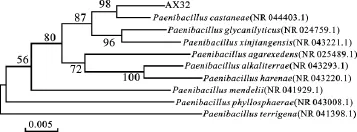
图3 AX32系统进化分析Fig.3 Phylogenetic analysis of AX32
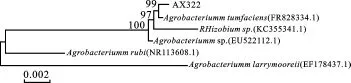
图4 AX322系统进化分析Fig.4 Phylogenetic analysis of AX322
2.3 解纤维素固氮芽孢杆菌AX32与伴生菌AX322的相互关系
表2是AX32和AX322纯培养与混合培养时生长量比较。由表2可见,两株菌混合培养时的活菌数均比纯培养时的活菌数明显减少,说明AX32与AX322之间存在竞争关系。

表2 AX32和AX322的纯培养与混合培养生长量比较Tab.2 Comparison on growth of sole and mixed cultivation of AX32 and AX322
图5和图6是AX32和AX322纯培养与混合培养时纤维素酶活性的比较。由图5可见,微晶纤维素酶活性,第1组(AX32纯培养)高于第2组(AX322纯培养),但差异不显著。混合培养的第3组(AX32∶AX322=1∶1)和第4组(AX32∶AX322=3∶1)都高于第1组和第2组,差异显著;混合培养的第5组(AX32∶ AX322=1∶3)略高于第1组,差异不显著;混合培养的第5组高于第2组,差异显著。由图6可见,β-葡萄糖苷酶活性,第1组略高于第2组,差异不显著;第3、4、5组均高于第1组和第2组,差异显著。总的来说,与纯培养相比,混合培养时微晶纤维素酶活性和β-葡萄糖苷酶活性都有提高。
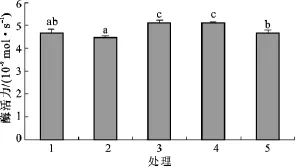
图5 AX32和AX322纯培养与混合培养微晶纤维素酶活性比较Fig.5 Comparison on microcrystalline cellulase activity of sole and mixed cultivation of AX32 and AX322
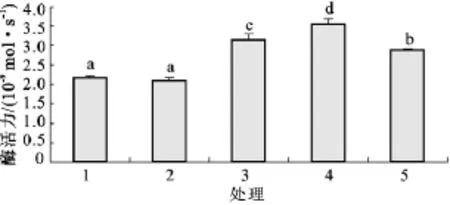
图6 AX32和AX322纯培养与混合培养β-葡萄糖苷酶活性比较Fig.6 Comparison onβ-glucosidase activity of sole and mixed cultivation of AX32 and AX322
图7是AX32和AX322纯培养与混合培养时固氮量比较。由图7可见,混合培养的第3、4、5组的固氮量略高于纯培养第1组,差异不显著,但明显高于纯培养第2组,差异显著,说明AX32和AX322混合培养时固氮量高于单独培养。
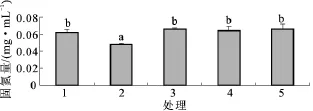
图7 AX32和AX322纯培养与混合培养固氮量比较Fig.7 Comparison on nitrogen-fixing amount of sole and mixed cultivation of AX32 and AX322
3 讨论
自生固氮菌分离培养时常伴生小菌落的现象早已发现[5],一般的分离纯化方法不易解决,解纤维素固氮芽孢杆菌及其与伴生菌的关系未见报道。本文依据固氮芽孢杆菌与土壤杆菌耐热性的差异以及伴生菌数量占优势的特点,通过提高加热温度获得了解纤维素固氮芽孢杆菌的纯培养,增加稀释度获得了伴生菌的纯培养。这对芽孢杆菌与非芽孢杆菌混合物的分离纯化有普遍意义。
目前,固氮菌剂生产主要使用圆褐固氮菌,该菌不能利用纤维素,菌剂保存期也较短。类芽孢杆菌属是有别于芽孢杆菌的新属[9-10],已有报道指出,某些类芽孢杆菌能够利用几丁质和纤维素等不溶性多糖,还有些类芽胞杆菌可以产生固氮酶有固氮作用[4,1113],解纤维素固氮芽孢杆菌可以利用纤维素作为碳源和能源进行固氮生长,且芽孢杆菌抗逆性强、菌剂保存期长。本实验室曾报道了既能利用纤维素又能固氮的胶质类芽孢杆菌CX21[4],解纤维素固氮芽孢杆菌AX32鉴定结果属于栗树类芽孢杆菌,AX32的生长量、固氮效率、纤维素酶活性以及盆栽试验中对黄瓜的促生长作用均高于CX21。解纤维素固氮芽孢杆菌的发现,丰富了类芽胞杆菌属中利用纤维素和固氮芽孢杆菌的种类;另外,在农业生产中,随着有机肥施用量的增加和谷物机械化收割秸秆还田的普及,解纤维素固氮芽孢杆菌更能适应土壤环境,具有潜在开发利用价值。
通过鉴定,伴生小菌落属于土壤杆菌属中的根癌土壤农杆菌。Anderson[14]曾报导在美国较多酸性和碱性土壤中有一种与固氮菌相伴生的小杆状菌且有固氮作用,命名为Pseudomonas azotocolligans,但Pseudomonas azotocolligans能否以纤维素为唯一碳源尚未有报道。本实验证实Agrobacterium tumefaciens AX322在微晶纤维素无氮培养基上生长良好,这很可能就是它在土壤中可以大量存在的原因。
本研究发现解纤维素固氮芽孢杆菌与其伴生菌混合培养时,互相竞争,导致菌数下降,这一结果与文献中伴生菌在无氮培养基上对固氮菌生长有抑制作用的结论一致[15]。本实验发现,混合培养与纯培养相比,纤维素酶活力和固氮量略有提高,但考虑到农用微生物菌剂产品的保质期,在固氮菌剂生产时,还是采用解纤维素固氮芽孢杆菌纯种培养为好。
4 结论
在筛选解纤维素固氮芽孢杆菌时常有小杆菌伴生,本研究通过提高加热温度和增加稀释度分别获得了解纤维素固氮芽孢杆菌AX32与伴生菌AX322的纯培养;依据形态特征、生理生化特性和16SrDNA序列分析对两种菌进行鉴定,解纤维素固氮芽孢杆菌AX32为栗树类芽孢杆菌(Paenibacillus castaneae),伴生菌AX322为根癌土壤农杆菌(Agrobacterium tumefaciens)。将两种菌分别培养及二者按不同比例接种进行混合培养,测定活菌数量、纤维素酶活性和固氮量,探讨两种菌的相互关系。结果发现,混合培养与单独培养相比,两种菌的活菌数量降低,种间关系为竞争,但混合培养时纤维素酶活性和固氮量略有提高。考虑到农用微生物菌剂产品的保质期,在固氮菌剂生产时,还是采用解纤维素固氮芽孢杆菌纯种培养为好。
[1]张卫峰,马林,黄高强,等.中国氮肥发展、贡献和挑战[J].中国农业科学,2013,46(15):3161-3171.
[2]Ding Y,Wang J,Liu Y,et al.Isolation and identification of nitrogen-fixing bacilli from plant rhizospheres in Binjing region[J].Journal Applied Microbiology,2005,99:1271-1281.
[3]孙建光,张燕春,徐晶,等.高效固氮芽孢杆菌筛选及其生物学特性[J].中国农业科学,2009,42(6):2043-2051.
[4]陶树兴,郭贤,梁建,等.纤维素降解固氮芽孢杆菌的筛选和鉴定[J].陕西师范大学学报:自然科学版,2014,42(1):65-69.
[5]王毓庆,罗国威.固氮菌Azotobacter伴生菌的研究[J].土壤学报,1963,11(4):405-409.
[6]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:353-398.
[7]Buchanan R E,Gibbens N E.伯杰细菌鉴定手册[M].中国科学院微生物研究所《伯杰细菌鉴定手册》翻译组,译.北京:科学出版社,1984:729-756.
[8]Angel Valverde,Alvaro Peix,Sergio Salazar,et al. Paenibacillus castaneae sp.nov.,isolated from the phyllosphere of Castanea sativa Miller[J].International Journal of Systematic and Evolutionary Microbiology,2008,58:2560-2564.
[9]Carol Ash,Fergus G,Priest,et al.Molecular identification of rRNA group3bacilli(Ash,Farrow,Wallbanks and Collins)using a PCR probe test[J].Antonie van Leeuwenhoek,1993,64(3):253-260.
[10]Wafa Achouak,Philippe Normand,Thierry Heulin. Comparative phylogeny of rrs and nifHgenes in the Bacillaceae[J].International Journal of Systematic Bacteriology,1999,49:961-967.
[11]Hong T Y,Meng M.Biochemical characterization and antifungal activity of an endo-1,3-β-glucanase of Paenibacillus sp.isolated from graden soil[J].Applied Microbiology Biotechnology,2003,61:472-478.
[12]DasGupta S M,Khan N,Nautiyal C S.Biologic control ability of plant growth-promoting Paenibacillus lentimorbus NRRL B-30488isolated from milk[J].Current Microbiology,2006,53:502-505.
[13]张高峡,卢振祖.从作物根际分离的多粘芽抱杆菌固氮作用的研究[J].武汉大学学报:自然科学版,1984,6:745-748.
[14]Anderson G R.Nitrogen fixation by Pseudomonas like soil bacteria[J].Journal Bacteriology,1955,70:129-133.
[15]Ernest A G.Contamination of Azotobacter chroococcum by gram-negative bacterial rods[J].Nature,1953,171:1163.
〔责任编辑 王 勇〕
Identification and interrelation of cellulose degradation nitrogen-fixing bacillus and associated bacteria
XIONG Ping,TAO Shuxing*,LIANG Jian,FENG Xiaolei,GUO Xian,XU Zhenzhen,TANG Na
(School of Life Sciences,Shaanxi Normal University,Xi'an 710119,Shaanxi,China)
By increasing temperature and dilution degrees,pure cultivation of cellulose degradation nitrogen-fixing bacillus and its associated strain were obtained.Based on morphological,physiological,biochemical characteristics and 16SrDNA sequence analysis,two strains have been identified.A sole cultivation and mixed cultivation in different ratios were conducted respectively.Interrelation between two strains was discussed by determining cell count,cellulase activity and nitrogen-fixing amount.The results indicated that cellulose degradation nitrogen-fixing bacillus AX32is Paenibacillus castaneae and its associated strain AX322is Agrobacterium tumefaciens.Compared to the sole cultivation,viable number of both strains in mixed cultivation decreased,which suggests a competitive interspecific relationship.But both the cellulase activity and nitrogen-fixing amount increased in mixed cultivation.
cellulose degradation nitrogen-fixing bacillus;associated fungus;strain identification;interrelation
Q939.96
:A
1672-4291(2015)06-0059-06
10.15983/j.cnki.jsnu.2015.06.364
2015-02-10
陕西省自然科学基础研究计划(2011JM3003)
熊平,女,硕士研究生,研究方向为应用微生物学。E-mail:1933171373@qq.com
*通信作者:陶树兴,男,教授。E-mail:taoshx@snnu.edu.cn
——固氮微生物

