p53上调凋亡调控因子:口腔癌治疗新靶点
李俊福 姜娟 刘敏 雷印涛 陈岱韻
(1.山东大学口腔医学院,山东济南250012;2.泰山医学院附属医院口腔科,山东泰安271000)
p53上调凋亡调控因子:口腔癌治疗新靶点
李俊福1、2姜娟2刘敏2雷印涛2陈岱韻2
(1.山东大学口腔医学院,山东济南250012;2.泰山医学院附属医院口腔科,山东泰安271000)
p53上调凋亡调控因子;肿瘤,口腔癌
据2008年的全球统计,口腔癌年新发病例约274,000例,年死亡病例约127,000例[1]。在一些高发地区,每年新增病例甚至占男性恶性肿瘤的25%[2]。口腔癌已经成为严重威胁人类生命健康的恶性肿瘤之一。口腔癌的治疗方法主要有手术切除、放疗及化疗,但上述常规疗法在治疗肿瘤的同时会导致正常组织损伤,肿瘤治疗效果不佳及患者生活质量下降。因此,寻找能够减少正常细胞损伤的肿瘤治疗靶点具有重要的临床意义。
p53上调凋亡调控因子(p53 up-regulated modulator of apoptosis,PUMA)具有较强促细胞凋亡作用,近年来相继有学者研究发现PUMA在许多恶性肿瘤如结直肠癌、乳腺癌、肺癌等的发生发展过程中均具有强大的促凋亡作用[3-5]。研究表明,上调PUMA在肿瘤细胞中的表达可以增强肿瘤细胞对放化疗的敏感性,而PUMA的缺失可以有效降低由放、化疗引起的组织损伤。因此,PUMA已经成为肿瘤治疗研究的热门靶点之一。在口腔癌治疗研究领域,与PUMA相关研究相继见于文献报道,对于口腔癌的治疗具有重要的研究价值。本文总结PUMA的结构和功能,同时综述PUMA在口腔癌治疗中的研究进展。
1 PUMA的结构与功能
PUMA基因于2001年被发现[6-8],因其能被p53迅速诱导产生强大的促细胞凋亡作用而将其编码产物命名为p53上调凋亡调制物。人PUMA基因定位在19q31,cDNA全长1.9kb,富含GC序列。PUMA基因的启动子区域存在有p53、Myc、forkhead box O3A(FoxO3a)等转录因子的结合位点。人PUMA基因共含有5个外显子(1a/1b、2、3、4)和三个内含子,外显子2含有假定的转录起始密码子,外显子3含有编码BH3的序列(图1)[9]。在应激刺激下,转录因子结合到PUMA基因启动子的特定结合位点激活PUMA转录,形成四种不同的转录本,分别是PUMA-α、PUMA-β、PUMA-γ和PUMA-δ,其中PUMA-β缺少外显子2,功能与PUMA-α相似,而PUMA-γ和PUMA-δ编码的蛋白质因缺少BH3结构域,丧失了诱导凋亡功能,目前研究最多的是PUMA-α,其编码的蛋白称为PUMA蛋白。
PUMA蛋白属于Bcl-2蛋白家族中的BH3-only家族,由193个氨基酸残基组成,主要结构包括BH3结构域(图2)[10],C末端跨膜结构域及N末端丝氨酸10号位磷酸化修饰位点三个部分[11]。BH3结构域由亮氨酸141,精氨酸142,精氨酸143,甲硫氨酸144,丙氨酸145,天冬氨酸146,天冬氨酸147,亮氨酸148,天冬酰胺149共9个氨基酸残基组成,位于PUMA氨基酸序列的第141-149位,这些氨基酸残基局部形成α螺旋空间结构(图2)。PUMA蛋白能够利用该结构结合到位于线粒体膜上Bcl-2抗凋亡蛋白家族表面的BH1,BH2和BH3结构域形成的疏水性凹槽,进而解除Bcl-2抗凋亡蛋白对直接促凋亡蛋白(如BID,BIM)的抑制作用最终起到诱导细胞凋亡的作用[12,13]。Cartron等人发现PUMA也能够通过BH3结构域与Bax的第一个α螺旋发生相互作用从而与凋亡效应蛋白Bax结合,直接活化Bax/Bak,产生细胞凋亡的作用[14]。羧基端的跨膜结构域(transmembrane region,TM)由43个氨基酸残基构成,该结构与PUMA的线粒体定位有关[6]。PUMA蛋白N末端第10号位丝氨酸是主要的磷酸化位点,其磷酸化后PUMA蛋白的稳定性和促凋亡能力下降[15]。

图1 PUMA基因结构示意图
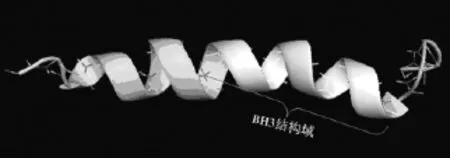
图2 PUMA蛋白BH3结构域空间结构示意图(PDB:2M04)
2 PUMA在口腔癌治疗中的作用
舌鳞状细胞癌(tongue squamous cell carcinoma,TSCC)在口腔癌中很常见,且恶性程度高,患者5年存活率约在50%~60%左右[16]。刘斌等人[17]在研究PUMA在TSCC中的表达及临床意义时发现,PUMA在舌鳞癌组织、舌癌旁组织及正常舌黏膜组织中的阳性表达率分别为36.67%、53.85%和80.00%,3组之间PUMA表达均有显著差异(P<0.05)。PUMA蛋白阳性表达频率在正常舌黏膜、舌癌旁组织与TSCC的转化过程中具有逐渐减弱的趋势,从蛋白水平证实了PUMA蛋白在正常舌黏膜、舌癌旁组织和TSCC中存在表达渐进缺失,提示PUMA蛋白表达降低可能与TSCC的发生、发展有关PUMA蛋白表达降低在舌鳞癌的发生、发展及转移过程中具有重要作用,对判断舌鳞癌的预后及治疗有一定的指导意义。
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)是口腔癌中最常见的恶性肿瘤,生长快,浸润性强,预后差,生存率很低。因此关于OSCC发生发展机制的研究以及新的治疗靶点的发现对于OSCC的治疗具有重要的临床意义。研究发现[18],经As-miR-222作用后,促凋亡蛋白PUMA水平上调,凋亡蛋白Bcl-2水平下调,此外,生物信息学和荧光素酶分析显示miR-222可直接结合到OSCC细胞系中PUMA mRNA的3'UTR区调节PUMA的促凋亡作用。江方方等人研究进一步证实[19],微小核糖核酸miR-222通过靶向于OSCC细胞中的PUMA进而影响细胞的生长,侵袭及凋亡能力,因此PUMA极有可能成为OSCC治疗中的新靶点。Coutinho-Camillo等[20]在探究抑制凋亡基因和促凋亡基因在OSCC细胞中的表达与OSCC临床病理学特征之间的关系时得出,PUMA表达量的增加与口底癌的发生、复发均有关,同时发现PUMA也是判断OSCC预后的独立因子。Yeh等人[21]在研究聚乙烯亚胺介导的PUMA基因转染在OSCC中的作用发现PUMA的外源性表达能够导致细胞凋亡并伴随细胞色素c的释放,细胞凋亡蛋白3和细胞凋亡蛋白9的活化,以及多聚二磷酸腺苷核糖聚合酶的裂解,并且聚乙烯亚胺介导的PUMA基因疗法可显著延长正位口腔鳞癌动物的生存期。上述研究结果表明聚乙烯亚胺介导的PUMA基因疗法对于OSCC的临床治疗具有极大的应用前景。
世界范围内头颈部鳞状细胞癌(Head and neck squamous cell carcinoma,HNSCC)在常见癌症中位列第八位,HNSCC患者往往对化疗反应欠佳。Sun等人[22]研究发现在大多数HNSCC细胞系中化疗制剂诱导的PUMA表达被抑制,而引入PUMA能够抑制HNSCC转移瘤的生长并且增加它们对化疗制剂顺铂的敏感性,相反PUMA被抑制时HNSCC细胞则对化疗制剂具有极大的抵抗性。2009年Sun等人[23]研究进一步证实PUMA参与介导表皮生长因子受体(epidermal growth factor receptor,EGFR)酪氨酸激酶抑制剂诱导的细胞凋亡,可加强和预测以EGFR为靶标的HNSCC的治疗敏感性。
3 结语
综上所述,传统的放化疗及手术疗法并不能显著的提高口腔肿瘤患者的生存率及存活期,寻找更为有效的治疗方法势在必行。PUMA结构决定了其具有强大的促凋亡功能,且这种功能与肿瘤的发生发展、肿瘤治疗抵抗、肿瘤细胞放化疗敏感性等息息相关,使得PUMA成为肿瘤治疗领域的新靶点。近年来有关PUMA在口腔肿瘤中的表达及临床意义的研究取得了一定的进展,特别是PUMA在促进OSCC、TSCC及NNSCC细胞凋亡等方面研究的重要发现极大地鼓舞了研究人员探寻PUMA与口腔肿瘤治疗相关性的信心。相信随着研究的不断深入,以PUMA为靶点的基因疗法必将为口腔肿瘤患者的临床治疗提供一个全新的选择。
[1]傅锦业.口腔癌相关危险因素的流行病学调查分析[J].中国口腔颌面外科杂志,2011(04):316-322.
[2]Warnakulasuriya S.Living with oral cancer:epidemiology with particular reference to prevalence and life-style changes that influence survival[J].Oral Oncol,2010,46(6):407-410.
[3]Dirisina R.p53 and PUMA independently regulate apoptosis of intestinal epithelial cells in patients and mice with colitis[J].Gastroenterology,2011,141(3):1036-1045.
[4]Roberts CG.Identification of PUMA as an estrogen target gene that mediates the apoptotic response to tamoxifen in human breast cancer cells and predicts patient outcome and tamoxifen responsiveness in breast cancer[J].Oncogene,2011,30(28):3186-3197.
[5]Yu J.PUMA sensitizes lung cancer cells to chemotherapeutic agents and irradiation[J].Clin Cancer Res,2006,12(9):2928-2936.
[6]Yu J.PUMA induces the rapid apoptosis of colorectal cancer cells[J].Mol Cell,2001,7(3):673-682.
[7]Nakano K.PUMA,a novel proapoptotic gene,is induced by p53[J].Mol Cell,2001,7(3):683-694.
[8]Han J.Expression of bbc3,a pro-apoptotic BH3-only gene,is regulated by diverse cell death and survival signals[J].Proc Natl Acad Sci U S A,2001,98(20):11318-11323.
[9]Yu J.PUMA,a potent killer with or without p53[J].Oncogene,2008,27 Suppl 1:S71-83.
[10]Follis AV.PUMA binding induces partial unfolding within BCL-xL to disrupt p53 binding and promote apoptosis[J].Nat Chem Biol,2013,9(3):163-168.
[11]黄伟.PUMA蛋白结构与功能研究进展[J].中华肿瘤防治杂志,2013(11):873-876.
[12]Yu J.PUMA mediates the apoptotic response to p53 in colorectal cancer cells[J].Proc Natl Acad Sci USA,2003,100(4):1931-1936.
[13]Ghiotto F.BH3-only proteins:the death-puppeteer's wires[J].Cytometry A,2010,77(1):11-21.
[14]Cartron PF.The first alpha helix of Bax plays a necessary role in its ligand-induced activation by the BH3-only proteins Bid and PUMA[J].Mol Cell,2004,16(5):807-818.
[15]Fricker M et al.Phosphorylation of Puma modulates its apoptotic function by regulating protein stability[J].Cell Death Dis,2010,1:e59.
[16]严颖彬.口腔癌患者术后生存质量评价及影响因素分析[J].中国口腔颌面外科杂志,2012(04):316-321.
[17]刘斌.p53上调凋亡调控因子在舌鳞癌中的表达及临床意义[J].中国口腔颌面外科杂志,2014(02):121-125.
[18]Chun-Zhi Z.MicroRNA-221 and microRNA-222 regulate gastric carcinoma cell proliferation and radioresistance by targeting PTEN[J].BMC Cancer,2010,10:367.
[19]Jiang F.miR-222 regulates the cell biological behavior of oral squamous cell carcinoma by targeting PUMA[J].Oncol Rep,2014,31(3):1255-1262.
[20]Coutinho-Camillo CM et al.Expression of Bcl-2 family proteins and association with clinicopathological characteristics of oral squamous cell carcinoma[J].Histopathology,2010,57(2): 304-316.
[21]Yeh CC.Polyethylenimine-mediated PUMA gene delivery to orthotopic oral cancer:suppression of tumor growth through apoptosis induction in situ and prolonged survival[J].Head Neck,2011,33(6):878-885.
[22]Sun Q.Chemosensitization of head and neck cancer cells by PUMA[J].Mol Cancer Ther,2007,6(12 Pt 1):3180-3188.
[23]Sun Q.PUMA mediates EGFR tyrosine kinase inhibitor-induced apoptosis in head and neck cancer cells[J].Oncogene,2009,28(24):2348-2357.
R781
:A
:7115-1004(2015)06-0711-03
10.3969/j.issn.1004-7115.2015.06.046
2015-1-27)
泰安市科技发展计划(编号:201340629)。
李俊福(1979—),男,山东泰安人,主治医师,主要从事临床口腔科工作。
陈岱韻。E-mail:daiyunchen@126.com。

