转染LC3影响舌鳞癌细胞TCA-8113对阿霉素耐药性*
张燎 刘婷婷
(泰安市口腔医院正畸科,山东泰安271000)
转染LC3影响舌鳞癌细胞TCA-8113对阿霉素耐药性*
张燎 刘婷婷
(泰安市口腔医院正畸科,山东泰安271000)
目的为了观察转染LC3质粒后,舌癌细胞内自噬活性的变化以及舌癌对阿霉素耐药性的变化。方法
通过转染重组质粒PEGFP-N1-LC3和空载体PEGFP-N1至舌鳞癌细胞TCA-8113,荧光显微镜下观察转染情况;用MTT法检测两组细胞增殖,观察转染LC3是否影响该细胞的增殖能力;为了观察舌癌对阿霉素耐药性的变化,用不同浓度阿霉素处理两组细胞,MTT法检测两组细胞48hIC50,并用Hochest33258染色观察两组细胞核凋亡情况;用Western Blot检测两组细胞自噬相关蛋白ATG5的表达,观察转染LC3后舌癌细胞内自噬及耐药性变化与以上蛋白及其通路是否相关。结果转染LC3重组质粒对细胞的增殖无影响,差异无统计学意义(P>0.05); MTT结果显示转染LC3组阿霉素48hIC50=5.040±0.235(uM),对照组IC50=1.599±0.332(uM),差异具有统计学意义(P<0.05),Hochest33258染色结果显示相同浓度阿霉素下对照组比转染LC3组细胞核凋亡明显;Western Blot检测未发现ATG5表达水平发生变化。结论转染LC3后细胞内自噬水平上调,其中机制可能与自噬相关蛋白ATG5通路无关。
舌癌;阿霉素;自噬
舌鳞癌是口腔鳞癌中最常见的恶性肿瘤,极易发生淋巴结转移,易复发,预后差,5年生存率仅50%~70%[1,2],舌癌的治疗是以手术为主的综合序列治疗,除根除性手术外,需要强调的是手术前后的放化疗,术前化疗有助于缩小手术范围,术后化疗可预防复发和转移,提高生存率,但是舌癌对于化疗药物的普遍耐药制约了其疗效和生存率。阿霉素(ADM)作为抗生素类抗肿瘤药通过抑制癌细胞的遗传物质核酸的合成达到抗癌的目的,属于广谱抗肿瘤药,对多种肿瘤细胞均有作用,目前阿霉素临床应用广泛,可以实现对肿瘤的多靶点靶向治疗,所以我们拟用阿霉素体外抑制舌鳞癌细胞的增殖,但是舌癌对化疗药物的普遍耐药依然是影响其临床疗效的主要障碍。
细胞自噬是将细胞内受损、变性或者衰老的蛋白质以及细胞器运输到溶酶体内进行消化降解的过程。自噬可以帮助细胞渡过营养不足、缺氧等应激状态生存下来,也可以诱导细胞发生自噬性死亡。肿瘤细胞内自噬功能的调节与放化疗抵抗密切相关,自噬的调节近年来已成为肿瘤放化疗增敏的热点:carew等发现自噬抑制剂能逆转CML细胞对伊马替尼的耐药[3];Beiiodi等也发现,自噬抑制剂3-MA,氯喹等药物和siRNA干扰剂如ATGS均能通过抑制自噬增强慢性白血病细胞对伊马替尼的敏感性[4];参与自噬调节的因子众多,其中自噬相关基因(Autophgy related gene ATG)对自噬调控有重要作用,在自噬不同阶段有不同的ATG基因参与,ATG5是参与调控自噬的重要基因,那么自噬影响化疗敏感性的过程是否与ATG5相关呢?目前尚无文献报道;另外微管相关蛋白1轻链3(microtubule associated protein 1 light chain 3,MAPl-LC3,LC3)也是参与自噬启动的关键因子,LC3以与磷脂酰乙醇胺结合的形式(LC3II)参与自噬启动时自噬小体的形成,LC3II的表达水平可以用来衡量自噬水平的高低。因此,本文通过转染增强LC3的表达观察自噬水平是否变化,并进一步观察转染后舌鳞癌细胞对阿霉素敏感性的变化及这一过程是否与ATG5相关。
1 材料与方法
1.1 细胞培养
人舌鳞癌细胞株TCA-8113购自中国科学院上海细胞库,细胞贴壁培养于含10%胎牛血清及1%青、链霉素的RPMI-1640培养液中,置于37℃,5%CO2的饱和湿度孵箱中培养,隔天换液,融合度达80%时传代。
1.2 试剂
带有LC3基因的质粒,lipofectamine2000,MTT,Hoechst33258,兔抗人LC3多克隆抗体LC3A,人抗兔p-akt多克隆抗体P-AKT,人抗兔Atg5多克隆抗体Atg5,辣根过氧化物酶标记的羊抗兔IgG
1.3LC3质粒的转染、筛选稳定表达株及细胞分组
本实验所用质粒是人微管相关蛋白轻链3 (LC3)与增强型绿色荧光蛋白(EGFP)融合表达的真核表达载体PEGEP-N1-LC3和空载体PEGEP-N1,采用脂质体转染法,用上海贝尔股份有限公司提供的lipofectamine2000转染手册进行操作,将对数生长期的舌鳞癌细胞TCA-8113接种于6孔板,每孔DNA重组质粒用量4ug,37℃,5%CO2孵箱中培养4小时,换完全培养基终止转染,37℃,5%CO2孵箱中培养48 h,荧光显微镜下观察转染情况,其后加入1000 μg/mlG418,适时换液,7天后对照组(未转染细胞)全部死亡,而PEGEP-N1-LC3和PEGEP-N1除部分死亡外,其余均长出新的细胞克隆,待细胞生长至孔底面积80%左右,改用G418400ug/ml维持浓度对细胞进行扩增培养。将重组质粒PEGEP-N1-LC3转染的细胞命名为PEGEP-N1-LC3,定为实验组,转染空载体PEGEP-N1的细胞命名为PEGEP-N1,定位对照组。
1.4 细胞增殖分析
选取对数生长期的PEGEP-N1-LC3和PEGEP-N1,按每孔1×104个细胞接种于96孔板,每组设5个平行孔,置RPMI-1640培养液中培养,分别在培养24、48、72 h后MTT法检测各孔吸光度值并计算细胞相对增殖率,以时间为横坐标,相对增殖率为纵坐标绘制生长曲线;采用同样的方法接种两组细胞,加入不同浓度阿霉素处理细胞或不处理作为对照,每组设5个平行孔,置含0.5%胎牛血清的RPMI-1640培养液中饥饿培养,48 h后MTT法检测各孔吸光度值并计算细胞相对增殖率,绘制生长曲线,实验独立重复3次。
1.5 细胞凋亡检测
取对数生长期的PEGFP-N1-LC3和PEGFP-N1细胞按1×106/ml密度接种于6孔板,置含0.5%胎牛血清的RPMI-1640培养液中饥饿培养24 h,第2d开始,不同浓度阿霉素处理或不处理作为对照,48 h后甲醇1∶10用超纯水稀释后固定,Hoechst33258核染料染色,荧光显微镜下观察核凋亡情况。
1.6Western Blot检测细胞Atg5的表达情况
取接受不同浓度阿霉素处理的两组细胞提取全蛋白并进行蛋白定量,每个浓缩胶孔加入40 μg总蛋白,电泳,转膜,BSA封闭,分别加一抗(均用TBST 1∶1000稀释)和二抗(均用TBST稀释1∶3000)摇荡孵育,加ECL发光显示剂,扫描结果。
1.7 统计学处理
所得数据均用均数±标准差表示,用单因素方差分析,采用spass16.0软件系统进行数据处理,以P<0.05为差异有统计学意义。
2 结果
2.1 转染LC3后自噬水平上调
细胞转染48 h后用荧光显微镜观察(如图1所示),舌鳞癌细胞TCA-8113对质粒转染较敏感,PEGFP-N1-LC3质粒的转染效率为(81.53± 2.76)%,PEGFP-N1空载体的转染效率为(84.87 ±1.32)%,PEGFP-N1-LC3细胞内可见散在分布的用以标记LC3II的荧光颗粒,PEGFP-N1细胞内可见绿色荧光蛋白均匀分布整个细胞内,无颗粒状物质,证明PEGFP-N1-LC3组细胞自噬小体形成增加,自噬水平上调。

图1 荧光显微镜观察两组细胞(SP×400)
2.2 自噬增强对TCA-8113增殖无影响
MTT结果表明,与PEGFP-N1组相比较,PEGFP-N1-LC3组细胞增殖速度没有明显变化,两组细胞之间增殖率无统计学差异(P=0.0013),如图2所示,证明LC3表达增强后没有影响TCA-8113细胞的增殖。

图2 两组细胞生长曲线比较
2.3 自噬水平上调后,TCA-8113对阿霉素耐药性增强
根据MTT结果计算阿霉素48h IC50并绘制生长曲线,如图3所示,PEGFP-N1-LC3组IC50= 5.040±0.235(uM),PEGFP-N1组IC50=1.599± 0.332(uM),PEGFP-N1-LC3组IC50明显高于PEGFP-N1组,两组比较差异有统计学意义(P<0.05)。可以看出PEGFP-N1-LC3组对阿霉素的耐受性明显强于PEGFP-N1组,提示细胞转染LC3质粒后对阿霉素的耐药性增强;用Hochest33258染色,荧光显微镜下观察,如图4所示,图中可见PEGFP-N1组细胞在阿霉素浓度为2.5,5,7.5(uM)时均出现明显核固缩,碎裂,且呈剂量依赖关系,而PEGFP-N1-LC3组细胞在阿霉素浓度为7.5时才出现了明显的核碎裂。可见PEGFP-N1组的凋亡现象明显比PEGFP-N1-LC3组严重,提示转染LC3质粒后细胞对阿霉素的耐药性增强。
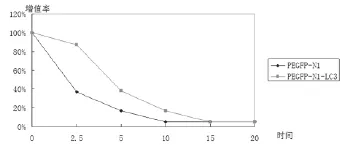
图3 不同浓度阿霉素作用48h细胞生长曲线

图4 不同浓度阿霉素作用48 h Hochest33258染料染色
2.4 转染LC3后未启动自噬相关蛋白ATG5
Western blot检测两组细胞ATG5的表达情况,如图5所示,可见两组细胞之间及不同浓度之间ATG5表达均无变化,提示我们在LC3增强自噬以及增加舌癌耐药性这个过程中均未启动自噬相关蛋白ATG5。

3 讨论
自噬是一个发生在真核细胞中由细胞初级溶酶体处理内源性底物的重要生理过程,自噬的过程源于自噬小体的形成,后者通过与溶酶体融合降解自噬小体内包含的多肽等物质。自噬活性的变化与肿瘤的发生,发展,以及肿瘤耐药性有着直接关系,已有研究证明乳腺癌[5],结直肠癌[6],宫颈癌[7],前列腺癌[8]等肿瘤中放化疗的抵抗与自噬有关,自噬已经成为研究抑制肿瘤生长和克服肿瘤耐药的新靶点。自噬活性的变化涉及一系列相关蛋白、因子的表达和相互作用,其中LC3是哺乳动物细胞中酵母Atg8的基因同源物,定位于前自噬泡和自噬泡膜表面,LC3在自噬启动时是自噬小体形成中的关键因子[9]。LC3分I型和II型。未发生自噬时,细胞内合成的LC3为胞浆可溶性的I型LC3,当自噬开始时,首先形成自噬小体,LC3I与自噬小体膜上的磷脂酰乙醇胺(PE)结合,形成LC3II,LC3II定位于自噬体膜上并介导自噬小体膜的延伸和完成,LC3II是特异性定位于自噬体膜的分子标识,LC3II的数量与自噬体数量正相关[10,11],因此LC3II/LC3I常作为衡量自噬活性的标准[12,13]。
为了研究LC3-自噬-耐药三者之间的关系,我们在舌鳞癌细胞TCA-8113中转染重组质粒PEGEP-N1-LC3,经鉴定,转染该质粒后细胞内LC3获得有效表达,细胞内荧光标记点提示了LC3表达增强提高了自噬水平。对LC3影响舌癌细胞TCA-8113阿霉素耐药性的研究需要首先确认LC3高表达后是否影响了该细胞的正常增殖。经MTT检测,绘制生长曲线发现LC3高表达后对该细胞增殖无明显影响。进一步饥饿状态下通过阿霉素处理细胞,同时进行MTT检测绘制生长曲线和Hochest染色观察核凋亡情况,结果均表明LC3表达增强后有效提高了TCA-8113对阿霉素的耐药性,这种自噬功能的激活在阿霉素作用过程中起到了保护细胞的作用。
自噬过程受多种信号通路的调控,LC3在激活自噬机制时涉及了哪些因子和通路呢?我们检测了饥饿状态下梯度浓度阿霉素作用后自噬相关蛋白ATG5的表达水平,结果显示,ATG5随药物剂量及是否转染LC3趋势都无变化,提示高表达LC3增强自噬活性也许与ATG5无关。
综上所述,本研究证实了转染LC3重组质粒后确实可以提高自噬水平,同时这种自噬水平的提高在阿霉素作用时起到了保护细胞的作用,使细胞得以生存,增加了舌鳞癌细胞TCA-8113对阿霉素的耐药,这个过程可能与自噬相关蛋白ATG5无关,本研究为抑制自噬增加舌癌化疗敏感性提供了实验依据,可望为舌癌化疗提供新思路。但本研究对该过程中涉及的通路和因子研究不足,需要在下一阶段研究中侧重此部分。
[1]Sakai M,Yokoyama J,Tashiro M,et al.A novel procedure combining transoral resection and set-back tongue flap for oropharyngeal cancerv[J].Acta oto-laryngologica,2015(0):1-5.
[2]Brotherston D,Poon I,Peerani R,et al.Tumor shrinkage associated with whole-mount histopathologic techniques in oral tongue carcinoma[J].Pathology-Research and Practice,2015(暂未分卷).
[3]Wilhelm SM,Carter C,Tang L,et al.BAY 43-9006 exhibits broad spectrum oral antitumor activity and targets the RAF/MEK/ ERK pathway and receptor tyrosine kinases involved in tumor progression and angiogenesis[J].Cancer Res,2004,64(19):7099-7109.
[4]Belludi C,Lidonnici M R,Hamilton A,et,al.Targeting autophagy potentiates tyrosine kinase inhibitor-induced cell death in Philadelphia chromosome-positive cells,incliding primary CML stem cells[J].J Clin Invest,2009,119(5):1109-1123.
[5]KlionskyDJ,Emr SD.Autophagy as a regulated pathway of cellular degradation[J].Science,2000,290(5497):1717-1721.
[6]Klionsky DJ,Abdalla FC,Abeliovich H,et al,Guidelines for the use and interpretation of assays for monitoring autophagy[J].AUTOPHAGY,2012,8(4):445-544.
[7]Apel A,Herr I,Schwarz H,et al,Blocked autophagy sensitizes resisitant carcinoma cells to radiation therapy[J].Cancer Res,2008,68(5):1485-1494.
[8]Li J,Hou N,Faried A,et al.Inhibition of autophagy by 3-MA enhances the effect of 5-FU-induced apoptosis in colon cancer cells[J].Ann Surg Oncol,2009,16(3):761-771.
[9]Otomo C,Metlagel Z,Takaesu G,et al.Structure of the human ATG12~ATG5 conjugate required for LC3 lipidation in autophagy[J].Nature structural&molecular biology,2013,20(1):59-66.
[10]Liu D,Yang Y,Liu Q,et al.Inhibition of autophagy by 3-MA potentiates cisplatin-induced apoptosis in esophageal squamous cell carcinoma cells[J].Medical oncology,2011,28(1):105-111.
[11]Apel A,Herr I,Schwarz H,et al.Blocked autophagy sensitizes resisitant carcinoma cells to radiation therapy[J].Cancer Res,2008,68(5):1485-1494.
[12]Lin D,Yang Y,Liu Q,et al,Inhibition of autophagy by 3-MA potentiates cisplatin-induced apoptosis in esophageal squamous cell carcinoma cells[J].Med Oncol,2011,28(1):105-111.
[13]Apel A,Herr I,Schwarz H,et al.Blocked autophagy sensitizes resisitant carcinoma cells to radiation therapy[J].Cancer Res,2008,68(5):1485-1494.
A Study of LC3 effect of TCA -8113 on adriamycin resistance in tongue squamous cell carcinoma cells
ZHANG Liao LIU Ting-ting
(Dept.of Orthodontics,Stomatology Hospital of Taian City,Taian 271000,China)
Objective:To observe the up-regulation expression of LC3 on the resisitance of tongue cancer to adriamycin and to explore the mechanism.Methods:Used the recombinant plasmid GFP-LC3 and the control plasimid GFP-non transfect the human tongue squamons carcinoma cell lines TCA-8113,the transfection was observed under fluorescence microscope.the expression of was detected by MTT assay,and the expression of autophagy related protein Atg5 was detected by Blot Western in two groups.Results:After transfection of GFP-LC3,There was no significant difference in the proliferation(P>0.05).the ADM 48hIC50 of GFP-LC3cells is 5.040±0.235(uM),the control cells is1.599±0.332 (P<0.05),Hochest33258 staining showed that the apoptotic cells in the control group were significantly more than that in the LC3 group.No change of ATG5 expression was found in Blot Western.Conclusion:Enhancing the expression of LC3 can increase the resisitance of tongue cancer by rising autophagy,its mechanism may be not through Atg5 pathway.
tongue cancer;adriamycin;autophagy
R781
A
1004-7115(2015)08-0852-04
10.3969/j.issn.1004-7115.2015.8.004
2015-6-9)
山东省泰安市科技发展计划(201340629)。
张燎(1971—),男,山东新泰人,副主任医师,硕士,主要从事口腔正畸工作。

