问号钩体5 6 601株外分泌蛋白功能研究
聂志文,梁振山,曾令兵
(1、上海市第一人民医院宝山分院检验科,上海200940;2、江西省儿童医院检验科,江西 南昌330006;3、南昌大学第一附属医院,江西 南昌330006)
钩端螺旋体病(简称“钩体病”)是世界范围内流行的人兽共患病[1-3]。钩体病的临床症状轻重、缓急不一,轻症患者可只表现为感冒样症状;而重症患者则可出现肝、肾、肺等多脏器的出血性病变,甚至死亡[4]。目前,钩体病的关键致病因子还未完全阐明[5]。本研究在前期分泌蛋白质组的基础上,对其中筛选得到的问号钩体外分泌蛋白的致病功能进行研究,为进一步阐明问号钩体的致病因子及致病机制提供必要的依据[6]。
1 材料与方法
1.1 材料
1.1.1 基因组 由上海交通大学病原生物学教研室提供问号钩体56601株的基因组。
1.1.2 菌株和质粒 克隆菌株为E.coli DH5α,表达宿主为E.coli Bl21(DE3),均购于天根生物有限公司。表达载体为pET28a(+)由上海交通大学病原生物学教研室馈赠。
1.1.3 试剂 KOD-plus购于TOYOBO公司。限制性内切酶及连接酶Solution I,购于TAKARA公司。异丙基硫代半乳糖苷(IPTG)购于Promega公司。蛋白至分子量标准购自Fermentas公司。其他试剂均为进口分装。
1.1.4 问号钩体感染兔血清 该血清由上海交通大学病原生物学教研室馈赠。由问号钩体强毒株56601株,经耳缘静脉注射感染新西兰兔制备获得。
1.1.5 培养基 配制LB培养基:1%NaCl,1%胰蛋白胨以及0.5%酵母浸出液,百分比为质量体积比。1.1.6引物 由上海Invitrogen公司合成。
1.2 方法
1.2.1 四个钩体外分泌蛋白表达载体的构建 PCR反应条件如下,预变性:95℃ 2min;扩增步骤:95℃变性 1min;55℃退火 30s;68℃延伸 1~2min(延伸时间由产物大小决定);进行35个循环;72℃延伸10min。PCR引物见表1。

表1 钩体外分泌蛋白重组克隆引物
1.2.2 获得的PCR产物在相应的限制性内切酶作用后,在连接酶Solution I的作用下,与pET28a(+)连接,最终得到携带有目的基因的表达载体。随后,将相应的表达载体转入表达宿主E.coli Bl21(DE3)中,进行后续的表达纯化过程。四个钩体外分泌重组蛋白的表达和纯化
将构建完成的表达载体转入表达宿主E.coli Bl21(DE3)中,在卡那霉素抗性(100μg/ml)平板中过夜生长,挑选阳性克隆于5ml LB培养基中,37℃200r/min振荡培养至对数生长期后,按1:100扩大培养。并于37℃200r/min振荡培养至OD值在0.8~1.0左右,将培养瓶移至25℃培养箱中,200r/min振荡培养。30min后,加入0.1mM IPTG过夜诱导表达。第二天,10,000r/min弃去上清液,收集菌体。 菌体加入 30ml NTA-0(150mM NaCl,50mM Tris HCl pH8.0,咪唑浓度为0mM)并充分混匀重悬,于超声破碎仪中充分破碎菌体至清亮(功率为200~300W),约5min。超声破碎后,将混合液于离心机中>13,000r/min离心大于20min,弃去上清。沉淀物用NTA-0及8M脲素,充分溶解。未能溶解部分,于离心机中>13,000rpm离心20min去除。同时,Ni2+中加入NTA-0-8M脲素,室温平衡20min。平衡后,将脲素溶解的蛋白加入到Ni2+中,随后以不同浓度的咪唑进行梯度洗脱,进行SDS-PAGE,收集在目的分子量位置,条带单一相应管的蛋白。最后,将收集好的蛋白进行透析及超滤浓缩至500μl左右,并测定蛋白浓度。
1.2.3 四个钩体外分泌重组蛋白的Western Blot重组纯化后得到的钩体外分泌蛋白先进行SDS PAGE电泳,后以100V恒定电压,电转1h,将SDS PAGE胶上的蛋白,转移至醋酸纤维膜上。用封闭液(5%脱脂奶粉)室温封闭 1h,TBST(TBS,0.05%吐温-20)洗膜3次,每次5min。然后,将膜与准备好的1:3000稀释的组氨酸标记单克隆抗体 (anti-His),或问号钩体56601株感染兔血清于4℃反应过夜。用TBST洗膜3次,每次5min;再与1:5000辣根过氧化物酶标记的羊抗鼠(或兔)IgG室温反应30min,后以发光底物(Thermo Scientific Pierce ECL Plus Substrate)显色。
1.2.4 钩体外分泌蛋白体外黏附功能验证 将Fibronectin、Laminin、Collagen I、Collagen IV、BSA 等介质包被在在96孔板中 (未包被孔作为空白对照),4℃包被过夜;封闭(无蛋白封闭缓冲液,Thermo Scientific);加入 1μg 目的蛋白,37℃作用 3h;弃去反应液,PBST充分洗涤5遍,并拍干;加入Anti-His HRP(1:2,000)100μl;37℃反应 1h; 弃去反应液,PBST充分洗涤5遍,并拍干;加入100μl混合好的A、B显色液,常温显色15min;终止显色;加入50μl 1MH2SO4,终止显色反应;450nm 中测定其OD值。统计学方法采用单因素方差分析,P<0.05。
2 结果
2.1 在前期问号钩体56601株外分泌蛋白质组的基础上,筛选得到四个可能与问号钩体致病相关的蛋白-LA_2413、LA_2823、LA_3469 和 LB_194,其表达情况见图1A。与56601株感染兔血清的Western Blot见图1B。
2.2 问号钩体56601株重组外分泌蛋白与ECMs的黏附作用,见图2及图3。结果显示,LA_3469与LA_2413能够与Laminin、Collagen I和 Collagen IV有黏附作用;而LA_3469还能够与Fibronectin有黏附作用[14,15]。
3 讨论
钩体病是一种世界范围内流行的人兽共患病,其在77个国家已有报道,尤以水稻种植为主的广大发展中国家,更为盛行。我国也是钩体病的高发地区之一,主要集中在降水量相对充足的长江中下游地区,如江西省、湖北省、四川省等省份[5]。自80年代后,我国钩体病的发病率虽然处于逐年下降的趋势,但是钩体病疫区常常随着洪水季节的到来而出现爆发。然而,钩体病的致病机制及关键致病因子,却未被完全阐明。并且,近年来的研究主要集中在钩体的外膜蛋白上[7-9],关于钩体的分泌蛋白质组却鲜有报道。直至2013年,由本研究组成员首先报道了问号钩体56601株的分泌蛋白质组。该研究采用无蛋白培养基C-70,不同于钩体的常用培养基EMJH和Korthof。C-70中不含有或含有微量的蛋白成分,这不仅利于富集钩体的分泌蛋白,而且还可以避免培养基中的其他蛋白成分对后期的质谱检测造成不必要的影响。关于钩体的无蛋白或低蛋白培养基,已有学者在1978年进行了报道。该类培养基旨在获得钩体疫苗菌株,应用于钩体病的预防。随后,我国的钩体病研究学者根据该类培养基的特性,对钩体无蛋白培养基进行了改良,最终获得C-70培养基。而C-70培养基也同样应用在制备钩体疫苗当中。本研究的前期工作,首先评估了钩体无蛋白培养基C-70对强毒株问号钩体56601株的生长、形态以及毒力的影响。经研究发现,C-70培养获得的钩体,其形态及生长状况,与EMJH培养钩体相比,并未出现显著性差异。此外,C-70培养钩体也保持了其感染金黄地鼠的能力[6]。随后,我们借助56601株的全基因组及蛋白质组数据,对问号钩体的分泌系统做了较为系统的分析,最终发现,问号钩体具备了部分分泌系统的关键元件,而尤以I、II型分泌系统相对完整[10]。在此基础上,我们鉴定并分析了56601株的分泌蛋白质组。随后,我们通过钩体感染金黄地鼠模型,比较了鉴定得到的钩体分泌蛋白在体内外的表达差异。最终,我们发现,有两个蛋白在体内下调表达,有15个蛋白上调表达。而在上调表达的蛋白中,有8个蛋白为脂蛋白。既往的研究表明,脂蛋白不仅是钩体的重要组成成分(如LipL32等),也是重要的致病因子,同样,其也是非常重要的钩体病诊断和疫苗的候选靶标。本研究在此基础上,对筛选得到的8个脂蛋白进行分析,发现其中有4个蛋白已经被研究,而另外 4 个 脂 蛋 白 (LA_2413、LA_2823、LA_3469 和LB_194)功能并未有相关报道。因此,本研究对这四个脂蛋白的体外致病功能进行了初步的分析,为进一步筛选新的钩体致病因子提供一定的依据。

图1 问号钩体56601株外分泌蛋白体外重组表达

图2 问号钩体56601株重组外分泌蛋白与不同细胞外基质的黏附作用
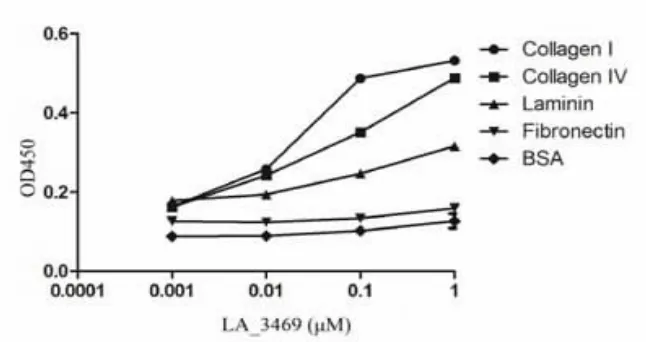
图3 LA_3469在不同浓度下与不同介质的黏附作用
细胞外基质(extracelular matrix,ECM),是由动物细胞合成并分泌到细胞外,分布在细胞表面或细胞之间的大分子,主要是一些多糖和蛋白,或蛋白聚糖。这些物质能够构成复杂的网架结构,对于防御病原菌的入侵有着非常重要的作用。前期的研究表明,钩体的部分表面暴露蛋白(主要是外膜蛋白),能够与宿主的细胞外基质发生黏附,并以此发挥一定的致病功能[7,11,12]。与此同时,致病性钩体主要是通过破损的皮肤入侵并感染人体的,而细胞外基质是构成该屏障的主要组成成分。因此,本研究首先体外重组表达了这四个问号钩体外分泌蛋白,获得了纯化的体外重组蛋白。通过体外黏附实 验 , 研 究 LA_3469、LA_2413、LA_2823 以 及LB_194与不同细胞外基质的黏附功能,最终发现,LA_3469与LA_2413能够与细胞外基质Laminin、Collagen I以及Collagen IV发生黏附作用,LA_3469还能够与Fibronectin发生黏附作用。Cao等的蛋白质组结果中显示,LA_3469在37oC时表达量上调,这也进一步提示LA_3469是钩体的一个重要的致病因子[13]。
本研究在前期问号钩体外分泌蛋白质组的基础上,对筛选得到的体内外表达存在差异的外分泌脂蛋白进行了体外的功能实验。这为筛选钩体的关键致病因子及阐明钩体病的致病机制提供了新思路。
[1]Schreier S,Doungchawee G,Chadsuthi S,et al.Leptospirosis:current situation and trends of specific laboratory tests[J].Expert Rev Clin Immunol,2013,9(3):263-280.
[2]Koizumi N,Watanabe H.Leptospirosis vaccines:past,present,and future[J].J Postgrad Med,2005,51(3):210-214.
[3]Picardeau M.Diagnosis and epidemiology of leptospirosis[J].Med Mal Infect,2013,43(1):1-9.
[4]Evangelista K,Coburn J.Leptospira as an emerging pathogen:a review of its biology,pathogenesis and host immune responses[J].Future Microbiol,2010,5(9):1413-1425.
[5]Zhang C,Wang H,Yan J.Leptospirosis prevalence in Chinese populations in the last two decades[J].Microbes Infect,2012,14(4):317-323.
[6]Zeng LB,Zhuang XR,Huang LL,et al.Extracellular Proteome Analysis of Leptospira interrogans serovar Lai[J].OMICS,2013,17(10):527-535.
[7]Pinne M,Matsunaga J,Haake D.Leptospiral outer membrane protein microarray,a novel approach to identification of host ligand-binding proteins[J].J Bacteriol,2012,194(22):6074-6087.
[8]Adler B,Lo M,Seemann T,et al.Pathogenesis of leptospirosis:the influence of genomics[J].Vet Microbiol,2011,153(1-2):73-81.
[9]Matsunaga J,Barocchi MA,Croda J,et al.Pathogenic Leptospira species express surface-exposed proteins belonging to the bacterial immunoglobulin superfamily[J].Mol Microbiol,2003,49(4):929-945.
[10]Ren SX,Fu G,JiangXG,etal.Unique physiologicaland pathogenic features of Leptospira interrogans revealed by wholegenome sequencing[J].Nature,2003,422(6934):888-893.
[11]Atzingen MV,Barbosa AS,De Brito T,et al.Lsa21,a novel leptospiral protein binding adhesive matrix molecules and present during human infection[J].BMC Microbiol,2008,8:70.
[12]Atzingen MV,Gómez RM,Schattner M,et al.Lp95,a novel leptospiral protein that binds extracellular matrix components and activates e-selectin on endothelial cells[J].J Infect,2009,59(4):264-276.
[13]Cao XJ,Dai J,Xu H,et al.High-coverage proteome analysis reveals the first insight of protein modification systems in the pathogenic spirochete Leptospira interrogans[J].Cell Res,2010,20(2):197-210.
[14]Figueira CP,Croda J,Choy HA,et al.Heterologous expression of pathogen-specific genes ligA and ligB in the saprophyte Leptospira biflexa confers enhanced adhesion to cultured cells and fibronectin[J].BMC Microbiol,2011,11:129
[15]Choy HA1,Kelley MM,Chen TL,et al.Physiological Osmotic Induction of Leptospira interrogans Adhesion:LigA and LigB Bind Extracellular Matrix Proteins and Fibrinogen[J].Infect Immun,2007,75(5):2441-2450.

