三重荧光定量PCR快速检测水产品中的双链DNA病毒的研究
黄佳鸣,宁喜斌,史秀杰,刘 葒,丛 健,兰文升,*
(1.上海海洋大学食品科学与工程学院,上海 201306;2.深圳出入境检验检疫局动植物检验检疫技术中心,深圳市外来有害生物检测技术研发重点实验室,广东深圳 518045)
三重荧光定量PCR快速检测水产品中的双链DNA病毒的研究
黄佳鸣1,2,宁喜斌1,史秀杰2,刘 葒2,丛 健1,兰文升2,*
(1.上海海洋大学食品科学与工程学院,上海 201306;2.深圳出入境检验检疫局动植物检验检疫技术中心,深圳市外来有害生物检测技术研发重点实验室,广东深圳 518045)
目的:建立对水产品中三种双链DNA病毒(斑点叉尾鮰病毒、锦鲤疱疹病毒、流行性造血器官坏死病毒)快速、敏感、特异的检测方法。方法:针对三种病毒的DNA聚合酶基因的保守序列设计三对特异性引物和三条Taqman探针,优化体系,建立三重荧光定量PCR体系,并对该方法的灵敏性和特异性评估。结果:建立的三重荧光定量PCR体系特异性强,引物之间及引物和探针之间无相互干扰。对三种病毒的检测限均能达到102拷贝/μL。结论:该方法体系稳定,重复性好,可操作性强,对水产品中的双链DNA病毒的快速检测具有重要的应用价值。
斑点叉尾鮰病毒;锦鲤疱疹病毒;流行性造血器官坏死病毒;三重荧光定量PCR
我国是一个水生动物及其产品进出口大国和消费大国,各种水产食品已成为满足我国人民日益增长的蛋白质需求的重要来源。然而,现实高密度养殖模式以及水环境的污染造成水生动物疫病频发,在爆发的水生动物疫病中,病毒性疫病成为水生动物发病率较高和难以根治的最重要疫病,因此,病毒病成为水生动物健康养殖的关注焦点[1]。
水生动物DNA病毒病是由双链DNA病毒引发,在水生动物中尚未发现单股单链DNA病毒,常见的引起鱼类传染病的双链DNA病毒都属于虹彩病毒科和疱疹病毒科[2]。主要有:流行性造血器官坏死病毒(EHNV)、真鲷虹彩病毒(RSIV)、锦鲤疱疹病毒(KHV)、斑点叉尾鮰病毒(CCV)、淋巴囊肿病毒(LCDV)。其中,EHNV、KHV、CCV三种病毒被农业部列入二类动物疫病,且EHNV、KHV同时被世界动物卫生组织列入《水生动物疾病诊断手册》[3]。这些病毒引发的水生动物疫病给水产养殖业带来的危害甚为严重。因此,在疫病尚未传播时,及时检出病原,采取积极防控措施,将减少由疫病带来的经济损失。
DNA聚合酶基因是诊断双链DNA病毒感染的潜在靶标区域[4],目前已有许多专家学者以DNA聚合酶基因为目的基因,建立了对双链DNA病毒的检测方法[5-7]。通过对水生动物双链DNA病毒的DNA聚合酶基因序列分析,发现虽然不同种病毒基因组序列差异较大,但是DNA聚合酶基因具有一定同源性,可以充分利用这些DNA聚合酶基因的同源区设计引物,然后利用基因片段之间仍然存在足够的碱基差异,用高灵敏的探针加以鉴别[8]。

表1 制备阳性标准品的引物Table 1 Primers for positive standard
1 材料与方法
1.1 材料与仪器
本实验所用的CCV毒株购自ATCC(编号:ATCC-12665),用斑点叉尾鮰卵巢细胞系(CCO细胞系)增殖;KHV毒株为深圳出入境检验检疫局动植中心水生动物检测重点实验室分离所得,用锦鲤尾鳍细胞系细胞系(KF-1细胞系)增殖;EHNV毒株为实验室分离所得,用鲤上皮瘤细胞系(EPC细胞系)增殖;RSIV毒株为实验室分离所得,由石鲈鳍条细胞系(GF细胞系)增殖;GFHNV毒株为实验室分离所得,由KF-1细胞系增殖。病鱼样本:CCV病样是由美国夏威夷大学鲁元安老师于2005年赠送鮰鱼组织,KHV病样是由本实验室于2010年从广州某渔场的锦鲤中获得的。
LB固/液体培养基干粉 购自life公司;病毒DNA抽提试剂盒 购自Qiagen公司;pMD18T载体、T4 DNA连接酶、PCR试剂盒、凝胶回收试剂盒、质粒纯化试剂盒 均购自宝生物工程(大连)有限公司(TaKaRa)。
ABI7500荧光定量PCR仪 美国ABI公司;核酸蛋白分析仪 德国Eppendorf公司;凝胶成像仪Gel Logic 4000 pro 美国柯达公司;电泳仪 北京六一仪器厂。
1.2 实验方法
1.2.1 病毒DNA的提取 分别从感染CCV病毒的CCO细胞,感染KHV病毒的KF-1细胞,感染EHNV病毒的EPC细胞,感染RSIV病毒的GF细胞和感染GFHNV病毒的KF-1细胞中提取五种病毒的DNA,所用试剂盒为DNeasy® Blood&Tissue Kit(Qiagen),方法参考该试剂盒的使用手册。
1.2.2 三种病毒阳性标准品的制备 用特异性引物组CF/CR、KF/KR和EF/ER(20μmol/L)通过PCR方法扩增DNA聚合酶基因片段,模板为从病毒的细胞培养物提取的DNA,DNA序列来自GenBank,见表1。PCR反应体系(50μL):Ex Taq酶缓冲液25μL(含DNA聚合酶和dNTP),上游引物1μL,下游引物1μL,模板6μL,ddH2O 17μL。反应条件:95℃预变性3min、94℃变性45s、退火温度见表1、退火45s、72℃延伸80s为一个循环,进行31个循环后,72℃再延伸7min。电泳鉴定,并用试剂盒MiniBEST Agarose Gel DNA Extraction Kit Ver.3.0(TaKaRa)分别回收相应目的片段,然后将回收的目的片段与pMD18-T载体连接。连接产物分别转化E.coliDH5α感受态细胞,通过菌落PCR筛选阳性克隆,用试剂盒MiniBEST Plasmid Purification Kit Ver.3.0(TaKaRa)提取质粒,测序鉴定。得到测序结果后,用核酸蛋白分析仪测定阳性质粒浓度,根据阿弗加德罗常数将浓度转换为拷贝数,将获得的重组质粒作为阳性对照参照标准。1.2.3 Taqman探针及其引物的设计与合成 根据GenBank中CCV、KHV和EHNV三种病毒的DNA聚合酶基因序列,运用Primer express 3.0软件针对三种病毒分别设计引物并筛选出符合条件的探针序列,再运用BLAST分析探针的特异性,设计并得到表2中引物和探针,三种探针的5′端分别用FAM、JOE、TAMRA三种荧光染料标记,3′端用BHQ1猝灭集团标记。
1.2.4 引物、探针浓度及反应条件优化 将三种病毒阳性质粒稀释,浓度大致为106拷贝/μL,以稀释后的三种病毒阳性质粒为模板,按试剂盒Platinum® 定量PCR SuperMix-UDG的操作手册进行荧光PCR反应。分别选用0.2、0.3、0.4、0.5、0.6μmol/L的引物浓度和0.2、0.3、0.4、0.5、0.6μmol/L的探针浓度,采用矩阵法筛选和确定引物和探针的最佳浓度,以获得最低的CT值和较高的相对荧光强度增加值(ΔRn)时的引物和探针浓度为最佳。
1.2.5 三重荧光定量PCR的建立 三重荧光定量PCR反应体系(20μL):2×qPCR SuperMix-UDG 10μL,CCV引物(上下游各20μmol/L)0.5μL,KHV引物(上下游各20μmol/L)0.5μL,EHNV引物(上下游各20μmol/L)0.5μL,CCV探针(10μmol/L)0.5μL,KHV探针(10μmol/L)0.5μL,EHNV探针(10μmol/L)0.5μL,Rox 0.5μL,模板2μL,ddH2O 3μL。反应条件:95℃,10min;95℃,15s;60℃,1min;40个循环。

表2 三重荧光定量PCR使用的引物和探针Table 2 Primers and probes used in Triplex real-time PCR assay
1.2.6 特异性实验 提取另外两种双链DNA病毒(RSIV和GFHNV)的DNA作为模板,分别进行三重荧光定量PCR检测,以确定三重荧光定量PCR反应的特异性。
1.2.7 敏感性实验 用分光光度计分别测定3种病毒的DNA阳性质粒的原始浓度,通过分子量计算出单位体积的拷贝数,并将3种病毒阳性样品稀释到相同浓度,分别混合均匀后,做10倍系列稀释,得到3种病毒DNA浓度均为107、106、105、104、103和102拷贝/μL,利用已建立的三重荧光定量PCR的方法在同一试管检测三种病原。
1.2.8 三重和单重荧光定量PCR方法的比较 为比较三重荧光定量PCR与单重之间的差异,将三种病毒混合后,十倍梯度稀释,取混合液中浓度为106、105、104和103拷贝/μL的四个稀释度为模板,然后分别用单重实时荧光PCR和多重实时荧光PCR进行检测,每组做三个平行,以确定单重和多重实时荧光PCR之间的差异。
单重荧光定量PCR反应体系(20μL):2×qPCR SuperMix-UDG 10μL,引物(上下游各20μmol/L)0.5μL,探针(10μmol/L)0.5μL,ROX 0.5μL,模板2μL,ddH2O 6μL。反应条件:95℃,10min;95℃,15s;60℃,1min;40个循环。
1.2.9 三重荧光定量PCR对病鱼组织样的检测 本研究用三重荧光定量PCR方法对相应的病鱼样本进行检测,以验证该方法的灵敏性和特异性,病料来源是深圳出入境检验检疫局动植中心水生动物检测重点实验室保存的已经确诊感染CCV病毒的和感染KHV病毒的病鱼组织样品,这两种病料经实验室PCR检测并测序,确证分别感染了相应病毒。然而由于国内未有EHNV引起的发病报道以及没有分离到相应的病原,本方法未能对该病毒的样品进行检测。DNA抽提使用试剂盒(DNeasy® Blood&Tissue Kit,Qiagen),方法参考该试剂盒的操作手册。从病料中分别抽提两种病毒的DNA,并将得到的DNA样品按1∶1混合,用建立的三重荧光定量PCR方法进行检测。
2 结果与分析
2.1 三重荧光定量PCR体系的建立
由图1可知,同一反应体系中,三种信号间的影响不大,可以有效的区分出来。三种荧光信号的强度,FAM>JOE>TAMRA。对引物探针优化的实验结果表明,不同浓度的引物和探针的配比对检测结果的影响较大,而三种引物和探针的浓度比为2∶1时,效果较好。本实验采用的是:三种引物的浓度为0.5μmol/L,探针为0.25μmol/L。

图1 三重荧光定量PCR扩增曲线Fig.1 Amplification curve of the Triplex real-time PCR assay
2.2 三重荧光定量PCR特异性实验
提取RSIV和GFHNV作为模板,分别进行三重荧光定量PCR检测,以确定该方法的特异性,结果这两种病毒都没有扩增,说明该方法有较强特异性。
2.3 三重荧光定量PCR干扰性实验
为确定3种病毒的探针、引物之间是否存在相互干扰现象,用三重反应体系分别对CCV、KHV和EHNV的DNA病毒模板进行扩增,结果均只有一种对应的特异性探针发生水解,得到一条与单重荧光PCR一致的典型曲线,另外两种探针检测显示为阴性,说明各探针、引物之间无相互干扰现象。
2.4 三重荧光定量PCR敏感性实验
对由3种混合的病毒稀释的阳性标准品进行三重荧光定量PCR检测,如图2所示,A、B、C分别为CCV、KHV和EHNV的灵敏度测试结果。由图可知在模板浓度为107拷贝/μL~102拷贝/μL时,浓度与CT值成正比;而当模板浓度为10拷贝/μL时,CT值与模板浓度不成线性关系,且呈现弱阳性。故三重荧光定量PCR对3种DNA病毒模板最低可检测至102拷贝/μL。
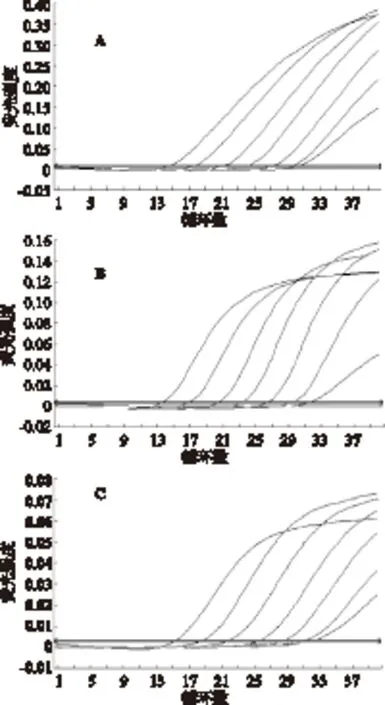
图2 三重荧光定量PCR灵敏度检测Fig.2 Sensitivity detection of the Triplex real-time PCR assay注:A为CCV的灵敏度测试结果; B为KHV的灵敏度测试结果; C为EHNV的灵敏度测试结果。
2.5 三重和单重荧光定量PCR方法的比较
由表3可见,三重荧光定量PCR在对三种病毒的不同浓度模板检测时,CT值每梯度之间相差在3.3左右,说明仪器操作带来的误差对CT值的影响较小,说明影响PCR的CT值差异的主要因素是模板浓度的变化。而变异系数介于0.24%~2.42%之间,说明该法具有良好的稳定性。对数据分析的结果,单重实时荧光PCR和三重荧光定量荧光PCR在同一浓度模板检测上并没有明显差异。
2.6 三重荧光定量PCR对病鱼组织样品的检测
图3为实际组织样品的检测结果,含CCV的五个重复样品检测结果CT值为13.8,根据阳性样品的标准曲线,检测浓度为107拷贝/μL,说明样本中含有CCV核酸浓度较高,含KHV的五个重复样品检测结果CT值为19,根据阳性样品的标准曲线,检测浓度为105拷贝/μL,说明样本中含有KHV核酸浓度略少,该方法能够有效的区分CCV和KHV,引物和探针之间没有相互干扰现象,检测一致性较好。而且,检测结果不受样品中其它核酸的影响,表明该检测方法中的引物和探针具有很好的特异性。

表3 四种不同稀释度模板的单重 和三重荧光定量PCR效果比较Table 3 Amplification comparison of singlet and Triplex real-time PCR assay on four different dilutions template
*注:三重荧光定量的CT值与各自单重荧光定量的CT值无显著差异(p>0.05)。

图3 三重荧光定量PCR对受感染病鱼的检测Fig.3 Detection of infected diseased fish by the Triplex real-time PCR assay
3 结论与讨论
OIE手册推荐的水生动物病毒检测方法全部基于普通PCR技术,但是在具体操作过程中发现这种传统经典方法敏感性仍然不够高,经常发生漏检现象(通过细胞分离法做比对实验验证)[9]。由于荧光定量PCR具有自动化程度高、无需电泳、灵敏度高和检测速度快等的特点,因此,对病原的实际检测中该方法具有很高的实用性。国内外已有通过荧光定量PCR技术对水产品种出现的双链DNA病毒检测研究[10-14],目前,主流荧光定量PCR方法对各种病原的检测仍然是一对一的检测方法,在大批量样品的筛选时,单重荧光PCR在成本和工作效率上存在较大的劣势,因此高通量、低成本、高效率的进行批量快速检测将是未来检测技术的发展趋势[15-16]。
本实验针对斑点叉尾鮰病毒(CCV)、锦鲤疱疹病毒(KHV)和流行性造血器官坏死病毒(EHNV)三种病毒的DNA聚合酶基因设计引物探针,应用PCR仪器的多通道检测功能,建立了基于三条不同荧光信号标记的Taqman探针的三重荧光PCR检测体系。实验验证了三重方法的特异性,对同属的病原具有很好的鉴别能力,同时,也排除了3种探针和相应引物之间的干扰性。比较实验的结果也表明单重实时荧光PCR和三重荧光定量PCR在相同模板检测上并没有明显差异,对三种病毒的检测下限均能达到102拷贝/μL,相比普通PCR方法具有很高的灵敏性。因此,本实验建立的三重荧光定量PCR就可以对样品中存在的一种或多种双链DNA病毒做出检测,从而大大提高了工作效率,节省了检测成本。本文也为针对水产品中其他的双链DNA病毒多重荧光定量PCR检测技术提供了参考依据。
[1]卢良恕. 水生动物疫病防治工作迫在眉睫[J]. 中国动物保健,2004,3:50-51.
[2]Fauquet C M,Mayo M A,Maniloff J,etal. VIIIth Report of the International Committee on Taxonomy Viruses[M]. Academic Press,2005:145-162.
[3]Manual of Diagnostic Tests for Aquatic Animals,World Organization for Animal Health[M]. OIE,2013:256-259,328-335.
[4]Joon B J,Kyung H P,Ho Y K,etal. Multiplex PCR for the diagnosis of red sea bream iridoviruses isolated in Korea[J]. Aquaculture,2004,235(1-4):139-152.
[5]Andor D,Scott E,LaPatra B M. Molecular confirmation of a new herpesvirus from catfish(Ameiurus melas)by testing the performance of a novel PCR method,designed to target the DNA polymerase gene of alloherpesviruses[J]. Arch Virol,2008,153(11):2123-2127.
[6]Hagit K,Gilad H,Ariel D. Detection and phylogeny of Lymphocystivirus in sea bream Sparus aurata based on the DNA polymerase gene and major capsid protein sequences[J]. Aquaculture,2008,275(1-4):58-63.
[7]Taisei I,Masakazu Y,Shotaro I,etal. Detection and sequence analysis of DNA polymerase and major envelope protein genes in koi herpesviruses derived from Cyprinus carpio in Gunma prefecture,Japan[J]. Veterinary Microbiology,2005,110(1-2):27-33.
[8]Chen M H,Kuo S T,Renault T,etal. Development of a polymerase chain reaction for the detection of abalone herpesvirus infection based on the DNA polymerase gene[J]. Journal of Virological Methods,2012,185(1):1-6.
[9]Anneke E R,Joy A B,Alison T,etal. Development of a quantitative polymerase chain reaction(qPCR)assay for the detection of dwarf gourami iridovirus(DGIV)and other megalocytiviruses and comparison with the Office International des Epizooties(OIE)reference PCR protocol[J]. Aquaculture,2012,358-359:155-163.
[10]Diana J,Alison T,Richard J W. A validated quantitative polymerase chain reaction assay for the detection of ranaviruses(Family Iridoviridae)in fish tissue and cell cultures,using EHNV as a model[J]. Aquaculture,2012,356-357:186-192.
[11]范万红,刘荭,江育林. 锦鲤疱疹病毒实时定量PCR检测方法的建立于应用[J]. 中国海洋大学学报,2007,37(5):785-788.
[12]孙颖杰,周优,岳志芹,等. 淋巴囊肿病毒实时定量PCR检测方法的建立和应用[J]. 中国海洋大学学报,2009,39(2):253-258.
[13]李惠芳,刘荭,吕建强,等. TaqMan实时荧光PCR快速检测斑点叉尾鮰病毒[J]. 长江大学学报:自然科学版,2008,5(1):42-46.
[14]张旻,景宏丽,方珍珍,等. 一种真鲷虹彩病毒实时荧光定量PCR检测方法的建立[J]. 检验检疫学刊,2011,21(5):38-41.
[15]韩春来. 三种食源性致病菌多重荧光PCR检测方法的建立[J]. 家禽科学,2011,8:11-14.
[16]许建明,段向英,张念之,等. 三重实时荧光RT-PCR检测三种鱼类弹状病毒的研究[J]. 检验检疫学刊,2009,19(1):5-10.
Study on rapid detection of double-stranded DNA viruses by the Triplex real-time PCR assay
HUANG Jia-ming1,2,NING Xi-bin1,SHI Xiu-jie2,LIU Hong2,CONG Jian1,LAN Wen-sheng2,*
(1.College of Food Science and Engineering,Shanghai Ocean University,Shanghai 201306,China;2.Shenzhen R&D Key Laboratory of Alien Pest Detection Technology,Animal & Plant Inspection and Quarantine Technical Center,Shenzhen Entry-Exit Inspection and Quarantine Burea,Shenzhen 518045,China)
Object:Establish rapid,sensitive and specific methods of detecting three double-strand DNA viruses,Channel catfish virus(CCV),Koi herpesvirus(KHV),Epizootic hematopoietic necrosis virus(EHNV),from fish samples. Method:Three pairs of specific primers and three Taqman probes were designed targeting for conserved sequence of DNA polymerase gene of three kinds of virus. The Triplex real-time PCR assay was established. The sensitivity and specificity of the method were evaluated. Results:The sensitivity of this method was 102copy·μL-1for detecting DNA of three viruses. The assay was specified for three kinds of virus CCV,KHV and EHNV. In the experiment,non-interference between primers and probes was found. Conclusion:The Triplex real-time PCR assay was a stable and reliable method for rapid detection of three double-strand DNA viruses in aquatic animal products.
CCV;KHV;EHNV;Triplex real-time PCR
2014-04-08
黄佳鸣(1989-),男,硕士研究生,研究方向:食品安全。
*通讯作者:兰文升(1968-),男,博士,高级兽医师,研究方向:水生动物疫病学。
国家质检总局科技计划项目(2013IK052);深圳出入境检验检疫局科技计划项目(SZ2011003)。
TS254.7
A
1002-0306(2015)01-0311-05
10.13386/j.issn1002-0306.2015.01.057

