食源性MRSA氨基糖苷类耐药基因多重PCR方法建立
战晓微,郑秋月,傅俊范,徐君怡,陈 璐,董姝君
(1.沈阳农业大学,植物保护学院,辽宁沈阳 110866;2.辽宁出入境检验检验局,辽宁大连 116001;3.沈阳市排水管理处,辽宁沈阳 110000;4.大连市第二十四中学,辽宁大连 116001)
食源性MRSA氨基糖苷类耐药基因多重PCR方法建立
战晓微1,郑秋月2,*,傅俊范1,徐君怡2,陈 璐3,董姝君4
(1.沈阳农业大学,植物保护学院,辽宁沈阳 110866;2.辽宁出入境检验检验局,辽宁大连 116001;3.沈阳市排水管理处,辽宁沈阳 110000;4.大连市第二十四中学,辽宁大连 116001)
目的:了解食源性金黄色葡萄球菌中耐甲氧西林金黄色葡萄球菌(methicillin-resistantStaphylococcusaureus,MRSA)及对氨基糖苷类庆大霉素、卡那霉素抗生素的耐药性情况,并建立快速检测鉴定金黄色葡萄球菌耐药性多重PCR方法。方法:对金黄色葡萄球菌进行增菌培养,并提取DNA作为模板,以nuc基因作为菌属鉴定基因,mecA基因作为MRSA检测基因,aacA-aphD及aph(3′)-Ⅲa基因作为耐氨基糖苷类庆大霉素、卡那霉素的检测目的基因,建立四重PCR检测方法并进行特异性及灵敏度评价;利用所建立的方法检测72株食品及食物中毒患者来源的金黄色葡萄球菌。结果:成功建立四重PCR检测方法,且72株金黄色葡萄球菌均有nuc基因检出,mecA基因与MRSA检测符合率达100%,aacA-aphD、aph(3′)-Ⅲa基因与庆大霉素、卡那霉素耐药菌株的符合率达95.12%。结论:本实验所建立的多重PCR方法灵敏度高、特异性好,可以快速检测出MRSA,并对氨基糖苷类庆大霉素、卡那霉素耐药菌株检测具有较高的准确率。
耐甲氧西林金黄色葡萄球菌,氨基糖苷类,耐药基因
随着抗生素的广泛使用,食源性金黄色葡萄球菌耐药株、多重耐药株广泛流行,其中被称为“超级细菌”的耐甲氧西林金黄色葡萄球菌(methicillin-resistant S.aureus,MRSA)常表现为多重耐药,其具有传染力强、多重耐药性、致病毒力因子多等特点[1],成为临床抗感染治疗的一大难题[2]。另外,由于MRSA常表现为对氨基糖苷类、大环内酯类、四环素类等其他多种抗生素同时耐药[3],因此,由MRSA其引起的感染常难以控制。MRSA的耐药性与mecA基因编码的青霉素结合蛋白2a(penicillin binding protein 2a,PBP2a)密切相关[4],因此,mecA检测通常被认为是检测MRSA的“金标准”。MRSA自1961年Jevons首次报道以来,在世界各地相继出现,近年来,随着医院内MRSA感染的日益严重,其在猪、牛等家畜中呈高流行率,且该菌是引起牛乳房炎最主要的病原菌之一[5],由于动物源性细菌和耐药基因可以通过食物链传播,会对人类健康造成严重危害[6]。

表1 四种引物序列Table 1 Sequences of four sets of primers for target genes
由于氨基糖苷类抗生素近年来被大量使用于抗金黄色葡萄球菌,使其耐药菌株逐渐出现,且有报道称猪源MRSA中对氨基糖苷类卡那霉素、庆大霉素、托普霉素和新霉素等的耐药性为30%左右[7-8],多重耐药现象大大增加了人类感染后治愈的难度。氨基糖苷修饰酶(AME)的产生是细菌对氨基糖苷抗菌药物耐药的主要机制,AME主要有3种:氨基糖苷乙酰转移酶(AAC)、氨基糖苷核甙转移酶(ANT)和氨基糖苷磷酸转移酶(APH),共30多种基因型,并不断有新的基因型发现。产广谱氨基糖苷修饰酶AAC(6′)-APH(2′)是金黄色葡萄球菌耐氨基糖苷类抗生素的主要原因,该酶是国内多数地区主要流行AME类型,可由aacA-aphD基因编码[9];其次流行的AME是APH(3′)酶,该酶可由aph(3′)-Ⅲa基因编码[10]。
本文利用多重PCR方法,针对金黄色葡萄球菌的特异性nuc基因,MRSA的耐药决定因子mecA基因及耐庆大霉素/卡那霉素基因(aacA-aphD、aph(3′)-Ⅲa)建立多重PCR快速检测方法,以快速鉴定出金黄色葡萄球菌,并检测MRSA及耐庆大霉素/卡那霉素金黄色葡萄球菌。
1 材料与方法
1.1 材料与仪器
实验菌株 72株金黄色葡萄球菌(来源见表3);耐氨基糖苷类抗生素MRSA,金黄色葡萄球菌ATCC25923,大肠杆菌1株、沙门氏菌1株、单增李斯特菌1株、副溶血性弧菌1株、粪肠球菌1株、铜绿假单胞菌1株(均由本实验室保存)。
培养基 营养琼脂,Mueller-Hinton(M-H)培养基,baird parker琼脂(B-P),胰蛋白胨大豆琼脂培养基(TSA),胰蛋白胨大豆肉汤(TSB)美国BD公司。
苯唑西林(OXA)、头孢西丁(CFX)、庆大霉素(GEN)、卡那霉素(KAN)、妥布霉素(TOB) 杭州天和微生物;prepman uitra 细菌提取试剂 美国AB公司;TaqDNA聚合酶,dNTPmixture,DNA marker,Goldview 大连宝生物公司;PCR引物 由大连宝生物公司合成。
微生物自动鉴定系统 PHOENIX-100,美国BD公司;PCR扩增仪 TC3000G,英国TECHNE公司;超微量紫外可见光分光光度计 NANODROP2000C,Thermo公司;电泳仪 600SI,上海博彩生物科技有限公司;凝胶成像系统 GBOX-F3,GENE公司。
1.2 实验方法
1.2.1 金黄色葡萄球菌鉴定及药敏实验 根据金黄色葡萄球菌检验GB 4789.10-2010方法分离鉴定金黄色葡萄球菌,根据《动物及其制品中细菌耐药性的测定纸片扩散法》SN/T1944-2007方法检测菌株对苯唑西林,头孢西丁,庆大霉素、卡那霉素、妥布霉素抗生素的耐药性,参照美国临床和实验室标准研究所(CLSI)的解释标准及M100-S23的更新内容进行结果判读[11-13],质量控制与细菌耐药性测定同步进行,测量质控菌株的抑菌环,其直接应在规定范围之内,操作方法及质控菌株抑菌环直径限度范围参见SN/T1944-2007方法。质控菌株金黄色葡萄球菌ATCC25923。
1.2.2 多重PCR方法建立 以prepman uitra 细菌提取方法提取细菌DNA,使用紫外分光光度计分别测定吸收波长260nm及280nm的OD值,当OD260/OD280的比值在1.6~1.9之间时,表明细菌DNA适宜进行PCR实验;利用公式OD260×稀释倍数×50/1000计算DNA浓度,-20℃保存。
[14-17],设计合成检测引物(表1),参照TAKARA公司TaqTM操作说明书配制PCR反应液,并调整各引物浓度,确定四重PCR反应体系为:Taq聚合酶0.25μL,10×buffer 5μL,dNTP mixture 4μL,nuc、mecA、aph(3′)-Ⅲa、aacA-aphD四种引物添加量分别为2.4、2.4、2.4、0.8μL(10μmol/L),DNA 5μL,dH2O补足至50μL。将PCR反应液于PCR扩增仪进行PCR扩增,反应条件为:94℃,3min;94℃,1min,55℃,1min,72℃,1min,35个循环;72℃,7min。取PCR产物10μL上样,进行琼脂糖凝胶电泳检测,3%琼脂糖电泳,电压为200V,电流190mA,电泳时间为20min,电泳结束后,将胶置于凝胶成像系统下鉴定。针对nuc、mecA、aph(3′)-Ⅲa、aacA-aphD四种引物进行单一PCR扩增及电泳检测,同时将携带有mecA、aph(3′)-Ⅲa、aacA-aphD基因的阳性菌株混合后进行DNA提取,并进行PCR检测,同时设置阴性对照。

表2 金黄色葡萄球菌在不同稀释度下的细菌数量(单位:cfu/mL)Table 2 The number of bacteria in different dilution for S.aureus(cfu/mL)

表3 72株金黄色葡萄球菌分离株耐药性检测结果及来源Table 3 The detection results of antibiotic resistance and origin of 72 strains for S. aureus
1.2.3 四重PCR检测方法的应用 利用所建立的四重PCR检测方法对与食品相关的不同来源的72株金黄色葡萄球菌进行检测,同时用全自动微生物鉴定系统和纸片扩散法进行检测,比较检测结果,确定所建立的方法与经典检测方法的符合率,评价其可靠性及实用性。
2 结果与分析
2.1 四重PCR检测方法特异性及灵敏度
提取DNA,根据已建立的PCR检测方法进行PCR扩增并电泳检测,结果(图1)显示金黄色葡萄球菌可扩增出PCR片段,而大肠杆菌、沙门氏菌、单增李斯特菌、副溶血性弧菌、粪肠球菌、铜绿假单胞菌未扩增出,表明建立的方法对金黄色葡萄球菌具有较好的特异性。
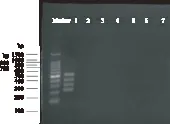
图1 四重PCR检测方法特异性试验Fig.1 Specificity test of multiple PCR detection method注:1.金黄色葡萄球菌;2.大肠杆菌;3.沙门氏菌; 4.单增李斯特菌;5.副溶血性弧菌;6.粪肠球菌; 7.铜绿假单胞菌;泳道1中扩增条带依次为 523,400,310,227bp。
经梯度稀释后检测金黄色葡萄球菌增菌液的细菌数量,其不同稀释度下的细菌数量见表2,利用本实验所建立的方法对不同稀释度下的金黄色葡萄球菌进行DNA提取并PCR检测,多重PCR检测结果(图2)显示,本实验所建立的多重PCR检测方法可检测到10-5稀释倍数的菌液(细菌数量为2.3×103cfu/mL)。
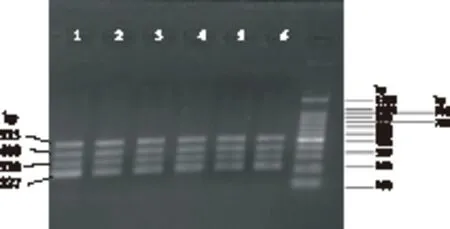
图2 四重PCR检测方法灵敏度试验Fig.2 Sensitivity test of multiple PCR detection method注:1. 2.3×108cfu/mL;2. 2.3×107cfu/mL; 3. 2.3×106cfu/mL; 4. 2.3×105cfu/mL;5. 2.3×104cfu/mL; 6. 2.3×103cfu/mL。
2.2 四重PCR检测方法应用
通过金黄色葡萄球菌检验方法GB 4789.10-2010分离出的72株不同来源的金黄色葡萄球菌经全自动微生物鉴定系统确定,该72株菌均为金黄色葡萄球菌属。利用本实验建立的多重PCR方法检测此72株菌,其中72株金黄色葡萄球菌均检出nuc基因,检出42株菌携带mecA基因,38株菌携带aacA-ahpD基因,3株菌携带aph(3’)-Ⅲa基因,其中2株菌同时携带aacA-ahpD基因和aph(3’)-Ⅲa基因(结果见表3,图3)。

续表

续表

图3 金黄色葡萄球菌PCR检测结果Fig.3 PCR detection results of staphylococcus aureus
注:耐药基因型结果:+表示PCR阳性,-表示PCR阴性;耐药表型结果:R表示耐药,I表示中介,S表示敏感。
3 讨论
本实验中,对72株金黄色葡萄球菌进行纸片扩散法及全自动微生物鉴定系统进行耐药表型检测,结果表明,携带mecA基因的金黄色葡萄球菌对苯唑西林及头孢西丁均显示为耐药及中介耐药,而未携带mecA基因的金黄色葡萄球菌对苯唑西林及头孢西丁均显示为敏感,说明多重PCR方法对MRSA的检测与耐药表型检测方法的结果一致。只携带氨基糖苷类耐药基因aacA-ahpD的金黄色葡萄球菌共36株,其中有3株对庆大霉素耐药对卡那霉素敏感,有5株对庆大霉素敏感对卡那霉素耐药,有28株对庆大霉素、卡那霉素均耐药;只携带氨基糖苷类耐药基因aph(3′)-Ⅲa的金黄色葡萄球菌有1株,该菌对卡那霉素耐药,对庆大霉素敏感;同时携带两种氨基糖苷类耐药基因aacA-ahpD和aph(3′)-Ⅲa的金黄色葡萄球菌为2株,其中1株对庆大霉素、卡那霉素均耐药,1株对卡那霉素耐药同时对庆大霉素敏感。由此可知,多重PCR方法检测出的携带氨基糖苷类耐药基因均对卡那霉素、庆大霉素两种抗生素中至少一种抗生素耐药,说明本方法对检测氨基糖苷类耐药菌株与传统方法检测结果一致。此外,另有1株食物中毒患者来源的金黄色葡萄球菌对卡那霉素敏感且对庆大霉素耐药;1株食品工作人员来源的金黄色葡萄球菌对卡那霉素及庆大霉素均耐药,未检出aacA-ahpD、aph(3′)-Ⅲa两种基因。因此,此72株金黄色葡萄球菌中39株携带至少一种氨基糖苷类耐药基因的耐药菌株与利用纸片扩散法检测的耐药表型结果一致,而有2株耐药表型为氨基糖苷类耐药人体分离株未检出aacA-aphD、aph(3′)-Ⅲa两种基因,耐药基因型和耐药表型的符合率达95.12%(39/41)。
MRSA及氨基糖苷类耐药菌株是目前金黄色葡萄球菌耐药菌株的常见类型,在进出口食品检疫中,尤其是对动物源性食品中耐药菌株的检测和预防更为关键。王伟等2013年报道877株金黄色葡萄球菌中猪源性菌株中MRSA检出率为20.6%,而食源性菌株的MRSA的检出率为3.6%[18]。燕霞等2012年报道浙江省奶牛养殖区的70株牛源金黄色葡萄球菌对庆大霉素的耐药率为67.1%[19]。面对该类耐药菌株高流行率的严峻现实,本实验建立的PCR方法通过检测耐药基因确定细菌耐药性,具有快速稳定的优势,弥补了食品检疫中纸片扩散法通过耐药表型判断耐药的检测方法耗时长、稳定性差等不足,同时也保障了食品检测中耐药菌株检测的准确性。
目前,金黄色葡萄球菌耐药性的检测方法主要有耐药表型和耐药基因型检测两类,其中主要包括纸片扩散法、MIC稀释法等方法的耐药表型检测目前仍是临床微生物耐药性检测的主要方式[20],而对于食源性、动物源性的金黄色葡萄球菌的耐药性检测标准仍以纸片扩散法为主,尽管传统手工药敏实验方法检测细菌耐药表型的方法较完善,且由于价格低廉,应用广泛,但仍然存在操作繁琐,耗时长,且受人为因素影响较大等问题,同时由于纸片扩散法主要是为抗生素灭菌提供参考,研究分离菌株对抗生素的耐受情况,而不是直接评估体外细菌耐药株对人体的影响,因此,针对耐药基因型检测的方法可有效地预防携带耐药基因的耐药菌株危害人类,且以PCR方法为基础的分子生物学技术检测细菌耐药基因的方法不但能够快速可靠地检测细菌耐药性,有效地避免手工药敏检测方法假阴性、假阳性的现象,也为细菌耐药机制的研究提供了有力工具[21]。
我国对金黄色葡萄球菌耐药菌株造成的公共卫生及食品安全问题虽然高度关注,但目前尚无一种快速准确稳定的检测方法。本研究建立的金黄色葡萄球菌,MRSA及氨基糖苷类耐药菌株多重PCR检测为实际检测提供了一种快速有效的方法。对耐药菌株不断增加的严峻形势,有必要尽快开展相关监测工作和技术储备,以便应对国际贸易中耐药性细菌对我国食品安全的冲击。
4 结论
根据本文所建立的多重PCR方法检测不同来源的72株金黄色葡萄球菌野生分离株发现,其中nuc基因、mecA基因检测结果与传统方法的检测结果符合率达100%,而携带氨基糖苷类耐药基因aacA-aphD、aph(3′)-Ⅲa的菌株与传统方法检测的耐药表型检测结果一致,说明本方法对检测aacA-aphD、aph(3′)-Ⅲa基因型的耐氨基糖苷类抗生素的金黄色葡萄球菌具有准确稳定快速的检测能力,此外,两株由人体分离的金黄色葡萄球菌耐药表型为氨基糖苷类抗生素耐药,但未检出aacA-aphD、aph(3′)-Ⅲa基因,可能由于该耐药菌株为其他耐药基因型或其他耐药机制引起,在未来的工作中将进一步研究。
参考文献
[1]Franklin D L Antimicrobial resistance:the example of Staphylococcus aureus[J]. J Clin Invest,2003,111:1265-1273.
[2]茆海丰,徐兆云.MRSA和MSSA氨基糖苷类药物耐药性和耐药基因检测[J].现代检验医学杂志,2006,21(5):36-38.
[3]李宏,李伟,郭秀娟,等.金黄色葡萄球菌耐药性及耐药基因检测[J].河北医药,2012,34(1):44-46.
2016年4月24日播种蕹菜育苗,5月24日移栽。供试材料处理和施基肥、追肥、取土样、捞剩余秸秆的方式,以及采收标准等均按文献[10]的方法进行。根据蕹菜茬口共计栽培138 d,分别于6月17日、7月4日、7月22日、8月8日、8月27日、9月17日和10月8日共采收7次。
[4]Song M D,Wachi M,Doi M,etal.Evolution of an inducible penicillin-target protein in methicillin-resistantStaphylococcusaureusby gene fusion[J].FEBS Lett.1987,221:167-171.
[5]苏洋,蒲万霞,陈智华,等.牛源金黄色葡萄球菌的耐药性及耐甲氧西林金黄色葡萄球菌的检测[J].中国农业科学,2012,45(17):3602-3607.
[6]Ferber D. Livestock feed ban preserves druds’ power[J]. Science,2002,295:27-28.
[7]刘君,陈创夫,褚明亮,等.牛源耐甲氧西林金黄色葡萄球菌的分离鉴定[J].动物医学进展,2008,29(9):42-44.
[8]杨智满,舒畅.猪群中耐甲氧西林金黄色葡萄球菌的高流行率[J]. 国外畜牧学,2007,27(4):57-59.
[9]Takezo U.Dissemination of nosocomial multiple-aminoglycoside-resistantStaphylococcusaureuscaused by horizontal transfer of the resistance determinant(aacA/aphD)and clonal spread of resistant strains[J]. Am J Infect Control,2004,6:215-219.
[10]杨宏军,高运东,王长法,等.PCR扩增Nuc基因检测奶牛乳腺炎致病性金黄色葡萄球菌[J].家畜生态学报,2007,28(6):80-82.
[11]GB 4789.10-2010,食品微生物学检验:金黄色葡萄球菌检验.[S].
[12]SN/T1944-2007,动物及其制品中细菌耐药性的测定纸片扩散法[S].
[13]Clinical and Laboratory Standards Institute. M100-S23 Performance standards for antimicrobial susceptibility testing:twenty-third informational supplement[S]. Wayne,PA:CLSI,2013.
[14]Cremonesi P,Luzzana M,Brasca M,etal. Development of a multiplex PCR assay for the identification ofStaphylococcusaureusenterotoxigenic strains isolated from milk and dairy products[J]. Molecular and Cellular Probes,2005,19:299-305.
[15]Wang X,Meng JH,Zhang J,etal. Characterization ofStaphylococcusaureusisolated from powdered infant formula milk and infant rice cereal in China[J]. Int J Food Microbiol,2012,153:142-147.
[16]Turutoglu H,Hasoksuz M,Ozturk D,etal. Methicillin and aminoglycoside resistance inStaphylococcusaureusisolates from bovine mastitis and sequence analysis of their mecA genes[J]. Vet Res Commun,2009,33:945-956.
[17]Strommenger B,Kettlitz C,Werner G,etal. Multiplex PCR. Assay for simultaneous detection of nine clinically relevant antibiotic resistance genes inStaphylococcusaureus[J]. J Clin Microbiol,2003,41:4089-4094.
[18]王伟,郭云昌,裴晓燕,等.中国食源性和猪源性耐甲氧西林金黄色葡萄球菌遗传特性和耐药特征分析[J].卫生研究2013,42(6):925-931.
[19]燕霞,陈俭,张丽佳,等.浙江省主要奶牛养殖区乳房炎致病菌金黄色葡萄球菌的耐药性[J]. 福建农林大学学报,2012,41(6):633-636.
[20]杨华为,蒋迪,王璨,等. 细菌鉴定和耐药性检测方法的发展[J].临床药物治疗杂志,2006,4(4):39-43.
[21]夏成静,陆学东.分子生物学技术在病原菌耐药检测中的应用进展[J]. 中华医院感染学杂志,2008,18(2):297-300.
Establishment of Aminoglycoside resistance gene of foodborne MRSA detection method by Multiple-PCR
ZHAN Xiao-wei1,ZHENG Qiu-yue2,*,FU Jun-fan1,XU Jun-yi2,CHEN Lu3,DONG Shu-jun4
(1.Shenyang Agricultural University,College of Plant Protection,Shenyang 110866,China;2. Liaoning Entry-Exit Inspection and Quarantine Bureau,Dalian 116001,China;3. Shenyang Municipal Drainage Management,Shenyang 110000,China;4. Dalian NO.24 High School,Dalian 116001,China)
Objective:To investigate the prevalence of methicillin-resistantStaphylococcusaureusMRSA and resistance to Aminoglycoside gentamicin,kanamycin in foodborneS.aureus,and establish a rapid quadruple-PCR method for detection and identification antibiotic resistance ofS.aureus. Methods:Genomic DNA was extracted as template for PCR fromS.aureusrecoveried and cultured in enrichment medium. According to nuc for Genus,mecA for MRSA,aacA-aphD and aph(3′)-Ⅲa for Gentamicin and kanamycin,quadruple-RCR detection method was developed,its sensitivity and specificity were evaluated;a total of 72 strains ofS.aureusfrom food and patients with food poisoning were detected by quadruple RCR method. Results:Quadruple-RCR detection method was established. 72 strains ofS.aureusall had nuc,the coincidence rate of mecA and MRSA was 100%,the coincidence rate of aacA-aphD,aph(3’)-Ⅲa and gentamicin,kanamycin was 95.12%. Conclusion:this established quadruple-RCR method was specific,sensitive. MRSA could be tested rapidly,and there was high accurate rate for detection of gentamicin,kanamycin resistant strains ofS.aureus.
MRSA;aminoglycoside;resistant gene
2014-01-21
战晓微(1986-),女,博士,研究方向:有害生物与环境安全。
*通讯作者:郑秋月(1972-),女,博士,高级工程师,研究方向:食品安全检测与研究。
科技部质检公益性专项课题(201210043)。
TS201.3
A
1002-0306(2015)01-0303-06
10.13386/j.issn1002-0306.2015.01.055

