荧光定量PCR方法鉴别肉制品中羊源性成分
赵 新,王 永,兰青阔,刘 娜,陈 锐,朱 珠,李欧静
(天津市农业质量标准与检测技术研究所,天津 300381)
荧光定量PCR方法鉴别肉制品中羊源性成分
赵 新,王 永*,兰青阔,刘 娜,陈 锐,朱 珠,李欧静
(天津市农业质量标准与检测技术研究所,天津 300381)
根据羊线粒体DNA细胞色素b基因序列,设计特异性引物和Taqman探针。通过反应条件的优化筛选,构建标准曲线,建立灵敏、可靠的肉制品中羊源性成分的实时荧光PCR鉴别方法。结果表明,所设计的引物可有效地进行肉制品中羊肉成分的鉴别,特异性强,灵敏度高达16pg/μL;标准曲线扩增效率达98.561%,R2=1,符合《实时荧光定量国际化标准-MIQE指南》要求;本研究建立的方法检测结果与国标GB/T 20190-2006 方法结果符合率达100%,且不需电泳、酶切和测序等步骤。通过对市售肉制品样本的鉴别验证了方法的实用价值,为肉制品质量的有效控制提供了新的途径。
荧光定量PCR方法,羊源性成分,鉴别
随着市场上羊肉价格的不断大幅上涨,部分不法企业及商贩在高成本的羊肉中掺入低廉的其他肉类品种,或通过羊油浸泡、作料添加等方式处理后冒充羊肉进行销售,由此引发了国内乃至国际贸易中诸如“马肉风波”、“牛羊肉掺”等一系列的食品安全事件,严重危害了人民健康,扰乱和破坏了市场秩序。
20世纪80年代,国外开始对肉的种属鉴定进行研究,多应用复合PCR技术,随机扩增多态性PCR技术,限制性片段长度多态性PCR技术,巢式PCR技术以及实时荧光定量PCR技术对不同种属的肉类品种进行广泛研究,而国内针对鉴别肉品种类的研究多局限于普通PCR技术的应用[1-2]。同时,参比检疫部门依据国家标准《饲料中牛羊源性成分的定性检测定性聚合酶链式反应(PCR)法》(GB/T 20190-2006)对进出口饲料进行牛羊源性成分检测的一般PCR方法,均需对PCR产物进行凝胶电泳才能完成整个检测,而且一旦遇到可疑阳性结果,必须进行酶切鉴定[3]。因此,基于时效性和准确性上的优势,实时荧光定量PCR技术已经在动物源性成分检测的很多项目上逐步取代了普通PCR方法,成为检测动物源性成分最常用的分子生物学方法[4]。
国外多应用复合PCR技术,随机扩增多态性PCR技术,限制性片段长度多态性PCR技术,巢式PCR技术以及实时荧光定量PCR技术对不同种属的肉类品种进行广泛研究。
动物线粒体DNA(mitochondrial DNA,mtDNA)无组织特异性,进化速度快,大约为单拷贝核DNA的5~10倍,在基因组成上具有较高的保守性,一般由2个非编码区和37个编码基因组成,是研究动物种群遗传学和分子系统学最常用的分子标记。随着分子生物学技术的快速发展,动物线粒体基因组测序研究突飞猛进,迄今已有上千种动物完成了线粒体基因组全序列的测序。本研究根据用作动物品种鉴定标志的线粒体DNA,选取其中细胞色素b基因的保守区域,设计羊源性成分的引物与探针,以FAM荧光素进行标记,扩增目的片段大小为82bp,大小仅为国标方法目的片段的1/3,成功建立了鉴别羊源性成分的实时荧光定量PCR方法,适用于肉制品中动物源性成分产品的羊源性成分的鉴别[5]。
1 材料与方法
1.1 材料与仪器
生鲜羊肉、生鲜牛肉、生鲜猪肉、生鲜鸡肉、生鲜鸭肉、驴肉、鲫鱼、大豆粉 均购于天津市农贸市场;裂解液(10mol/L NaOH、500mmol/L EDTA、1mol/L Tris·Cl、5mol/L NaCl、10%十二烷基磺酸钠)、TE缓冲液(10mmol/L Tris·HCl、1mmol/L EDTA)、三氯甲烷-异戊醇(24∶1)、异丙醇、70%乙醇、灭菌双蒸水;定量PCR SuperMix-UDG预混液 invitrogen公司;引物、探针 由上海生工生物技术有限公司合成。
StepOnePlus Real-time PCR仪 美国ABI公司;SUB-cell GT核酸电泳仪、ND-1000 NanoDrop核酸蛋白测定仪 美国Bio-Rad公司;G:BOX凝胶成像系统 英国SYNGENE公司;Allegra 21R Centrifuge高速冷冻离心机 美国BECKMAN公司。
1.2 实验方法
1.2.1 引物与探针的设计 根据GenBank中公布的羊线粒体DNA细胞色素b基因序列,运用Primer Express 3.0软件,设计引物和探针序列,见表1,引物和探针由上海生工生物工程有限公司合成。

表1 PCR和测序引物序列Table 1 PCR primers and sequencing primers
1.2.2 标准品的制备 取生鲜羊肉和鸡肉的瘦肉部分切成约1cm3大小肉丁,用蒸馏水洗净,在10℃的蒸馏水中浸泡过夜,以去除多余的盐分和油脂,肉丁置搅拌机中充分绞碎,将肉泥于白瓷盘中铺成薄饼状,70℃烘干4h左右即为干饼,再置搅拌机中绞碎为干粉状。按照质量浓度,以鸡肉为基质,配制羊肉浓度含量为100%、50%、10%、5%、1%的标准品,备用。
1.2.3 DNA模板的提取 称取50mg样品,加入500μL DNA提取细胞裂解液和10μL蛋白酶K,混匀,55℃水浴消化2h,加入4μL RNA酶,37℃ 10min;将消化后的裂解液加入等体积的Tris饱和酚,缓慢颠倒混匀,12000r/min离心10min;取上清液,加入等体积的Tris饱和酚,缓慢颠倒混匀,12000r/min离心10min;取上清液,加0.5倍体积的Tris饱和酚和0.5倍体积的氯仿/异戊醇(24∶1),缓慢颠倒混匀,4℃ 12000r/min离心10min;取上清液,加0.1倍体积的乙酸钠溶液和2.5体积的4℃预冷的无水乙醇,轻轻颠倒混匀,4℃ 12000r/min离心5min;取沉淀,加500μL 70%乙醇洗涤沉淀2次;室温下放置使残留乙醇完全挥发,加入100μL TE(pH8.0)溶解DNA沉淀,在NanoDrop核酸蛋白测定仪中进行核酸含量的测定,也可用等效动物基因组提取试剂盒提取基因组DNA。
1.2.4 羊源性成分实时荧光PCR反应条件的建立 PCR反应体系为20μL,各成分含量为:2×SuperMix-UDG预混液10μL,上下游引物各1μL,探针引物0.4μL,模板2μL(模板浓度50ng/μL)无菌超纯水补足20μL,混匀后离心,在实时荧光PCR仪上开始循环。循环参数为:95℃预变性15min,然后进行45个循环,每个循环为95℃变性20s,62℃退火30s。
1.2.5 标准曲线的建立 将配制的50%、10%、5%、1%的4个梯度标准品作为模版,建立20μL反应体系,每个标准品设置3个平行,根据1.2.4建立的反应条件进行实时荧光PCR扩增。
1.2.6 方法特异性研究 分别选取生鲜牛肉、生鲜猪肉、生鲜鸡肉、生鲜鸭肉、驴肉、鲫鱼、大豆粉的DNA作为PCR反应的模版,以已知的生鲜羊肉DNA作为阳性对照模版,去离子水作为阴性对照模版,按1.2.4反应程序及条件进行实时荧光PCR扩增。
1.2.7 方法灵敏度研究 用鲑鱼精DNA将提取的羊肉DNA原液稀释至50ng/μL,然后进行5倍系列梯度稀释,即50、10、2ng/μL、400、80、16、3.2pg/μL、640fg/μL等8个梯度,去离子水作为阴性对照模版,以1.2.4建立的反应程序及条件进行实时荧光PCR检测。
1.2.8 样品检测 分别采用实时荧光PCR方法和国标GB/T 20190-2006方法对30份不同肉制品来源的DNA样品进行羊源性成分检测,验证所建立的实时荧光PCR方法检测肉制品中羊源性成分的适用性。在每一个检测实验中采用同管等量的DNA模板,每份DNA样品的每种方法检测必须重复2次,每次均设置2个平行实验,只有当每种方法的2次重复实验与所有平行实验结果都一致时,才确定该份DNA样品的检测结果,否则需重新进行检测。最后,分别比对2种方法对每一份DNA样品的检测结果是否一致,计算2种方法的检测结果符合率。
2 结果与分析
2.1 DNA模版提取及浓度测定
DNA提取结果如表2所示,260/280比值在1.8~2.0之间,260/230比值在2.0以上,提取方法对核酸中蛋白质、RNA、盐分等杂质的处理较为得当,同时用1%琼脂糖电泳检测核酸提取质量,可得到相对单一条带,符合定量检测DNA质量要求,结果见图1。
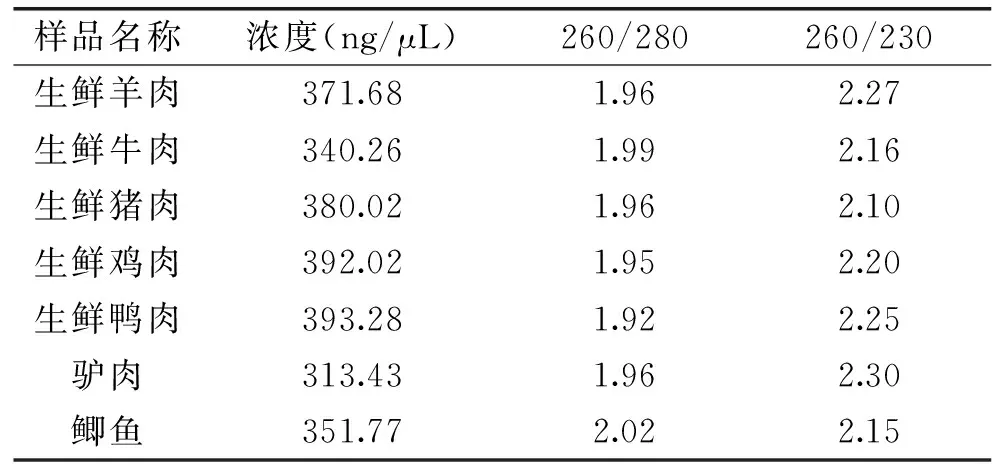
表2 不同肉源品种DNA浓度Table 2 DNA concentration of different meat varieties

图1 不同肉源品种DNA电泳检测Fig.1 DNA electrophoresis detection of different meat varieties注:M,DL2000 DNA Marker;1,生鲜羊肉;2,生鲜牛肉; 3,生鲜猪肉;4,生鲜鸡肉;5,生鲜鸭肉;6,驴肉;7,鲫鱼。
2.2 标准曲线的建立
本实验标准曲线的建立是通过对不同质量浓度梯度的标准品(50%、10%、5%、1%)进行扩增,每个梯度设三个重复,选取重复性好的作为标准点,以标准品的Ct值(threshold cycle)为横坐标对初始浓度的对数值作图,即得标准曲线y=-3.357x+32.942(注:标准曲线公式 y=ax+b,式中以Ct值作为y轴,以拷贝数的对数作为x轴),R2=1,扩增效率达98.561%,符合《实时荧光定量国际化标准-MIQE指南》要求,R2>0.980,扩增效率在90%~105%之间,如图2所示。在实时定量PCR过程中,Ct值是一个重要的参数,它与扩增产物成正比。反应初,模板数越高,需要越少的循环数达到荧光信号阈值,阈值的信号明显高于背景信号,这时所需要的循环数便是Ct值,有实验表明它总是出现在扩增指数期,根据每管中样品各自的Ct值,借助于标准曲线方程便可知其所含基因初始量。

图2 定量标准曲线Fig.2 Quantitative standard curve
2.3 引物和探针的特异性实验
分别选取生鲜牛肉、生鲜猪肉、生鲜鸡肉、生鲜鸭肉、熟驴肉、鲫鱼、大豆粉的DNA作为检测模板,使用real-time PCR进行检测,检测结果均为阴性,引物和探针的特异性较高,符合实验要求,见图3。同时以已知的生鲜羊肉DNA作为阳性对照,去离子水作为阴性对照模版,结果均正常,实验可信度较高。

图3 方法特异性研究荧光扩增曲线Fig.3 Fluorescent amplification curve of specific research method
2.4 方法敏感性实验
结果表明,以50、10、2ng/μL、400、80、16pg/μL的羊源性成分DNA样本作为模板时,均能收集到明显的FAM荧光扩增曲线,而以3.2pg/μL、640fg/μL的羊源性成分DNA样本和去离子水作为模板时,FAM 荧光扩增为阴性,如图4及表3所示,因此本方法的最低检出限为16pg/μL DNA浓度。

图4 方法灵敏度研究荧光扩增曲线Fig.4 Fluorescent amplification curve of sensitivity research method

表3 羊源性成分灵敏度检测结果Ct值Table 3 DNA concentration of different meat varieties

表4 本研究建立的实时荧光PCR方法和GB/T 20190Y-2006方法的样品检测比对结果Table 4 Comparison of results detected by real-time PCR and GB/T 20190-2006 method
2.5 实际样品鉴定结果
按方法1.2.4,分别采用本研究建立的实时荧光PCR方法和国标方法对30份不同肉制品来源DNA样品进行羊源性成分检测。检测结果表明,本研究建立的实时荧光PCR方法具有良好的特异性,与国标方法的检测结果符合率为100%,未出现假阳性或假阴性结果,两种方法的检测结果比对见表4。
3 结论与讨论
物种基因的正确选择及基因片段长度的大小是动物源性成分检测的关键。线粒体DNA是高等动物唯一的核外遗传物质,基因组中无间隔系列、无组织特异性、种内遗传稳定、种间高度变异、个体不同组织中均含有大量的线粒体、可以获得较高的拷贝数,已广泛用作食品及饲料中动物源性成分检测的靶基因[6-8]。
同时有研究表明待测样本DNA的破坏程度与加工温度密切相关,如加热到100℃,DNA片段长度会锐减到1100bp,至120℃则锐减到600bp以下[9],如果待测基因片段过长,可能在实际检测中无法发现目的片段。因此本研究特选择羊线粒DNA细胞色素b基因作为靶基因;同时采用Taqman实时荧光PCR技术,检测片段长度仅为82bp[10]。
本研究所建立的实时荧光定量PCR技术检测肉制品中羊源性成分具有较高的准确性与稳定性,通过荧光信号的检测可以直接对产物进行定量,再加上它高通量和低成本的优点,必将代替传统的检测方法。该方法所建立的标准曲线扩增效率达98.561%,相关系数值为1,符合《实时荧光定量国际化标准-MIQE指南》中要求的R2>0.980,扩增效率在90%~105%之间,测定结果准确可靠,该研究为动物源性成分鉴定的深入研究提供了新的先进可靠的手段。
最后应用本方法对实际样本进行检测,30份模拟样本的检测结果与实际情况完全吻合。表明本研究所制定的方法完全能够满足肉制品中羊源性成分日常检测需求,是防止商家掺假牟利的有效手段。基因定量分析是未来检测手段的一个重要发展方向,虽然还存在着一定的技术性问题,比如对于熟肉制品加工工艺当中DNA断裂损伤或提取效率不充分对定量结果与真实值之间偏差的影响,但是随着分子生物学技术的不断发展必将会日趋完善,在生命科学技术领域会有很大的应用前景[11-13]。
[1]钟伟军,陈金顶. PCR检测饲料中牛源组织成分的研究[J]. 华南农业大学学报,2006,27(3):33-36.
[2]潘良文,陈家华,丁燕,等. 进口肉骨粉中牛成分检测研究[J]. 生物技术通报,2001(5):23-26.
[3]国家标准GB/T 20190-2006《饲料中牛羊源性成分的定性检测定性聚合酶链式反应(PCR)法》.
[4]Calvo J H,Zaragoza P,Osta R. Technical note:A quick and more sensitive method to identify pork in processed and unprocessed food by PCR amplification of a new specific DNA fragment[J]. J Anim Sci,2001(79):2108-2112.
[5]杨宝华,宗卉. 根据线粒体基因的特异性鉴别检测饲料中的动物源性成分[J]. 科学实验与研究,2002,5:1-3.
[6]Momcilovic D,Rasooly A. Detection and analysis of animal materials in food and feed[J]. Journal of Food Protection,2000,63:1602-1609.
[7]Tartaglia M,Saulle E,Pestalozza S,etal. Detection of bovine mitochondrial DNA in ruminant feeds:A molecular approach to test for the presence of bovine-derived materials[J]. Journal of Food Protection,1998,61:513-518.
[8]Wang RF,Myers MJ,Campbell W,etal. A rapid method for PCR detection of bovine materials in animal feedstuffs[J]. Molecular and Cellular probes,2000,14(1):1-5.
[9]Ebbehoj E,Thomsen P. Differentiation of closely related species by DNA hybridization[J]. Meat Sci,1991,31:359-366.
[10]汪永信,安虹,程坚,等. 双重实时荧光PCR法检测食品和饲料中的鸡源性成分[J]. 生物技术通报,2012(5):134-138.
[11]闫喜中,张锐,孟志刚,等. 实时荧光定量PCR法检测抗虫棉基因拷贝数方法的建立[J]. 安徽农业科学,2008,36(26):11376-11377.
[12]曾少灵,秦智锋,阮周曦,等.多重实时荧光PCR检测牛、山羊和绵羊源性成分[J]. 生物工程学报,2009,25(1):139-146.
[13]Soichi T,Eiji M,Kazuhiro M,etal. PCR method of detecting pork in foods for verifying allergen labeling and for identifying hidden pork Ingredients in processed foods[J]. Biosci Biotechnol Biochem,2007,71(7):1663-1667.
Real-time PCR detection of sheep derived materials in meat product
ZHAO Xin,WANG Yong*,LAN Qing-kuo,LIU Na,CHEN Rui,ZHU Zhu,LI Ou-jing
(Institute of Tianjin Agriculture Quality Standard and Testing Technology,Tianjin 300381,China)
Targetingcytochromeb gene of mitochondrial DNA from sheep,the specific primers and TaqMan probes were designed. After optimization of reaction conditions and establishment of standard curve,a fluorescent real-time PCR method had been set up to detect sheep derived materials. The results showed that the specific primers could identify sheep derived materials in meat product specially and effectively,and the sensitivity was as high as 16pg/μL. Amplification efficiency of the standard curve was 98.561% and correlation coefficientR2was 1.000. These properties meet the requirement of the《MIQE Guide》. The results obtained according to the new method and the National Standard(GB/T20190Y-2006 routine PCR method)were exactly the same,and electrophoresis,restriction digestion and sequencing were avoided in the new method. The value of this method was proved though the identification of the meat product from the market. The assay provides a new way for the quality control of the meat products.
Real-time PCR method;sheep derived materials;detection
2014-03-27
赵新(1983-),女,硕士,助理研究员,研究方向:主要从事农产品分子检测技术研究。
*通讯作者:王永(1977-),男,博士,副研究员,研究方向:主要从事农产品安全质量分子检测技术研究。
天津市应用基础与前沿技术研究计划(14JCQNJC14800)。
TS251.5
A
1002-0306(2015)01-0299-05
10.13386/j.issn1002-0306.2015.01.054

