基于QuEChERS前处理技术的水产品中喹诺酮类药物多残留ELISA检测方法的建立
杨金易,张 燕,曾道平,王 弘,徐振林,沈玉栋,雷红涛,孙远明
(1.华南农业大学食品学院 广东省食品质量安全重点实验室 农业部农产品贮藏保鲜质量安全风险评估实验室,广东广州 510642;2.广东产品质量监督检验研究院,广东佛山 528300;3.广州万联生物科技有限公司,广东广州 510642)
基于QuEChERS前处理技术的水产品中喹诺酮类药物多残留ELISA检测方法的建立
杨金易1,张 燕2,+,曾道平3,王 弘1,徐振林1,沈玉栋1,雷红涛1,孙远明1
(1.华南农业大学食品学院 广东省食品质量安全重点实验室 农业部农产品贮藏保鲜质量安全风险评估实验室,广东广州 510642;2.广东产品质量监督检验研究院,广东佛山 528300;3.广州万联生物科技有限公司,广东广州 510642)
建立了水产品中3种喹诺酮类(恩诺沙星、环丙沙星、氧氟沙星)兽药多残留的新型QuEChERS前处理技术结合酶联免疫快速检测的分析方法。基本流程为样品经90%乙腈(1%乙酸)均质提取离心后,上清液依次用C18净化、静置沉淀蛋白后用于测定,该前处理方法灵敏、快速、经济、实用性强。测试曲线线性范围为0.107~177.896ng/mL,检出限为0.0087μg/kg,IC50值为4.34ng/mL。样品批内和批间平均回收率分别为94.10%、93.70%,批内变异系数为4.09%~8.41%,批间变异系数2.78%~7.99%。检测结果与HPLC的相关系数R2=0.9897,表明酶联免疫检测方法及样品前处理方法适合喹诺酮类药物多残留检测。
QuEChERS,ELISA,多残留,喹诺酮,水产品
氟喹诺酮类药物(FQs)是一类人工合成药物,属于广谱抗菌药,具有广谱、高效、低毒等特点。其主要用于动物疾病的防治和饲料中动物生长促进剂[1],但药物滥用现象较为严重,导致药物残留,威胁人类健康[2]。世界各国十分重视FQs类抗菌药残留问题,对常用的FQs药物制定了相应的残留限量标准,如欧盟[3]规定动物肌肉等组织中恩诺沙星等的MRLs为0.01~1.9mg/kg;美国禁止在水产养殖业中使用FQs[4];日本对进口生鳗鱼及其制品的环丙沙星等残留限量控制在检测限的0.05mg/kg[5]。因此,加强对FQs类药物的残留监控并建立一种快速高效的检测方法对加强水产品质量安全的监测具有重要的意义。
关于FQs检测方法研究报道,一般有高效液相色谱[6-9]、液相色谱-串联质谱法[10-13]、免疫测定法[14-17]等,液相色谱法仪器昂贵,成本较高,不易推广应用,免疫测定法具有操作简便、快速等优点。样品前处理技术是整个分析技术中的关键步骤,近年来,出现了一些新的样品前处理技术,如基质固相分散萃取[18],固相萃取[19-20],超临界流体萃取[21]等,在传统的样品前处理技术的基础上有了较大的改善,但是这些方法各有一些无法避免的缺陷。Anastassiadas等在2003年提出了一种快速(Quick)、简单(Easy)、廉价(Cheap)、高效(Effective)、可靠(Rugged)和安全(Safe)的分散固相萃取(QuEChERS)技术。QuEChERS作为一项新型的前处理技术,目前已有科研人员将该技术应用于动物组织中的兽药残留检测[22-26],但是将该样品前处理方法运用于检测喹诺酮类药物多残留的ELISA方法尚未见报道。
本文首次将QuEChERS法和酶联免疫检测方法有机结合起来用于检测FQs多残留,对提取净化方法、酶联免疫方法建立的条件进行了改进和优化,建立了一种QuEChERS结合ELISA同时检测水产品中3种FQs药物多残留的方法,具有快速、简单、准确度高等优点,能够满足水产品中FQs药物残留检测要求,适合大批样品的快速测定。
1 材料与方法
1.1 材料与仪器
喹诺酮类药物 浙江国邦药业有限公司;HRP标记羊抗鼠IgG 武汉博士德生物工程有限公司;水产品 市售;分散固相吸附剂(C18、PSA、NH2) 博纳-艾杰尔科技公司;包被液、稀释液、洗涤液、封闭液均按照文献[27]的方法配制;喹诺酮类包被原、喹诺酮类抗体均为实验室前期制备;其他试剂均为国产分析纯。
Wellwash MK2洗板机 美国Thermo公司;6k高速冷冻离心机 德国Sartorius公司;Multiskan MK 3酶标仪 美国Thermo公司;微量移液器 美国Eppendorf公司;酶标板 深圳金灿华实业有限公司;高效液相色谱仪 日本岛津。
1.2 实验方法
1.2.1 FQs间接竞争酶联免疫分析法(FQs-ELISA)的实验步骤 用包被液将FQs包被原稀释30000倍,加入酶标板孔中,100μL/孔,37℃包被过夜;用洗涤液洗2次,拍干,加入120μL封闭液,37℃水浴箱孵育3h,甩干孔中液体,放37℃烘箱中烘干备用。
用0.01mol/L磷酸盐缓冲液(PBST)分别将标准品稀释不同浓度的标准品溶液,如0、0.01、0.05、0.2、0.78、3.13、12.5、50、200ng/mL。取50μL稀释好的标准品到包被好的板条中,加入50μL稀释好的抗体,在37℃水浴箱中孵育30min,用洗液洗5次;拍干后加入100μL酶标二抗(羊抗鼠),在37℃水浴箱中孵育20min,用洗液洗5次;拍干后加入底物缓冲液和底物液等体积的混合液100μL/孔,混匀后置于37℃水浴箱孵育10min。加入50μL终止液,用波长为450nm的酶标仪测定吸光值A。
1.2.2 反应条件的优化 按照1.2.1中的操作步骤,分别对包被原稀释倍数、抗体稀释倍数、竞争反应时间、标准品稀释液等条件进行优化。通过比较最大吸光值Amax、半抑制浓度IC50以及Amax/IC50来确定最优的反应参数,建立标准曲线。
1.2.3 标准曲线的绘制 按照优化方案优化ELISA方法后,得到FQs间接竞争ELISA方法的最佳反应条件,即:包被抗原稀释倍数为1∶30000,包被温度为37℃,包被时间为12h(过夜);FQs抗体稀释液为T液,稀释倍数为1∶6000;标准品稀释液为0.01mol/L PBST,反应体系的pH7.5;二抗稀释液为P液,稀释倍数为1∶6000;反应时间为一抗30min、二抗20min,反应条件为37℃水浴。
在最优的工作条件下,以环丙沙星药物的溶液浓度对数为横坐标,B/B0(%)值为纵坐标,采用OriginPro8.5软件进行拟合,绘制环丙沙星icELISA方法的标准曲线。根据标准曲线计算出该方法的半抑制浓度(IC50)和线性范围(IC20~IC80)。
1.2.4 样品前处理 将样品用均质机进行均质,准确称取1g样品,置于15mL离心管中,加入5mL 90%乙腈(1%乙酸)提取液,涡旋振荡5min,以6000r/min的转速离心10min。取上清液转入装有分散固相萃取剂(200mg C18)的10mL离心管中,涡旋2min。将10mL离心管放入离心机中以6000r/min的转速离心2min。静置10min,充分沉淀蛋白质。取适量的萃取液稀释到合适的倍数,待测。
1.2.5 添加回收实验 称取阴性样品,样品中加入标准品的浓度为20、50、100ng/g,同时用不添加药物的样品作阴性对照。按照1.2.2步骤进行样品处理,用ELISA进行检测,计算其回收率。
1.2.6 特异性实验 交叉反应率反映某种测定方法对被测物质的专一程度。对检测方法特异性的考察,通常比较待测物与其结构或功能类似物质之间的交叉反应率。选择ELISA检测步骤,在同等条件下以环丙沙星(ciprofloxacin,CIP)为基准物质,依次绘制其他结构类似物竞争抑制曲线,计算结构类似物的IC50,以下列公式计算交叉反应率(Cross Reactions,CR)。
1.2.7 基质效应 选择空白样品,进行样品预处理,得到样品提取液,以各样品处理液和标准品稀释液将各标准品按照配制标准曲线的梯度稀释,进行ELISA实验,分别绘制标准曲线,比较分析,考察不同样品基质对标准曲线的影响[28-29]。
1.2.8 方法准确性实验 准确度是指测的结果与真实值的接近程度,表示分析方法测量的正确性,可用回收率表示[30]。在空白样品中添加不同含量水平的标准品,按照1.2.4方法进行样品处理,按照1.2.5步骤进行测定,计算回收率。计算公式如下:

2 结果与分析
2.1 FQs-ELISA标准曲线建立
以环丙沙星标准品溶液浓度对数为横坐标,B/B0值为纵坐标,进行拟合,结果如图1所示。该方法的IC50值为4.34ng/mL;检出限为0.0087μg/kg,检测范围为0.107~177.896ng/mL。
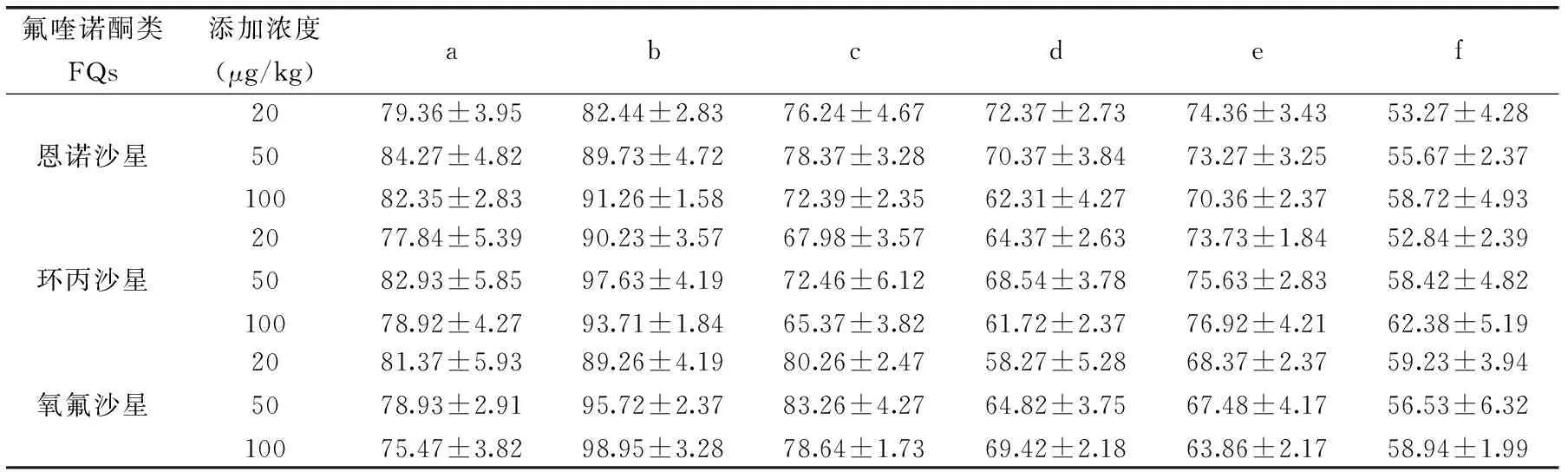
表1 不同提取剂对FQs回收率的影响(%,n=3)Table 1 Effect of the extracting solvent on recovery(%,n=3)
注:a:100%乙腈(1%乙酸);b:90%乙腈(1%乙酸)水溶液;c:75%乙腈(1%乙酸)水溶液;d:50%乙腈(1%乙酸)水溶液;e:90%乙腈水溶液;f:100%乙腈。

表2 提取方法对回收率的影响(n=3)Table 2 Effect of the extracting method on recovery(n=3)
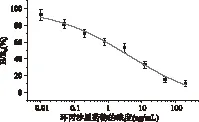
图1 环丙沙星icELISA法标准曲线(n=3)Fig.1 Standard curve of CIP by IC-ELISA(n=3)
2.2 样品前处理条件的优化
实验中考察了萃取剂、提取方式、提取时间、净化填料、净化时间等各项实验条件对回收率的影响,从而确定最优条件。上述的参数是相互制约的,共同影响着萃取和分离平衡,从而影响样品回收率高低。
2.2.1 提取试剂的选择 分别采用100%乙腈(1%乙酸)、90%乙腈(1%乙酸)水溶液、75%乙腈(1%乙酸)水溶液、50%乙腈(1%乙酸)水溶液、90%乙腈水溶液、100%乙腈作为提取溶剂,样品中加入标准品的浓度为20、50、100ng/g,测定回收率,结果见表1。
结果显示,含酸的乙腈提取效果远大于纯乙腈,和文献[36]报道相一致。当在乙腈和乙腈(1%乙酸)中分别加入不同比例的水时,提取效率顺序为:90%乙腈(1%乙酸)-水溶液>90%乙腈-水溶液;90%乙腈(1%乙酸)-水溶液>75%乙腈(1%乙酸)-水溶液;90%乙腈(1%乙酸)-水溶液>100%乙腈(1%乙酸)>50%乙腈(1%乙酸)-水溶液。所以选择90%乙腈(1%乙酸)水溶液作为提取剂。
萃取剂的选择不仅要遵循“相似相溶”规则,而且要考虑萃取溶剂对随后的处理过程的影响。由于恩诺沙星、环丙沙星、氧氟沙星等喹诺酮药物结构式中均有4-喹诺酮母核,是酸碱两性的化合物[25,32],易溶于含乙酸的乙腈水溶液,且样品的回收率更高,与文献[25,33-34]报道一致。针对于水产品样品,其富含蛋白质,采用含乙腈的萃取剂时,提取的上清液中含有的蛋白质更少,对于采用QuEChERS除杂过程更有利。
涂装是现代产品制造工艺中的重要环节之一,它包括涂装前对被涂物表面的处理、涂布工艺和干燥三个基本工序以及设计合理的涂层系统。传统涂装工艺中,在喷漆、烘干工段会产生大量的有机溶剂气体,其主要成分是甲苯、二甲苯、苯等,这些有害物质外排不仅影响大气环境,而且有火灾和爆炸的环境风险。涂装工艺产生的环境污染与涂料选择、作业环境条件、质量及工艺管理各方面息息相关[1]。
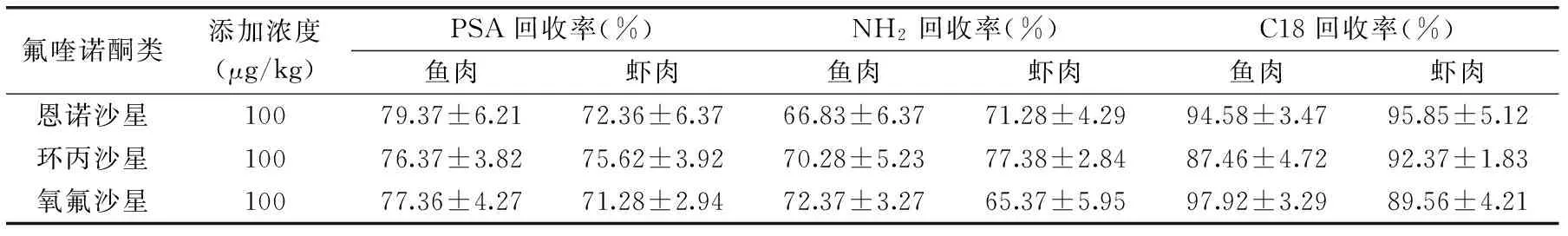
表3 不同吸附剂对FQs回收率的影响(n=3)Table 3 Recovery data of FQs for different sorbents(n=3)
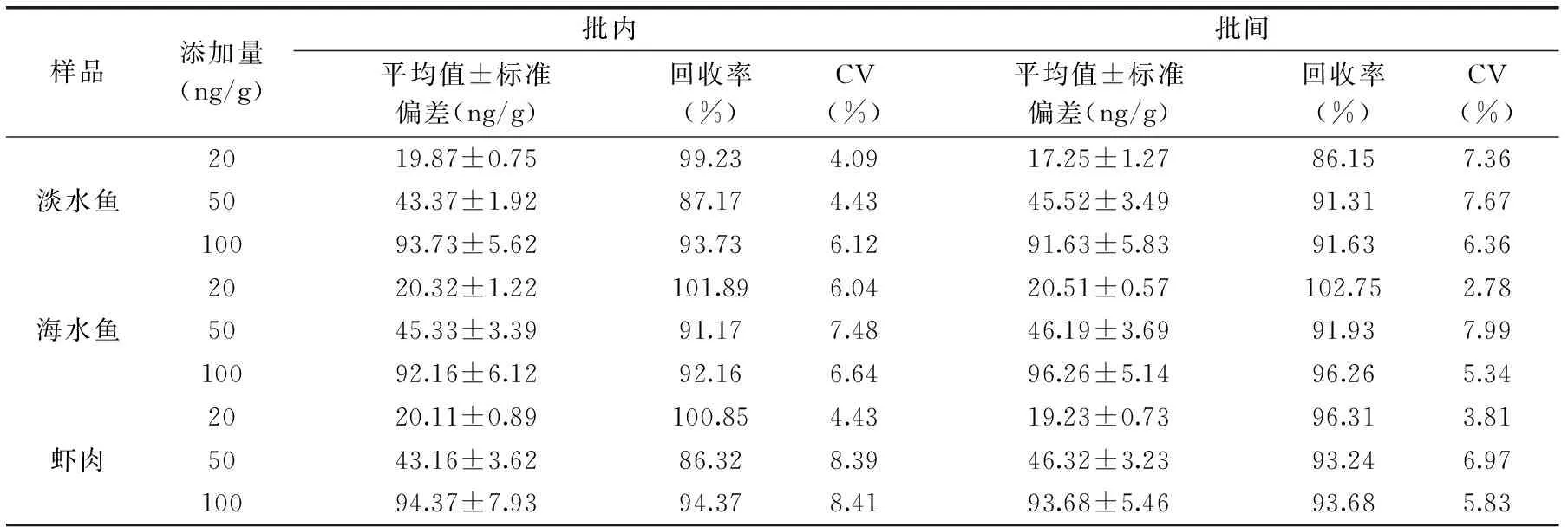
表4 不同种类样品添加回收实验结果(n=3)Table 4 Recovery data of FQs for different samples(n=3)
2.2.2 提取方式的选择 样品中加入标准品,以酸化乙腈为提取剂,分别比较涡旋振荡、摇床振荡、超声波破碎3种提取方式对提取效率的影响,测定结果见表2。结果表明,3种提取方式的回收率均表现出差异,可以看出涡旋振荡的提取方法回收率最高,效果最好。
2.2.3 净化填料的选择 净化填料有乙二胺-N-丙基硅烷(PSA)、氨基(-NH2)和C18吸附剂。采用酸性乙腈为提取溶液,分别比较了C18、NH2、PSA的几种吸附剂对样品基质的净化效果,测定了相应的回收率,结果如表3。实验结果表明,C18的净化效果是最好的,回收率在90%左右,其他几种吸附剂除杂效果较差,回收率偏低。
由于PSA和NH2可清除脂肪酸、部分酚类、色素和糖类,而C18吸附剂是在硅胶基质上接有十八烷基,具有较高的相覆盖率和碳含量,对非极性物质有较高的容量,对油脂和一些非极性的基质成分的去除效果很好[25]。针对于水产品来说,C18吸附剂除杂效果最好。因此选取C18作为实验的净化吸附剂。并对C18的用量进行了优化,结果如图2所示。综合考虑,最终选择C18的用量为200mg。

图2 C18使用量的优化Fig.2 Comparison of the abilities of different amount of C18
2.2.4 净化时间的选择 对样品净化时间进行了优化,比较了2、5、10、15min的净化效果,结果如图3所示,表明净化时间为2min时,效果最好。随着净化时间的延长,C18吸附剂在吸附杂质的同时,可能会吸附一定的目标物,导致回收率偏低。因此从节约时间和回收效果方面综合考虑,选择净化时间为2min。

图3 净化时间的优化Fig.3 Comparison of the abilities of different Cleaning time
2.3 方法准确性
准确度是指测的结果与真实值的接近程度,表示分析方法测量的正确性,可用回收率表示。在空白样品中添加不同含量水平的FQs标准品,进行样品预处理,按照ELISA步骤测定,计算回收率。用同一批次试剂盒对样品进行检测,每个样品设3个重复,连续测定3次,计算批内和批间变异。结果如表4所示,各种样品批内、批间平均回收率94.10%、93.70%,且各个样品批内变异系数为4.09%~8.41%,批间变异系数为2.78%~7.99%。
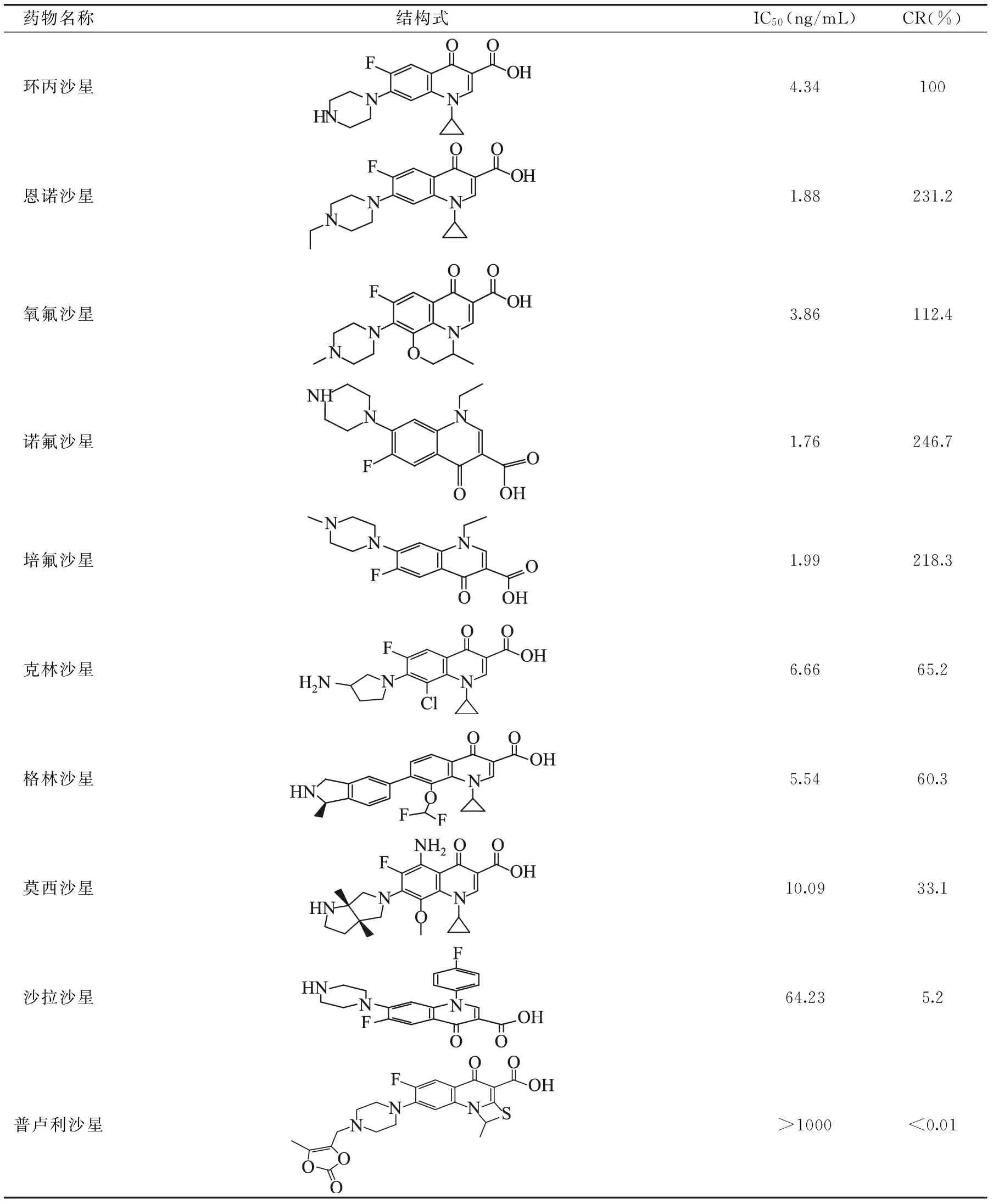
表5 喹诺酮类药物的交叉反应表Table 5 Cross-reactivity of FQs antisera with analogues
本实验选择恩诺沙星、氧氟沙星、格林沙星、诺氟沙星、普卢利沙星、培氟沙星、莫西沙星、沙拉沙星、可林沙星9种环丙沙星结构类似物或功能类似物在相同条件下分别进行ELISA测定,计算其标准曲线的IC50值,以环丙沙星的交叉反应率为基准(100%),考察交叉反应率的情况(见表5)。由实验结果得知,该抗体除与普卢利沙星、沙拉沙星和莫西沙星有低的交叉反应率外,与其他结构类似物的交叉反应率均大于50%。表明该抗体可用于实际样品中喹诺酮类药物的多残留检测。
2.5 基质效应
样品的基质效应是指由于样品提取液的基质成分复杂,其中某些杂质可能会影响反应过程中抗原抗体的特异性结合,从而对目标物的检测造成一定影响的现象。基质效应的存在可能会降低检测灵敏度,还有可能产生假阳性。因此,需要评估样品中的潜在干扰物质对检测结果的影响。本实验对不同种类阴性样品进行样品预处理,得到样品提取液,考察不同样品提取液对ELISA方法的影响,结果如下图4所示。由图可知,所得到的标准曲线几乎全部重合,表明经过前处理后不同样品的基质效应对ELISA检测FQs基本无影响。

表6 不同种类样品中FQs添加回收实验结果(n=3)Table 6 Recoveries of FQs from spiked fish and shrimp by ELISA and HPLC(n=3)

图4 不同基质标准曲线与FQs标准曲线的比较Fig.4 Normalised standard curve by ELISA for FQs under optimized conditions
2.6 相关性实验结果
称取空白样品,加入不同浓度的标准品溶液,进行样品预处理,得到样品提取液,过0.22μm滤膜上机测定或稀释合适的倍数后用试剂盒测定,结果如图5和表6所示。由实验结果可知,HPLC法回收率在80%~110%之间,所建立的HPLC法准确度良好。

图5 鱼肉空白样品和加标样品(50ng/mL)色谱图Fig.5 Chromatogram data of FQs from spiked fish by HPLC注:OFL:氧氟沙星;CIP:环丙沙星;ENR:恩诺沙星。
对两种方法测定结果进行线性回归分析,以ELISA试剂盒测得的样品浓度为x轴,以HPLC测得的样品浓度为y轴,绘制散点图,做拟合曲线,结果如图6所示。回归方程为y=1.0658x+0.4006,相关系数R2=0.9897,说明建立的ELISA检测样品中的FQs结果准确可靠。
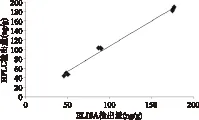
图6 HPLC与ELISA法检测样品中FQs的线性相关性分析Fig.6 Analytical result of ELISA and HPLC methods
3 结论
本文以水产品中国际较为关注的喹诺酮类药物为目标物,通过改进样品前处理方法中的一些提取净化的相关条件,首次建立了QuEChERS-ELISA快速测定水产品中喹诺酮类药物多残留的方法。该方法不仅简化了实验步骤,而样品前处理和检测过程均缩短了检测时间,降低了检测成本,并且能够保证多种药物同时检测。相比于仪器的方法,更加的省时,方便,快捷。该方法批内回收率为86.32%~101.89%,批间回收率86.15%~102.75%,与曹慧、曹鹏等人[35-36]相比,样品回收率更高,结果更稳定,符合喹诺酮类药物残留测定要求。经HPLC-MS方法进行确证,该ELISA方法及样品前处理方法检测结果准确可靠,可以满足水产品中喹诺酮类药物的实际检测需求。
[1]Kummerer K. Antibiotics in the aquatie environment-A review-Part I[J]. Chemosphere,2009,75(4):417-434.
[2]钱卓真. 动物性食品中喹诺酮类药物残留检测技术研究进展[J]. 福建水产,2007(4):61-65.
[3]刘丽娟,刘虹,梁敏,等. 喹诺酮类药物不良反应与药物相互作用[J].医药导报,2005,24(10):959-960.
[4]刘正才,杨方,李耀平,等. UPLC-MS/MS对鳗鱼中26种喹诺酮类及磺胺类抗生素药物残留的快速测定[J]. 分析测试学报,2008,27(11):1171-1175.
[5]占春瑞,温志海,卜延刚,等. 鸡肉中多种喹诺酮类兽药残留量的高效液相色谱测定研究[J]. 食品科学,2005,26(10):172-175.
[6]叶鹿鸣,谢东华.高效液相色谱荧光检测法测定牛奶中3种氟喹诺酮残留研究[J].中国卫生检验杂志,2008,18(5):804-806.
[7]陈静,郑荣,季申,等. 超高效液相色谱法同时测定化妆品中的19中喹诺酮类抗生素[J]. 分析化学,2013,41(6):931-935.
[8]陈辉华,戴军,王洪新,等. HPLC对鱼肉中3种四环素类和5种氟喹诺酮类兽药残留的同时测定[J]. 分析测试学报,2008,27(9):951-955.
[9]刘媛,谢孟峡,丁岚,等. 高效液相色谱同时测定鸡蛋中4种氟喹诺酮类药物残留[J]. 分析化学,2004,32(3):352-355.
[10]Fernandez-Torres R,Bello Lopez M A,Olias Consentino M,etal. Enzymatic-microwave assisted extraction and high-performance liquid chromatography-mass spectrometry for the determination of selected veterinary antibiotics in fish and mussel samples[J]. Journal of Pharmaceutical and Biomedical Analysis,2011,54:1146-1156.
[11]Chiaochan C,Koesukwiwat U,Yudthavorasit S,etal. Efficient hydrophilic interaction liquid chromatography-tandem mass spectrometry for the multiclass analysis of veterinary drugs in chicken muscle[J]. Analytica Chimica Acta,2010,682:117-129.
[12]王志杰,冷凯良,孙伟红,等. 高效液相色谱-串联质谱法同时测定鳗鱼和虾肉中残留的33种喹诺酮和磺胺类药物[J].色谱,2009,27(2):138-143.
[13]包晓丽,任一平,张虹. 超高效液相色谱-电喷雾串联四级杆质谱法检测牛奶中22种喹诺酮类抗生素[J]. 分析化学,2009,37(3):389-394.
[14]Silverlight J,Coldham N,Thorne L,etal. Antibodies to the quinolones and fluoroquinolones for the development of generic and specific immunoassays for detection of these residues in animal pro-ducts[J]. Food Addit Contam,2003,20(3):221-228.
[15]Hueta C,Charlier C,Tittlemiter S,Simultaneous determination of(fluoro)quinolone antibiotics in kidney,marine products eggs,and muscle by enzyme-linked immunosorbent assay(ELISA)[J]. Agr Food Chem,2006,54(8):2822-2827.
[16]Burkin M A. Enzyme-linked immunosorbent assays of fluoroquinolones with selective and group specificities[J]. Food Agric Immunol,2008,19(2):131-140.
[17]Zhu Y,Li L,Wang Z H,etal. Development of an Immunochromatography Strip for the Rapid Detection of 12 Fluoroquinolones in Chicken Muscle and Liver[J]. J Agric Food Chem,2008,56(14):5469-5474.
[18]Birjandi A P,Bidari A,Rezaei F,etal. Speciation of butyl and Phenyltin compounds using dispersive liquid-liquid mieroextraction and gas chromatography-flame Photometrie detection[J]. J Chromatogr A,2008,1193:19-25.
[19]Rezaei F,Bidari A,Birjandi A P,etal. Development of a dispersive liquid-liquid microextraction method for the determination of polychlorinated biphenyls in water[J]. J Hazad Mater,2008,158:621-627.
[20]Yazdi A S,Razavi N,Yazdinejad S R. Separation and determination of anlitriptyline and nortriptyline by dispersive liquid-liquid microextraction combined with gas chromatography flame ionization detection[J].Talanta,2008,75:1293-1299.
[21]Pena M T,Casais M C,Mejuto M C,etal. Development of an ionic liquid based dispersive liquid-liquid microextraction method for the analysis of polycycli aromatic hydroearbons in water samples[J]. J Chromatogr A,2009,1216:6356-6364.
[22]Aguilera-Luiz M M,Martinez Vidal J L,Romero-Gonzalez R,etal. Multi-residue determination of veterinary drugs in milk by ultra-high-perssure liquid chromatography-tandem mass spectrometry[J]. Journal of Chromatography A,2008,1205:10-16.
[23]Renata P L,Reyes R C,Romero-Gonzalez R,etal. Multiresidue determination of veterinary drugs in aquaculture fish samples by ultra high performance liquid chromatography coupled to tandem mass spectrometry[J]. Journal of Chromatography B,2012,895-896:39-47.
[24]Aguilera-Luiz M M,Martinez Vidal J L,Romero-Gonzalez R,etal. Multiclass method for fast determination of veterinary drug residues in baby food by ultra-high-performance liquid chromatography-tandem mass spectrometry[J]. Food Chemistry,2012,132:2171-2180.
[25]李慧芳,殷军港,刘永明. 鱼肉中喹诺酮类药物残留检测前处理方法的研究[J].中国渔业质量与标准,2012,2(1):62.
[26]张毅,岳振峰,蓝芳,等.分散固相萃取净化与液相色谱/串联质谱法测定牛奶中8类禁用药物留量[J].分析化学,2012,40(5):724-729.
[27]朱立平,陈学清. 免疫学常用实验方法[M]. 北京:人民军医出版社,2000:351-357.
[28]赵银丽,王建华,王自良,等.抗恩诺沙星单克隆抗体杂交瘤细胞株的筛选及竞争ELISA试剂盒的研制[J].核农学报,2008,22(6):898-903.
[29]Tittlemier S A,Gelinas J M,Dufresne G,etal. Development of a direct competitive enzyme-linked immunosorbent assay for the detection of fluoroquinolone residues in shrimp[J]. Food Analytical Methods,2008,1(1):28-35.
[30]刘文英. 药物分析[M].北京:人民卫生出版社,1999.
[31]易江华,段振娟,方国臻,等. QuEChERS方法在食品农兽药残留检测中的应用[J].中国食品学报,2013,13(2):153-158.
[32]杨先乐. 新编鱼药手册[M].北京:中国农业出版社,2005:199-201.
[33]卜明楠,石志红,康健,等. QuEChERS结合LC-MS/MS同时测定虾肉中72种兽药残留[J].分析测试学报,2012,31(5):552-558.
[34]胡鲲,杨先乐,唐俊,等. 绒螯蟹中3种氟喹诺酮类药物残留检测的前处理方法研究[J].华中农业大学学报,2007,26(5):670-675.
[35]曹慧,陈小珍,朱岩,等. QuEChERS-超高效液相色谱-串联质谱技术同时测定乳制品中磺胺类和喹诺酮类抗生素残留[J].食品科技,2013,38(6):323-329.
[36]曹鹏,牟妍,高飞,等.分散固相萃取-超高效液相色谱-串联质谱法同时检测火锅食材中11种喹诺酮类药物[J].色谱,2013,31(9):862-868.
Simultaneous determination of Fluoroquinolones in seafood by modified QuEChERS and Enzyme-linked Immunosorbent Assay
YANG Jin-yi1,ZHANG Yan2,+,ZENG Dao-ping2,WANG Hong1,XU Zhen-lin1,SHEN Yu-dong1,LEI Hong-tao1,SUN Yuan-ming1
(1.College of Food Science,South China Agriculture University,Guangdong Provincial Key Laboratory of Food Quality and Safety,Guangzhou 510642,China;2.Guangdong Testing Institute of Product Quality Supervision,Foshan 528300,China;3.Guangzhou Wanlian Biological Technology Co.,Ltd.,Guangzhou 510642,China)
A method was developed for the simultaneous determination of 3 Fluoroquinolones(FQs)(enrofloxacin,ciprofloxacin,ofloxacin)residues including enrofloxacin,ciprofloxacin,ofloxacin in seafood samples by new QuEChERS and Enzyme-linked Immunosorbent Assay(ELISA). The approach involved the extraction of sample with acetonitrile containing 1%(v/v)acetic acid,and the supernatant liquid was directly purified with C18,meanwhile,was used for the precipitation of protein. The method was proved to be sensitive,rapid,precise,economical and applied. The calibration curve should be virtually linear in the range of 0.107~177.896ng/mL,the limit of detection(LOD)was 0.0087μg/kg,and IC50value was 4.34ng/mL. Average recovery rate was 94.10% and 93.70% separately in same batch and different batch,coefficient of variation was 4.09%~8.41% and 2.78%~7.99% separately in same batch and different batch. The results showed good coefficient with HPLC(R2=0.9897),which proved to be suitable for the screening of seafood samples for the presence of FQs.
QuEChERS;ELISA;multi-residues;Fluoroquinolones;seafood
2014-03-26 +并列第一作者
杨金易(1979-),男,博士,讲师,研究方向:食品质量与安全。 张燕(1987-),女,硕士研究生,研究方向:食品安全检测技术。
广州市珠江科技新星专项(2013J2200080);国家星火计划(2012GA780001,2013GA780035);NSFC-广东联合基金(U1301214);广东省自然科学基金(S2013030013338);教育部博士点基金(20114404130002);广东省科技计划项目(重点专项)(2012A020100002,2010A032000001-4);广州市科技企业孵化器发展专项(2012Ss-P204)。
TS254.7
A
1002-0306(2015)01-0292-07
10.13386/j.issn1002-0306.2015.01.053

