紫花苜蓿根颈芽发育成枝过程中叶元的发生模式研究
方强恩,张勃,师尚礼
(草业生态系统教育部重点实验室,甘肃农业大学草业学院,甘肃省草业工程实验室,中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070)
紫花苜蓿根颈芽发育成枝过程中叶元的发生模式研究
方强恩,张勃,师尚礼*
(草业生态系统教育部重点实验室,甘肃农业大学草业学院,甘肃省草业工程实验室,中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070)
叶元由节、节间、叶器官以及叶腋下的侧生分生组织组成,是植物茎枝生长发育的基本单位。本研究首次采用扫描电镜技术,通过跟踪观察WL168紫花苜蓿根颈芽从萌发至孕蕾期顶端分生组织的微形态发育过程,初步探讨了苜蓿叶元的发生发育规律。结果显示,在苜蓿叶元发生过程中,复叶原基以向顶式的模式形成。腋芽原基和复叶原基均起源于顶端分生组织,但两者并非同步生长,苜蓿叶元的发育过程由此表现出两种模式:模式Ⅰ和模式Ⅱ。模式Ⅰ,复叶原基发育能力强,腋芽原基在侧小叶原基形成后才出现,发育速度缓慢;模式Ⅱ,腋芽原基在托叶原基形成后便开始发生,相对模式Ⅰ发生时间提前,生长速度明显快于复叶原基和生长锥。苜蓿根颈芽在返青出土前,其叶元以模式Ⅰ发生,出土后,转变为模式Ⅱ。当地上叶元数增加到16~17时,腋芽原基发育为花序,小花原基开始出现。分析表明,根颈芽叶元的发生由模式I转向模式Ⅱ是苜蓿营养生长向生殖生长转变的标志,苜蓿根颈芽在返青出土前已完成了其营养器官的发生,出土后即转入成花过渡期。
紫花苜蓿;根颈芽;叶元;原基
高等植物的生长发育是由顶端分生组织(shoot apical meristem,SAM)不断产生重复单位,即叶元(phytomer)(又称体节metamer)的过程[1-3]。每个叶元包括两类亚单位:节点亚单位(nodal sub-unit)和节间亚单位(internodal sub-unit),前者产生侧生结构(包括叶片、腋芽),后者形成茎结构(cauline structures)[4]。植物结构的这种重复发育模式,使得只需跟踪观察茎端分生组织的变化特征就能窥视其发育的全貌。在植物不同生长阶段,虽然叶元中各组成部分(节间、叶和腋芽)的发育特点不尽相同[4],但其“节-茎-叶连续体(node-stem-leaf contiuum)”结构不会变化,它是植物内在的自主性生理单元(autonomous physiological units)[5-6]。叶元所体现的这种拓扑学特征,为研究植物生长规律提供了新的视角和手段[7-10]。
目前,研究者已通过叶元研究对水稻(Oryzasativa)、玉米(Zeamays)、大麦(Hordeumvulgare)、白三叶(Trifoliumrepens)等栽培植物的生长发育规律进行了探索,并获得了很多有价值的成果[8,12-14]。Fournier和Andrieu[15]研究表明,玉米茎秆的生长进程可划分为4个阶段,其中叶元长度变化和叶鞘的出现是阶段1向阶段2转变的起始标志。Sylvie和Jean[7]应用叶元概念研究了水稻叶片和分蘖发生的同步性,结果发现主茎和蘖枝的叶片同步发生,腋芽能否发育为蘖芽取决于其空间拓扑位置以及主茎的发育阶段。Kurihara等[11]研究发现,分析马铃薯(Solanumtuberosum)叶元的数量特征可以有效评价块茎在不同生长阶段的发育状态,从而预测最终块茎产量。
紫花苜蓿(Medicagosativa,文中简称苜蓿)是世界上种植规模最大、利用价值最高的优质牧草[16]。在其地下根颈部能持续形成大量根颈芽是苜蓿最重要的生长特性[17],这种特性有利于苜蓿抗寒、抗旱和再生[18]。苜蓿的再生枝主要来自根颈芽[19-20],单株根颈芽数量和发育成枝能力是决定苜蓿高产的关键因素[21],但目前有关根颈芽发育成枝的规律仍不清楚。因此,研究根颈芽的发生发育机理对苜蓿育种和高产栽培均有重要意义。最新研究发现,拟南芥的茎端生长由营养阶段向生殖阶段转变时其叶元特征发生了显著变化,叶元中第一个节间的伸长是该植物转向生殖生长的可靠标志[4,22]。据此推测,苜蓿根颈芽从萌发出土到发育成枝、成花过程中,其叶元的发生方式可能也存在着某种规律性变化。本研究选取WL168紫花苜蓿为材料,利用扫描电镜跟踪观察了根颈芽发育成熟前后其芽端叶元的发生过程,试图回答两个问题:1)苜蓿叶元中叶片、腋芽的发生方式及其早期发育的时间次序是怎样的;2)根颈芽从营养生长期向生殖生长期转变时,叶元的发生方式是否发生了变化。
1 材料与方法
1.1材料
试验材料为WL168(M.sativa‘WL168’),种子购自北京正道生态科技有限公司。WL168是近年来由美国牧草资源公司(Forage Genetics International,FGI)培育出的高产、优质、多抗紫花苜蓿品种,秋眠级为2,抗寒级为1。该品种适应性强,在我国东北、内蒙古、新疆、西藏、甘肃和青海等地均可种植,是干旱、寒冷地区的首选品种。
1.2试验地概况及种植管理
试验在甘肃农业大学兰州牧草试验站进行,该地区属温带半干旱大陆性气候,四季分明、光照充足。海拔1517.3 m。年平均降雨量320 mm,年日照时数2474.4 h。田间试验小区面积3 m×3 m,4次重复。2013年4月17日播种。播前结合整地施磷肥750 kg/hm2、氮磷复合肥375 kg/hm2。条播,播种行距30 cm,播量为15 kg/hm2。播种深度1.5~2.0 cm。田间管理包括间苗、中耕除草、适时灌溉。播种当年分别于7月5日、8月25日两次刈割,每次留茬高度均为5 cm。
1.3试验方法
取样:自2014年3月5日开始取样。每次挖取5株长势一致的植株(根颈深为3 cm左右),在距离根颈1 cm内的部位摘取长度相似的根颈芽15个,其中5个清洗后用2.5%戊二醛固定,用于扫描电镜观测。另10个用50%FAA固定,以备统计叶元数。芽出土前,每5 d取样1次。芽出土后,按叶龄(地上完全展开的叶片数)取样,直到13叶龄时(孕蕾期)结束。
叶元数的统计方法:取FAA固定后的芽置于解剖镜下,用针和镊子自下而上逐个剥下鳞叶(scale leaf,芽基部的鳞片状叶)和幼叶(embryonic leaf,芽顶端没有展开的早期叶),直到芽端生长锥和两个叶原基外露。鳞叶数和幼叶数之和便是叶元数。对于芽生长出土后发育而来的再生枝,分地下叶元数和地上叶元数两部分分别统计。地下叶元数即地下鳞叶(scale)数,地上叶元数是地上茎部展开的叶片数(即叶龄数)和顶端幼叶数之和。
叶元发生过程的扫描电镜观察:取2.5%戊二醛固定2 h后的芽,切取顶端1~2 cm,放在铺有滤纸的培养皿中,滤纸提前用PBS缓冲液浸湿,然后在解剖镜下轻轻剥离幼叶直至芽露出生长锥,立即移入培养皿内用0.1 mmol/L的PBS冲洗3次,每次15 min;然后依次用30%,50%,70%,85%,95%和100%的乙醇脱水,每次15~20 min,其中100%乙醇置换2次;用1∶1的乙醇∶叔丁醇溶液置换30 min,再用100%叔丁醇置换2次,每次30 min;将置换后的芽置于4℃ 冰箱中预冷,然后放入VFD-21S冷冻干燥仪中进行干燥。待样品干燥后,用碳导电胶粘到样品台上,在MSP-2S 型磁控离子溅射仪上喷金90 s。最后用日立S-3400N扫描电镜(scanning electron microscope,SEM)进行观察、拍照。
2 结果与分析
2.1叶元的发生模式
发育成熟的苜蓿叶元由三出复叶、腋芽、节、节间组成,复叶包括托叶、一对侧小叶和一个顶端小叶(图1,图2A)。苜蓿根颈芽萌发出土发育为枝条的过程,是顶端分生组织不断重复形成叶元的过程(图2B),利用扫描电镜技术可以完整地观察到叶元的初始发育变化。从时间进程看,一个叶元的发育正好是伴随复叶原基的形成而完成的(图1)。依据早期叶原基、托叶原基、侧小叶原基、腋芽原基和顶端小叶原基发生的时空次序,苜蓿叶元的发育形成过程可区分为5个阶段(stages,S1~S5,图1)。
本研究发现,在根颈芽出土前后的不同发育时期,叶元形成过程中5个阶段的发生特点不尽相同,总体表现为两种发育模式。
2.1.1模式Ⅰ 该模式下叶元的发生过程:在S1阶段,芽顶端组织通过分化生长,首先在其一侧边缘出现凸起,形成条状的早期叶原基(incipient leaf primordium,图1A),此时未见其他任何器官的分化。S2阶段,叶原基向高、宽、厚3个方向生长,在其两侧分化出了托叶原基(stipule primordium,ST)。托叶原基半包围顶端分生组织(图1A)。S3阶段,在托叶原基和叶原基之间形成了两个侧小叶原基(lateral leaflet primordium,LL,图1B)。同时,在相对叶原基180°方向的位置,下一个叶元的早期叶原基已经开始显现(图1B,※)。S4阶段,在叶原基近轴基部出现了腋芽原基(axillary bud primordium,AB,图1C)。由于叶原基与生长锥同时在不断进行顶端生长和边缘生长,在该阶段托叶和侧小叶原基更加清晰易辨。S5阶段,在叶原基远轴面发育出了毛状体(trichomes)(图1D,箭头),顶端小叶原基(terminal leaflet primordium,TL)形成,发育增大的托叶和叶片原基明显向内收拢,包裹住了腋芽原基和部分顶端分生组织。至此,一个叶元单位中的所有组成结构便全部发育形成。模式Ⅰ中叶元各组成的形成顺序为:早期叶原基(节)→托叶原基→侧小叶原基→腋芽原基→顶端小叶原基。
2.1.2模式Ⅱ 在模式Ⅱ中,S1阶段的发育与模式Ⅰ相同(图1E)。S2阶段,1对托叶原基(ST)在早期叶原基两侧形成,此时在其基部已能隐约看到正在发生的腋芽原基(图1E,※)。S3阶段,腋芽原基(AB)形成(图1F),同时,在斜对叶原基(夹角小于180°)的位置,又开始了下一个叶元的发育(图1F,※)。S4阶段,在托叶原基和叶原基中间出现2个侧叶原基(LL ) (图1G),该阶段中腋芽原基发育速度很快,其生长高度已经与叶原基接近。S5阶段,在叶原基顶端远轴面可以看到正在形成的毛状体(图1H,箭头),顶端小叶原基(TL)发育形成。此时,腋芽原基继续在偏离中心的位置快速生长,膨大鼓起,体积几乎与生长锥相同,而且生长高度明显超出叶片。至此,一个叶元单元全部发育完成。模式Ⅱ中叶元各组成的形成顺序是:早期叶原基(节)→托叶原基→腋芽原基→侧小叶原基→顶端小叶原基。

图1 紫花苜蓿叶元的两种形成模式
2.2根颈芽发育进程中叶元的变化特征
根颈芽在出土前,叶元以模式Ⅰ发生(图2,表1)。新的叶元总是在前一叶元的相对位置(180°)有规律的出现。随着叶元数的增加,芽不断增长,临出土时叶元数已增至(18.30±1.40)个(表1)。芽出土后,很快进入3叶龄期,在地下预先形成的叶元中有(10.20±1.10)个已露出地面,地下保留约(7.00±2.00)个叶元(表1)。与出土前相比,此时新叶元开始在偏离上一叶元正对面的位置发生,腋芽原基的发育速度明显快于小叶原基,叶元发育开始表现出模式Ⅱ的发生特征(图2D~I)。随后,新叶元的发生愈加偏离前一叶元的中心轴,腋生分生组织发生速度不断增加,体积变大(图2E~I)。
10叶龄期,叶元形成速度增加,此时在芽顶端能同时看到3个正在发育的叶元(图2G)。到11叶龄期,叶元形成速度进一步加快(表1),芽端有5个叶元正在发育(图2H),地上叶元数已增加到(17.50±1.29)个(表1)。此时第16节的腋生分生组织已经发育为花序原基,并在其基部开始出现苞片和花原基(图2H)。自11叶龄开始,花序原基快速分化,发育速度和生长体积均远远超过了顶端分生组织(图2H~I),从此,苜蓿开始纵向由下而上、横向从外到内不断分化出大量花原基(图2I)。

图2 紫花苜蓿根颈芽生长成枝过程中叶元的发育变化
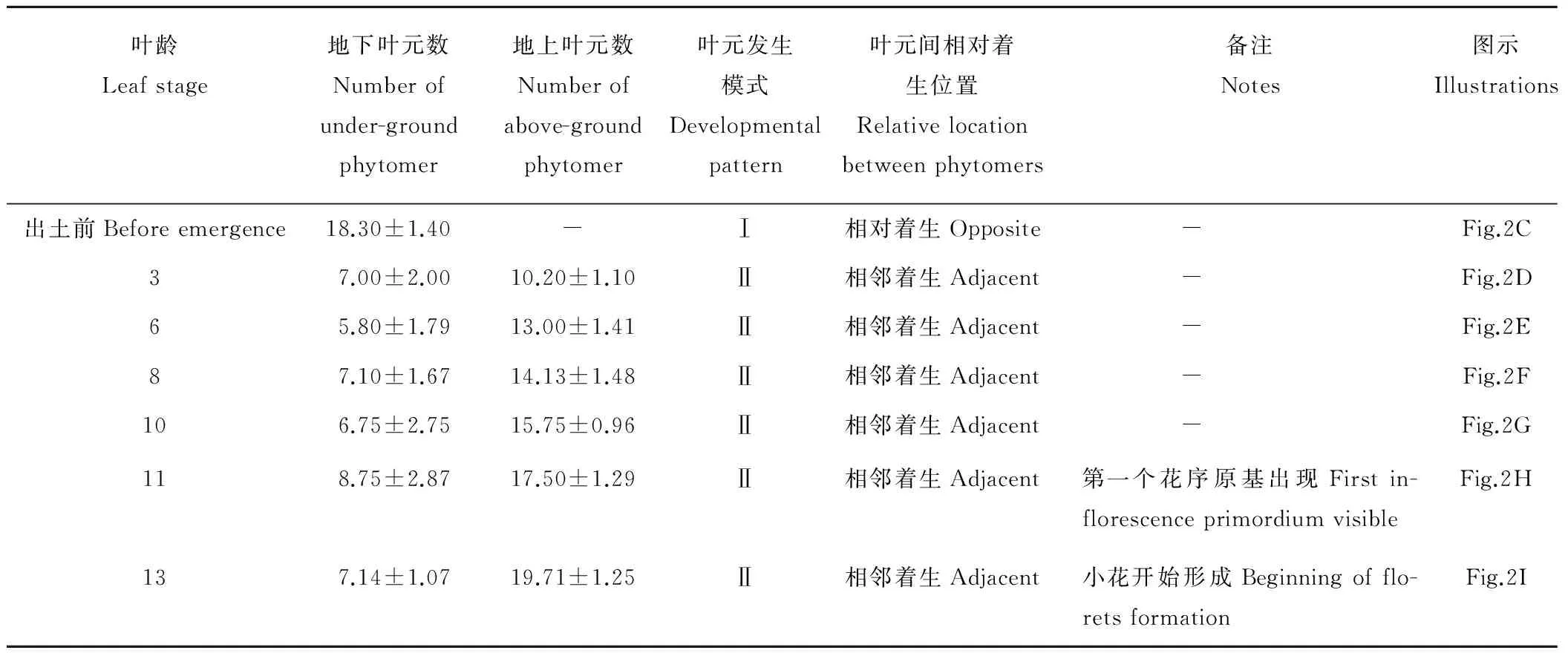
表1 返青期紫花苜蓿根颈芽发育进程中叶元的变化特征Table 1 Phytomer developmental characteristics of crown bud of alfalfa during spring regrowth
3 讨论
3.1苜蓿叶元发育过程中叶片与腋芽原基的发生
豆科植物复叶的发生方式具有多样性。研究报道,百脉根(Lotusjaponicus)叶原基的发生顺序是向基式(basipetal)的[23]。蒺藜苜蓿(M.truncatula)的复叶则以向顶式(acropetal)的模式发生[24]。豌豆(Pisumsativum)复叶结构特殊,叶顶端有卷须,在叶片早期发育过程中,小叶原基是向顶式发生的,但卷须却是以向基式的模式发生[25]。本研究发现,紫花苜蓿的复叶发生模式为向顶式,与蒺藜苜蓿相同。复叶原基在发生过程中共出现了早期叶原基、托叶原基、侧小叶原基和顶端小叶原基4个原基类型,这4个类型的原基沿纵轴方向自下而上依次形成。关于植物复叶中小叶沿纵轴发生方向的差异性,有一种解释认为是由于复叶原基纵轴方向激活小叶原基细胞发生分化的区域不同而引起的。如果叶原基基部细胞分化活跃,新的小叶原基会由顶向基发育,相反,如果顶部细胞分化活跃,则新小叶原基由基向顶发育[26]。Ikeuchi等[27]通过对白屈菜(Chelidoniummajus)的研究发现,虽然白屈菜的叶原基表现出向基式的发育模式,但叶原基中活跃细胞在纵轴方向开始分化生长的位点是不固定的,该研究结果显然与上述解释不符。目前关于植物叶片发生方式的多样性问题还没有合理的解释[28],其形成机理有待进一步研究。
本研究发现,苜蓿叶元的形成过程表现出两种模式:模式Ⅰ和模式Ⅱ。在这两种模式中,腋芽原基的发生时间和发育能力并不同。模式Ⅰ,在托叶原基和侧小叶原基形成期间还观察不到腋芽原基。腋芽原基直到侧小叶原基形成后才出现,且生长缓慢,之后被增大的叶原基包围;模式Ⅱ中,腋芽原基在托叶原基形成期就已经发生,该原基发生后生长快速,很快高出了叶原基和生长锥(见图1F-H)。Long和Barton[29]研究发现,在拟南芥早期生长阶段,其基生叶腋部观察不到腋生分生组织,腋生分生组织一直到茎生叶片形成之后才出现,这与本文研究结果相似。关于腋芽分生组织的发生原理有两种解释[30]:一是保留分生组织假说(reserve meristem hypothesis),这一假说认为腋芽原基与其上的叶片原基一样都起源于同一群顶端分生组织细胞,这些细胞从来没有丧失它们的分生特性。另一种假说为从头起始假说(initiation de novo hypothesis),认为腋芽分生组织是在叶片形成后由其腋部的细胞重新起始形成的。据此判断,苜蓿和拟南芥腋芽的发生特征似乎符合从头起始假说。但有学者通过原位杂交技术研究发现,拟南芥在营养生长期,其基部叶腋中虽然观察不到组织学上有明显区别的腋芽分生组织,但在原基的近轴一侧已有部分细胞表达LAS基因,LAS是腋芽分生组织起始所需要的基因,由此表明该位置早已具备形成腋芽分生组织的潜力,这一结果又支持了保留分生组织假说[31]。Leyser[32]分析认为,保留分生组织假说和从头起始假说可能并非明显不同的机制,只是其调控基因的表达和原基中细胞分化范围不同而已。
3.2苜蓿叶元发生模式的意义
植物在不同发育时期,其叶元各组成(节间、叶片和腋芽)的生长发育会表现出相应的变异性[3]。这种变异性可以用来鉴别植物的发育阶段[33-34]。Pouteau和Albertini[4]通过分析叶元的变化特征评价了拟南芥营养生长向生殖生长转变的过程,结果发现,在营养生长期,叶元中仅见基生的叶片,观察不到明显的节间和腋枝。当发育转向生殖生长阶段时,叶元发生了两次标志性变化:一次是节间首次伸长生长(bolting),节部发育出腋生繁殖枝(paraclade);另一次是从节部直接开出第一朵花。由于这两次变化发生的时间和空间是不同的,因此拟南芥的生殖生长表现出两个不同的发育区段:茎生叶区和花序区,在茎生叶区叶元侧生结构包括茎生叶和发达的侧生分枝,而花序区叶元的侧生结构仅有小花。Leyser[32]简练概括了拟南芥整个发育阶段的变化特征,认为拟南芥叶片原基和腋芽原基都是由初生分生组织产生的原基分化而来,但在营养生长阶段,原基主要用于产生叶片;成花过渡期,原基主要用于产生腋芽分生组织;到成花期,腋芽分生组织发育为小花。本研究发现,苜蓿叶元的发育变化特征与拟南芥相似。当叶元以模式Ⅰ发育时,叶原基发生早,且发育快速。腋芽原基在侧小叶原基形成后才出现,发育缓慢,很快被增大的叶片原基包围。显然,该模式下分生组织细胞的分化主要倾向于产生叶原基,叶原基对腋芽和生长锥起到明显的保护作用。当转变到模式Ⅱ后,腋芽原基在托叶原基形成后便出现,与模式Ⅰ相比,发生时间提前,且生长速度明显快于叶原基和生长锥。该时期叶器官的发育相对滞后,分生组织细胞的分化以腋芽发育为主。叶片由于发育迟缓,对芽端生长锥和腋芽原基的保护作用明显减弱。两个叶元间的相对着生位置也发生了变化(表1)。当地上叶元数增加到16~17后,腋芽分生组织发育为花序原基,苞片和小花原基也开始形成。根据Leyser[32]的观点,在苜蓿根颈芽发育过程中,叶元的模式Ⅰ发育时期为营养器官生长期,模式Ⅱ发育时期为成花过渡期,叶元发生方式由模式Ⅰ转向模式Ⅱ是苜蓿营养生长向生殖生长转变的标志。当地上叶元数增加到16~17后,发育进入成花期。
苜蓿根颈芽发育成枝的能力决定单茎生物量的形成,是影响苜蓿高产的一个潜在指标[21]。本研究首次从叶元水平揭示了苜蓿根颈芽发育进程中生长阶段的转变过程和判断方法,这为根颈芽发育成枝机理和苜蓿高产栽培技术研究提供了理论基础。
3.3苜蓿根颈芽的预生长
大多数温带多年生草本植物会利用前一年或更早预发生的芽在当年形成更新枝[35-36],不同植物再生芽的预发生时间是不同的。Meloche和Diggle[37]发现,蔷薇科羽叶花属植物Acomastylisrossii的叶和花序提前3年预先发生。高山植物珠芽蓼(Polygonumviviparum)的叶与花序从预发生到成熟至少需要4年时间[38]。不同物种间芽的预先发育程度也存在差异。有些植物仅预先形成茎、叶等营养器官,也有植物会预先形成茎、叶以及花序[39-40]。目前关于草本植物芽预生长的研究主要集中在温带高山草原与北极冻原植物的生态适应性方面[38,41],有关栽培作物芽预生长规律的研究鲜有报道。本文研究发现,苜蓿根颈芽的大多数叶节是在前一个生长季形成的。返青出土前根颈芽已经预先形成(18.30±1.40)个叶元。出土后,早期预先形成的(10.20±1.10)个叶元随之露出地面,叶元的发生模式此时也由出土前的模式Ⅰ转变为模式Ⅱ,当地上叶元数增加到(17.50±1.29)个时,腋芽分生组织发育为花序。根据上述研究结果分析,苜蓿根颈芽在返青出土前已经预先完成了营养器官的发生,出土后便立即向成花期过渡。Stubbendieck和Burzlaff[42]在对格兰马草(Boutelouagracilis)叶元发育的研究中发现,该植物分蘖芽从发生到开花平均发育13个叶元,其中前6个叶元是提前1年预发生的,后7个叶元在返青期形成并很快发育为生殖枝,这种预生长特性与本研究结果相似。Diggle[38]认为,芽的预生长特性有利于植物茎叶和繁殖结构在下一个生长季开始后迅速成熟。因此,根颈芽的预先发育为苜蓿返青期的快速生长和高产牧草的形成奠定了基础。
[1] Mündermann L, Erasmus Y, Lane B,etal.Quantitative modeling ofArabidopsisdevelopment.Plant Physiology, 2005, 139:960-968.
[2] Evert R F.Esau’s Plant Anatomy (3rd ed.)[M].New Jersey:John Wiley & Sons, Inc, 2006.
[3] Cheplick G P.Population differentiation in the tiller architecture ofMicrostegiumvimineum(Poaceae) in relation to habitat.Plant Species Biology, 2015, 30:16-27.
[4] Pouteau S, Albertini C.An assessment of morphogenetic fluctuation during reproductive phase change inArabidopsis.Annals of Botany, 2011, 107:1017- 1027.
[5] Watson M A, Casper B B.Morphogenetic constraints on patterns of carbon distribution in plants.Annual Reviews of Ecology and Systematics, 1984, 15:233-258.
[6] Rolf S, Rolf R.The fundamental relevance of morphology and morphogenesis to plant research.Annals of Botany, 1997, 80:571-582.
[7] Sylvie J, Jean D.Synchronism of leaf and tiller emergence relative to position and to main stem development stage in a rice cultivar.Annals of Botany, 2005, 95:401-412.
[8] Brian P F, Jerome D F, Udda L,etal.The barley phytomer.Annals of Botany, 2007, 100:725-733.
[9] Singels A, Inman-Bamber N G.Modelling genetic and environmental control of biomass partitioning at plant and phytomer level of sugarcane grown in controlled environments.Crop & Pasture Science, 2011, 62:66-81.
[10] Zhu J Q, Bruno A, Jan V,etal.Towards modelling the flexible timing of shoot development:simulation of maize organogenesis based on coordination within and between phytomers.Annals of Botany, 2014, 114:753-762.
[11] Kurihara H, Kuroda T, Kinoshita O.Morphological bases of shoot growth to estimate tuber yields with special reference to phytomer concept in potato plant.Japanese Journal of Crop Science, 1978, 47:690-698.
[12] Robin C, Hay M J, Newton P C.Effect of light quality (red:far-red ratio) and defoliation treatments applied at a single phytomer on axillary bud outgrowth inTrifoliumrepensL.Oecologia, 1994, 100:236-242.
[13] Helene G, Claude V, Baudry N.Comparison of horizontal spread of white clover (TrifoliumrepensL.) grown under two artificial light sources differing in their content of blue light.Annals of Botany, 1998, 82:41-48.
[14] Jochem B E, Jan V.Modeling branching in cereals.Frontiers in Plant Science, 2013, 4:1-6.
[15] Fournier C, Andrieu B.Dynamics of the elongation of internodes in maize (ZeamaysL.):analysis of phases of elongation and their relationships to phytomer development.Annals of Botany, 2000, 86:551-563.
[16] Yue Y H, Qi X, Wang Y R,etal.Persistence of 35Medicagosativavarieties at the 10th year after establishment.Acta Prataculturae Sinica, 2014, 23(1):58-64.
[17] Ernest S.Alfalfa and Relatives:Evolution and Classification ofMedicago[M].Wallingford:CABI, 2011.
[18] Marquez-Ortiz J J, Johnson L D.Crown morphology relationships among alfalfa plant introductions and cultivars.Crop Science, 1996, 36:766-771.
[19] Pembleton K G, Volenec J J.Partitioning of taproot constituents and crown bud development are affected by water deficit in regrowing alfalfa.Crop Science, 2010, 50:989-999.
[20] Dan U, Marvin H H.Alfalfa Germination and Growth[M].Wisconsi, Madison:University of Wisconsin, 2011.
[21] Volenec J J.Physiological control of alfalfa growth and yield[A].In:Smith D L, Hamel C.Crop Yield, Physiology and Processes[M].Berlin, Heidelberg:Springer-Verlag, 1999.
[22] Pouteau S, Albertini C.The significance of bolting and floral transitions as indicators of reproductive phase change inArabidopsis.Journal of Experimental Botany, 2009, 60(12):3367-3377.
[23] Luo J H, Yan J, Weng L,etal.Different expression patterns of duplicated PHANTASTICA-like genes inLotusjaponicussuggest their divergent functions during compound leaf development.Cell Research, 2005, 15:665-677.
[24] Wang H L, Chen J H, Wen J Q,etal.Control of compound leaf development by FLORICAULA/LEAFY Ortholog SINGLE LEAFLET1 inMedicagotruncatula.Plant Physiology, 2008, 146:1759-1772 .
[25] Hofer J, Ellis T H.The genetic control of patterning in pea leaves.Trends in Plant Science, 1998, 11(3):439-444.
[26] Gleissberg S.Comparative analysis of leaf shape development in Papaveraceae-Papaveroideae.Flora, 1998, 193:269-301.
[27] Ikeuchi M, Tatematsu K, Yamaguchi T,etal.Precocious progression of tissue maturation instructs basipetal initiation of leaflets inChelidoniummajussubsp.asiaticum(Papaveraceae).American Journal of Botany, 2013, 100:1116-1126.
[28] Tsukaya H .Comparative leaf development in angiosperms.Current Opinion in Plant Biology, 2014, 17:103-109.
[29] Long J, Barton M K.Initiation of axillary and floral meristems inArabidopsis.Developmental Biology, 2000, 218:341-353.
[30] Garrison R.Studies in the development of axillary buds.American Journal of Botany, 1955, 42:257-266.
[31] Thomas G, Oliver C, Elisabeth S,etal.Molecular analysis of the LATERAL SUPPRESSOR gene inArabidopsisreveals a conserved control mechanismfor axillary meristem formation.Genes & Development, 2003, 17:1175-1187.
[32] Leyser O.Regulation of shoot branching by auxin.Trends in Plant Science, 2003, 8:541-545.
[33] Diggle P K.Heteroblasty and the evolution of flowering phonologies.International Journal of Plant Sciences, 1999, 160:123-134.
[34] Jones C S.An essay on juvenility, phase change, and heteroblasty in seed plants.International Journal of Plant Sciences, 1999, 160:105-111.
[35] Vesk P A, Westoby M.Funding the bud bank:a review of the costs of buds.Oikos, 2004, 106:200-208.
[36] Jarcuska B.Is preformation of future shoots inFagussylvaticaL.buds reflected in bud/sprouted shoot traits relationships? Dendrobiology, 2011, 66:25-31.
[37] Meloche C G, Diggle P K.Preformation, architectural complexity, and developmental flexibility inAcomastylisrossii.American Journal of Botany, 2001, 88:980-991.
[38] Diggle P K.Extreme preformation in alpinePolygonumviviparum:an architectural and developmental analysis.American Journal of Botany, 1997, 84:154-169.
[39] Geber M A, Kroon H, Watson M A,etal.Organ preformation in mayapple as a mechanism for historical effects on demography.Journal of Ecology, 1997, 85:211-223.
[40] Klimesova J, Klimes L.Bud banks and their role in vegetative regeneration-a literature review and proposal for simple classification and assessment.Perspectives in Plant Ecology, Evolution and Systematics, 2007, 8:115-129.
[41] Mark A F.Floral initiation and development in New Zealand alpine plants.New Zealand Journal of Botany, 1970, 8:67-75.
[42] Stubbendieck J, Burzlaff D F.Nature of phytomer growth in blue grama.Journal of Range Management, 1971, 24:154-156.
参考文献:
[16] 岳彦红, 齐晓, 王彦荣, 等.35个10龄紫花苜蓿品种的持久性比较.草业学报, 2014, 23(1):58-64.
Development of phytomers produced by root crown shoots inMedicagosativa
FANG Qiang-En, ZHANG Bo, SHI Shang-Li*
KeyLaboratoryofGrasslandEcosystem,MinistryofEducation,CollegeofPrataculturalScience,GansuAgriculturalUniversity,PrataculturalEngineeringLaboratoryofGansuProvince,SinoU.S.CenterforGrazinglandEcosystemSustainability,Lanzhou730070,China
The phytomer, consisting of a node, leaflike organ, internode, and lateral meristem in the axil of a leaf, is a basic structural unit of shoot growth and development.With scanning electron microscopy (SEM), the developmental characteristics of phytomers in alfalfa variety ‘WL168’ were observed throughout the developmental phases of the apical meristem in crown buds from sprouting to flowering.During the development of phytomers, the primordial compound leaf emerged in an acropetal pattern.Both the primordial axillary bud and compound leaf originated from the apical meristem, but they differed in the rhythm of development; phytomers showed two patterns of development.Pattern-I was featured by the faster development of primordial compound leaves than primordial axillary buds which appeared after the formation of lateral primordial leaves.For patternⅡ, primordial axillary buds grew faster than primordial compound leaves, initiating after the formation of primordial stipules.Before the crown bud emerged from the soil, the phytomer developed through pattern-Ⅰ, and immediately after emergence, through pattern-Ⅱ.When the number of aboveground phytomer reached 16-17, the axillary meristem became reproductive.It was concluded that the shift of phytomer development from pattern Ⅰ to pattern Ⅱ can be an indicator of the transition from vegetative to reproductive growth in alfalfa.
alfalfa; crown bud; phytomer; primordium
10.11686/cyxb2015253
http://cyxb.lzu.edu.cn
2015-05-14;改回日期:2015-06-26
国家现代牧草产业技术体系-栽培与草地管理(CARA-35),农业部牧草种质资源保护与利用(NB2130135)和甘肃农业大学盛彤笙科技创新基金(GSAU-STS-1228)资助。
方强恩(1980-),男,甘肃天水人,讲师,在读博士。E-mail:fangqen@163.com
*通信作者Corresponding author.E-mail:shishl@gsau.edu.cn
方强恩, 张勃, 师尚礼.紫花苜蓿根颈芽发育成枝过程中叶元的发生模式研究.草业学报, 2015, 24(12):146-154.
FANG Qiang-En,ZHANG Bo,SHI Shang-Li.Development of phytomers produced by root crown shoots inMedicagosativa.Acta Prataculturae Sinica, 2015, 24(12):146-154.

