珠芽蓼内生菌ZA1对马铃薯的防病促生研究
畅涛,杨成德,薛莉,杨小利,冯中红,郝蓉蓉,张振粉,陈秀蓉
(草业生态系统教育部重点实验室,甘肃农业大学草业学院,甘肃省草业工程实验室,中-美草地畜牧业可持续发展研究中心,甘肃 兰州730070)
珠芽蓼内生菌ZA1对马铃薯的防病促生研究
畅涛,杨成德*,薛莉,杨小利,冯中红,郝蓉蓉,张振粉,陈秀蓉
(草业生态系统教育部重点实验室,甘肃农业大学草业学院,甘肃省草业工程实验室,中-美草地畜牧业可持续发展研究中心,甘肃 兰州730070)
利用常规方法对莫海威芽孢杆菌ZA1分泌吲哚乙酸(IAA)、固氮、溶磷和产抑菌酶等能力进行定性测定,并在室内和大田条件下对其防治马铃薯病害及促生作用进行了研究。ZA1在含和不含色氨酸的King培养基中分泌IAA分别为12.17和9.75 mg/L,具有固氮能力并能分泌胞外蛋白酶,但无溶磷能力,且不能产生几丁质酶和葡聚糖酶;10倍液喷雾对贮藏期马铃薯坏疽病的防效达85.9%;20倍液拌种对田间马铃薯晚疫病防效为26.56%,但马铃薯商品薯增产率达36.29%,每hm2增产率达33.88%。采用10倍稀释液对马铃薯块茎拌种后盆栽55 d,根、茎及叶绿素含量均高于对照,其中经10倍ZA1处理后,根长与干、鲜重分别增加8 cm、0.75 g和5.07 g,株高、茎粗及茎干、鲜重分别增加2.74 cm、0.27 cm、0.52 g和5.73 g,干湿根冠比分别增加0.214和0.094,叶绿素含量增加0.54 mg/g;且可诱导马铃薯植株内的过氧化物酶(POD)、多酚氧化酶(PPO)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT )和苯丙氨酸解氨酶(PAL)酶活性增加。本研究明确了菌株ZA1对马铃薯的防病促生作用及对其防御酶的诱导,为ZA1开发成为微生物农药及菌肥提供理论依据。
莫海威芽孢杆菌;马铃薯;防病促生;防御酶
马铃薯(Solannmtuberosum)在全国种植面积较广,是农民重要的经济支柱。据调查,近年来,马铃薯贮藏期病害发生严重,其中以马铃薯坏疽病菌(Phomafoveata)引起的进境检疫病害马铃薯坏疽病最为严重,严重影响马铃薯的品质,加之马铃薯苗期晚疫病(Phytophthorainfestans)发病率较高,导致马铃薯的商品薯率下降,带来严重的经济损失。贮藏库中,由于不便多次施用化学农药进行防治,而生物防治可以1次施用,菌株定殖后较长时间有效,因此成为马铃薯贮藏期病害防治的更佳途径。目前,植物内生菌[1]作为生防菌的来源之一,已成为研究热点。目前,有关从植物体内分离得到可以抑制植物病原菌的内生菌[2-9]的文献较多,且分离得到的部分内生菌凭借其生物学功能可以使植物得到更多的养分补充[10-13],从而达到对植物的促生作用。对生防菌抑菌机制的研究更是得到众多学者的青睐,刘雪等[14]认为,生防菌之所以能够抑制病原菌,是因为其能够产生胞外分泌型抑菌物质;与此同时,邢介帅等[15]从生防菌T2中分离纯化得到了具有抑菌作用的胞外蛋白酶,经过进一步的研究发现,生防菌还可以分泌小分子量的抗菌肽[16]和大分子量的抑菌蛋白[17]等胞外分泌型物质;也有学者从植物诱导抗病性入手研究生防菌的防病机制,如孙建波等[18]、杨海莲等[19]通过试验证明生防菌可诱导植物的防御酶,使其活性增加,从而达到抵抗病原菌侵染的目的。本课题组从东祁连山高寒草地珠芽蓼(Polygonumviviparum)内生细菌中筛选得到的莫海威芽孢杆菌(Bacillusmojavensis)ZA1对马铃薯坏疽病菌具有明显的抑制作用,且该菌株对马铃薯贮藏期的多种病害具有较好的抑制作用[20],虽然莫海威芽孢杆菌ZA1对P.foveata的室内抑制效果明显,但其对马铃薯在贮藏期及田间的防病促生是否明显有待于研究,其防病促生的机制也有待于明确,加之马铃薯坏疽病是我国检疫性病害,有关其生物防治国内除本项目组外未见报道,对该病害的生物防治研究具有一定的意义。因此,明确菌株ZA1的生物学功能及其在贮藏期和田间的防病促生作用,为ZA1开发成为微生物菌肥及农药提供理论依据,以便为马铃薯生长期促生及贮藏期病害防治提供新的途径和理论依据。
1 材料与方法
1.1材料
1.1.1供试菌株 供试拮抗菌:莫海威芽孢杆菌(Bacillusmojavensis)ZA1,为珠芽蓼内生细菌;供试病原菌:马铃薯坏疽病菌,均由甘肃农业大学植物病理实验室提供。
1.1.2供试农药及马铃薯品种 供试农药:75%肟菌·戊唑醇(75% Oxime bacteria·tebuconazole,水分散剂,德国拜耳集团);25%嘧菌酯(25% Azoxystrobin,悬浮剂,英国先正达有限公司);供试品种:新大坪,陇薯3号。
1.1.3供试培养基 牛肉胨培养基、牛肉胨培养液、马铃薯葡萄糖琼胶培养基、无机磷培养基(PKO)、阿须贝培养基、几丁质培养基、葡聚糖培养基和蛋白酶培养基[15,21-23]。
1.2ZA1产IAA、溶磷和固氮能力测定
1.2.1产IAA的定性及定量测定 采用Salkowski比色法对ZA1进行产IAA能力测定,3个重复均变红为阳性,表示能分泌IAA,不变色为阴性,表示不分泌IAA。制作纯3-IAA标准曲线,配制2组浓度依次为2.5,5.0,7.5,10.0,12.5,15.0,17.5 mg/L和25,50,75,100,125,150,175 mg/L的标液,分别取4 mL,在1组中加入PC比色液4 mL,另1组中加入S2比色液4 mL,黑暗静置30 min,取出后测其OD530值,制作纯3-IAA标准曲线。将培养12 d的ZA1的菌悬浮液和空白对照离心10 min,转速为10000 r/min,取上清液4 mL分别加入等量比色液,黑暗静置30 min后测OD530值,以加了比色液的空白为对照。用相应的标准曲线计算菌株分泌IAA的量。
1.2.2溶磷能力的定性测定 将ZA1点接于PKO(或蒙金娜)平板培养基上,置于28℃恒温培养箱培养5 d后,观察菌株在培养基平板上形成的溶磷圈,有溶磷圈的记为阳性。
1.2.3固氮能力的定性测定 将ZA1点接于阿须贝培养基上,同时将200 μL ZA1菌悬液接入阿须贝液体培养基中,重复3次,以无菌水接种做对照,28℃培养,在第3,5,7天目测其生长状况,在阿须贝培养基上明显生长者和能使液体培养基变浑浊的记为阳性,继代培养3代仍为阳性,则认为具有固氮能力。
1.3抑菌酶类的定性测定
ZA1分别点接于各培养基,在几丁质培养基30℃下培养3~5 d,葡聚糖培养基28℃下培养7 d,蛋白酶培养基37℃下培养5 d,若菌落周围出现透明圈,则定性认为ZA1具有分泌这些酶的能力。
1.4室内贮藏期药效试验
活化马铃薯坏疽病菌后制成浓度约1×106孢子悬液待用。选大小均匀且无病的新大坪薯块200个,用昆虫针在块茎上造表面为1 cm2、深度为0.2 cm的伤口,后将悬浮液均匀喷在薯块表面,100%保湿48 h。设置处理拮抗菌发酵液稀释10,20,30倍,以75%肟菌·戊唑醇4000倍液和25%嘧菌酯1800倍液药剂对照,以清水为空白对照。将处理液均匀喷在薯块表面。15℃下黑暗处理,待其发病后,对发病情况进行分级,计算病情指数并测定ZA1的防治效果。
病情指数=[∑(各级病斑数×对应级数)/(总调查数×最高级数)]×100 防效(%)=[(对照病情指数-处理病情指数)/对照病情指数]×100
分级标准:0级,不发病;1级,病斑边缘无扩展,腐烂深度0.1~0.2 cm;3级,病斑边缘无扩展,腐烂深度0.2~0.5 cm;5级,病斑边缘有扩展,腐烂深度0.5 cm以内;7级,病斑边缘有扩展,腐烂深度0.5~1.0 cm;9级,病斑边缘有扩展,腐烂深度1 cm以上。
1.5盆栽促生能力测定
活化ZA1 24 h后,将其发酵液(3.8×108CFU/mL)稀释10,20,30倍,取未发芽的马铃薯切块进行拌种,种植于花盆中,并按土壤质量(g)与发酵液体积(mL)比为35∶1进行灌根。温室下管理55 d后,测定马铃薯根长与株高、干湿重、茎直径及叶绿素a、b含量,并计算根冠比。
1.6田间防病促生测定
本试验于甘肃定西市岷县麻子川乡完成,试验地共设9个小区,四周无保护行,每小区20 m2。将ZA1发酵液稀释20倍后与新大坪进行拌种,25%嘧菌酯1800倍液药剂对照,清水为空白对照。于2013年4月15日播种,8月29日进行病害调查并测产。每小区按“Z”字型五点取样,每点调查2株,每株取上中下共20片叶,对地上部晚疫病进行分级并计算病情指数和防效。测产时,每小区选中心5 m2,测其产量,并根据大小情况对其分类,得出商品薯和每hm2的增产率。
晚疫病分级标准:0级,无病斑;1级,病斑面积占整片叶面积的5%以下;3级,病斑面积占整片叶面积的6%~10%。5级,病斑面积占整片叶面积的11%~20%;7级,病斑面积占整片叶面积的21%~50%;9级,病斑面积占整片叶面积的50%以上。
1.7ZA1对马铃薯植株体内几种酶活性的影响
1.7.1接种与取样方法 活化ZA1 24 h后,将其发酵液(CFU=3.8×108)稀释20倍,采用喷雾法分别将发酵液均匀喷于生长60 d后的马铃薯盆栽苗子上。每隔6 h在植株上、中、下分别取2片叶子,于-20℃保存。
1.7.2粗酶提取 将处理叶片剪碎,放入预冷研钵中,加入 3.0 mL 硼酸缓冲液(0.1 mol/L pH 8.8 内含0.2% PVP 1 mmol/L EDTA-Na2)冰浴条件下研磨成匀浆,转入2.0 mL 离心管,l0000 r/min、4℃离心 20 min,上清液即为所需的酶粗提取液,于-20℃保存。
1.7.3酶活测定 参考文献[24]的方法对马铃薯的过氧化物酶(peroxidase, POD)、多酚氧化酶(polyphenol oxidase, PPO)、超氧化物歧化酶(superoxide dismutase, SOD)、过氧化氢酶(catalase, CAT)和苯丙氨酸解氨酶(phenylalanine ammonialyase, PAL)进行酶活测定,以各酶的相对活性(处理酶活减去对照酶活)衡量ZA1对马铃薯的诱导抗性。
1.7.4可溶性蛋白含量测定 采用考马斯亮蓝G-250 法,用牛血清蛋白配制成0~1000 μg/L标准溶液,595 nm 比色制作标准曲线,吸取各样品提取液0.1 mL,加入考马斯亮蓝5 mL,振荡器充分混匀、放置2 min后在595 nm下比色,记录吸光值,通过标准曲线计算各样品蛋白质的含量。
1.8统计分析
采用Excel软件处理数据,并使用SPSS 16.0软件的新复极差法(Duncan)进行统计分析。
2 结果与分析
2.1ZA1产IAA、溶磷和固氮能力测定
2.1.1IAA的定性测定 结果表明,含100 mg/L色氨酸的培养液在比色反应中呈红色,与对照差异显著(图1),说明在King培养基中加入100 mg/L的色氨酸能够促进ZA1合成IAA。
2.1.2IAA的定量测定 结果表明,不含色氨酸的King培养液中分泌IAA的浓度为9.75 mg/L;含100 mg/L色氨酸的King培养液中分泌IAA的浓度为12.17 mg/L,后者IAA的合成量是前者的1.25倍,说明色氨酸的存在能较明显地增加ZA1合成IAA的量,即外源色氨酸可以作为ZA1合成IAA的前体物质。
2.1.3溶磷能力的定性测定 结果表明,ZA1在PKO无机磷培养基和蒙金娜培养基上(有机磷培养基)分别培养没有溶磷圈出现,说明ZA1没有溶解有机磷和无机磷的能力。
2.1.4固氮能力的定性测定 结果表明,ZA1点接于阿须贝培养基后,在第3天时形成菌落,第5天时形成明显的菌落;接种于液体培养基后,5 d后培养液变浑。连续培养3代后,ZA1在第5天时同样能形成菌落并能使培养液变浑,说明ZA1具有固氮能力。
2.2抑菌酶类的定性测定
ZA1接种于培养基上培养后,几丁质培养基与葡聚糖培养基上无透明圈产生,蛋白酶培养基上有透明圈产生(图2),直径为3.2 cm,说明ZA1不能分泌几丁质酶和葡聚糖酶,但能够分泌胞外蛋白酶,且胞外蛋白酶的作用效果明显。

图1 ZA1比色反应
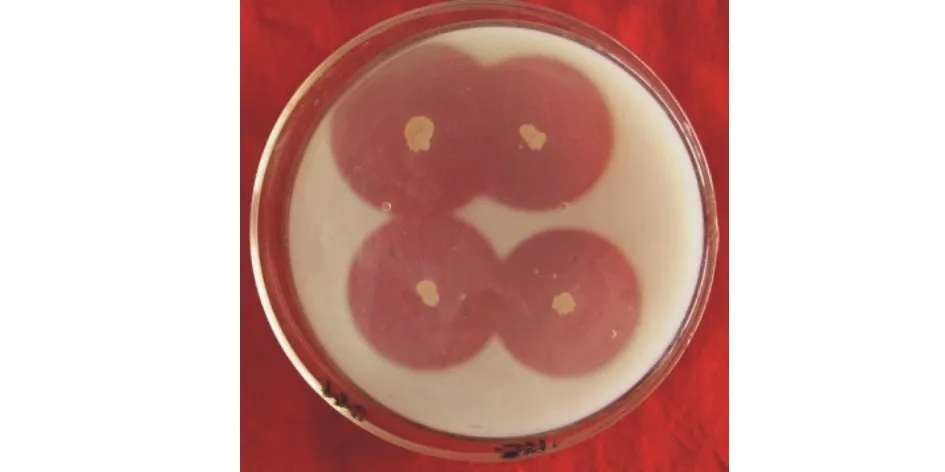
图2 ZA1分泌胞外蛋白酶
2.3室内贮藏期药效试验
贮藏期接种P.foveata后,对照病情指数为37.87%,75%肟菌·戊唑醇4000倍液和25%嘧菌酯1800倍液处理后病情指数分别为7.83%和8.33%,ZA1发酵液稀释10,20和30倍处理后,病情指数依次为4.80%,8.12%和11.44%。ZA1发酵液稀释随着稀释倍数的增加,防效依次下降,当稀释20倍时,其防效与75%肟菌·戊唑醇4000倍液和25%嘧菌酯1800倍液的防效差异不显著(图3),说明菌株ZA1在马铃薯贮藏期对马铃薯坏疽病具有较好的防效,可以替代化学药剂在贮藏期对马铃薯坏疽病进行防治。
2.4盆栽促生能力测定
2.4.1马铃薯生物量测定 ZA1发酵液拌种马铃薯块茎后,10,20,30倍液处理依次出苗,均先于对照出苗,说明ZA1具有促进马铃薯块茎发芽的作用。55 d后在10,20,30倍液处理的根部可明显观察到较小的马铃薯块茎,但对照没有发现;不同处理下,根的长度分别增加8.00,5.20和0.34 cm,根的干重分别增加0.72,0.50和0.34 g,根的湿重分别增加5.07,2.81和1.62 g,株高分别增加2.74,3.40和2.74 cm,茎的干重分别增加0.52,0.47和0.25 g,茎的湿重分别增加5.73,2.10和1.03 g,茎直径分别增加0.17,0.11和0.10 cm(表1);且马铃薯的根冠比与对照相比有明显的增加(图4),说明ZA1对马铃薯的促生作用明显。
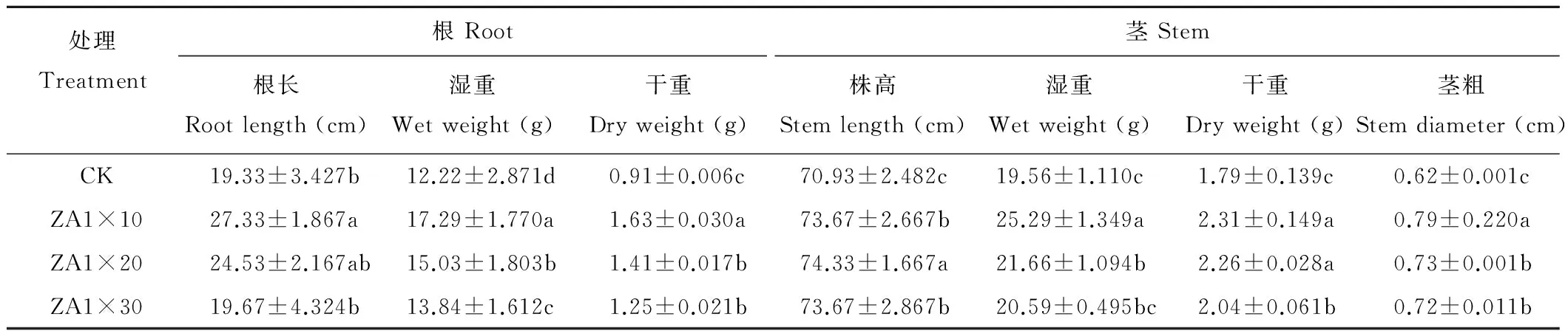
表1 马铃薯的生物量测定Table 1 The determination of biomass of potato
注:不同大写字母表示差异极显著(P<0.01),不同小写字母表示差异显著(P<0.05),下同。
Note:The different capital letters mean the significant difference atP<0.01, the different small letters mean the significant difference atP<0.05.The same below.
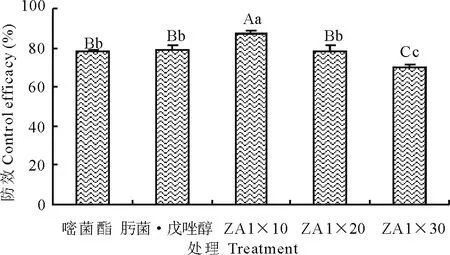
图3 ZA1贮藏期防效

图4 马铃薯苗期根冠比
嘧菌酯:Azoxystrobin; 肟菌·戊唑醇:Oxime bacteria·tebuconazole.不同大写字母表示差异极显著(P<0.01),不同小写字母表示差异显著(P<0.05),下同。The different capital letters mean the significant differences atP<0.01, the different small letters mean the significant differences atP<0.05,the same below.
2.4.2马铃薯叶片叶绿素含量测定 经不同稀释倍数的ZA1拌种后,叶绿素含量分别增加0.54,0.26和0.13 mg/g,叶绿素a与叶绿素b分别有不同程度的增加(表2),但随稀释倍数的增加,叶绿素含量呈下降趋势,说明高浓度ZA1可促进马铃薯的光合作用。
2.5田间防病促生测定
经ZA1拌种后,对马铃薯生长期的晚疫病防效为26.56%,商品薯率高于对照,且商品薯的增产率达到36.29%,折合每hm2产量 (包括商品薯及非商品薯)增产率可达33.88%,其商品薯及每hm2增产率均比25%嘧菌酯高,说明拮抗菌ZA1拌种马铃薯后在田间具有防病促生效果(表3)。
2.6ZA1对马铃薯防御酶的影响
2.6.1马铃薯叶片防御酶活性测定 与对照相比,经20倍ZA1发酵液诱导后,马铃薯叶片防御酶中,CAT、SOD和POD整体变化趋势为先增后减,但是活性变化与对照相比较小;PAL和PPO活性变化最大,其中PPO于接种ZA1 6 h后活性小于对照,随后开始增加,于36 h时达到最大值后开始减小,PAL活性在36 h达到最大值后也开始减小,但后期有所增加(图5)。说明拮抗菌ZA1诱导马铃薯后,可以使马铃薯防御酶活性增加,有利于马铃薯抵抗病原菌的侵染。
2.6.2马铃薯叶片可溶性蛋白含量测定 经ZA1诱导后,马铃薯叶片可溶性蛋白含量与对照相比有所增加,接种ZA1 48 h后,可溶性蛋白达到最大量(图6)。说明ZA1能够使马铃薯叶片的可溶性蛋白含量增加,可以使马铃薯起到防病的作用。

表2 马铃薯叶片叶绿素含量测定Table 2 The determination of chlorophyll content in potato leaf mg/g

表3 ZA1田间防病促生测定Table 3 The determination of control and growth promotion of ZA1 in the fields %
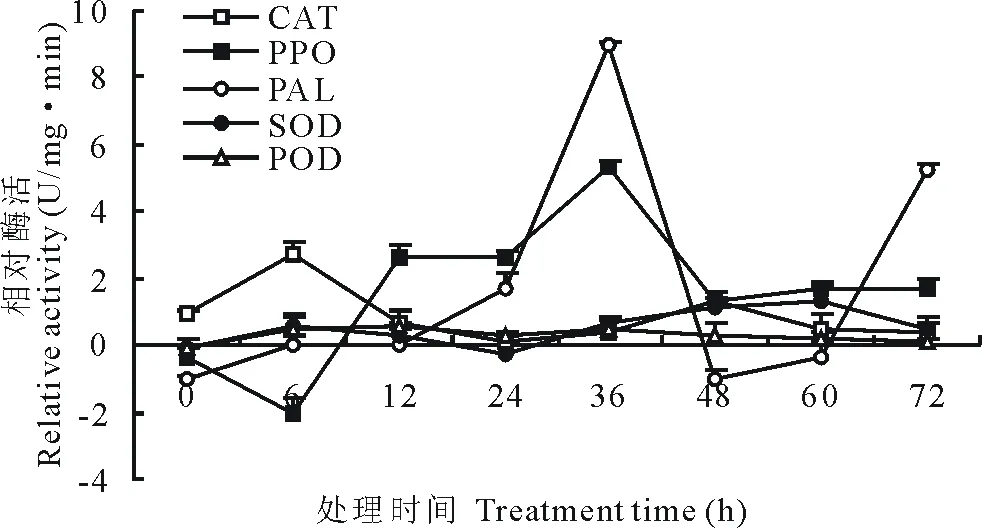
图5 马铃薯叶片防御酶的相对活性变化

图6 马铃薯叶片蛋白质含量的变化
3 讨论
内生菌可通过分泌IAA、解溶磷和联合固氮作用对植物达到促生的作用[6-12],其中分泌IAA可以促进植物种子的发芽[25]。珠芽蓼内生菌ZA1具有分泌IAA和固氮的能力,但无解溶磷能力,经盆栽促生测定表明,马铃薯块茎拌种ZA1后,其出苗速度快于对照,说明ZA1分泌IAA后可促进马铃薯块茎的发芽,这与前人报道一致。ZA1对马铃薯的促生作用不仅体现在促进发芽上,经其拌种后,马铃薯根、茎的长度及干、湿重均高于对照,根冠比和叶绿素含量也比对照高,说明ZA1对马铃薯具有促生作用。田间拌种ZA1后,马铃薯的商品薯增产率与每hm2产量增产率比对照高出36.29%和33.88%,表明ZA1对马铃薯在田间的增产作用极其明显。目前,还没有测定ZA1对其他植物有无促生作用及其促生机制,对此有待于进一步研究。
邢介帅等[15]报道生防菌T2产生的胞外蛋白酶具有抑菌能力,通过与T2产生的胞外蛋白酶的性质对比,ZA1产生的抑菌物质与T2产生的胞外蛋白酶在耐酸碱及耐高温等部分性质上不符合,说明ZA1产生的抑菌物质除胞外蛋白酶之外,还可能具有其他类型的抑菌物质,如耐酸耐碱耐高温的抗菌肽,且室内抑菌能力测定结果表明ZA1对马铃薯贮藏期病害如马铃薯坏疽病、炭疽病及褐腐病均具有良好的抑制效果[20],加之马铃薯贮藏期病害不方便化学农药的防治,因此本项目组筛选得到的拮抗菌ZA1对马铃薯贮藏期的病害进行生物防治具有一定的意义。本试验经贮藏期防效测定,10倍ZA1发酵液对马铃薯坏疽病的防效可达85.9%,显著高于75%肟菌·戊唑醇4000倍液和25%嘧菌酯1800倍液的防效,表明ZA1是马铃薯坏疽病的有效生防菌。张鹏等[26]报道药剂对马铃薯晚疫病的防效均在79%以上,虽然ZA1对田间晚疫病的防效仅为26.56%,但与25%嘧菌酯1800倍液的防效差异不显著,由于马铃薯晚疫病属气传病害,仅在播种时进行拌种,而未在马铃薯苗期喷雾可能是造成其防效较差的原因,因此ZA1对马铃薯晚疫病及它病害的防效试验还需进一步研究。
拮抗菌能诱导植物产生病程相关的苯丙氨酸解氨酶、多酚氧化酶、过氧化氢酶、超氧化物歧化酶与过氧化物酶的活性发生变化[18,27-29],可使植物的抗性增加。本研究中,于马铃薯叶片喷施20倍ZA1后,使得5种防御酶的活性均有增加,整体表现出先增后减的趋势,与文献[18,27-29]报道一致; PAL与PPO的活性变化与文献报道的略有差别,这可能与处理时间仅为72 h有关,由于每次取样对植株可能造成不同程度的损伤,可能是导致其部分酶活变化与文献[18,27-29]中酶活变化趋势不一致的原因,具体原因还有待于进一步研究。植物的可溶性蛋白也可作为衡量抗性的指标[30],本试验中马铃薯经ZA1诱导后,60 h内蛋白含量均高于对照,说明喷施ZA1后可诱导提高马铃薯抗性。经室内和大田防试验研究,证明珠芽蓼内生菌ZA1对马铃薯坏疽病具有较强的抑制作用,并对马铃薯具有较好的防病促生能力,同时,可诱导马铃薯获得抗性。因此,ZA1可开发成为高效的微生物农药及菌肥。
[1] Lodewyckx C, Mergeay M, Vangronsveld J,etal.Isolation, characterization, and identification of bacteria associated with the zinc hyperaccumulatorThlaspicaerulescenssub sp.Calaminaria.International Journal of Phytoremediation, 2002, 4:101-115.
[2] Cho K M, Young S H, Mi L S,etal.Endophytic bacterial communities in ginseng and their antifungal activity against pathogens.Microbial Ecology, 2007, 54:341-351.
[3] Islam S M A, Math R K, Kim J M,etal.Effect of plant age on endophytic bacterial diversity of balloon flower (Platycodongrandiflorum) root and their antimicrobial activities.Current Microbiology, 2010, 61:346-356.
[4] Ramesh R, Joshi A A, Ghanekar M P.Pseudomonads, major antagonistic endophytic bacteria to suppress bacterial wilt pathogen,Ralstoniasolanacearumin the eggplant (SolanummelongenaL.).World Journal of Microbiology and Biotechnology, 2009, 25:47-55.
[5] Forchetti G, Masciarelli O, Izaguirre M,etal.Endophytic bacteria improve seedling growth of sunflower under water stress, produce salicylic acid, and inhibit growth of pathogenic fungi.Current Microbiology, 2010, 61:485-493.
[6] Li C H, Zhao M W, Tang C M,etal.Population dynamics and identification of endophytic bacteria antagonistic toward plant-pathogenic fungi in cotton root.Microbial Ecology, 2010, 59:344-356.
[7] Wang Y, Zhan R L, He H,etal.Antibiotic substances produced by mangrove endophytic bacteria Kc-38 and biocontrol efficacy on anthracnose of postharvest mangoes.Chinese Journal of Biological Control, 2012, 27(1):82-87.
[8] Wang F, Ji M S, Gu Z M,etal.Effect of antifungal substances from endophytic bacteria B36 onFulriafulva.Chinese Journal of Biological Control, 2009, 25(3):250-254.
[9] Chang T, Wang H Q, Yang C D,etal.Identification and evaluation of biological control potential of B-401 endophytic bacteria in grasses on alpine grasslands.Acta Prataculturae Sinica, 2014, 23(3):282-289.
[10] Hou X J, Li Z N, Han D Y,etal.Presence of indigenous endophytic bacteria in jujube seedlings germinated from seedsinvitro.Frontiers of Agriculture in China, 2010, 4(4):443-448.
[11] Wang C Y, Chen X R, Yang C D,etal.Identification of an endophytic phosphate-solubilizing bacteria isolated fromKobresiacapillifolia.Journal of Gansu Agricultural University, 2011, 46(3):99-103.
[12] Oliveira A L M, Urquiaga S, Döbereiner J,etal.The effect of inoculating endophytic N2-fixing bacteria on micropropagated sugarcane plants.Plant and Soil, 2002, 242:205-215.
[13] Liu J L, Fang F, Shi X H,etal.Isolation and characterization of PGPR from the rhizosphere of theAvenasativain saline-alkali soil.Acta Prataculturae Sinica, 2013, 22(2):132-139.
[14] Liu X, Mu C Q, Jiang X L,etal.Research progress of the metabolic substances produced byBacillussubtillisand their application on biocontrol of plant disease.Chinese Journal of Biological Control, 2006, 10, 22(Supplement):179-184.
[15] Xie J S, Li R, Zhao L,etal.Purification, characterization and antagonism of an extracellular protease fromBacillussubtilisstrain T2.Acta Phytopathologica Sinica, 2008, 38(4):377-381.
[16] Gao F, Ma L P, Qiao X W,etal.Purification of antifungal peptide produced by antagonisticBacilluscereusBC98-I againstFusariumoxysporum.Acta Phytopathologica Sinica, 2007, 37(4):403-409.
[17] Zhai R H, Shang Y K, Liu F,etal.Characteristics and inhibitory action of antifungal protein produced byBacillussubtilisstrain G8.Journal of Plant Protection, 2007, 34(6):592-596.
[18] Sun J B, Wang Y G, Zhao P J,etal.Colonization of biocontrol strain XB16 againstFusariumwilt pathogen of banana and its effect on defense-related enzymes.Chinese Journal of Tropical Crops, 2012, 31(2):212-216.
[19] Yang H L, Sun X L, Song W.Current development on induced resistance by plant growth promoting and endophytic bacteria.Acta Phytopathologica Sinica, 2000, 30(2):106-110.
[20] Chang T, Wang H Q, Yang C D,etal.Screening and identification of antagonist bacteria againstPhomafoveataon potato.Chinese Journal of Biological Control, 2014, 30(2):247-252.
[21] Fang Z D.Research Method of Plant Pathology(Third Edition)[M].Beijing:Chinese Agriculture Press, 1997.
[22] Gulpiye, Huang L L, Kang Z S.Study on a strain of high chitinase producing bacteria against plant pathogens.Acta Agriculturae Boreali-occidentalls Sinica, 2006, 15(6):189-191.
[23] Tang Z Y, Wang H, Xiong S B,etal.Studies on the screening of β-1,3-glucanase producing strains and enzyme producing condition.Journal of Hunan Agricultural University (Natural Sciences), 2006, 32(5):552-556.
[24] Gao W.The Biocontrol Mechanism of Bacillus marinus B-9987[D].Qingdao:Qingdao University of Science and Technology, 2009.
[25] Armando C F D, Francisco E C C, Fernando D A,etal.Isolation of micropropagated strawberry endophytic bacteria and assessment of their potential for plant growth promotion.World Journal of Microbiology and Biotechnology, 2009, 25:189-195.
[26] Zhang P, Wang W Q, Huang Q L,etal.Development of 40% fluopicolide·pyraclostrobin suspension concentrate and its controlling efficacy to potato late blight in the field.Scientia Agricultura Sinica, 2013, 46(15):3142-3150.
[27] Qin G Z, Tian S P, Liu H B,etal.Polyphenol oxidase, peroxidase and phenylalanine ammonium lyase in postharvest peach fruits induced by inoculation with pichia membranefaciens or rhizopus stolonifer.Scientia Agricultura Sinica, 2003, 36(1):89-93.
[28] Zhuang J H, Gao Z G, Yang C C,etal.Biocontrol ofFusariumwilt and induction of defense enzyme activities on cucumber byTrichodermaviridestrain T23.Acta Phytopathologica Sinica, 2005, 35(2):179-183.
[29] Yan Y H, Wang H K, Xiao R F,etal.Bio-control effects of a lactic acid bacteria on tomatoBotrytisblight and its induction on defense-related enzymes.Microbiology, 2011, 38(12):1801-1806.
[30] Tai L M, Liang W L, Zuo Y H,etal.Changes of defensive enzymes activity in different resistant potato varieties after inoculated withAlternariasolani.Plant Physiology Journal, 2010, 46(11):1147-1150.
参考文献:
[7] 汪远, 詹儒林, 何红, 等.红树内生细菌菌株Kc-38的抗菌物质及对采后芒果炭疽病的防效.中国生物防治学报, 2012, 27(1):82-87.
[8] 王芳, 纪明山, 谷祖敏, 等.苦参内生枯草芽孢杆菌B36抗菌物质对番茄叶霉病菌的作用机制.中国生物防治, 2009, 25(3):250-254.
[9] 畅涛, 王涵琦, 杨成德, 等.高寒草地禾草内生细菌B-401的鉴定及生物防治潜力评价.草业学报, 2014, 23(3):282-289.
[11] 王辰月, 陈秀蓉, 杨成德, 等.线叶嵩草内生细菌的鉴定及溶磷效果的初步研究.甘肃农业大学学报, 2011, 46(3):99-103.
[13] 刘佳莉, 方芳, 史煦涵, 等.2株盐碱地燕麦根际促生菌的筛选及其促生作用研究.草业学报, 2013, 22(2):132-139.
[14] 刘雪, 穆常青, 蒋细良,等.枯草芽孢杆菌代谢物质的研究进展及其在植病生防中的应用.中国生物防治, 2006, 10, 22(增刊):179-184.
[15] 邢介帅, 李然, 赵蕾, 等.生防芽孢杆菌T2胞外蛋白酶的纯化及其抗真菌作用.植物病理学报, 2008, 38(4):377-381.
[16] 高芬, 马利平, 乔雄梧, 等.枯萎菌拮抗芽孢杆菌BC98-I抗菌多肽的纯化.植物病理学报, 2007, 37(4):403-409.
[17] 翟茹环, 尚玉珂, 刘峰, 等.枯草芽孢杆菌G8抗菌蛋白的理化性质和抑菌作用.植物保护学报, 2007, 34(6):592-596.
[18] 孙建波, 王宇光, 赵平娟, 等.拮抗菌XB16在香蕉体内的定殖及对抗病相关酶活性的影响.热带作物学报, 2012, 31(2):212-216.
[19] 杨海莲, 孙晓璐, 宋未.植物根际促生细菌和内生细菌的诱导抗病性的研究进展.植物病理学报, 2000, 30(2):106-110.
[20] 畅涛, 王涵琦, 杨成德, 等.马铃薯坏疽病Phomafoveata生防菌的筛选及鉴定.中国生物防治学报, 2014, 30(2):247-252.
[21] 方中达.植病研究方法(第三版)[M].北京:中国农业出版社, 1997.
[22] 古丽皮艳, 黄丽丽, 康振生.一株高产几丁质酶细菌对植物病原真菌的抑制作用研究.西北农学报, 2006, 15(6):189-191.
[23] 唐治玉, 王淮, 熊善柏, 等.β-1,3-葡聚糖酶产生菌的筛选及其产酶条件.湖南农业大学学报(自然科学版), 2006, 32(5):552-556.
[24] 高伟.海洋芽孢杆菌 B-9987 生物防治机制研究[D].青岛, 青岛科技大学, 2009.
[26] 张鹏, 王文桥, 黄啟良, 等.40%氟菌·唑醚悬浮剂的研制及其对马铃薯晚疫病田间防治效果.中国农业科学, 2013, 46(15):3142-3150.
[27] 秦国政, 田世平, 刘海波, 等.拮抗菌与病原菌处理对采后桃果实多酚氧化酶、过氧化物酶及苯丙氨酸解氨酶的诱导.中国农业科学, 2003, 36(1):89-93.
[28] 庄敬华, 高增贵, 杨长城, 等.绿色木霉菌T23对黄瓜枯萎病防治效果及其几种防御酶活性的影响.植物病理学报, 2005, 35(2):179-183.
[29] 闫艳华, 王海宽, 肖瑞峰, 等.一株乳酸菌对番茄灰霉病的防效及对几种防御酶活性的影响.微生物学通报, 2011, 38(12):1801-1806.
[30] 台莲梅,梁伟伶,左豫虎,等.马铃薯不同品种感染早疫病菌后防御酶活性变化.植物生理学通讯,2010, 46(11):1147-1150.
Effects of disease control and growth promotion ofPolygonumviviparumendophytic bacteriaBacillusmojavensison potato
CHANG Tao, YANG Cheng-De*, XUE Li, YANG Xiao-Li, FENG Zhong-Hong, HAO Rong-Rong, ZHANG Zhen-Fen, CHEN Xiu-Rong
KeyLaboratoryofGrasslandEcosystem,GansuAgriculturalUniversity,MinistryofEducation,CollegeofPrataculturalScience,GansuAgriculturalUniversity,PrataculturalEngineeringLaboratoryofGansuProvince,Sino-U.S.CenterforGrazinglandEcosystemSustainability,Lanzhou730070,China
This research was to study the effects of disease prevention, growth promotion and defense enzymes induction ofBacillusmojavensisZA1 on potato, and provide a theoretical basis for microbial fungicide and fertilizer use.The abilities of IAA secretion, nitrogen fixation, phosphate solubilization and inhibition enzyme production of ZA1 have been researched qualitatively by general methods.The effects of controlling disease and growth promotion of ZA1 on potatoes were studied under the condition of indoors and fields.The concentration of IAA secreted by ZA1 in the King medium with and without tryptophan were 12.17 and 9.75 mg/L.ZA1 possessed the capacity of nitrogen fixation and extracellular proteases, chitinase and glucanase production, but without the ability of phosphate solubilization.The control efficiency of ZA1 was 85.9% by spraying 10 times diluting fermentation broth on potato tubes in storage-period against potato gangrene, and was 26.56% by seed dressing fermentation broth with diluting for 20 times on potato tubes under field condition against potato late blight.In field condition, the production ratios of commodity potato were increased by 36.29% and 33.88% per hectare, respectively.Pot experiments with the seed dressing potatoes showed that the content of roots, stems and chlorophyll were higher than the control group.After treatment by ZA1 20 times fermentation broth on potato tubes, the length of the root and wet and dry weight were increased by 8 cm, 0.75 g and 5.07 g, respectively.In the same time, the plant height, stem diameter, stem wet and dry weight and the content of chlorophyll were increased by 2.74 cm, 0.27 cm, 0.52 g, 5.73 g and 0.54 mg/g, respectively.The root-shoot ratios of wet and dry weight were increased by 0.214 and 0.094, respectively.When spraying diluting fermentation broth of ZA1 on potato leaves, the results indicated that the activity of catalase (CAT), polyphenol oxidase (PPO), phenylalanine ammonialyase (PAL), SOD and POD of potatoes were increased.ZA1 possessed the biological function of disease prevention and growth promotion under indoor and field conditions obviously, which showed that ZA1 had the potential to become microbial fungicide and fertilizer.
Bacillusmojavensis; potatoes; disease control and growth promotion; defense enzymes
10.11686/cyxb2014233
http://cyxb.lzu.edu.cn
2014-05-09;改回日期:2014-08-15
国家自然科学基金(No.31160122)和盛彤笙基金(GASU-STS-1418)资助。
畅涛(1986-), 男, 甘肃白银人, 在读硕士。E-mail:changt1986@126.com
*通信作者Corresponding author.E-mail:yangcd@gsau.edu.cn
畅涛, 杨成德, 薛莉, 杨小利, 冯中红, 郝蓉蓉, 张振粉, 陈秀蓉.珠芽蓼内生菌ZA1对马铃薯的防病促生研究.草业学报, 2015, 24(12):83-91.
CHANG Tao, YANG Cheng-De, XUE Li, YANG Xiao-Li, FENG Zhong-Hong, HAO Rong-Rong, ZHANG Zhen-Fen, CHEN Xiu-Rong.Effects of disease control and growth promotion ofPolygonumviviparumendophytic bacteriaBacillusmojavensison potato.Acta Prataculturae Sinica, 2015, 24(12):83-91.

