单纯性胰腺创伤后大鼠胰腺细胞增殖状况的实验研究*
陈光宇,戴睿武,罗 皓,陈振宇,陈 涛,黎冬暄,吕润华,汤礼军
(成都军区总医院全军普通外科中心,成都 610083)
论著·基础研究
单纯性胰腺创伤后大鼠胰腺细胞增殖状况的实验研究*
陈光宇,戴睿武△,罗 皓,陈振宇,陈 涛,黎冬暄,吕润华,汤礼军
(成都军区总医院全军普通外科中心,成都 610083)
目的 构建大鼠单纯性胰腺创伤模型观察胰腺细胞增殖变化特点并探讨胰腺细胞增殖与组织损伤的关系。方法 将60只Wistar大鼠分为2组:撞击组(采用BIM-Ⅲ生物撞击机构建胰腺创伤大鼠模型,40只)和对照组(假手术组,20只),每组大鼠于建模后6、24、72 h,7 d处死,采用分光光度法检测各组大鼠血清淀粉酶(AMS)、脂肪酶(LPS)活性,通过TUNEL染色和流式细胞技术测定胰腺组织细胞死亡并分析细胞周期分布特点,Western blot测定胰腺组织Bcl-2、Bax蛋白的表达。结果 撞击组大鼠LPS活性升高时相点晚于AMS且持续时间较长,TUNEL染色、流式细胞检测、Western blot结果揭示胰腺创伤可诱导胰腺组织细胞凋亡和代偿性增生。胰腺细胞增殖变化特点表明胰腺创伤后的最佳治疗时间是发病24 h内。结论 同时检测AMS和LPS有助于判定胰腺的外分泌功能受损情况。
模型,动物;细胞增殖;胰腺创伤;Bcl-2;Bax
随着交通事故的频发及可产生较强冲击波的现代武器的广泛应用,胰腺创伤的发病率逐年上升。胰腺是一类具有分泌功能的实质性脏器,胰腺创伤后可引起出血、胰瘘、炎症、创伤后胰腺炎的发生,病死率高达20%[1-2]。目前针对胰腺创伤的研究关注于其诊治方法,而胰腺创伤后的病理生理变化尚不完全清楚。本研究前期实验成功构建了一种模拟单纯性胰腺创伤的大鼠模型[3],为了进一步了解胰腺创伤后大鼠胰腺细胞增殖变化特点,进行了以下研究。
1 材料与方法
1.1 实验动物与试剂 实验使用健康雄性SPF级Wistar大鼠60只,体质量200~220 g,平均(208.9±8.5)g,由四川大学华西医学中心实验动物研究所提供。戊巴比妥钠购于美国Sigma公司,血清淀粉酶(amylase,AMS)、脂肪酶(lipase,LPS)测定试剂盒购于南京建成公司,TUNEL染色试剂盒购于瑞士Roche公司,细胞周期检测试剂盒购于美国BD公司,兔抗大鼠Bcl-2、Bax购于美国Santa Cruz公司,β-actin内参抗体购于上海康成公司,辣根过氧化酶标记的羊抗兔二抗购于武汉博士德公司,ECL发光试剂盒购于美国Millipore公司,组织蛋白提取试剂盒及BCA蛋白定量测定试剂盒购于南京碧云天公司。
1.2 动物分组及模型制备 所有大鼠按随机数字表法分为撞击组(40只)和对照组(20只),将每组大鼠平均分为4个小组,分别于建模后6、24、72 h,7 d处死各小组大鼠。所有大鼠建模前禁食12 h,建模后任意进食饮水。动物模型制备方法如下,(1)撞击组:给予3%戊巴比妥钠(0.1 mL/100 g)麻醉大鼠后取腹壁正中切口,在胰腺下方垫一小塑料片,用BIM-Ⅲ生物撞击机产生400 kPa恒定压力气流冲击胰腺组织[3]构建胰腺创伤大鼠模型。(2)对照组:仅行开腹手术,翻动胰腺数次后关腹。
1.3 检测指标及方法 每组大鼠分别于建模后腹腔动脉采血处死,留取血清、胰腺组织待测。
1.3.1 血清相关指标检测 AMS、LPS活性按试剂盒说明采用分光光度法检测。
1.3.2 TUNEL法检测胰腺细胞凋亡 严格按照试剂盒说明书操作,胰腺细胞核中有棕黄色颗粒者为凋亡细胞,每张切片在400倍镜下选取5个视野,计算凋亡细胞数和总细胞数,凋亡指数(AI)=凋亡细胞数/总细胞数×100%。
1.3.3 流式细胞技术观察胰腺细胞凋亡和增生 参考文献[4]所述方法,应用细胞周期检测试剂盒(碘化丙啶染色)在流式细胞仪上用FlowJo程序分析G0/G1期,S期和G2/M期细胞分布情况并计算出增殖指数(proliferation index,PI)[参考公式:PI= (S+G2/M)/(G0/G1+S+G2/M)× 100%],同时通过该软件检测AI。
1.3.4 Western blot检测胰腺组织Bcl-2、Bax的表达 参照组织蛋白提取试剂盒说明提取胰腺组织蛋白并用BCA法测定蛋白浓度;Western blot操作过程如下:用上样针吸取20 μg蛋白至十二烷硫酸钠聚丙烯酰胺电泳凝胶上进行电泳分离并转至聚偏氟乙烯(PDVF)膜(购于美国Roche公司),随后将PVDF膜置于质量浓度5 g/mL脱脂牛奶中封闭1 h,然后在4 ℃下分别用Bcl-2(1∶500)、Bax抗体(1∶500)和β-actin内参抗体(1∶2 000)孵育过夜,再分别将膜放入含有二抗(1∶1 000)的脱脂牛奶中孵育3 h,用ECL显色液显影于感光胶片上,最后用UVP Biospectrum 410凝胶成像系统对Western blot目的条带扫描后进行分析,蛋白含量以条带的光密度值(Int)×面积(mm2)表示,以此代表Bcl-2和Bax的相对表达量。

2 结果
2.1 血清相关指标检测结果 建模后撞击组大鼠6、24、72 h、7 d存活率分别为100%、80%、70%、70%,对照组大鼠均存活。血清AMS活性:撞击组大鼠血清AMS活性在建模后6 h迅速升高,建模后24 h达最高值,在建模72 h急剧下降;撞击组大鼠血清LPS活性在建模后6 h也开始上升,建模后72 h达最高值,建模后7 d恢复正常值;这提示胰腺创伤后大鼠血清LPS活性升高晚于AMS,但其升高持续时间长于AMS;对照组各时相点间大鼠血清AMS和LPS活性差异无统计学意义(P>0.05),见表1。
2.2 胰腺细胞凋亡和增殖情况 TUNEL染色与流式细胞仪检测结果都提示撞击组各时相点大鼠胰腺细胞AI在建模后6 h最高,随后逐渐下降,但均较对照组高;撞击组大鼠胰腺细胞PI在建模后6 h降低,建模后24 h则显著上升,建模后7 d达最高值;对照组各时相点间大鼠AI和PI差异均无统计学意义(P>0.05),见图1,表2、3。
2.3 Western blot检测胰腺组织Bcl-2、Bax表达 采用UVP Biospectrum 410图像分析系统测出各条带的光密度值半定量显示出Bcl-2、Bax在胰腺组织内的表达情况,撞击组大鼠胰腺组织Bcl-2表达随时间推移逐渐增强,而Bax的表达则随时间推移逐渐减弱,对照组大鼠胰腺组织各时相点Bcl-2、Bax表达无明显差异,见图2、表4。
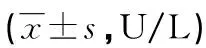
表1 建模后各组大鼠血清中AMS、LPS活性
a:P<0.05,与撞击组同期比较;b:P<0.05,与前一时相点组内比较。

A:对照组;B:撞击组建模后6 h;C:撞击组建模后24 h;D:撞击组建模后72 h;E:撞击组建模后7 d;胰腺细胞核中有棕黄色颗粒者为凋亡细胞。
图1 各时相点大鼠胰腺细胞凋亡情况检测(TUNEL染色×400)

表2 建模后各组大鼠
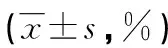
表3 建模后各组大鼠胰腺细胞增殖情况
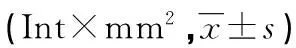
表4 建模后各组大鼠胰腺组织Bcl-2、Bax的表达
a:P<0.05,与同组上一时间点比较。
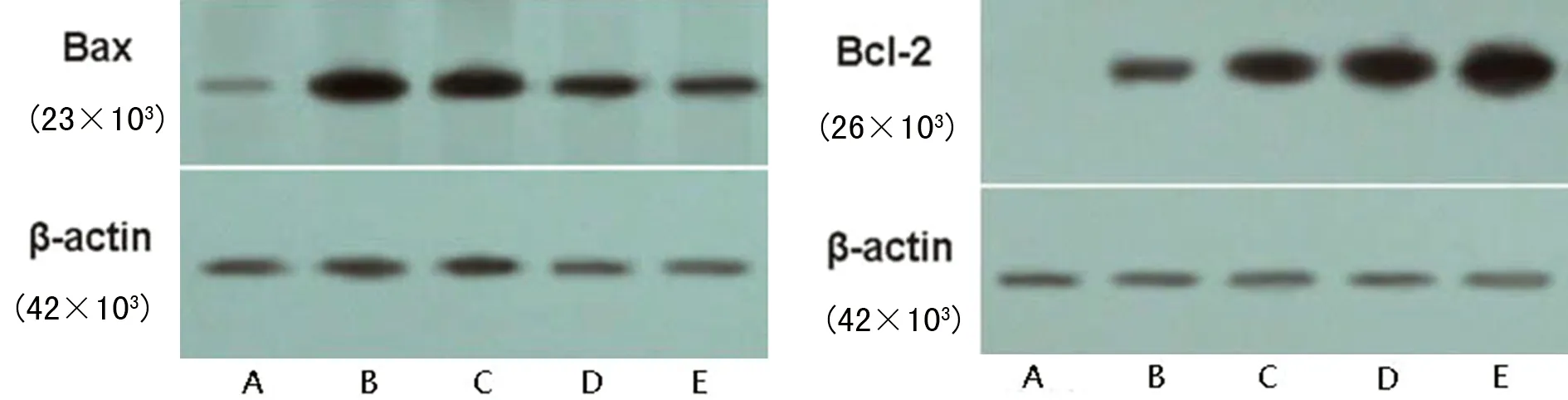
A:对照组;B:撞击组建模后6 h;C:撞击组建模后24 h;D:撞击组建模后72 h;E:撞击组建模后7 d。
图2 Western blot检测撞击组胰腺组织Bcl-2、Bax的表达
3 讨论
本研究中参照前有方法[3]构建了大鼠胰腺创伤模型并观察胰腺创伤7 d内的相关生理变化。研究发现胰腺创伤后的早期阶段(6~24 h)大鼠活动减少,仅保持基本生命活动的被动体位。创伤后24~72 h,多数大鼠已逐渐开始进食及活动,创伤后72 h至7 d时,大鼠均存活并能完成正常生理活动,这说明24 h内是胰腺创伤的危险时段,胰腺创伤的相关治疗应尽早进行。血清胰酶活性的检测结果提示撞击组大鼠血清AMS活性在早期即升高但持续时间短,而LPS活性升高出现较晚而持续时间长,这种现象与通过注射雨蛙素等化学方法诱导大鼠急性胰腺炎的酶学变化类似[5-6]。通过对酶学结果的分析,作者认为同时测定血清AMS和LPS活性有助于评估胰腺的外分泌功能[7]。
细胞凋亡是胰腺疾病的一种保护性反应[8]。促凋亡蛋白Bax和抗凋亡蛋白Bcl-2被认为是细胞死亡的关键调控因子,它们能产生同源二聚体化和异源二聚体化,这两种蛋白之间的比例决定了凋亡的发生[9-10]。TUNEL染色和流式细胞仪检测结果提示AI在胰腺创伤早期阶段(6 h)即升高达极值并随时间推移逐渐下降。本研究利用Western blot技术检测Bax和Bcl-2的表达来评估机体调控细胞死亡的能力。结果表明撞击组大鼠胰腺组织内Bax的表达在创伤后6 h最强,此时Bcl-2的表达则较弱。Bax的表达在创伤后24 h均逐渐减弱,而Bcl-2的表达则随时间推移逐渐增强。基于以上结果作者推断胰腺细胞凋亡活动在胰腺创伤后早期(6 h以前)增强,随后凋亡小体形成并被吞噬细胞清除。创伤24 h后,随着胰腺组织自我修复和凋亡小体的清除,组织损伤程度逐渐改善,新发的凋亡细胞也逐渐减少,故总凋亡细胞数降低[11]。以上结果也提示胰腺创伤干预的关键时相点在24 h内。
作者利用流式细胞仪观察细胞周期分析了胰腺细胞增殖情况,结果显示撞击组大鼠胰腺细胞PI在创伤后早期(6 h)有所下降,但与对照组比较无明显差异,此时撞击组大鼠胰腺细胞AI最高,表明创伤后早期细胞凋亡最显著。创伤24 h后,PI逐渐增高,在创伤7 d后达最高值,但AI却随时间推移而降低。以上AI的变化与TUNEL染色结果一致,验证了TUNEL染色的结果,另外也提示在创伤24 h后细胞增殖修复机制已激活,胰腺细胞的增殖修复在创伤后期将持续存在。同时通过流式细胞仪对细胞凋亡比率的检测作者注意到创伤早期(6 h)细胞凋亡比率较高,但是创伤24 h后凋亡细胞明显减少,说明胰腺创伤后存在机体代偿性地抑制细胞凋亡的机制,对机体损伤起到了保护调节作用。
本研究中借助前期建立的大鼠单纯性胰腺创伤动物模型探讨了胰腺创伤后细胞增殖的变化规律。创伤造成胰腺组织破坏可在早期发生,胰腺细胞内溶酶体破坏后引起胰酶激活是胰腺创伤后细胞破坏及组织损伤较其他腹腔内脏器伤情更重的原因[12]。通过TUNEL染色、流式细胞仪检测凋亡发现创伤后24 h胰腺已开始激发自我修复机制。Bcl-2及Bax蛋白的Western blot检测结果揭示机体对胰腺创伤后凋亡的干预关键时相点在24 h内。最后,流式细胞仪对PI的检测验证了细胞增殖情况,细胞增生启动于胰腺创伤早期,在7 d达到高峰。确定胰腺创伤后细胞增殖的变化规律为以后针对胰腺创伤后治疗的相关研究提供了理论基础。
[1]Thomas H,Madanur M,Bartlett A,et al.Pancreatic trauma-12-year experience from a tertiary center[J].Pancreas,2009,38(2):113-116.
[2]Mayer JM,Tomczak R,Rau B,et al.Pancreatic injury in severe trauma:early diagnosis and therapy improve the outcome[J].Dig Surg,2002,19(4):291-297.
[3]戴睿武,田伏洲,董家鸿,等.一种大鼠胰腺创伤模型的建立及伤情特点分析[J].重庆医学,2007,36(5):444-446,449.
[4]Castro J,Ribó M,Navarro S,et al.A human ribonuclease induces apoptosis associated with p21WAF1/CIP1 induction and JNK inactivation[J].BMC Cancer,2011,11:9.
[5]Cheng S,Yan WM,Yang B,et al.A crucial role of nitric oxide in acute lung injury secondary to the acute necrotizing pancreatitis[J].Hum Exp Toxicol,2010,29(4):329-337.
[6]Sailai Y,Yu X,Baiheti P,et al.Influence of nuclear factor kappaB activation on inflammatory mediators of alveolar macrophages in rats with acute necrotizing pancreatitis[J].J Investig Med,2010,58(1):38-42.
[7]黄红霞,黄晓英,徐建如,等.临床肺部感染评分在呼吸机相关性肺炎中的诊断价值和护理管理对策[J].实用临床医药杂志,2011,15(2):30-32.
[8]Vonlaufen A,Phillips PA,Xu Z,et al.Withdrawal of alcohol promotes regression while continued alcohol intake promotes persistence of LPS-induced pancreatic injury in alcohol-fed rats[J].Gut,2011,60(2):238-246.
[9]Shi L,Chen J,Yang J,et al.MiR-21 protected human glioblastoma U87MG cells from chemotherapeutic drug temozolomide induced apoptosis by decreasing Bax/Bcl-2 ratio and caspase-3 activity[J].Brain Res,2010,1352:255-264.
[10]Malla R,Gopinath S,Alapati K,et al.Downregulation of uPAR and cathepsin B induces apoptosis via regulation of Bcl-2 and Bax and inhibition of the PI3K/Akt pathway in gliomas[J].PLoS One,2010,5(10):e13731.
[11]Elbanna HG,Ebrahim MA,Abbas AM,et al.Potential value of estrogen receptor beta expression in colorectal carcinoma:interaction with apoptotic index[J].J Gastrointest Cancer,2012,43(1):56-62.
[12]Kong Y,Zhang H,He X,et al.Endoscopic management for pancreatic injuries due to blunt abdominal trauma decreases failure of nonoperative management and incidence of pancreatic-related complications[J].Injury,2014,45(1):134-140.
Experimental research on the characteristics of pancreatic cells regeneration in an animal model for isolated pancreatic trauma*
ChenGuangyu,DaiRuiwu△,LuoHao,ChenZhengyu,ChenTao,LiDongxuan,LvRunhua,TangLijun
(CenterofGeneralSurgery,GeneralHospitaloftheChinesePeople′sLiberationArmyChengduMilitaryRegion,Chengdu,Sichuan610083,China)
Objective To study the relationships between tissue damage and the ability of the pancreatic cells to regenerate,and analyze the alteration of the pancreatic cells regeneration.Methods Sixty rats were divided into two groups:impact group(the pancreas was injured by a BIM-Ⅲ biotical impact machine,40 rats) and control group(sham operated,20 rats).All rats were sacrificed at 6 h,24 h,72 h,7 d after operation.The level of AMS,LPS in the serum were detected by spectrophotometry,pancreatic cells regeneration were examined and analyzed by TUNEL staining and flow cytomertry,and the Bcl-2 and Bax expression were measured by Western blot.Results In the impact groups,LPS was activated later than AMS,and lasted persistently.The results from TUNEL stain,flow cytometry and Western blot indicated that pancreatic trauma induces cell death and the compensatory proliferation of pancreatic cells.The characteristics of pancreatic cells regeneration in the animal model of isolated pancreatic trauma indicate that the proper remedial time is in the first 24h after the pancreatic trauma.Conclusion Detecting AMS and LPS at the same time can help us to determine the exocrine function of pancrease.
model,animal;cell regeneration;pancreatic trauma;Bcl-2;Bax
10.3969/j.issn.1671-8348.2015.04.004
国家自然科学基金(81001695);成都军区总医院院管课题(2013YG-B065)。 作者简介:陈光宇(1980-),医师,硕士,主要从事胰腺炎治疗研究。△
,E-mail:rwdai@163.com。
R641
A
1671-8348(2015)04-0442-04
2014-08-18
2014-10-06)

