尼美舒利通过PPARγ途径抑制结肠癌细胞增殖*
章向成,陈光侠,张 红,何晓华,刘世育,晏 燕
(1.南京医科大学附属淮安第一医院ICU,江苏淮安 223300;2.江苏省徐州市第一人民医院消化科 221002;3.南京医科大学附属淮安第一医院内分泌科,江苏淮安 223300)
论著·基础研究
尼美舒利通过PPARγ途径抑制结肠癌细胞增殖*
章向成1,陈光侠2△,张 红3,何晓华2,刘世育2,晏 燕2
(1.南京医科大学附属淮安第一医院ICU,江苏淮安 223300;2.江苏省徐州市第一人民医院消化科 221002;3.南京医科大学附属淮安第一医院内分泌科,江苏淮安 223300)
目的 观察过氧化物酶增殖物激活受体γ(PPARγ)抑制剂GW9662干预后,尼美舒利(N)对结肠癌细胞凋亡和增殖的影响,探讨PPARγ途径在N抗癌机制中的作用。方法 体外培养结肠癌SW480细胞,设立不加药对照组、单用PPARγ抑制剂GW9662组(GW9662组,药物浓度0.1、0.5、1.0、5.0 μmol/L)、单用N组、GW9662+N组共4组。MTT检测各组细胞生长抑制率;流式细胞术(FCM)检测细胞凋亡及细胞周期的变化。Western blot检测各组中PPARγ、p21Waf1、p27Kip1、Bcl-2、Bax、VEGF蛋白的表达。结果 MTT检测结果:GW9662组较对照组细胞增殖差异无统计学意义(P>0.05);N组呈时间依赖性抑制SW480细胞增殖(P<0.01);在GW9662+N组中GW9662呈剂量及时间依赖性减弱N抑制细胞增殖的作用。FCM检测结果:细胞凋亡率在GW9662组与对照组之间差异无统计学意义(P>0.05);N组与对照组比较,SW480细胞凋亡率显著增加,差异有统计学意义(P<0.01),G0/G1期细胞比例明显增加,S期及G2/M期细胞比例显著减少;GW9662+N组细胞凋亡率较N组明显降低(P<0.01),细胞在G0/G1期的比例降低,S期和G2/M期细胞的比例升高。Western blot检测结果:N组与对照组比较SW480细胞的PPARγ、p21Waf1、 p27Kip1、Bax蛋白表达率显著增加(P<0.05或P<0.01),Bcl-2、VEGF的表达率则明显下调(P<0.01);GW9662+N组与N组比较,SW480细胞的PPARγ、p21Waf1、 p27Kip1、Bax蛋白显著表达下调(P<0.05或P<0.01),而Bcl-2、VEGF的表达则上调(P<0.05)。结论 N在体外能有效抑制结肠癌细胞SW480的增殖,促进其凋亡。PPARγ通路在N影响结肠癌细胞增殖、凋亡中发挥重要作用。
过氧化物酶体增殖物激活受体;细胞增殖;细胞凋亡;结肠癌细胞;SW480细胞;尼美舒利
结肠癌是最常见的消化道恶性肿瘤之一,流行病学研究显示,长期服用阿司匹林可明显降低结直肠癌发病的危险性[1]。2000年,美国食品与药品管理局(U.S.food and drug administration,FDA)已批准将选择性环氧化酶-2(cyclooxygenase-2,COX-2)抑制剂罗非昔布用于FAP的治疗[2]。多数学者认为非甾体抗炎药(NSAIDs)主要通过抑制COX途径发挥抗肿瘤作用,本课题组前期试验证明,无论是选择性还是非选择性COX-2抑制剂均可呈时间和剂量依赖性抑制结肠癌细胞增殖[3]。过氧化物酶增殖物激活受体(peroxisome proliferator-activated receptors,PPARs)是一类由配体激活的核转录因子,PPARγ在多种肿瘤细胞中表达,如结肠癌、胃癌、前列腺癌等[4-6],国外最近有学者发现PPARγ、NF-κB等非COX途径在NSAIDs的抗肿瘤机制中也具有重要作用[4]。NSAIDs可通过激活PPARγ在结肠癌早期调节炎性因子,从而促进肿瘤细胞凋亡[7]。本研究旨在探讨PPARγ在尼美舒利(nimesulide,N)影响结肠癌细胞凋亡及增殖中发挥的作用及其机制,以期为临床提供结肠癌防治的新策略。
1 材料与方法
1.1 材料 人结肠癌细胞系SW480购自上海细胞生物研究所。碘化丙啶(PI)购自晶美生物有限公司。胰蛋白酶、小牛血清、RPMI 1640细胞培养液购自美国Gibco公司;N、四甲基偶氮唑蓝(MTT) 、二甲基亚砜(DMSO)、GW9662 购自美国Sigma公司,青霉素、链霉素购自华北制药厂,RNA酶购自厦门泰晶生物有限公司;DAB试剂盒、Power vision染色试剂盒购自北京中山金桥生物技术有限公司;兔抗PPARγ单克隆抗体、鼠抗p21Waf1、 p27Kip1、Bcl-2、Bax、VEGF单克隆抗体购自美国Santa Cruz生物技术公司;二抗购自北京中山金桥生物工程公司。
1.2 方法
1.2.1 细胞培养 复苏后细胞转入细胞培养瓶中,加入约5 mL细胞培养液,在37 ℃,5% CO2条件下含有双抗(青霉素100 U/mL;链霉素100 U/mL)的RPMI-1640培养基(含0.002 μmol/L的L-谷氨酞胺40 μL,10%小牛血清)培养,常规进行细胞传代,取对数生长期细胞进行实验。
1.2.2 实验分组 实验共分4组:(1)不加药对照组;(2)GW9662组(终浓度分别为0.1、0.5、1.0、5.0 μmol/L);(3)N组;(4)GW9662+N组。
1.2.3 MTT法检测细胞增殖情况 取对数生长期SW480细胞,以1×105/mL的细胞密度接种于96孔板中,0.2 mL/孔,常规培养。24 h后加入GW9662(终浓度分别为0.1、0.5、1.0、5.0 μmol/l)干预,干预0.5 h后再分别加入N(终浓度为200 μmol/L),按实验分组,每组每个浓度每个时间点设12个复孔,分别培养至24、48、72 h后,每孔加入MTT液20 μL,37 ℃孵育4 h后弃上清液,每孔加入DMSO 150 μL,轻轻震荡10 min使其充分溶解后,在490 nm波长酶标仪上测定各孔光吸收值(OD) 来评估细胞增殖情况。细胞生长抑制率=(1-给药组OD值/空白组OD值)×100%。
1.2.4 流式细胞术(FCM)检测细胞周期及凋亡情况 将对数生长期SW480细胞以每孔2×105/mL的细胞密度接种于24孔板,1 mL/孔,常规培养,24 h后加入GW9662(终浓度为0.5 μmol/L)干预,干预0.5 h后加入N(终浓度为200 μmol/L)。按实验分组每组设6个复孔,进行下面步骤:(1)0.25%胰蛋白酶消化收集细胞,用RPMI-1640培养液洗涤3遍;(2)加入70%冷乙醇4 ℃固定过夜;(3)PBS洗涤3次,每次洗涤后,800 r/min,离心2~3 min,去上清液。最后加入PI染液,4 ℃避光染色30 min。采用Beckon/Dickinson FACSCalibur型流式细胞仪,在488 nm波长处进行检测,记录激发波长488 nm处的红色荧光。
1.2.5 Western blot检测各组细胞PPARγ、p21Waf1、 p27Kip1、Bcl-2、Bax和VEGF蛋白的表达 将SW480细胞稀释为1×105/mL,按每瓶10 mL接种于50 mL培养瓶,培养24 h细胞附壁后,倒掉培养液,加入GW9662(终浓度分别为0.1、0.5 μmol/L)干预,干预0.5 h后再加入N(终浓度为200 μmol/L),按实验分组,每组3个平行样本,继续培养24 h后取出,0.25%胰酶消化、离心收集细胞,PBS洗涤3次。细胞超声粉碎机粉碎细胞后收集上清液作为细胞总蛋白,并用考马斯亮蓝蛋白定量试剂盒进行蛋白定量。取一定量的蛋白质样品与2×十二烷基硫酸钠(SDS)上样缓冲液(100 mmol/L Tris碱、200 mmol/L DTT、4% SDS、0.2%溴酚蓝、20%甘油)混合,按每泳道30 μg加载于SDS-PAGE凝胶电泳样品孔中,100 V电泳至溴酚蓝达分离胶,加大电压至200 V,直至溴酚蓝达凝胶底部。半干电转移至硝酸纤维膜上,3%牛血清清蛋白封闭,分别加入1∶500稀释的兔抗PPARγ单克隆抗体、1∶400稀释的鼠抗p21Waf1、 p27Kip1、Bcl-2、Bax、VEGF单克隆抗体,4 ℃孵育过夜,加入二抗,室温孵育2 h,NBT/BCIP显色观察结果。

2 结果
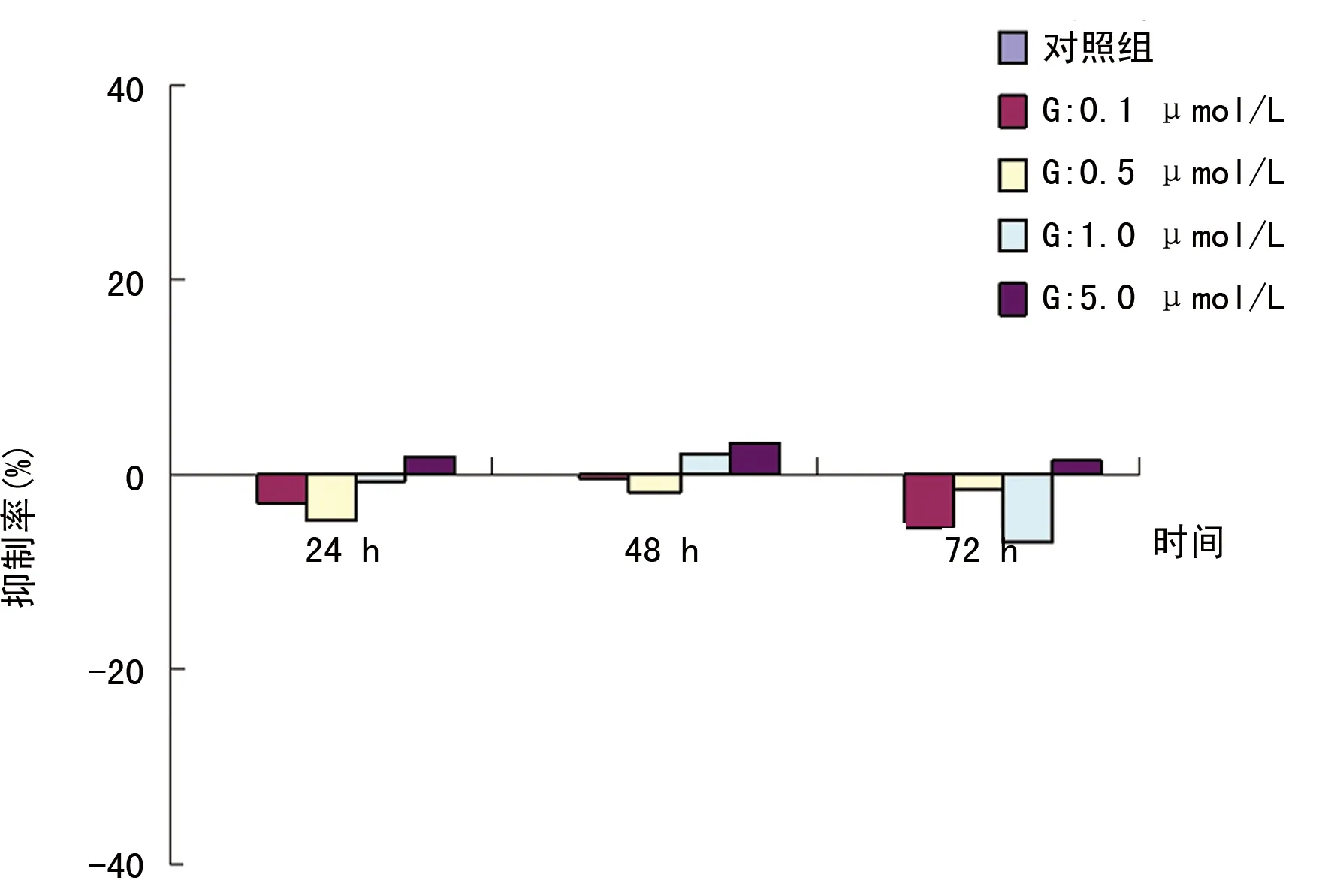
2.1 不同浓度GW9662干预后,N对SW480细胞增殖影响的变化 MTT法结果显示,单用不同浓度的GW9662(0.1、0.5、1.0、5.0 μmol/L)作用于SW480细胞24、48、72 h较对照组无明显变化,见图1。N(200 μmol/L)较对照组呈时间依赖性抑制SW480细胞的生长(P<0.01)。在一定剂量范围内,不同浓度GW9662干预后,N作用于SW480细胞24、48、72 h,其抑制SW480细胞增殖的作用被GW9662呈时间剂量依赖性减弱。当GW9662浓度为0~0.5 μmol/L,24 h时,对N的抑制作用达高峰,48 h后开始下降,而到72 h时对N的抑制作用明显下降,见表1、图2。
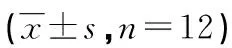
表1 GW9662、N对SW480细胞增殖的影响
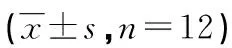
续表 1GW9662、N对SW480细胞增殖的影响
G:GW9662;a:P<0.05,b:P<0.01,与对照组比较;c:P<0.01,与N组比较。
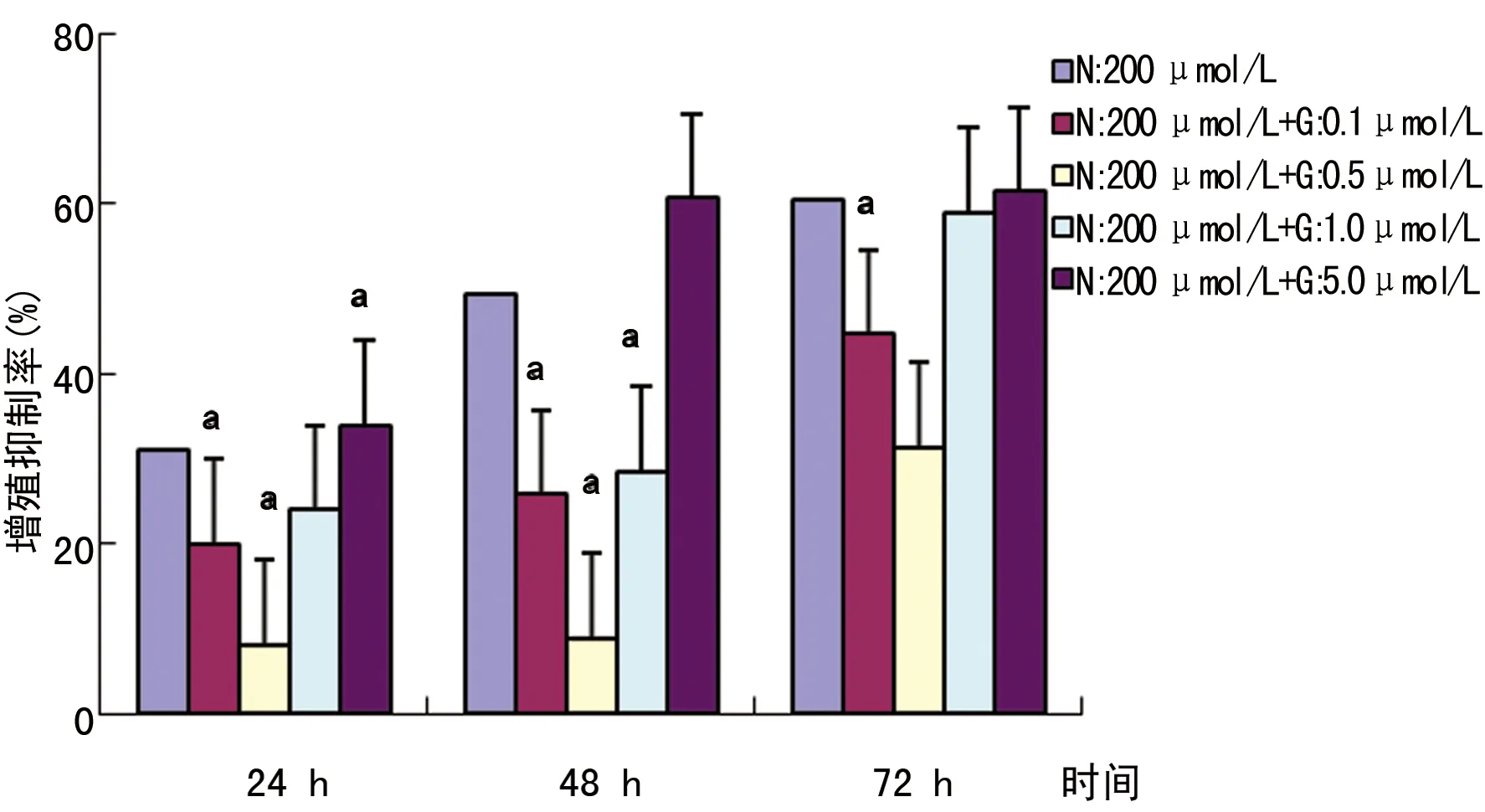
2.2 不同浓度GW9662干预后,N对SW480细胞凋亡及细胞周期影响的变化 FCM分析结果显示,与对照组比较,GW9662组无明显变化,N组SW480细胞凋亡率明显增加,G0/G1期细胞比例增加,S期和G2/M期细胞比例减少,细胞阻滞在G0/G1期;GW9662+N作用于SW480细胞24 h后细胞凋亡率较N组明显降低,见表2、图3,并且改变了细胞周期的分布:SW480细胞在G0/G1期受阻滞的比例降低,S期和G2/M期比例升高,见表2。GW9662+N组与N组或对照组比较,差异均有统计学意义(P<0.01)。
G:GW9662。
图1 GW9662对SW480细胞增殖的影响
2.3 GW9662及N对SW480细胞PPARγ和p21Waf1、p27Kip1、Bcl-2、Bax、VEGF表达的影响 Western blot检测结果显示,N组较对照组细胞的PPARγ表达增强,同时 p21Waf1、 p27Kip1、Bax表达亦增强,而Bcl-2、VEGF的表达下调;GW9662+N组与N组比较,细胞的PPARγ表达减低,同时 p21Waf1、 p27Kip1、Bax表达亦减低,而Bcl-2、VEGF的表达增强,差异有统计学意义(P<0.05或P<0.01),见表3。
G:GW9662;N:N;a:P<0.01,与N组比较。
图2 GW9662、N对SW480细胞增殖的影响

a:P<0.01,与对照组比较;b:P<0.01,与N组比较。
图3 GW9662、N对细胞凋亡率的影响
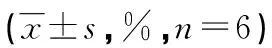
表2 GW9662、N对结肠癌SW480细胞凋亡及细胞周期的影响
G:GW9662;a:P<0.01,与对照组比较;b:P<0.01,与N组比较。

表3 GW9662、N对PPARγ、p21Waf1、p27Kip1、Bcl-2、Bax、VEGF表达的影响

续表3 GW9662、N对PPARγ、p21Waf1、p27Kip1、Bcl-2、Bax、VEGF表达的影响
G:GW9662;a:P<0.01,与对照组比较;b:P<0.01,c:P<0.05,与N组比较。
3 讨论
本研究MTT法检测细胞增殖情况,结果显示,当GW9662浓度超过0.5 mol/L时,对N的对抗的作用不再增强,反而使细胞增殖抑制率明显增加,可能与PPARγ受体已饱和及GW9662本身对细胞的毒性作用有关。NSAIDs可改变结肠癌细胞周期分布,并促进细胞凋亡[8]。本研究进一步行FCM检测发现,N作用后可增加细胞的凋亡率,并使G0/G1期细胞比例升高,S期和G2/M期细胞比例降低。而加入GW9662干预后,N的促细胞凋亡减弱,且G0/G1期细胞比例有所降低,S期和G2/M期细胞比例有所升高。说明N促使结肠癌细胞凋亡、改变细胞周期的作用能被PPARγ抑制剂GW9662对抗,提示PPARγ通路在NSAIDs影响细胞周期中很可能具有重要作用。国外Schwab等[9]研究亦表明美沙拉嗪可通过PPARγ通路抑制结肠癌细胞增殖并使结肠癌细胞阻滞于G0/G1期 。
p21Waf1、p27Kip1属于细胞周期蛋白依赖性激酶抑制因子(cyclin-dependent kinase inhibitors,CKIs)的CIP/KIP家族,是细胞周期调控的重要物质基础。p21Waf1、p27Kip1在细胞周期调控细胞G1期向S期转变。本研究结果证实N可明显上调结肠癌细胞株p21Waf1、p27Kip1的表达,而且这种作用在GW9662+N组明显减弱,从而证明N通过激活PPARγ通路,进而引起p21Waf1、p27Kip1在细胞内的活化,改变结肠癌细胞的细胞周期,促进其凋亡。Bax通过与自身组成同源二聚体或与Bcl-2、Bcl-XL组成异源二聚体抑制Bcl-2或Bcl-XL的活性而发挥促细胞凋亡的作用。大量资料表明,在多种肿瘤组织中都存在Bcl-2和/或Bax蛋白表达失常,而一些抗癌药物往往能够调节Bcl-2及Bax蛋白的表达[10-11]。PPARγ被激活后可以通过下调Bcl-2家族蛋白发挥促凋亡作用。本研究对Bcl-2、Bax表达进行了Western blot检测,结果表明N对Bcl-2表达下调及Bax的上调作用可被GW9662所对抗。因此作者推断PPARγ通路为N诱导结肠癌细胞凋亡的途径之一。
VEGF是一种功能强大且能产生多种生物学效应的细胞因子,肿瘤VEGF的表达与肿瘤侵袭转移有关[12]。本研究通过Western blot检测VEGF表达,观察PPARγ通路是否参与了N下调VEGF表达,从而抑制肿瘤转移的过程。研究结果表明PPARγ通路参与N抑制VEGF释放的过程。
综上所述,GW9662可部分对抗N对结肠癌SW480细胞的作用,由于GW9662是特异性PPARγ抑制剂,所以作者推测N通过PPARγ途径发挥抗肿瘤作用,其具体机制与以下因素有关:(1)增加p21Waf1、p27Kip1表达,阻止细胞周期进程;(2)降低Bcl-2的表达,增加Bax的表达,促进肿瘤细胞的凋亡;(3)抑制VEGF表达,从而抑制肿瘤血管生成。
[1]Smalley W,Ray WA,Daugherty J,et al.Use of non steroidal anti-inflammatory drugs and incidence of colorectal cancer:a population-based study[J].Arch Intern Med,1999,159(2):161-166.
[2]Fujimura T,Ohta T,Oyama K,et al.Role of cyclooxygenase-2 in the carcinogenesis of gastrointestinal tract cancer:a review and report of personal experience[J].World J Gastroenterol,2006,12(9):1336-1345.
[3]陈光侠,费素娟.两种NSAIDs抑制结肠癌细胞增殖的机制[J].南京医科大学学报:自然科学版,2005,25(12):923-927.
[4]Vaish V,Tanwar L,Sanyal SN.The role of NF-κB and PPARγ in experimentally induced colorectal cancer and chemoprevention by cyclooxygenase-2 inhibitors[J].Tumour Biol,2010,31(5):427-436.
[5]Yu J,Leung WK,Chen J,et al.Expression of peroxisome proliferator-activated receptor delta in human gastric cancer and its response to specific COX-2 inhibitor[J].Cancer Lett,2005,223(1):11-17.
[6]Matsuyama M,Yoshimura R.The target of arachidonic acid pathway is a new anticancer strategy for human prostate cancer[J].Biologics,2008,2(4):725-732.
[7]Koelink PJ,Mieremet-Ooms MA,Cerver WE.5-aminosalicylic acid interferes in the cell cycle of colorectal cancercells and induces cell death modes[J].Inflamm Bowel Dis,2010,16(3):379-389.
[8]Vaish V,Rana C,Piplani H,et al.Sulindac and celecoxib regulate cell cycle progression by p53/p21 up regulation to induce apoptosis during initial stages of experimental colorectal cancer[J].Cell Biochem Biophys,2014,68(2):301-319.
[9]Schwab M,Reynders V,Loitsch S,et al.PPARgamma is involved in mesalazine-mediated induction of apoptosis and inhibition of cell growth in colon cancer cells[J].Carcinogenesis,2008,29(7):1407-1414.
[10]Zhang L,Liu WZ,Lu H,et al.Synergistic inhibitory effect of nimesulide in combination with 5-fluorouracil on gastric cancer cells and its possible mechanisms[J].Chin J Dig,2005,25(9):530-533.
[11] Cheng AC,Huan TC,Lai CS,et al.Induction of apoptosis by luteolin through cleavage of Bcl-2 family in human leukemia HL-60 cells [J].Eur J Pharmacol,2005,509(1):1-10.
[12]Eldesoky A,Shouma A,Mosaad Y,et al.Clinical relevance of serum vascular endothelial growth factor and interleukin-6 in patients withcolorectal cancer[J].Saudi J Gastroenterol,2011,17(3):170-173.
Proliferation inhibition induced by Nimesulide through PPARγ pathway in human colon cancer cell*
ZhangXiangcheng1,ChenGuangxia2△,ZhangHong3,HeXiaohua2,LiuShiyu2,YanYan2
(1.DepartmentofICU,theFirstAffiliatedHuaianHospitalofNanjingMedicalUniversity,Huaian,Jiangsu223300,China;2.DepartmentofGastroenterology,XuzhouFirstPeople′sHospital,Xuzhou,Jiangsu221002,China;3.DepartmentofEndocrinology,theFirstAffiliatedHuaianHospitalofNanjingMedicalUniversity,Huaian,Jiangsu223300,China)
Objective To study PPARγ inhibitor(GW9662),on colon cancer SW480 cell proliferation and apoptosis intervened by Nimesulide(N) in vitro,in order to investigate the role of PPARγ pathway in colon cancer cell proliferation inhibition and apoptosis promotion induced by Nimesulide.Methods Cells were divided into 4 groups,namely:the control group,GW9662 group(GW9662 0.1,0.5,1.0,5.0 μmol/L),N group,GW9662+N group.MTT assay and FCM were used to determine proliferation,apoptosis and cell cycle of SW480 cells.And the expression of PPARγ,p21Waf1,p27Kip1,Bcl-2,Bax,VEGF proteins were measured by Western-blot.Results N inhibited SW480 cells proliferation in a time-dependent manner (P<0.01).During a special range,GW9662 attenuated effect of nimesulide inhibiting SW480 cells proliferation in a dose-and time-dependent manner.The results of FCM showed:the apoptosis rates of SW480 cells had no statistical change between GW9662 group and control group(P>0.05).Cell apoptosis rate of group N increased significantly,compared with control group(P<0.01).The apoptosis rates of SW480 cells incubated with Nimesulide and GW9662 dropped significantly compared with Nimesulide alone(P<0.01).Above results showed that GW9662 could attenuate the effect of nimesulide on cell apoptosis and cell cycle.The results of Western-blot:Compared with the control group,the expression of PPARγ,p21Waf1,p27Kip1,Bax protein were up-regulated significantly in nimesulide group(P<0.05 orP<0.01),but Bcl-2 and VEGF were down-regulated significantly(P<0.01).Compared with the nimesulide group,the expression of PPARγ,p21Waf1,p27Kip1and Bax protein were down-regulated obviously in GW9662+N group(P<0.05 orP<0.01).Correspondingly,Bcl-2 and VEGF were up-regulated obviously(P<0.05).Conclusion N could effectively inhibit SW480 cell proliferation and induce its apoptosis.PPARγ pathway may play an important role in proliferation inhibition and apoptosis induced by Nimesulide in colon cancer cell.
peroxisome proliferator-activated receptors;cell proliferation;cell apoptosis;colon cancer cells;SW480 cell;nimesulide
10.3969/j.issn.1671-8348.2015.04.005
徐州市科技计划项目(社会发展-XF11C074)。 作者简介:章向成(1979-),主治医师/讲师,硕士,主要从事消化系统肿瘤的研究。△
,E-mail:gx_chen2010@163.com。
R735.3
A
1671-8348(2015)04-0446-04
2014-08-02
2014-09-18)

