高迁移率蛋白B1对血管平滑肌细胞迁移的影响及分子机制研究*
杨 简,范致星,李馨欣,彭家芹,姜玉蓉,陈 勇
(三峡大学第一临床医学院心内科,湖北宜昌 443003)
·论著·
高迁移率蛋白B1对血管平滑肌细胞迁移的影响及分子机制研究*
杨 简,范致星,李馨欣,彭家芹,姜玉蓉,陈 勇
(三峡大学第一临床医学院心内科,湖北宜昌 443003)
目的 探讨高迁移率蛋白B1(HMGB1)对血管平滑肌细胞(VSMCs)迁移的影响及TLR4依赖的TLR4/PI3K/Akt信号通路介导的分子机制。方法 体外分离培养大鼠胸主动脉VSMCs,采用不同浓度HMGB1(0.1~1 000.0 ng /mL)处理,分为对照组(未经任何处理)、HMGB1组、HMGB1+TLR4 siRNA转染组、Control siRNA转染组和磷脂酰肌醇3-激酶(PI3K)抑制剂(LY294002)干预组,观察各组细胞活性及HMGB1对VSMCs迁移的影响;实时定量RT-PCR与Western blot分别检测TLR4、Akt、p-Akt、PI3K mRNA和蛋白的表达;ELISA测定PI3K的活性。结果 HMGB1(0.1~1 000.0 ng/mL)呈剂量依赖性促进VSMCs迁移(P<0.05);经细胞活性测定,HMGB1在使用的浓度范围内对VSMCs未造成细胞毒性作用(P<0.05);HMGB1(100 ng/mL)处理的VSMCs细胞组PI3K活性及Akt磷酸化水平明显增加(P<0.05);经TLR4 siRNA转染发现,HMGB1引起的VSMCs 迁移明显减弱(P<0.05),同样在PI3k抑制剂干预组,PI3K/Akt途径活化和HMGB1介导的VSMCs 迁移也被明显抑制(P<0.05)。结论 HMGB1呈剂量依赖性促进VSMCs迁移,TLR4依赖的TLR4/PI3K/Akt信号通路参与了此过程,提示以TLR4依赖的PI3K/Akt途径为靶点,可为阻塞性血管疾病的治疗提供新思路。
Toll样受体4;高迁移率蛋白B1;PI3K/Akt信号通路;血管平滑肌细胞
血管平滑肌细胞(vascular smooth muscle cells,VSMCs)的迁移是动脉粥样硬化和经皮冠状动脉介入治疗后血管再狭窄发生的关键环节[1],其受多种生物学信号的调节,如细胞因子、生长因子、血管活性肽等,其中促炎介质发挥关键作用[2]。高迁移率蛋白B1(HMGB1)是一种有效的促炎因子,参与了多种心血管疾病的发生、发展[3]。在既往的研究中,HMGB1被认为是一个作用于VSMCs等不同细胞系的化学诱导物[4],其主要与RAGE结合而促进细胞的迁移[5]。TLR4作为HMGB1的另一个受体,广泛表达于脉管系统,可通过激活细胞内的信号传导通路(如MAPK、JNK、NF-κB)诱导免疫和炎性反应[6]。本课题组前期研究发现TLR4/NF-κB信号通路能诱导HMGB1介导的血管内皮细胞激活[7],而且有研究发现球囊损伤后的VSMCs TLR4表达明显增加[8],这说明TLR4依赖的信号通路也可能参与了HMGB1介导的VSMCs迁移。磷脂酰肌醇3-激酶类(PI3Ks)和其下游的丝氨酸-苏氨酸激酶Akt (PI3K/Akt)在调控VSMCs的迁移、增殖、分化中扮演重要角色[9]。PI3K/Akt通路通过其配体与细胞表面的受体结合而激活,有研究发现TLR4与PI3K/Akt通路存在着交互效应[10]。基于上述发现,本实验将探讨TLR4依赖的PI3K/Akt信号通路是否参与了HMGB1介导的VSMCs迁移。
1 材料与方法
1.1 主要试剂 重组人HMGB1购自Sigma公司,PI3K抑制剂(LY294002) 购自Calbiochem公司;脂质体2000转染试剂购自Invitrogen公司;磷酸化Akt(Ser-473)抗体、Akt抗体购自Cell Signaling 公司;TLR4 siRNA、Control siRNA、TLR4抗体、PI3K抗体、GAPDH 抗体均购自Santa Cruz生物公司。
1.2 血管平滑肌细胞的培养和鉴定 从雄性SD大鼠(100~150 g)胸主动脉中分离出原始VSMCs,用含10%胎牛血清、100 U/mL的青霉素和100 μg/mL链霉素的DMEM培养基在37 ℃ 5% CO2培养箱中培养,将培养的第3~10代VSMCs用于实验研究。根据VSMCs生物形态特性及生长规律,进行细胞形态学鉴定,用特异性平滑肌细胞抗体SM-α-Actin,进行免疫细胞化学鉴定。
1.3 细胞活性测定 细胞活性测定用于评估HMGB1对于VSMCs的细胞毒性:0.4%台盼蓝染液处理经不同浓度HMGB1(0.1~1 000.0 ng/mL)刺激培养的VSMCs,染色5 min后于光镜下观察。细胞活性即未染色细胞占细胞总数的比例。
1.4 细胞迁移实验 使用直径6.5 mm的聚碳酸脂膜transwell小室进行VSMCs迁移实验:将经胰酶消化的细胞以5×104/孔的密度接种于transwell小室的上室,在其下室中加入含有不同浓度HMGB1(0.1~1 000.0 ng/mL)的无血清DMEM培养基。然后将制备好的transwell小室置于37 ℃ 5% CO2培养箱中孵育12 h,取出滤膜,去除上层VSMCs,用甲醇固定,苏木素染色。光镜下观察迁移到滤膜下室面的VSMCs并计数,每个样本计数4个随机选择的高倍视野(×200)的细胞数。
1.5 siRNA 转染 培养的VSMCs达到60%~70%的融合后,根据生物公司提供的操作说明,运用Lipofectamine 2000将等量的TLR4 siRNA或Control siRNA(作为阴性对照)分别转染VSMCs,48 h后收集细胞用实时定量RT-PCR与Western blot检测TLR4的沉默效果。
1.6 RT-PCR检测基因的表达水平 采用TRIzol法抽提细胞总RNA,取2 μg总RNA逆转录成cDNA。本实验设定GAPDH为管家基因,设计PCR扩增的引物序列(TLR4:正向引物5′-AGC CAT TGC TGC CAA CAT CA-3′,反向引物5′-GCC AGA GCT ACT CAG AAA C-3′;GAPDH:正向引物5′-GAC AAC TTT GGC TCG TGG A-3′,反向引物5′-ATG CAG GGG TTC TGG-3′)。实时荧光定量PCR由ABI Prism7500序列检测系统完成,定量结果使用2-△△Ct方法进行分析。
1.7 Western blot检测蛋白的表达水平 细胞经PBS洗涤两次后,于裂解缓冲液中采集。离心后蛋白样品经10%的SDS-PAGE凝胶电泳分离后,转移至硝酸纤维素膜上。在室温条件下用5%脱脂奶粉及Tris-缓冲盐溶液封闭后,分别加入TLR4抗体、磷酸Akt (Ser-473)抗体、Akt抗体、GAPDH 抗体以及辣根过氧化物酶标记的二抗进行孵育。蛋白检测由ECL化学发光检测试剂盒完成。
1.8 PI3K 的活性测定 HMGB1(100 ng/mL)处理TLR4 siRNA和Control siRNA 转染的VSMCs 6 h后,对获得的细胞裂解液进行免疫沉淀和PI3K活性测定[11]。每个样本取500 μg,加入PI3K p85抗体处理4 ℃过夜,析出的免疫复合物经蛋白A琼脂糖小体于4 ℃处理2 h。然后,离心收集样本,激酶缓冲液洗涤。PI3K的活性由竞争性ELISA试剂盒测定。

2 结果
2.1 HMGB1对VSMCs迁移的影响 培养的大鼠胸主动脉VSMCs在显微镜下呈典型的“峰谷”样生长。经特异性平滑肌细胞抗体SM-a-Actin免疫染色后证实,本实验细胞纯度大约为90%。经不同浓度HMGB1处理VSMCs可以显著增加其迁移活性,且HMGB1浓度为100 ng/mL时,细胞迁移效应最大。经细胞活性测定,HMGB1在使用的浓度范围内并未对VSMCs造成细胞毒性作用。

A:TLR4 mRNA分析图;B:Western blot图;C:Western blot图分析图;a:P<0.05。
图1 各组细胞TLR4 mRNA和蛋白表达情况

A:对照组;B:HMGB1组;C:HMGB1+Control siRNA组;D:HMGB1+TLR4 siRNA组;E:VSMCs细胞相对迁移分析图;a:P<0.05。
图2 TLR4在HMGB1介导VSMCs迁移中的作用
2.2 TLR4在HMGB1介导VSMCs迁移中的作用 为确定TLR4是否参与了HMGB1介导的VSMCs迁移,用100 ng/mL HMGB1 处理经TLR4 siRNA 转染后的VSMCs。结果如图1所示,转染48 h后,与Control siRNA组比较,TLR4 siRNA组TLR4 mRNA及蛋白表达水平均显著降低,分别下降(67.5±5.7)%和(78.3±3.2)%(P<0.05)。此外,HMGB1刺激TLR4 siRNA转染的VSMCs,迁移也受到明显抑制,见图2。
2.3 PI3K/Akt信号通路在HMGB1介导VSMCs迁移中的作用 与对照组比较,经HMGB1(100 ng/mL)处理的VSMCs可以显著增加PI3K活性和Akt(Ser-473)磷酸化水平(P<0.05)。然而,TLR4 siRNA转染VSMCs后再用相同剂量HMGB1刺激,PI3K活性和Akt (Ser-473)磷酸化水平被明显抑制(P<0.05),见图3。这些数据表明,HMGB1可能通过TLR4激活PI3K/Akt途径介导VSMCs的迁移。
2.4 PI3k在HMGB1介导Akt 激活和VSMCs迁移中的作用 上述结果已经证实PI3K与VSMCs的迁移有关,为确定PI3k是否参与了HMGB1介导的Akt激活和VSMCs迁移。本研究采用PI3K抑制剂LY 294002(10 μM)预处理VSMCs 30 min后,再用HMGB1刺激,结果如图4,LY 294002预处理能明显减少HMGB1介导的Akt磷酸化水平(P<0.05),但对其总蛋白表达水平没有影响。进一步研究发现,PI3K抑制剂LY 294002能明显抑制HMGB1介导的VSMCs迁移(P<0.05),见图5。这些结果表明,PI3K在HMGB1介导的Akt活化和VSMCs迁移中起着十分重要的作用。
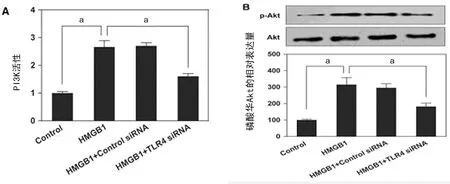
A:PI3K的活性测定;B:总Akt及磷酸化Akt(Ser-473)的表达水平;a:P<0.05。
图3 HMGB1通过 TLR4激活PI3K/Akt途径介导VSMCs迁移

a:P<0.05。
图4 Western blot 检测p-Akt和Akt蛋白表达情况
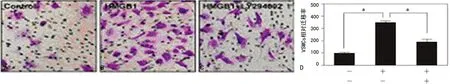
A:对照组;B:HMGB1组;C:HMGB1+PI3K抑制剂组;D:VSMCs相对迁移率分析图;a:P<0.05。
图5 LY294002抑制HMGB1介导的Akt磷酸化和VSMCs迁移
3 讨论
近年来,有研究报道HMGB1主要通过结合其受体RAGE或者激活TLR4/NF-κB通路产生炎性反应来促进VSMCs的增殖和迁移[5,7]。但是,抗炎因子或NF-κB与RAGE的抑制剂均不能完全抑制HMGB1介导的VSMCs迁移,说明还存在其他的信号介质参与了HMGB1介导的VSMCs迁移。因此,关于HMGB1介导VSMCs迁移的细胞内信号转导机制仍需深入探究。PI3K/Akt是常见的细胞信号通路,在细胞迁移、增殖、分化过程中发挥着重要作用[9]。PI3K是Akt良好的活化剂,有活性的Akt(p-Akt)与VSMCs 的迁移有关[12],也有人发现PI3K/Akt与TLR4通路下游的激活有关[13]。因此作者提出假设:PI3K/Akt通路是否通过TLR4参与HMGB1介导的VSMCs迁移。本研究证实HMGB1在体外呈剂量依赖性的促进VSMCs迁移,在此过程中,TLR4 siRNA可以抑制HMGB1 诱导的VSMCs迁移,这说明TLR4参与了这一过程。TLR4 siRNA还能明显抑制HMGB1诱导的PI3K活性和Akt磷酸化。同时PI3K的抑制剂LY294002也能有效抑制Akt 的磷酸化和HMGB1介导的VSMCs迁移。这些结果提示TLR4/PI3K/Akt 途径在HMGB1介导的VSMCs迁移中扮演重要角色。
本研究还发现,无论是TLR4沉默还是PI3K的抑制剂LY294002 仍然不能完全抑制Akt磷酸化和HMGB1介导的VSMCs迁移。由此,推测HMGB1介导VSMCs迁移的调控机制可能还涉及其他受体,例如TLR2或细胞内其他信号途径的参与,这需要进一步实验研究来阐明这一复杂机制。
总之,本研究结果说明TLR4/PI3K/Akt信号通路参与了HMGB1介导的VSMCs迁移。这些发现不仅有助于更好地理解HMGB1介导VSMCs 迁移的分子机制,也提示以TLR4 依赖的PI3K/Akt途径为靶点,可为狭窄阻塞性血管疾病的治疗提供新思路。
[1]Jukema JW,Ahmed TA,Verschuren JJ,et al.Restenosis after PCI.Part 2:prevention and therapy[J].Nat Rev Cardiol,2011,9(2):79-90.
[2]MontezanoAC,CalleraGE,YogiA,etal.AldosteroneandangiotensinⅡsynergisticallystimulatemigrationinvascularsmoothmusclecellsthroughc-Src-regulated redox-sensitive RhoA pathways[J].Arterioscler Thromb Vasc Biol,2008,28(8):1511-1518.
[3]Ding HS,Yang J,Chen P,et al.The HMGB1-TLR4 axis contributes to myocardial ischemia/reperfusion injury via regulation of cardiomyocyte apoptosis[J].Gene,2013,527(1):389-393.
[4]Smolarczyk R,Cichoń T,Jarosz M,et al.HMGB1--its role in tumor progression and anticancer therapy[J].Postepy Hig Med Dosw,2012,66(3):913-920.
[5]Kierdorf K,Fritz G.RAGE regulation and signaling in inflammation and beyond[J].J Leukoc Biol,2013,94(1):55-68.
[6]Bianchi ME,Manfredi AA.High-mobility group box 1(HMGB1) protein at the crossroads between innate and adaptive immunity[J].Immunol Rev,2007,220:35-46.
[7]Yang J,Huang C,Yang J,et al.Statins attenuate high mobility group box-1 protein induced vascular endothelial activation:a key role for TLR4/NF-κB signaling pathway[J].Mol Cell Biochem,2010,345(1/2):189-195.
[8]Heo SK,Yun HJ,Noh EK,et al.LPS induces inflammatory responses in human aortic vascular smooth muscle cells via Toll-like receptor 4 expression and nitric oxide production[J].Immunol Lett,2008,120(1/2):57-64.
[9]Gouffic Y,Guilluy C,Guérin P,et al.Hyaluronan induces vascular smooth muscle cell migration through RHAMM-mediated PI3K-dependent Rac activation[J].Cardiovasc Res,2006,72(2):339-348.
[10]Ojaniemi M,Glumoff V,Harju K,et al.Phosphatidylinositol 3-kinase is involved in Toll-like receptor 4-mediated cytokine expression in mouse macrophages[J].Eur J Immunol,2003,33(3):597-605.
[11]Liu Q,Chen T,Chen G,et al.Triptolide impairs dendritic cell migration by inhibiting CCR7 and COX-2 expression through PI3-K/Akt and NF-kappaB pathways[J].Mol Immunol,2007,44(10):2686-2696.
[12]Duan C,Bauchat JR,Hsieh T.Phosphatidylinositol 3-kinase is required for insulin-like growth factor-I-induced vascular smooth muscle cell proliferation and migration[J].Circ Res,2000,86(1):15-23.
[13]Ha T,Hua F,Liu X,et al.Lipopolysaccharide-induced myocardial protection against ischaemia/reperfusion injury is mediated through a PI3K/Akt-dependent mechanism[J].Cardiovasc Res,2008,78(3):546-553.
Effect of HMGB1 on the migration of vascular smooth muscle cells and its molecular mechanism*
YangJian,FanZhixing,LiXinxin,PengJiaqin,JiangYurong,ChenYong
(DepartmentofCardiology,theFirstClinicalMedicalCollege,TheThreeGorgesUniversity,Yichang,Hubei443003,China)
Objective To investigate the effect of high mobility group box-1(HMGB1) on the migration of vascular smooth cells(VSMCs) and the role of TLR4-dependent PI3K/Akt pathway in the process.Methods Primary VSMCs were isolated from the thoracic aorta of male SD rats and cultured in vitro.Control group,TLR4 siRNA transfected group,control siRNA transfected group and PI3k inhibitor (LY294002) intervention group were stimulated by HMGB1 (0.1-1 000.0 ng/mL).Expression of TLR4 mRNA was detected by RT-PCR,protein expression of TLR4,Akt,pAkt,PI3K were detected by Western blot.Activity of the immunoprecipitated PI3K enzyme was assessed in a competitive ELISA.The migration and cell viability of every groups were observed.Results HMGB1 (0.1-1 000.0 ng/mL) stimulated VSMCs migration in a dose-dependent manner and incubation of VSMCs with 100 ng/mL caused a rapid migration (P<0.05).At the concentrations used,HMGB1 did not cause any cytotoxic effects (P<0.05).Migration of VSMCs toward HMGB1 was significantly inhibited by silencing of TLR4 (P<0.05).Pretreated cells with TLR4 siRNA or the PI3K inhibitor LY294002 could markedly block PI3K/Akt pathway activation and VSMCs migration mediated by HMGB1 (bothP<0.05).Conclusion HMGB1 stimulated VSMCs migration in a dose-dependent manner and TLR4-dependent PI3K/Akt signaling pathway played an important role in the migration of VSMCs mediated by HMGB1.This research indicates that TLR4-dependent TLR4/PI3K/Akt signaling pathway could be the target in the treatment of obstructive cardiovascular disease.
Toll-like receptor 4;high mobility group box-1;PI3K/Akt pathway;vascular smooth muscle cells
10.3969/j.issn.1671-8348.2015.04.003
国家自然科学基金资助项目(81200088);宜昌市科技研究与开发项目(A12301-01)。 作者简介:杨简(1982-),硕士,主要从事冠心病基础与临床研究。
R54
A
1671-8348(2015)04-0439-03
2014-08-10
2014-10-10)

