不同近交系数的虾夷扇贝近交衰退研究❋
傅 强, 王 师, 赵 亮, 张 璐, 包振民
(中国海洋大学海洋生命学院,海洋生物遗传学与育种教育部重点实验室,山东 青岛 266003)
不同近交系数的虾夷扇贝近交衰退研究❋
傅 强, 王 师❋❋, 赵 亮, 张 璐, 包振民
(中国海洋大学海洋生命学院,海洋生物遗传学与育种教育部重点实验室,山东 青岛 266003)
在虾夷扇贝中通过自体受精构建了近交系数为0.5的自交家系,同时构建了近交系数为0.25的F2代近交家系和杂交对照家系,对生活史不同时期的生长和存活等适应性性状进行了近交效应的研究。研究发现不同的近交系数对不同性状的衰退影响不同:幼虫期生长性状的近交负荷为0.158~0.279,而存活率的近交负荷为0.915~1.101,存活率受近交的影响更大。两种性状的近交衰退从幼虫第16天才开始明显显现,并且近交负荷随着时间都有增大的趋势,到成体时分别增长为0.348~0.588和1.485~3.277。本研究表明,在虾夷扇贝中近交系数越高衰退越严重,存活率性状的衰退相比生长性状更严重,并且近交负荷都随着时间显著增大。
虾夷扇贝;自体受精;近交衰退;适应性性状;遗传负荷
有亲缘关系的个体之间的交配通常会导致一些与生物适应性相关的性状表型降低,这种现象被称为近交衰退(Inbreeding depression),最早是由Charlesworth[1]提出。虽然近交衰退带来的直接结果几乎都是有害的,但通过对近交的研究有助于帮助我们理解基因纯化进程中的规律和近交衰退的机理,以便于合理利用近交构建纯系、加快育种进程并减少或避免近交衰退;对近交负荷的研究同时也能帮助理解进化及物种保护等众多遗传学和交配系统进化等问题。因此近交衰退一直以来都是遗传育种学、进化生物学,保护遗传学和生态学等领域的研究热点。
虾夷扇贝(Patinopectenyessoensis)自1982年引入中国以来[2],已经成为中国北方最重要的海水养殖贝类之一。近年来,随着养殖规模的不断扩大,虾夷扇贝养殖群体逐渐出现了育苗成活率低、病害频发、高死亡率等现象[3]。许多学者都认为,由于种群内多代连续近交导致的虾夷扇贝种质退化,是产生上述现象的主要原因[4-5]。
虾夷扇贝本身虽为雌雄异体,但近年来在养殖群体中发现了一定比例的雌雄同体现象[6]。虽然这种雌雄同体产生的机制尚不明确,但无论哪种雌雄比例的性腺,都可以同时产生成熟的精、卵细胞。自体受精为研究虾夷扇贝近交衰退提供了很好的材料,国内也已有学者对虾夷扇贝自体受精的繁殖生物学做了初步研究[6-7],但在虾夷扇贝中仍缺乏系统的近交衰退相关研究。针对这一现状,作者于2012年利用不同的交配策略构建了不同近交系数的虾夷扇贝家系材料,通过记录各不同时期的不同性状衰退研究,探讨近交衰退在虾夷扇贝中的表现及规律,为虾夷扇贝近交衰退研究提供理论基础。
1 材料与方法
1.1 实验材料
用于构建家系的虾夷扇贝亲贝包含以下3种:(1)普通虾夷扇贝养殖群体二龄个体;(2)本实验室前期(2010年)构建的虾夷扇贝全同胞家系二龄子代个体;(3)雌雄同体的虾夷扇贝(雌雄性腺比约20∶1~40∶1)。亲贝于2012年1月由大连獐子岛海区转移至獐子岛集团原良种厂车间进行60 d的积温促熟,促熟结束后挑选性腺肥满、活力好且外型规则的种贝做亲本。所有选择用于家系构建的亲贝均为二龄且大小无显著差异。
1.2 实验设计
1.2.1 实验分组 本研究共分为3个实验组,杂交对照组、F2代近交组和自体受精的自交组,分别编号为A、B、C。根据通径计算的原理和莱特公式可以得出,3组的近交系数F分别为0、0.25、0.5。每组分别建立3个家系作为平行样,每个家系分3桶培育以消除桶间误差。
1.2.2 实验取样及性状选择 本实验所研究的与适应性相关的性状包括:受精率、孵化率、幼虫不同时期的存活率和壳长大小,以及成体不同时期的存活率和大小。计算方法如下:
受精率=(产生第一极体的受精卵数÷总卵数)×100%;
孵化率=(D形幼虫数÷受精卵数)×100%;
幼虫存活率=(取样时幼虫总数目÷初选幼后幼虫总数目)×100%;
成体存活率=(取样时成体总个数÷转移至海上养殖时总数目)×100%;
生长性状以壳长为代表,每次以家系为单位从不同桶中混合取样30个个体。
1.2.3 数据分析 不同实验组之间的性状比较采用多重比较分析。方差分析采用单因素方差分析(ANOVA)。在分析之前,所有的生长性状值都转化为其自然对数,孵化率等以百分比表示的性状值转化成其反正弦函数,以增加数据的正态性。方差分析采用SPSS17软件,近交衰退率的差异比较采用t检验,差异的显著性阈值设为0.05。
近交衰退率的计算采用公式:
式中:δx为近交衰退率;sx为近交组x的表型均值;Mx为对照组的表型均值。
近交负荷的计算方法为某性状均值的自然对数对近交系数F的回归斜率[1],参照公式:
lnZ0-lnZx=B×F。
式中:Z0为对照组的性状均值;Zx为近交组对应的性状均值;F为近交系数;B为近交负荷。
1.3 实验方法
1.3.1 家系的构建 A、B组分别随机挑选雌雄亲贝各3个,C组挑选雌雄同体亲贝3个,刷洗干净后置于阴凉通风处阴干1.5 h,雌雄亲贝分别放置于对应的100 L/25 L塑料桶内催产。催产水温为12 ℃,采用充气加搅拌的方法刺激产卵/产精。开始产卵/产精2 h后将亲贝拿出,按照预先设计的方案进行受精:C组雌雄同体自交组在桶内自体受精,A、B组3个雌性亲本各随机挑选1个雄性亲本的精子受精。加入的精子量以每个卵子周围有3~5个为宜,通过显微镜镜检受精情况。
1.3.2 孵化和幼虫培育 孵化期间胚胎密度控制在100个/mL以内,每隔30min搅拌1次,防止受精卵相互挤压影响孵化;72 h后胚胎发育至D形幼虫,用280目的筛绢进行选幼。将选出的幼虫转移至新桶中进行培育,初始培育密度控制在10个/mL。选幼后开始投喂适量金藻作为开口饵料,本着“少食多餐”的原则每日投喂3~4次,具体投饵量根据幼虫密度、生长和摄食情况及时调整,后期适当加投扁藻和硅藻。幼虫培育阶段持续微充气,每天换水70%,每周全量换水1次,每次换水时通过调整水体大小使各家系培育密度一致。每天显微镜观察幼虫的摄食、活动情况并按计划记录生长大小。
1.3.3 幼虫的变态附着 30 d后幼虫生长到260~280 μm时进入变态附着阶段,当30%幼虫出现眼点时开始投入1片附着基,后根据幼虫密度陆续投入3~5片附着基。当幼虫全部附着后继续在桶内培育1周,并在保苗出库前5 d进行降温处理:每次换水时降温0.5 ℃,直至桶内水温与自然海区水温一致。将附着基装入60目的聚乙烯网袋中并做好标记,转移到獐子岛海区自然保苗。
1.3.4 海上阶段的培育 稚贝转移到海上保苗后,定期每30 d更换网袋。当稚贝生长到壳长为2 cm时可以转入养成笼中,每45 d更换养殖笼并记录生长及剩余个体情况,每次更换网笼时根据个体大小情况调整每层个数并调整家系间密度一致。
所有实验、对照组在受精、孵化、幼虫培育、稚贝保苗及养成阶段都严格控制在相同的环境及条件下,以避免人为操作误差对实验的影响。
2 实验结果
2.1 不同近交系数对受精率和孵化率的影响
表1所示为3组受精率与孵化率的多重比较。从表中可以看出,3个实验组的受精率都较高且没有显著差异,说明受精过程并没有明显受到自交的影响。而在孵化率方面,自交组C与其他2组相比明显降低(P<0.05),近交组B相比对照组A却没有显著差异。自交组孵化率的衰退也达到了25.91%,说明自交使孵化率产生了较严重的衰退。
2.2 幼虫阶段的生长与存活分析
幼虫阶段不同时期生长情况的多重比较见表2。在幼虫发育的初期,3组之间幼虫大小无明显差异。从第16天开始,2实验组B、C的幼虫显著小于对照组A,并且2个实验组之间也存在有显著差异,自交组要小于近交组。从近交衰退率也可以看出,在每个时期自交组C的近交衰退率都显著高于近交组B,这种差异一直持续到幼虫发育结束(第26天),并且两实验组的近交衰退率都有随着时间增大的趋势。
幼虫时期的存活率见表3。与生长性状类似,在第6天之前3组的存活率并没有显著差异,差异直到幼虫发育到第16天才显示出来,自交组C要显著低于对照组,而近交组B的均值虽介于自交和对照之间,但与两者的差异均不显著。在同一时期,存活率的衰退率(7.32%~42.32%)要远高于生长性状(3.50%~13.02%);并且在存活率性状中,自交组和近交组的近交衰退率差异要更大,暗示了自交对存活率有更严重的影响。

表1 受精率与孵化率的多重比较
注:同一行内上标字母相同的表示差异不显著(P>0.05);括号内为本组3个平行样的标准差,下同。
Note:The values with different superscripts within each row are singnificantly different (P>0.05) ; Within parentheses are standard deviation same below.
值得一提的是,在整个幼虫培育阶段,我们并没有发现自交或近交对胚胎发育的进程有明显的影响,3个实验组间的胚胎发育基本是同步的,说明数据之间有较高的可比性。

表2 幼虫大小的多重比较

表3 幼虫存活率的多重比较
2.3 成体阶段近交衰退的表现
成体阶段不同时期生长和存活的多重比较见表4。在成体阶段,无论在哪个时期的何种性状,3组之间两两都有显著差异;并且相比于幼虫时期,成体时期的近交衰退率要更高,暗示了更大的遗传负荷。自交组的近交衰退率也一直显著的大于近交组,再次说明不同近交系数对近交衰退的影响是不同的。
2.4 回归分析及近交负荷的计算
在3个实验组中通过不同性状对近交系数F的回归分析可以帮助我们更好的理解衰退的程度。表5所示为不同时期的不同性状对近交系数的回归方程,由于本研究只有3组数据,我们仅能利用线性模型。根据回归分析的斜率,我们还计算出了不同性状在不同时期的近交负荷。近交负荷可以直观的反应出不同性状衰退的程度。图1、2分别所示为幼虫和成体阶段生长性状和存活率的近交负荷变化规律。不同性状在不同阶段表现出的近交负荷不同,总体来讲,死亡率性状的负荷(0.915~3.277)要明显高于生长性状(0.158~0.588),并且随着时间的推移,不同性状的近交负荷都有增大的趋势。
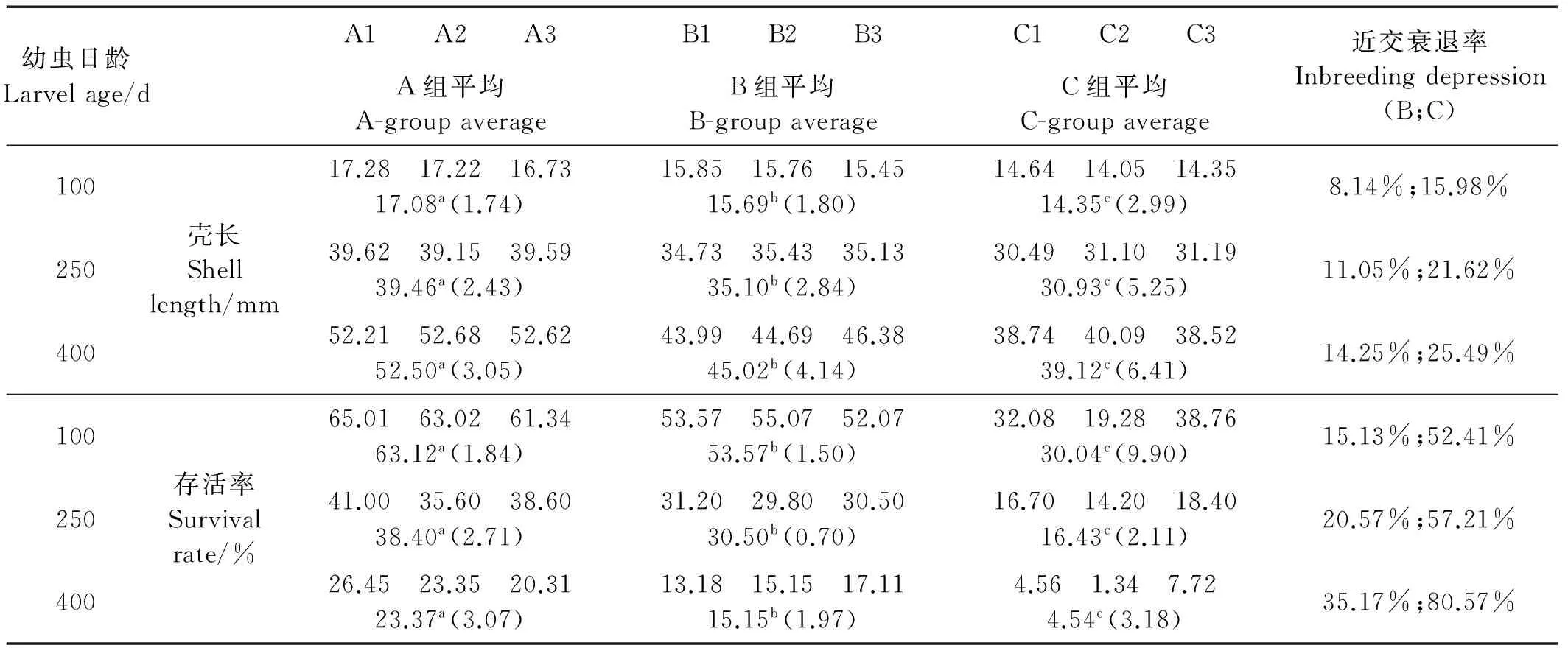
表4 养成期生长与存活的多重比较

表5 不同性状对近交系数的回归分析

图1 幼虫和成体阶段生长性状的近交负荷

图2 幼虫和成体阶段存活性状的近交负荷
3 讨论
3.1 虾夷扇贝自交家系与近交衰退的研究
近交衰退研究的动物模型主要集中在传统模式生物中。近年来,双壳贝类由于其独特的繁殖方式(高产卵量,快速发育的浮游幼虫及高死亡率)以及多样的交配系统,已经成为研究近交的良好新模式生物。另外,约9%的双壳贝类中都存在雌雄同体现象[8],自体受精可以造成严重的近交衰退,为研究近交衰退的机理提供了很好的材料。国内外已有许多利用双壳贝类自交系进行近交研究的报道[9-12]。
虽然在双壳贝类中的近交衰退几乎都是在雌雄同体物种进行,结果却不尽相同:如Ibarra等[9]发现墨西哥湾扇贝(Argopectencircularis)通过自交产生的幼虫,无论从生长速度还是存活率都要低于杂交;Zheng等[10]在海湾扇贝(Argopectenirradias)中也发现,近交会使幼虫和成体的各性状造成比较严重的衰退,且不同的近交系数对衰退的影响不同。然而并不是所有的性状都能检测到衰退,如Beaumont[12]发现欧洲大扇贝(Pectenmaximus)的近交会使幼虫的生长速度显著降低,但并不影响幼虫的死亡率;而在其他一些雌雄同体的扇贝中,甚至没有发现明显的衰退[11]。究其原因可能是由于不同种群的交配历史掩盖了近交衰退的检测[13]。作为一种雌雄异体生物中的自交系,虾夷扇贝可以避免由于部分自交带来的遗传结构的改变,从而更真实的检测出近交衰退的规律。因此是一种研究近交衰退的很好的动物模型。
3.2 虾夷扇贝中近交衰退表现
本研究通过构建不同近交系数的家系,研究虾夷扇贝不同性状在不同时期的近交衰退。由于选用虾夷扇贝群体是于2002年引进大连獐子岛,经过10 a的人工养殖,群体内已经有了一定程度近交。根据每代约1 700个个体的有效繁殖群体数目(Ne)粗略计算(个人统计),此群体的近交系数约为2.94×10-4,相比我们采用和自体受精和全同胞交配方式的近交系数(分别是0.5、0.25)要小的多,并且3种类型的亲贝来源于同一群体,相对的近交程度大小受群体自身近交背景影响较小。因此本实验假定杂交家系的近交系数为零,做为另2个近交组的对照。
从实验结果来看,近交对受精率没有显著影响,这与其他雌雄同体贝类中的研究结果一致。而自交组孵化率的明显衰退,这可能是由于自交使有害基因纯合过快,孵化过程中又涉及大量的变态、发育进程,因此孵化更易受到近交衰退的影响。在幼虫的生长和存活率方面,近交衰退在幼虫发育的前期并没有表现出来,而从第16天才开始明显,这可能是由于母体效应在幼虫发育的初期影响较大,掩盖了近交带来的不利影响;不论是在幼体或成体阶段的何种性状,近交衰退都是随着时间的推移增大的,近交负荷也呈明显上升的趋势,这说明随着生长,越来越多的效应相对较小的不良基因表现出来。本实验的研究结果与于瑞海等[7]在探索自交系的构建时发现的生长性状没有没有明显衰退有所出入,造成这种差异的主要原因,可能是二者的培育环境差异较大造成的。已有文献表明,相对较高的温度和较好的营养条件会掩盖近交衰退的检测[11],而本实验是在相对低温的条件下进行的(大连),因此更容易检测到性状的衰退。
本研究还发现,近交系数为0.25的F2组的衰退率要比自交组低,说明不同近交程度对近交衰退的影响是不同的,然而从3组的标准差来看,自交组要明显高于其他2组,说明相比其他2组,自体交配使不同个体之间的不良基因纯化率不同,因此造成个体间性状较大的差异。另外在同一近交系数下,2种不同类型性状的衰退程度也是不同的:在同一时期,存活率的近交负荷几乎都显著大于生长性状。对于不同性状近交衰退程度不同的原因,Lynch等[14]认为,由于适应性性状基因位点的突变对生物体而言几乎都是高度有害的;而相比之下形态性状的突变则相对可以接受,即适应性性状有较高的显性系数(Coefficient of dominance)。Roff[15]在蚤蝼(Gryllusfirmus)中利用数学模型证明,与生活史相关的适应性性状的显性系数要明显高于非适应性性状。DeRose等[16]对此也给出了3方面的解释,都认为适应性位点的突变对生物体的危害更大。总之,对此现有的大部分解释一致认为适应性性状相比其他性状有更高的显性系数。这一观点也逐渐被大家接受。
本研究明确表明,近交衰退普遍存在于虾夷扇贝养殖群体中,但不同的性状、不同的近交系数在不同的时期表现是不同的。在我们前期研究中发现的自交系更低的养成率以及不同家系的衰退差异,暗示着不同遗传背景下有害等位基因的固定和清除遗传负荷的发生。本实验对近交衰退的研究,有助于我们合理的利用近交或自交加速育种进程,对通过制定合理的育种策略以避免近交对产业的危害提供了理论基础。
[1] Charlesworth D, Charlesworth B. Inbreeding depression and its evolutionary consequences [J]. Annual Review of Ecology and Systematic, 1987,18: 237-268.
[2] 张福绥, 李淑英, 开玲欣, 等. 虾夷扇贝的引种、育苗及试养 [J]. 海洋科学, 1984, 1(5): 38-45.
[3] 张明明, 赵文. 我国虾夷扇贝死亡原因的探讨及控制对策 [J]. 中国水产, 2008(2): 65-66.
[4] Li Q, Xu K, Yu R. Genetic variation in Chinese hatchery populations of the Japanese scallop (Patinopectenyessoensis) inferred from microsatellite data [J]. Aquaculture, 2007, 269: 211-219.
[5] 丁君, 王婷, 常亚青, 等. 基于AFLP技术的不同群体虾夷扇贝遗传结构及多样性研究 [J]. 烟台大学学报, 2010(1): 47-53.
[6] 梁峻. 虾夷扇贝养殖群体数量性状遗传研究 [D]. 青岛: 中国科学院研究生院海洋研究所, 2008.
[7] 于瑞海, 王昭萍, 赵雪琳, 等. 虾夷扇贝雌雄同体自体受精繁殖生物学的研究 [J]. 中国海洋大学学报(自然科学版), 2011, 41(11): 23-26.
[8] Heller J. Hermaphroditism in mollusks [J]. Biological Journal of the Linnean Society, 1993, 48(1): 19-42.
[9] Ibarra A M, Cruz P, Romero B A. Effects of inbreeding on growth and survival of self-fertilized catarina scallop(Argopectencircularis) larvae [J]. Aquaculture, 1995, 134(1): 37-47.
[10] Zheng H, Li L, Zhang G. Inbreeding depression for fitness-related traits and purging the genetic load in the hermaphroditic bay scallop (Argopectenirradians)(Mollusca: Bivalvia) [J]. Aquaculture, 2012, 366: 27-33.
[11] Winkler F M, Estévez B F. Effects of self-fertilization on growth and survival of larvae and juveniles of the scallop (ArgopectenpurpuratusL.) [J]. Journal of Experimental Marine Biology and Ecology, 2003, 292(1): 93-102.
[12] Beaumont A R. Genetic aspects of hatchery rearing of the scallop (PectenmaximusL.) [J]. Aquaculture, 1986, 57(1): 99-110.
[13] Charlesworth D, Morgan M T, Charlesworth B. Inbreeding depression, genetic load, and the evolution of outcrossing rates in a multilocus system with no linkage [J]. Evolution, 1990, 44: 1469-1489.
[14] Lynch M, Walsh B. Genetics and Analysis of Quantitative Traits [M]. Sunderland: Sinauer Associates, MA, 1998.
[15] Roff D A. Effects of inbreeding on morphological and life history traits of the sand cricket,Gryllusfirmus[J]. Heredity, 1998, 81: 28-37.
[16] DeRose M A, Roff D A. A comparison of inbreeding depression in life-history and morphological traits in animals [J]. Evolution, 1999, 53: 1288-1292.
责任编辑 高 蓓
Analysis of Inbreeding Depression inPatinopectenyessoensisBased on Different Inbreeding Coefficient
FU Qiang,WANG Shi,ZHAO Liang,ZHANG Lu, BAO Zhen-Min
(The Key Laboratory of Marine Genetics and Breeding (MGB), Ministry of Education, College of Marine Life Sciences, Ocean University of China, Qingdao 266003, China)
This article focuses on inbreeding depression on different traits in the life cycle ofPatinopectenyessoensis. Using different mating strategies, we established selfed families with inbreeding coefficient 0.5, F2 families and controlled families respectively. Our study has shown that inbreeding loads of larval growth and survival was 0.158~0.279 and 0.915~1.101. Survival rate suffers more from inbreeding than growth traits. Both traits show an obvious increase with age, which were not significantly different among three groups until 16 days and whose inbreeding loads climbed to 0.348~0.588 and 1.485~3.277 in the adults stage. Our results shows that inbreeding depression is more serious in selfed group with higher inbreeding coefficient than in F2group, and is more severe in survival traits than in growth traits, both of which increased with age.
Patinopectenyessoensis; self-fertilization; inbreeding depression; fitness components; inbreeding loads
国家自然科学基金面上项目(31272656);留学归国人员科研启动金项目(教外司留[2013]1792号)资助
2014-11-21;
2014-12-11
傅 强(1987-),男,博士,主要从事贝类遗传育种研究。E-mail:oucfuq@163.com
❋❋通讯作者: E-mail:swang@ouc.edu.cn
P733.2
A
1672-5174(2015)11-043-06
10.16441/j.cnki.hdxb.20140384

