壳聚糖-生物炭微球对甲基红的吸附及微球菌剂的吸附增益效应
杜敬霆,孙朋飞,赵宇华,张昕*
(1.浙江农林大学林业与生物技术学院,浙江 临安 311300;2.浙江大学生命科学学院微生物研究所,杭州 310058)
随着现代工业的发展,染料已经广泛应用于印染、纺织、食品、药品和化妆品等行业.在我国,染料的年产量达到15万t,其中约有2000 ~3000 t染料会直接随着废水排入到环境中,我国的染料污染位居世界前列.在所有染料中,偶氮染料是目前工业上应用最为广泛的一类[1].它具有偶氮基,两端连接芳基,常用于纺织品的印染工艺中.据统计,在目前的染料品种中高达半数以上为偶氮染料,且该染料结构复杂,在水环境中能长期保持稳定.此外,偶氮染料结构中的芳香烃类化合物很难被去除,分解后能产生20多种致癌芳香胺,经过活化作用可改变人体的DNA结构从而引起病变和诱发癌变[2].因此,偶氮染料废水必须在排放前进行无害化处理.目前,已有多种处理偶氮染料废水的方法,其中物理吸附与微生物脱色被认为是最有效且对环境无害的手段[3].
壳聚糖是自然界中一种带正电荷的多糖,广泛分布于甲壳类动物、昆虫外壳和真菌的细胞壁中,年产量上百亿吨.壳聚糖具有生物兼容性、可降解性、无毒、生理惰性、抗菌性和重金属离子螯合性等优良特性[4].生物炭是以农业废弃秸秆为原料,在限氧条件下热裂解而成,具有孔隙丰富、对染料吸附性强等特点[5].由于均具有价廉、高效及不会对环境产生二次污染的特性,目前采用壳聚糖与生物炭进行有毒污染物质的吸附已成为新的研究热点,但迄今为止国内外尚未有壳聚糖与生物炭相结合制备微球用来吸附染料的相关报道.
本研究综合考虑生物炭空隙丰富、表面积大、吸附性强及壳聚糖可降解、生物兼容性好的优点制备了壳聚糖-生物炭微球制剂,并以典型偶氮染料甲基红为材料研究了壳聚糖-生物炭微球制剂对甲基红的吸附动力学及吸附机制.利用人工神经网络建模分析了pH、温度、染料初始质量浓度和吸附时间对吸附量的影响.在取得良好吸附效果的基础上,本研究将高效脱色菌株Bacillus sp.UN2包埋在微球中,通过比较壳聚糖-生物炭微球菌剂与壳聚糖-生物炭微球无菌制剂、微生物单独施用的吸附效果,明确了包埋微生物的微球菌剂的增益吸附效应,实验结果可为吸附剂-微生物组合制剂对环境中偶氮类染料去除的开发利用提供初步的理论依据.
1 材料与方法
1.1 材料
1.1.1 菌种来源 甲基红高效降解菌株Bacillus sp.UN2为本实验室分离保藏[6].
1.1.2 材料及培养基 壳聚糖(黏度50~800 mPa⋅s,脱乙酰度80% ~95%)和甲基红均为国产分析纯,购自国药集团化学试剂有限公司.生物炭由玉米秸秆在400℃条件下热解制备所得,粉碎后过筛,烘干至恒质量,冷却后保存在密封袋中备用.
Luria-Bertani培养基 (LB,pH 7.1):10 g/L 蛋白胨,5 g/L酵母膏,10 g/L NaCl(固体培养基含2%琼脂);在115℃灭菌30min,用于微生物培养.
甲基红溶液配制:称取1000 mg甲基红粉末溶于少量乙醇中,移入(1000 ±0.4)mL容量瓶内定容作为质量浓度为1000 mg/L的母液保存,用时稀释到试验所需质量浓度.
脱色研究所用的无机盐培养基配方:5.1 g/L K2HPO4,3.0 g/L KH2PO4,5 g/L NaCl,2.0 g/L 葡萄糖,最适pH条件.
1.2 试验方法
1.2.1 微球纯材料制剂及菌剂的制备 微球纯材料制剂:称取2.5 g壳聚糖粉末加入到100 mL体积分数为2%的乙酸溶液中,磁力搅拌1 h,静置过夜,使壳聚糖充分溶解,配制成质量分数为2.5%的壳聚糖溶液.在壳聚糖溶液中加入2%生物炭,在持续磁力搅拌下,将上述壳聚糖溶液用装有5号针头的注射器逐滴加到100 mL凝结液(含2 mol/L NaOH)中,制得多孔凝胶微球.壳聚糖微球制成后,在室温下放置过夜,然后用蒸馏水洗至中性,于4℃冰箱中保存待用.
微球菌剂的制备:在质量分数为2.5%的壳聚糖溶液中加入2%生物炭,再加入干质量为0.05 g的菌株UN2,而后依照微球纯材料制剂方法制成微球菌剂.
1.2.2 溶液pH对微球纯材料制剂吸附量的影响称取1 g壳聚糖-生物炭微球加入到100 mL质量浓度为200 mg/L、pH值范围1.0~10.0的甲基红溶液中.在恒温30℃、120 r/min下振荡90min后,分别取不同处理上清液用分光光度计测定甲基红浓度,研究pH值对吸附量的影响.吸附量计算方法:
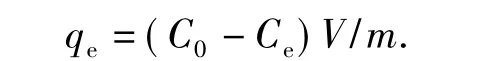
式中:qe为吸附量,mg/g;C0和Ce分别为初始和平衡液质量浓度,mg/L;V为溶液体积,L;m为吸附剂质量,g.
1.2.3 等温吸附试验 称取1 g微球分别加入到100 mL初始质量浓度为50~500 mg/L的甲基红溶液中,在温度分别为20、30和40℃条件下振荡90min,取上清液.使用分光光度计对上清溶液进行检测,计算吸附量.
1.2.4 吸附热力学试验 吉布斯自由能变ΔG0是判断吸附过程能否自发进行的基本条件,在试验温度20~40℃范围内选择5个温度,计算得到吸附过程中的热力学参数 ΔG0、熵变 ΔS0和焓变ΔH0.
1.2.5 吸附动力学试验 称取1 g壳聚糖微球加入到100 mL初始质量浓度分别为100、200和300 mg/L的甲基红溶液中,在温度30℃、振荡90min(120 r/min)过程中,每隔10min取样,使用分光光度计对上清溶液进行检测,计算吸附量.
1.2.6 人工神经网络模型构建 本研究应用人工神经网络[7]模拟壳聚糖-生物炭微球吸附甲基红的过程.选取200组实验数据构建神经网络模型,数据集分为3部分:150个作为训练集,25个作为验证集,25个作为测试子集.输入层:pH 1.0~10.0,温度20~40℃,染料初始质量浓度50~500 mg/L,吸附时间10~90min;输出层为微球对甲基红的吸附量.当训练曲线趋于给定的均方差(mean square error,MSE)值时,神经网络模型训练停止,完成建模.数据分析供试的4个参数(pH值,温度,染料初始质量浓度,吸附时间)对壳聚糖-生物炭微球吸附量影响的权重比例.
1.2.7 微球菌剂的增益脱色试验 称取1 g包埋微生物的微球菌剂加入到初始质量浓度为1000 mg/L的甲基红溶液中,在30℃、pH 3.0条件下,120 r/min振荡90min,取上清液测定后计算脱色率.同时,设置只含有纯吸附材料的微球制剂和仅含有与微生物菌剂中含量相等的微生物纯菌处理.上述所有吸附实验均重复3次,利用分光光度计在最大吸收波长410 nm处测定水溶液中甲基红的吸光值,计算脱色率.

式中:Ac为对照组的吸光值;Af为试验组的吸光值.
2 结果与分析
2.1 pH值对吸附量的影响
pH值是影响壳聚糖-生物炭微球对甲基红吸附的重要因素.溶液中氢离子浓度不仅影响包埋材料壳聚糖和生物炭表面的官能团、电荷量,而且对甲基红的形态结构也有一定的影响.从图1可以看出,在pH 1~3的范围内,吸附量随着pH值的增加而增加,当pH为3时,壳聚糖-生物炭微球对甲基红的吸附量达到最大值,此后随着pH值的升高吸附量快速下降,最后趋于平稳.

图1 pH值对壳聚糖-生物炭微球制剂吸附甲基红的影响Fig.1 Effects of pH on the adsorption capacity of chitosan-biochar microsphere for methyl red
2.2 染料初始质量浓度与温度对吸附量的影响
从图2可以看出:微球制剂对甲基红的吸附量随着染料初始质量浓度的升高而明显增加;低温更有利于微球对甲基红的吸附,本试验在甲基红初始质量浓度为500 mg/L、温度为20℃时,吸附量达到最大值(460 mg/g).
2.3 等温吸附
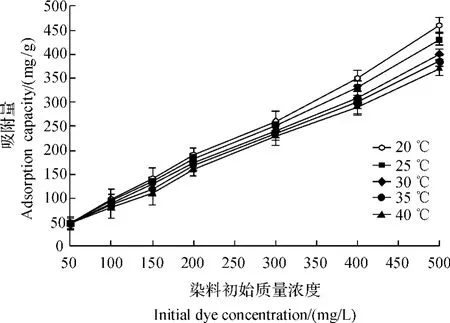
图2 染料初始质量浓度与温度对壳聚糖-生物炭微球制剂吸附甲基红的影响Fig.2 Effects of initial dye concentration and temperature on the adsorption capacity ofchitosan-biocharmicrosphere for methyl red
Langmuir[8]等温吸附方程和 Freundlich[9]等温吸附方程已广泛用于研究染料的等温吸附特性.吸附过程适合何种方程主要取决于决定系数R2值,当R2>0.99时拟合方程成立.

式中:Ce为平衡时溶液的质量分数,mg/g;qe为吸附量,mg/g;KL为朗缪尔吸附平衡常数,L/mg;Qmax为最大吸附量,mg/g;KF为Freundlich常数,L/g;n为Freundlich常数.
壳聚糖-生物炭微球对甲基红的等温吸附实验数据见表1.分析发现本研究的等温吸附过程符合Freundlich方程,R2均在0.99以上.Freundlich方程中的参数KF随温度升高而降低,表示吸附能力随温度升高而减弱.据 Yang等[10]报道,Freundlich方程中的参数n值在2~10的范围内表示有良好的吸附过程发生.在本试验中只有当温度为20℃时,n值才在这一范围内,同时吸附量达到最大,进一步证实低温更有利于吸附过程发生.
2.4 吸附热力学
吸附热力学参数可以反映壳聚糖-生物炭微球吸附甲基红的热力学性质及吸附机制.相关的热力学参数可以通过以下方程[11]计算:

表1 壳聚糖-生物炭微球吸附甲基红的等温吸附常数Table 1 Adsorption isotherm constants for the adsorption of methyl red onto the chitosan-biochar microsphere at various temperatures
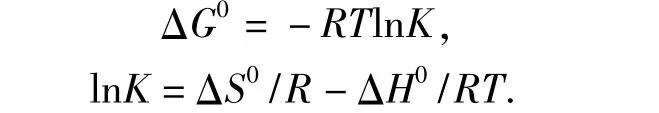
式中:ΔG0、ΔS0和ΔH0分别表示系统吉布斯自由能变化、熵变化和焓变化;T为绝对温度,K;K为反应平衡常数;R为气体常数,J/(mol⋅K).
从表2中可以看出:ΔG0值均为负值,说明壳聚糖-生物炭微球制剂对甲基红的吸附为自发过程[12];随着温度逐步升高(从20 ℃到 40 ℃),微球制剂对甲基红吸附的自发度降低;ΔS0均大于0,意味着温度升高将增加微球吸附甲基红系统的无序性,因而不利于反应的进行;ΔH0均为负值,表明此过程为放热过程,温度升高可抑制甲基红在微球上的吸附[13].该试验数据进一步从热力学角度解释了较低温度有利于吸附进行的原因.
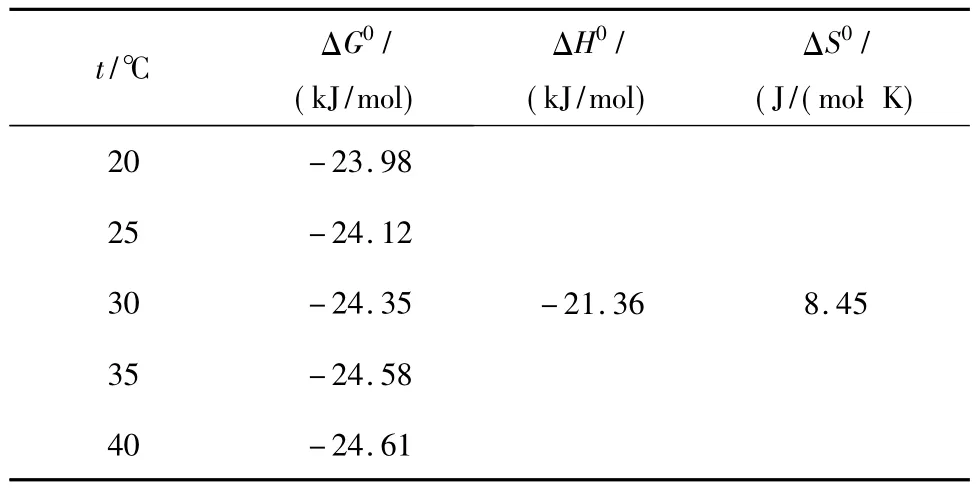
表2 壳聚糖-生物炭微球在吸附甲基红过程中的热力学参数Table 2 Thermo-dynamic parameters for the adsorption of methyl redonto the chitosan-biochar microsphere
2.5 吸附动力学
2.5.1 动力学方程 应用Lagergren准一级动力学方程与准二级动力学方程模型对图3的吸附动力学数据进行分析[14-15].2种动力学模型的线性方程分别表达如下:
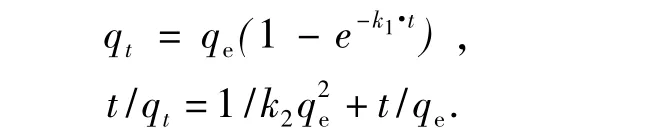
式中:qt为t时刻的吸附量,mg/g;qe为达到平衡时的吸附量,mg/g;k1为准一级动力学速率常数,min-1;k2为准二级动力学速率常数,g/(mg⋅min).数据拟合后的结果如表3所示.试验结果与
Lagergren准二级动力学方程拟合效果较好,R2均大于0.99.随着甲基红初始质量浓度的增大,吸附量和吸附速率均增加.
2.5.2 Elovich方程[16]该方程是对吸附过程中的吸附作用与解吸附作用进行研究,表达如下:

式中:qt为t时刻的吸附量,mg/g;α为吸附速率常数,g/(mg⋅min);β 为解吸附常数,g/mg.
结果(表4)显示:试验所得数据与Elovich方程有良好的拟合,R2均在0.99以上;随着染料初始质量浓度的增加,吸附常数α逐渐增大,解吸附常数β逐渐降低,吸附常数远远大于解吸附常数,表明在该过程中吸附作用远大于解吸附作用,即吸附占据主导地位,进一步证明了壳聚糖-生物炭微球具有优良的吸附性能.

表3 Lagergren准一级和准二级动力学方程模型参数Table 3 Parameters for pseudo-first-order and pseudo-second-order kinetic models
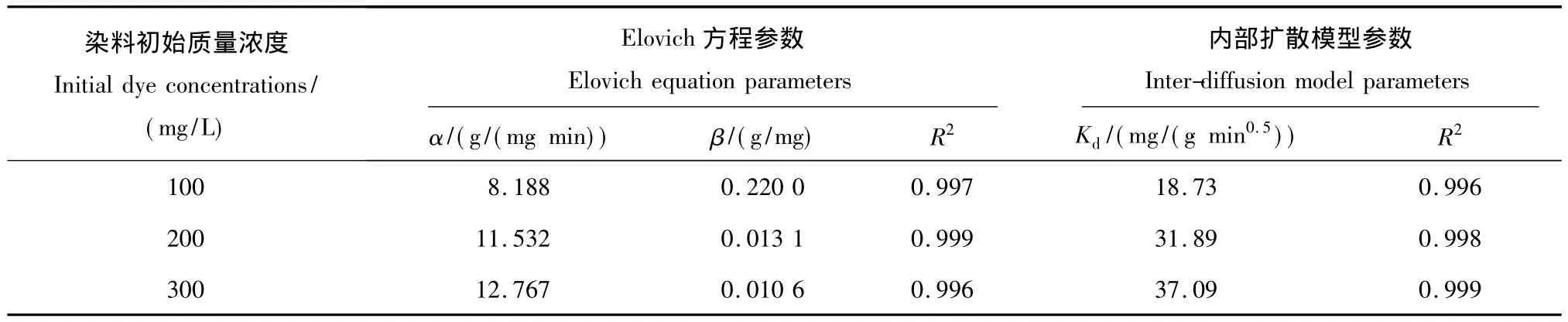
表4 Elovich方程参数和内部扩散模型参数Table 4 Parameters for elovich equation and inter-diffusion models
2.5.3 颗粒内扩散方程 在颗粒内扩散方程中,当qt与t0.5呈现良好的线性关系时,颗粒内扩散为吸附过程的限速步骤,方程[17]表达如下:

式中:Kd为内部扩散速率常数,mg/(g⋅min0.5),qt为t时刻(t/min)的吸附量,mg/g.
吸附剂从液相中吸附被吸附物时,可以分为吸附剂周围流体界膜中吸附质的迁移和在吸附剂颗粒内的扩散.从图3中可以看出:qt与t0.5存在良好的线性关系(R2>0.99),说明颗粒内扩散为该吸附过程的限速步骤,吸附并不是仅仅发生在微球表面;随着染料初始质量浓度的增大,Kd值越大,表明甲基红在微粒内部的扩散速率随着染料初始质量浓度的增加逐渐增大.
2.6 人工神经网络模型
由图4A可见,吸附试验的实测值与构建函数的预测值呈良好的线性关系(R2=0.996),说明该人工神经网络模型训练有效.输入层的4个因素对输出层-吸附量的影响程度结果(图4B)表明,温度对吸附过程的影响最大,相对重要性为32.76%,时间次之(25.56%),其余依次为pH(23.36%)和染料初始质量浓度(18.32%).

图3 壳聚糖-生物炭微球吸附甲基红的内部扩散模型Fig.3 Inter-diffusion model for the adsorption of methyl red onto the chitosan-biochar microsphere
2.7 微球菌剂的增益脱色试验

图4 吸附量实测值与预测值的回归分析(A)和使用神经网络进行的敏感度分析(B)Fig.4 Regression analysis of measured and predicted adsorption capacity(A)and sensitivity analysis using artificial neural network(B)
图5表明,与单纯壳聚糖-生物炭材料制剂和纯微生物菌剂相比,制得的壳聚糖-生物炭-微生物菌剂具有明显的增益效应,脱色效果大大提高.在较高质量浓度的甲基红液相中只添加微生物,20min后脱色率为8%,且随着时间的延长,脱色率不再增加.其余2组处理20min后脱色率为15%,之后随着时间的延长脱色率迅速攀升,80min后增幅减缓并趋于平稳.壳聚糖-生物炭-微生物菌剂与微生物单独脱色作用相比,脱色率提高了67%;与无微生物的微球相比,脱色率提高了29%.将进行脱色试验后的壳聚糖-生物炭-微生物菌剂进行破碎,用无菌水溶解,将溶解液稀释1×108倍后涂布于LB培养基平板上计数.结果发现仍有大量菌落长出,16S rDNA验证表明,菌落为试验时所加的高效降解菌株Bacillus sp.UN2,说明菌剂使用后仍具有一定的生命活性.虽然高质量浓度甲基红对微生物本身具有较强的毒害作用,但利用壳聚糖对微生物进行包埋固定,可以提高微生物对污染物的耐受度,这也许是微球菌剂增益脱色的原因之一[18].

图5 微球-微生物菌剂、壳聚糖-生物炭微球和菌株UN2的脱色率比较Fig.5 decolorization rate comparisons of microsphere-microbial inoculum,chitosan-biochar microsphere and strain UN2
3 讨论
物理吸附因为费用廉价、操作易行,而被认为是处理染料污染最为有效的途径之一[19-21].目前,可供选择的吸附材料很多,但其效果却大相径庭.如Arslan[22]用乙烯对苯二酸酯纤维吸附刚果红,最大吸附量仅为16.6 mg/g.生物炭因其空隙丰富、表面积大、吸附性强成为近年来的研究热点.有学者用水稻、玉米等植物秸秆制成生物炭用来吸附孔雀石绿、甲基蓝和甲基紫,结果证实均有不同程度的吸附效果,其中用水稻制得的生物炭对孔雀石绿的吸附率最高,为148.74 mg/g[23-25].壳聚糖因其可降解、生物兼容性好的优点已成为生物吸附材料的又一重要补充,研究发现壳聚糖对甲基红的吸附率为150 mg/g[26].本研究将壳聚糖与生物炭混合制备了新材料壳聚糖-生物炭微球制剂,在该制剂中生物炭不仅可自身吸附,同时起到了致孔剂的作用,提高了壳聚糖微球的孔隙率.以该制剂吸附甲基红发现,其吸附效率大大增加,可达460 mg/g,比单纯使用壳聚糖的吸附率提高3倍以上,与壳聚糖-纳米管水凝胶微球吸附刚果红的吸附效率相当[27].而相对纳米管材料,生物炭的原材料来源更广泛,价格低廉,更适合用于环境修复和污水处理.可见,新制得的微球制剂是一种新型有效的吸附制剂,具有巨大的应用潜力.
利用壳聚糖-生物炭微球吸附溶液中的甲基红,结果显示当pH值为3时,该微球对甲基红的吸附量达到最大值.在壳聚糖-生物炭微球制剂中,生物炭不仅能自身吸附,同时增加了微球表面孔隙数量,而壳聚糖的主要作用是提供表面官能团.由于壳聚糖具有独特的分子结构,在酸性条件下表面游离的氧基容易质子化,从而对阴离子型的染料如偶氮类染料甲基红具有较强的吸附性,所以在pH值呈酸性时有利于吸附的进行.这也许是壳聚糖-生物炭微球制剂在pH值为3时吸附效果最好的原因之一[26],但深入的作用机制目前尚无相关报道.
吸附结果表明,高的初始浓度和低温有利于微球制剂对甲基红的吸附.热力学分析证实壳聚糖-生物炭微球制剂吸附甲基红的过程为自发的放热过程,在该过程中,温度升高将增加系统的无序性,因而不利于吸附反应的进行.
物理吸附尽管廉价、高效,却仍有局限,比如吸附作用只能将染料分子从液相向吸附剂转移,不能将其彻底降解而使之无害化.由微生物发挥主导作用的生物降解解决了这一难题.通过体内的新陈代谢,微生物可将这些染料分子分解、利用,最终使之变成无害的小分子释放到环境中[3].然而,在高浓度条件下,微生物因为无法抵抗染料的毒害作用而丧失生物降解的优越性,如在本研究中,在初始质量浓度为1000 mg/L条件下,添加甲基红高效脱色菌株的脱色率在20min后仅为8%,且随着时间延长脱色率不再增加.当实验利用无生物毒性、性能优良的壳聚糖-生物炭微球为载体,将该菌株包埋其中制成菌剂时,结果发现与纯材料制剂和纯菌制剂相比,脱色率大大提高,而且处理污水的甲基红质量浓度(1000 mg/L)也高于筛选菌株所用的甲基红质量浓度(400 mg/L).可见,微球对微生物起到了一定的保护作用,吸附剂与微生物相结合产生的吸附增益效应为生物降解与物理吸附相结合去除染料的环境污染提供了初步的理论依据.
4 结论
利用玉米秸秆制备的生物炭与壳聚糖结合制备微球,在染料初始质量浓度为500 mg/L、pH 3.0和20℃条件下,微球对甲基红的最大吸附量为460 mg/g.吸附过程与Freundlich等温方程和准二级动力学方程拟合良好.吸附热力学研究表明,该过程为放热过程,低温有利于吸附的发生.Elovich方程与颗粒内部扩散方程研究发现:吸附作用为自发行为,内部扩散是吸附过程的限速步骤.随着染料初始质量浓度的增加,内部扩散速率增大,吸附性增强.利用神经网络对影响吸附的4个因素进行建模分析,结果显示温度对吸附过程的影响最大,相对重要性为32.76%,时间次之(25.56%),其余依次为pH(23.36%)和染料初始质量浓度(18.32%).在高质量浓度的甲基红溶液中,包埋微生物的壳聚糖-生物炭微球菌剂与无微生物的微球相比,脱色率提高了29%,与微生物单独脱色作用相比,脱色率提高了67%.
[1]Saratale R G, Saratale G D, Chang J S, et al.Bacterial decolorization and degradation of azo dyes:A review.Journal of the Taiwan Institute of Chemical Engineers, 2011,42:138-157.
[2]Ayed L, Mahdhi A, Cheref A, et al.Decolorization and degradation of azo dye methyl red by an isolated Sphingomonas paucimobilis:Biotoxicity and metabolites characterization.Desalination, 2011,274:272-277.
[3]Debrassi A,Baccarin T,Demarchi C A,et al.Adsorption of Remazol Red 198 onto magnetic N-lauryl chitosan particles:Equilibrium,kinetics, reuse and factorial design.Environmental Science and Pollution Research, 2012,19(5):1594-1604.
[4]Yang Y,Lin X,Wei B,et al.Evaluation of adsorption potential of bamboo biochar for metal-complex dye:Equilibrium, kinetics and artificial neural network modeling.International Journal of Environment Science and Technology, 2014,11:1093-1100.
[5]Mittal A, ThakurV, Gajbe V. Evaluation ofadsorption characteristics of an anionic azo dye Brilliant Yellow onto hen feathers in aqueous solutions. EnvironmentalScience and Pollution Research, 2012,19(6):2438-2447.
[6]Zhao M,Sun P F,Du L N,et al.Biodegradation of methyl red by Bacillus sp.strain UN2:Decolorization capacity, metabolites characterization and enzyme analysis.Environmental Science and Pollution Research, 2014,21:6136-6145.
[7]Nourouzi M M,Chuah T G,Choong T S Y,et al.Modeling biodegradation and kinetics of glyphosate by artificial neural network.Journal of Environmental Science and Health, 2012,47:455-465.
[8]Langmuir I.The adsorption of gases on plane surfaces of glass,mica and platinum.Journal of the American Chemical Society,1918,40:1361-1403.
[9]Freundlich H M F. Über die adsorption in lösungen.Zeitschrift für Physikalische Chemie, 1906,57:385-470.
[10]Yang Y Y,Jin D F,Wang G,et al.Biosorption of Acid Blue 25 onto unmodified and CPC-modified biomass of Penicillium YW01:Kinetic study,equilibrium isotherm and FTIR analysis.Colloids and Surfaces B:Biointerfaces, 2011,88:521-526.
[11]Kumar Y P, King P, Prasad V.Zinc biosorption on Tectona grandis L.f.leaves biomass:Equilibrium and kinetic studies.Chemical Engineering Journal, 2006,124(1):63-70.
[12]Aytas S,Yurtlu M, Donat R.Adsorption characteristic of U(Ⅵ)ion onto thermally activated bentonite.Journal of Hazardous Materials, 2009,172(2/3):667-674.
[13]Kalavathy M H,Karthikeyan T,Rajgopal S, et al.Kinetic and isotherm studies of Cu(Ⅱ)adsorption onto H3PO4-activated rubber wood sawdust.Journal of Colloid and Interface Science,2005,292(2):354-362.
[14]Lagergren S.Zur theorie der sogenannten adsorption gelöster stoffe.Handlingar, 1898,24:1-39.
[15]Ho Y S, McKay G.Kinetic models for the sorption of dye from aqueous solution by wood.Process Safety and Environmental Protection, 1998,76:183-191.
[16]Mall I D, Srivastava V C, Agarwal N K.Removal of orange-G and methyl violet dyes by adsorption onto bagasse fly ash-kinetic study and equilibrium isotherm analyses.Dyes and Pigments,2006,69(3):210-223.
[17]Demiral H,Gündüzoˇglu G.Removal of nitrate from aqueous solutions by activated carbon prepared from sugar beet bagasse.Bioresource Technology, 2010,101(6):1675-1680.
[18]Mahmoud D K,Salleh M A M,Karim W A W A,et al.Batch adsorption of basic dye using acid treated kenaf fibre char:Equilibrium, kinetic and thermodynamic studies. Chemical Engineering Journal, 2012,181:449-457.
[19]Forgacs E, Cserháti T, Oros G.Removal of synthetic dyes from wastewaters:A review.Environment International, 2004, 30:953-971.
[20]Mahmoodi N M,Hayati B,Arami M,et al.Single and binary system dye removal from colored textile wastewater by a dendrimer as a polymeric nanoarchitecture:Equilibrium and kinetics.Journalof Chemical and Engineering Data, 2010, 55:4660-4668.
[21]Yang Y Y,Wang G,Wang B,et al.Biosorption of Acid Black 172 and Congo Red from aqueoussolution by nonviable Penicillium YW 01:Kinetic study, equilibrium isotherm and artificial neural network modeling.Bioresource Technology, 2011,102(2):828-834.
[22]Arslan M.Use of 1, 6-diaminohexane-functionalized glycidyl methacrylate-g-poly(ethylene terephthalate)fiber for removal of acidic dye from aqueous solution.Fibers and Polymers, 2010,11:177-184.
[23]Hameed B H, El-Khaiary M I.Kinetics and equilibrium studies of malachite green adsorption on rice straw-derived char.Journal of Hazardous Materials, 2008,153(1/2):701-708.
[24]Xu R K,Xiao S C,Yuan J H,et al.Adsorption of methyl violet from aqueous solutions bythebiochars derived from crop residues.Bioresource Technology, 2011,102(22):10293-10298.[25]Liu Y L, Zhao X R, Li J L, et al.Characterization of bio-char from pyrolysis of wheat straw and its evaluation on methylene blue adsorption.Desalination and Water Treatment, 2012,46(1/2/3):115-123.
[26]贾海红,徐祥华,马龙生,等.甲基红在壳聚糖上吸附富集的研究.环境工程学报,2012,5(12):2768-2772.Jia H H, Xu X H, Ma L S, et al.Research on adsorption enrichment of methyl red on chitosan. Chinese Journal of Environmental Engineering, 2012,5(12):2768-2772. (in Chinese with English abstract)
[27]Chatterjee S, Chatterjee T, Woo S H.A new type of chitosan hydrogelsorbentgenerated by anionic surfactantgelation.Bioresource Technology, 2010,101(11):3853-3858.

